Los síndromes paraneoplásicos son trastornos asociados con el cáncer, pero sin un efecto directo de la masa tumoral o sus metástasis. A los síndromes neurológicos paraneoplásicos cuando se presentan asociados a anticuerpos anti-Hu se los engloba entre los «síndromes anti-Hu». Los síndromes neurológicos paraneoplásicos asociados al anti-Hu, suelen tener una manifestación clínica diversa y multifocal, destacando la neuronopatía sensorial paraneoplásica y/o encefalomielitis paraneoplásica. En el presente artículo se reporta una presentación rara, en un varón de 72 años, con síndromes neurológicos paraneoplásicos asociado a anti-Hu, con fenotipo de neuropatía sensorial, que después de 4 años desarrolla cáncer de vejiga. A propósito del caso se realiza la revisión de la literatura.
Paraneoplastic syndromes are disorders associated with cancer, but without a direct effect of the tumor mass or its metastases. Paraneoplastic neurological syndromes (PNS) when associated with proven anti-Hu syndromes are included among the “anti-Hu syndromes”. PNSs associated with anti-Hu usually have a diverse and multifocal clinical manifestation, highlighting paraneoplastic sensory neuronopathy and/or paraneoplastic encephalomyelitis. This article reports a rare presentation in a 72-year-old male with SNP associated with anti-Hu, with sensory neuropathy phenotype, who developed bladder cancer after 4 years. On the subject of the case, a literature review is carried out.
Los síndromes paraneoplásicos son trastornos asociados con el cáncer, pero sin un efecto directo de la masa tumoral o sus metástasis. Los síndromes neurológicos paraneoplásicos (SNP), con la presencia de anticuerpos anti-Hu se han denominado «síndrome anti-Hu». Estos SNP asociados al anti-Hu, suele tener manifestación clínica diversa y multifocal, destacando la neuronopatía sensorial paraneoplásica y/o encefalomielitis paraneoplásica1. El electroencefalograma puede ser más sensible que la resonancia magnética (RM) para el diagnóstico temprano de SNP, de origen cerebral2. Sin embargo en presencia de la neuropatía sensorial, se deben realizar múltiples estudios de descarte de otras causas como diagnóstico diferencial.
Se reporta una presentación rara en un varón adulto mayor, que desarrolla SNP asociado al anti-Hu, con posterior diagnóstico de cáncer de vejiga.
Reporte de casoUn paciente varón de 72 años, de raza mestiza, con antecedente laboral de haber trabajado durante 20 años en una fábrica de preparación de tinte de anilina, niega antecedentes de tabaco y consumo de alguna droga recreativa o medicamento. Ingresa al establecimiento por presentar, desde hace 8 meses, pérdida de sensibilidad y hormigueo de pies bilateral que progresó a manos desde hace 2 meses. A la evaluación clínica demostró hipoestesia en patrón de calcetín-guante, con alteración de la vibración, propiocepción y sensación de temperatura hasta el hueco poplíteo y codo, de miembros inferiores y miembros superiores, respectivamente. Los reflejos tendinosos profundos estaban disminuidos en todas las extremidades. Su marcha libre mostraba la necesidad de aumentar la base de sustentación con resultado Romberg positivo.
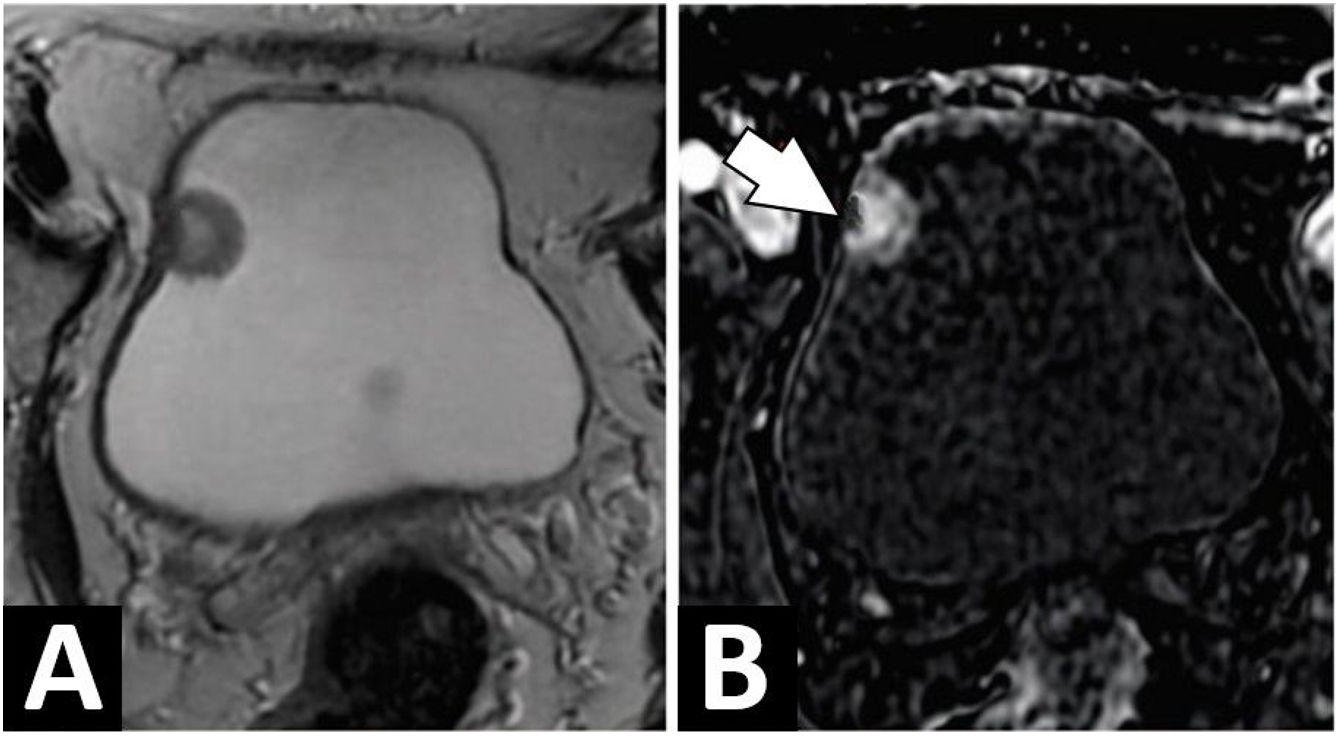
Los resultados del trabajo rutinario de laboratorio para neuropatía periférica, a saber: hemograma completo, panel metabólico completo, hormona estimulante del tiroides, vitamina B 12, ácido metilmalónico, hemoglobina A1c, prueba de tolerancia a la glucosa de 2 horas e inmunoelectroforesis sérica, estuvieron dentro de los límites normales. Las investigaciones de bajo rendimiento que incluyeron velocidad de sedimentación globular, anticuerpos antinucleares, panel de hepatitis B y C, complemento 3 y 4, crioglobulinas, anticuerpo anticitoplasma de neutrófilos (ANCA) y virus de la inmunodeficiencia humana fueron negativos. El estudio de conducción nerviosa mostró evidencia electrofisiológica de neuropatía sensorial desmielinizante difusa de moderada a grave. La RM fue negativa para afectación intracraneal. Al no encontrarse un origen que justifique la clínica neurológica, se realiza un panel paraneoplásico, que reveló la presencia de anticuerpo anti-Hu. Se planteó realizar tomografía por emisión de positrones corporal total (PET-CT), sin embargo, no fue concedido por su sistema de cobertura médica. Con este resultado de sospecha oncológica, se realiza tomografía espiral multicorte de tórax, abdomen y pelvis con contraste (TEM TAP), no revelando alteraciones. Se planteó el tratamiento con inmunoglobulina intravenosa, pero el paciente rechazó cualquier medida de tratamiento para la neuropatía. Después de 49 meses, presenta hematuria macroscópica, y progresión de la hipoestesia hasta la mitad del muslo y antebrazo, por lo que se solicita nuevas TEM TAP, que solo evidencia una imagen captante de contraste en vejiga. Por lo que se realiza RM de pelvis, mostrando una lesión pediculada de 2cm en la pared lateral derecha de la vejiga, sin compromiso de la muscular propia (fig. 1). Se realiza la resección transuretral del tumor vesical, con resultado histopatológico de carcinoma urotelial de alto grado. Con esto se determina el diagnóstico de SNP anti-Hu positivo por cáncer de vejiga (pT1 N0 M0) de alto riesgo. Continuando con tratamiento a base de Calmette-Guérin en la vejiga. Las cistoscopias de seguimiento han sido negativas hasta los 3 años. Los síntomas neuropáticos no desaparecieron ni progresaron tras el tratamiento, en un seguimiento de 40 meses.
Resonancia magnética multiparamétrica de pelvis. A) Imágenes axiales ponderadas en T2 que muestran una lesión pediculada en la pared lateral derecha de la vejiga. La línea de baja intensidad de señal que representa la muscularis propia parece continua, sin signos de infiltración. B) Contraste dinámico mejorado, las imágenes muestran realce temprano de la lesión. Con realce de la submucosa debajo de la lesión (punta de flecha), que representa el tallo fibromuscular. Este signo es compatible con un estadio pT1.
Los SNP son trastornos del sistema nervioso inmunomediados con diversas manifestaciones clínicas. El anticuerpo nuclear anti-neuronal (ANNA-1) se encuentra entre los autoanticuerpos más comunes asociados con el SNP. ANNA-1, también conocido como anticuerpo anti-Hu, es un anticuerpo IgG policlonal dirigido contra antígenos intracelulares de células tumorales y neurales3. El SNP asociado a autoanticuerpos anti-Hu puede manifestarse como neuropatía sensorial, neuronopatía sensorial, neuropatía autónoma, ataxia cerebelosa y encefalitis límbica1,2. El carcinoma de pulmón de células pequeñas (CPCP) es el cáncer más común asociado con el SNP de anticuerpos anti-Hu. También se sabe que el linfoma de Hodgkin y las neoplasias malignas de la próstata, el cuello uterino, los ovarios, el timo y la mama causan SNP anti-Hu4.
Las neuropatías de fibras pequeñas suelen provocar ardor y dolor punzante con parestesias. Mientras las neuropatías de fibras grandes son el resultado de la atenuación de las fibras Aβ, que regulan las señales propioceptivas de vibración y tacto. Algunas enfermedades pueden producir polineuropatías de etiología mixta, que se componen de fibras pequeñas y grandes (diabetes mellitus)5. Para obtener una postura más integral en relación con las posibles etiologías subyacentes, se deben contemplar las posibles causas: inmunomediadas, como sarcoidosis, síndrome de Sjogren, lupus eritematoso sistémico, y síndrome paraneoplásico; metabólicas, como diabetes mellitus e hiperlipidemia; deficiencias nutricionales, como vitamina B12, cobre, vitamina E y ácido fólico; tóxicas, como quimioterapia, inducida por fármacos y alcohol; hereditarias, como hemocromatosis, enfermedad de Fabry, síndrome de Ehlers-Danlos y ataxia de Friedreich; infecciosas o parainfecciosas, como sífilis, lepra, virus de la inmunodeficiencia humana y hepatitis C; otras: especialmente secundarias a vasculitis en sus distintos tipos. Cabe acotar que en un porcentaje no despreciable la causa de la polineuropatía queda como indeterminada o idiopática6–8. Las neuropatías sensoriales subagudas se observan comúnmente en casos inmunomediados y postinfecciosos, mientras que las variantes idiopáticas han demostrado ser de instalación más insidiosa y/o evolución más tórpida. La afectación motora puede verse en personas con neuropatías sensoriales paraneoplásicas que provocan la ausencia de reflejos de estiramiento6. En nuestro caso, por el síntoma de hormigueo y las alteraciones de la propiocepción, acompañado de reflejos de estiramiento disminuidos, nos encontrábamos frente a una neuropatía de fibras mixtas, con sospecha de un síndrome paraneoplásico, confirmándose la neuropatía, con el resultado de la electrofisiología, de neuropatía sensorial desmielinizante difusa de moderada a grave. Por ello se procedió a realizar los estudios correspondientes a fin de excluir otras causas frecuentes como así también las asociadas a patologías oncológicas. Resultando positivo a la presencia de anticuerpo anti-Hu, confirmando el origen inmunológico por efecto paraneoplásico. Además, por la marcha con base de sustentación ampliada también se sospechaba de afectación del cerebelo, ataxia aferente o sensitiva por déficit sensitivo distal. Sin embargo, resultó normal la RM.
Se reconoce que los SNP general pueden ir acompañados de dos patrones separados de respuesta inmune: síndromes en los que la respuesta inmune está dirigida contra receptores neuronales u otros antígenos de la membrana celular y síndromes en los que la inmunorreactividad está dirigida contra proteínas neuronales intracelulares. El primer grupo de síndromes se caracteriza por disfunción neuronal, puede estar asociado o no con una neoplasia subyacente y, con frecuencia, son susceptibles al tratamiento autoinmune susceptible. Los síndromes del último grupo, aquellos en los que la respuesta inmunitaria se dirige a los antígenos intracelulares, casi siempre se encuentran en presencia de cáncer y se caracterizan por la muerte neuronal. Los déficits neurológicos en estas condiciones, una vez agotada la reserva neuronal intrínseca, son irreversibles. Entre los principales anticuerpos antineuronales paraneoplásicos reactivos con antígeno intracelular y su respectivo fenotipo tenemos a: anti-CRMP5, con neuritis óptica, degeneración cerebelosa y encefalomielitis; anti-GAD65, con de síndrome de la persona rígida, encefalitis límbica y ataxia cerebelosa; anti-Hu (ANNA-1), con encefalitis límbica, encefalomielitis y neuropatías sensoriales; anti-Ma1, con encefalitis límbica o del tronco encefálico; anti-Ma2, con encefalitis límbica o del tronco encefálico; anti-Ri (ANNA-2), con degeneración cerebelosa, opsoclonus mioclonus y encefalitis del tronco encefálico; anti-Tr, con fenotipo de degeneración cerebelosa; y por último el anti-Yo, con degeneración cerebelosa3,9. Se plantea como mecanismo de lesión neuronal, la respuesta de los linfocitos T mediante anticuerpos contra las proteínas celulares internas (por ejemplo, Yo y Hu), se ha demostrado repetidamente: infiltrados de citotóxicos (CD8 +) y anticuerpos en cerebros de pacientes con encefalomielitis3,10. Así mismo, el anti-Hu IgG se ha asociado con encefalomielitis en el contexto de cáncer de pulmón de células pequeñas11–13.
Se requiere un enfoque multidisciplinario para identificar el cáncer subyacente en pacientes con SNP. Una búsqueda exhaustiva de la neoplasia maligna oculta en el momento de la aparición de los síntomas suele ser negativa, ya que el SNP puede preceder al diagnóstico de cáncer hasta en 5 años. Sin embargo, el seguimiento de los pacientes con SNP es crucial porque una proporción muy alta de pacientes eventualmente desarrollan una neoplasia maligna. Específicamente, los anticuerpos anti-Hu se asocian con un 87% de riesgo de desarrollar CPCP u otros tumores6,14,15. En pacientes con sospecha de SNP es obligatorio realizar una prueba de detección de malignidad subyacente. El PET-CT es más sensible a los tumores más pequeños que la tomografía computarizada (TC). Los anticuerpos antineuronales pueden actuar como marcadores para tumores específicos como tumores de mama o de órganos reproductivos para anti-Yo, CPCP para anti-Hu, mama o pulmón para anti-Ri, o testículo para anti-Ma23. Es posible que se necesiten pruebas adicionales, que incluyen mamografía y ecografía pélvica o testicular. Si se identifica una neoplasia maligna con imágenes, el tratamiento debe guiarse según pautas oncológicas determinadas para cada tipo de tumor. En nuestro caso, ante la falta accesibilidad al estudio PET-CT, se procedió a buscar el origen con TEM TAP, para buscar el origen del primario, no evidenciándose alteración. No se logró realizar el seguimiento longitudinal estrecho imagenológico, por decisión del paciente, que recién regresa al establecimiento por presentar hematuria.
Divulgamos este caso raro de SNP anti-Hu asociado, por carcinoma urotelial de vejiga, manifestado por neuropatía sensitiva exclusiva. Revisando en la literatura, se han publicado 2 casos, asociados a cáncer de vejiga urinaria. El primer caso de SNP anti-Hu asociado fue en una mujer de 76 años, que presentó una histología de carcinoma de células de transición de bajo grado (G1 pTa) con clínica de encefalitis límbica y neuropatía sensorial16. El segundo caso, en un varón de 70 años, presentó una histología de carcinoma de células de transición de alto grado (G3 pT1 N0 M0), luego de 2,5 años desarrolló clínica de neuropatía sensorial exclusiva sin afectación del SNC17. Estos hallazgos muestran similitud a nuestra comunicación, ya que los tres se dan en un grupo etario de 70 o más años, destacándose la singularidad de nuestro caso por haber tenido exposición laboral a la anilina como factor de riesgo para cáncer de vejiga, y la presentación de la neoplasia por hematuria, después de 4 años del comienzo neurológico.
La RM se utiliza cada vez más para el diagnóstico de tumoración maligna de vejiga, ya que permite la estadificación para el preoperatorio, gracias a la alta resolución espacial, su capacidad en discriminar la afectación de la pared de la vejiga y la infiltración de tejido extravesical, la hacen superior a la TC y otras modalidades de imagen. Además, la RM proporciona un estudio de toda la superficie de la vejiga, lo que permite la detección de múltiples focos tumorales, que es crucial, ya que en el cáncer de vejiga es frecuente la multicentricidad18. En nuestro caso, después de la sospecha imagenológica por TEM TAP de una lesión vesical y sin lesiones a distancia, se procedió a realizar inmediatamente la RM para estadificar, resultando en un estadio clínico I. Se procedió a su inmediato manejo con resección transuretral, confirmándose la histopatología de carcinoma urotelial de alto grado, y continuando con el tratamiento oncológico adecuado.
El inicio rápido del tratamiento en la enfermedad paraneoplásica, especialmente cuando la afección se acompaña de anticuerpos contra antígenos intracelulares, es esencial para prevenir un deterioro neurológico permanente, sustancial o la muerte. El tratamiento de la enfermedad neurológica paraneoplásica que implica anticuerpos contra antígenos intracelulares como anti-Hu, anti-Yo y anti-Ri tiende a ser más difícil. Se han utilizado corticosteroides, plasmaféresis, inmunoglobulina intravenosa, rituximab y ciclofosfamida con grados de éxito variables, y por lo general con pobre o escasa respuesta. En estas condiciones, se produce una pérdida neuronal irreversible tiempo dependiente, lo que hace que el tratamiento inmediato o incluso urgente sea extremadamente importante. La evidencia sugiere que los pacientes pueden tener un mejor pronóstico con un inicio más temprano del tratamiento, y los estudios patológicos confirman claramente que la pérdida neuronal ocurre con el tiempo. Aunque el tratamiento puede inducir solo una remisión parcial de los síntomas neurológicos, el inicio rápido de la terapia aún puede permitir evitar mayores daños19–22. En nuestro caso el paciente rechazó el tratamiento dirigido al tipo antiinmune, por lo que posiblemente continuó con una lenta progresión en el transcurso de los 4 años de evolución pre detección del tumor y una tendencia a la estabilización de la sintomatología neurológica tras la resección tumoral.
El tratamiento de cualquier SNP debe coordinarse estrechamente con un equipo interdisciplinario de atención experimentado, que incluya al neurólogo, para la evaluación y planteamiento de opciones terapéuticas respecto al déficit neurológico. Las decisiones de tratamiento con respecto a la inmunoterapia deben acordarse en el seno del equipo de atención, teniendo en cuenta también el momento de la radiación o quimioterapia necesarias y el posible efecto de interacción medicamentosa entre ambas21. El tratamiento oncológico oportuno de la neoplasia maligna subyacente es importante en el resultado general del paciente.
ConclusiónSe requiere un alto grado de sospecha clínica para diagnosticar SNP infrecuentes y sus neoplasias malignas ocultas asociadas. El neurólogo debe estar integrado en el equipo interdisciplinario (oncología, neurología, rehabilitación, psicología, etc.), para apoyar al diagnóstico, tratamiento y seguimiento. Ante la presencia de SNP sin origen tumoral detectado, se debe realizar un seguimiento estrecho orientado a su búsqueda. Los SNP asociados a anti-Hu tienen pobre respuesta a las terapias autoinmunes. Sin embargo, la resección del tumor primario lo más precoz posible puede detener la progresión del SNP, mejorando el pronóstico funcional del déficit neurológico.
FinanciaciónEste estudio no presentó financiación.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Nuestro agradecimiento a la Universidad Peruana Los Andes, y al Centro Especializado María Auxiliadora.