Una mujer de 52 años acudió al Servicio de Urgencias con convulsiones, y cuadrantopsia inferior derecha. Su historial médico fue notable por un adenocarcinoma de mama derecho HER2 puro estadio clínico iv por compromiso hepático, que fue diagnosticado aproximadamente 2años antes. Se sometió a tratamiento con quimioterapia, mastectomía radical derecha, continuando con inmunoterapia hasta presentar el evento neurológico. Los estudios de imágenes revelaron una masa parietooccipital izquierda con base meníngea. Se sometió a estudio de líquido cefalorraquídeo, siendo negativo para células neoplásicas e infección, y una biopsia de la lesión meníngea, con resultado de adenocarcinoma de mama metastásico. Junto con los resultados, se diagnosticó metástasis leptomeníngea única. Este caso clínico presenta una complicación poco común para el subtipo HER2 puro, pero conocida del cáncer de mama con sobrevida larga.
A 52-year-old woman came to the emergency department with seizures and right lower quadrantopsia. Her medical history was notable for a clinical stage iv pure HER2 right breast adenocarcinoma due to liver involvement, which was diagnosed approximately 2years earlier. She underwent chemotherapy treatment, right radical mastectomy, continuing with immunotherapy until presenting the neurological event. Imaging studies revealed a left parietal occipital mass with a meningeal base. She underwent a study of the cerebrospinal fluid being negative for neoplastic cells and infection, and a biopsy of the meningeal lesion, resulting in metastatic breast adenocarcinoma. Together with the results, a single leptomeningeal metastasis was diagnosed. This clinical case presents a rare complication for the pure HER2 subtype, but known from breast cancer with long survival.
La carcinomatosis leptomeníngea (CL) es una complicación en etapa tardía de los tumores malignos que metastatizan al líquido cefalorraquídeo (LCR) y leptomeninges. La presentación clínica de CL es variable, ya que cualquier nivel del sistema nervioso central (SNC) puede verse afectado1. La metástasis leptomeníngea es una complicación poco común pero clásica del cáncer de mama, está volviéndose más frecuente por el incremento de la sobrevida. Los adenocarcinomas de cualquier sitio primario son el tipo de tumor histológico más común para metastatizar a las leptomeninges2.
Presentamos un caso poco frecuente de metástasis leptomeníngea focal de primario de mama tipo HER2 puro.
Reporte de casoMujer de 52 años, natural de Junín, inició con neoplasia maligna de mama derecha HER2 puro estadio clínico iv por compromiso hepático. Recibe quimioterapia (QT), luego es intervenida quirúrgicamente loco regionalmente. Durante un año y 10 meses recibió trastuzumab por 12 cursos. A los 2 meses siguientes presenta convulsión tónica clónica, con clínica neurológica postictal de solo cuadrantopsia inferior derecha, le realizan resonancia magnética (RM) cerebral con contraste, evidenciándose una lesión extraaxial a nivel parietooccipital izquierdo con amplia base meníngea, que mide aproximadamente 25×15×13,5mm de bordes regulares y lobulados (fig. 1). Se realizaron 3estudios de LCR en tiempo diferentes, sin evidencia de células neoplásicas ni alteraciones en los valores. Por la sospecha de ser un meningioma de grado iii, se realiza biopsia con resultado de AP: compatible con carcinoma con inmunohistoquímica de RE negativo, RP negativo y HER2 positivo. Con estos resultados se le propone QT intratecal y sistémica asociada a radioterapia, sin embargo, la paciente rechaza el tratamiento a base de QT en ese momento. Por lo que recibe radioterapia externa localizada a dosis de 2.500 cGy en 5 sesiones a nivel de lesión tumoral (fig. 2). Continúa QT a base de capecitabina durante 10 meses, en dicho periodo la lesión dependiente de meninges no presentó crecimiento. La paciente fallece a los 2 años y 11 meses del diagnóstico de cáncer de mama, presentando falla hepática por múltiples lesiones metastásicas, que comprometía el 65% del parénquima hepático.
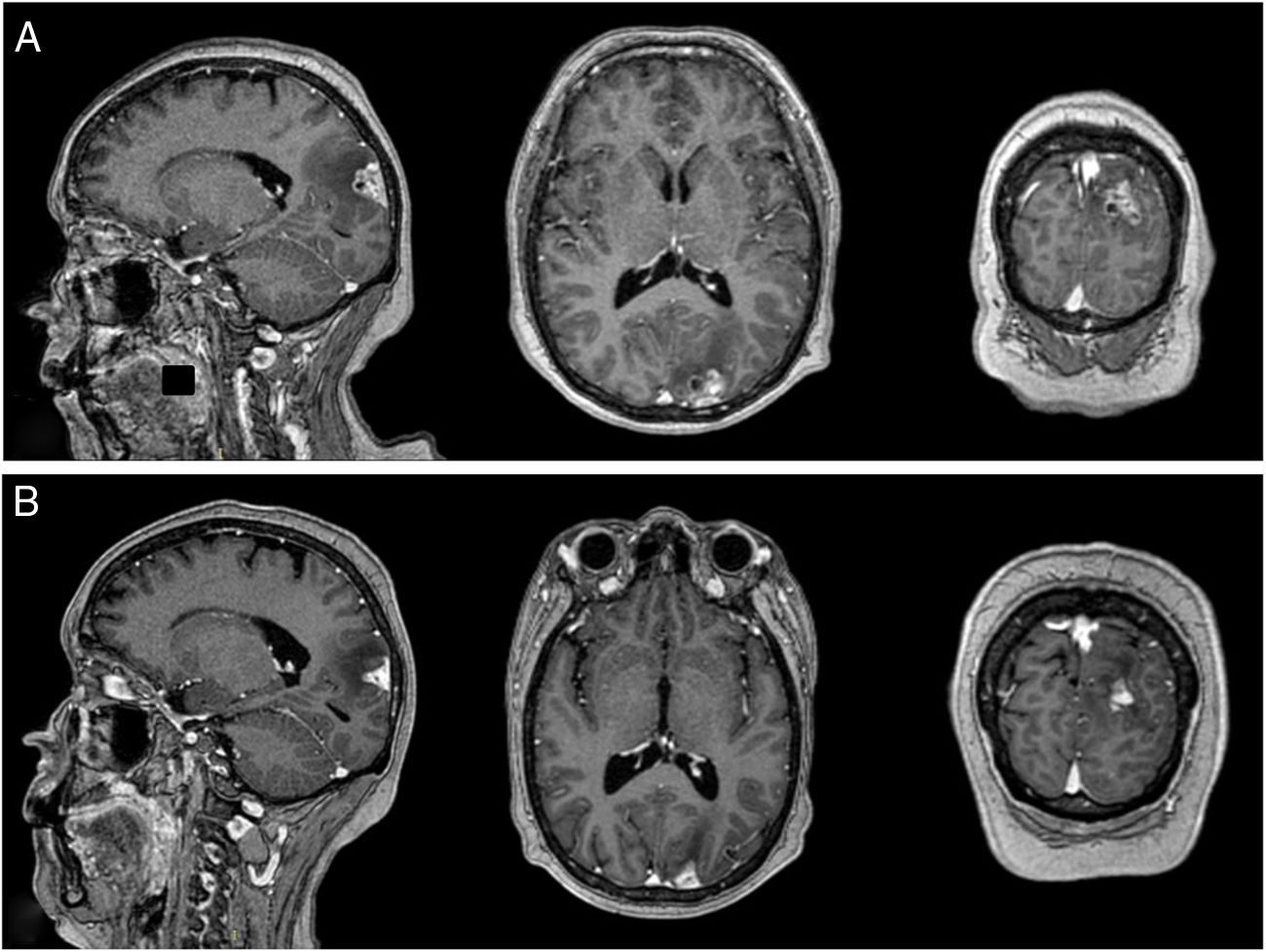
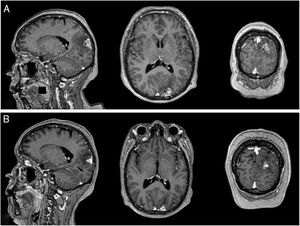
RM cerebral con contraste. A) Imagen prerradioterapia. Lesión extraaxial a nivel parieto-occipital izquierdo con amplia base meníngea, que mide 25×15×13,5mm en coronal, antero-posterior y transversal respectivamente, de bordes regulares y lobulados con significativo realce heterogéneo con el contraste, se proyecta hacia parénquima cerebral adyacente condicionando significativo edema local con predominio en el lóbulo parietal. B) Imagen posradioterapia de 10 meses. Lesión captadora de contraste a nivel de región occipital izquierda de 17×11mm, asociado a edema vasogénico.
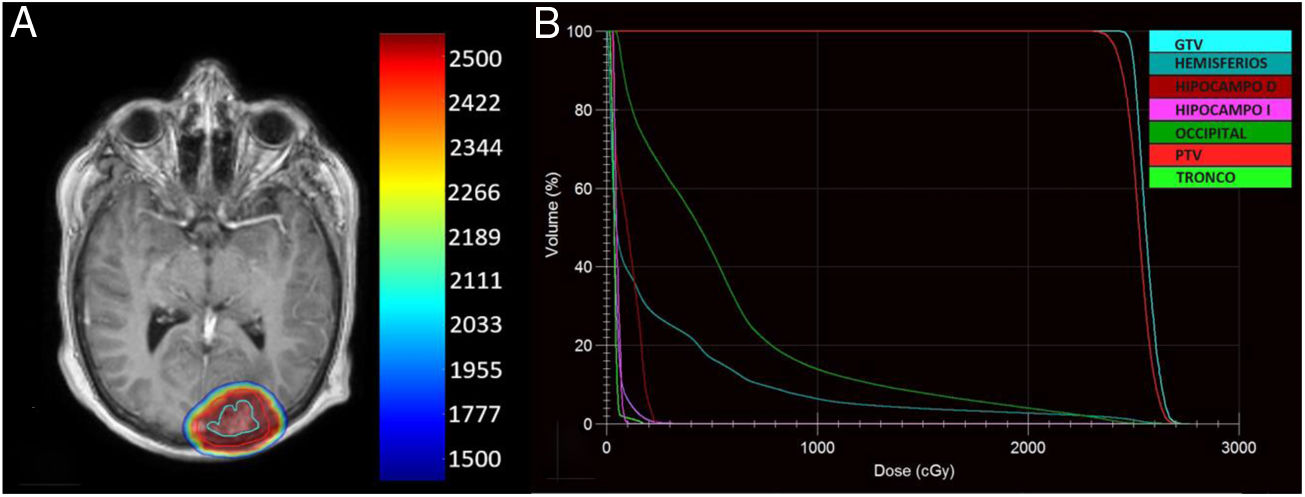
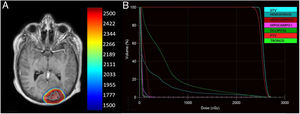
Planificación IMRT con algoritmo MONACO. A) Curvas de dosis de irradiación en cGy en plano axial. B) Histograma dosis volumen, con dosis media y dosis máxima, de 263,5 cGy/2.663 cGy, hipocampo derecho de 101 cGy/249,5cGy, hipocampo izquierdo 50,1 cGy/105,8cGy, lóbulo occipital de 557,1 cGy/2.548 cGy, tronco encefálico de 37,4 cGy/186,1cGy, volumen tumoral grosero (GTV) de 2.562,9 cGy/2.763,7cGy, y volumen tumoral de planificación (PTV) de 2.524,5 cGy/2.763,7cGy, respectivamente.
Determinar la incidencia de CL es complejo, según los estudios de autopsias de pacientes con cáncer que tenían síntomas neurológicos, la prevalencia de enfermedad leptomeníngea es aproximadamente del 19%. La CL se ha informado cada vez más en pacientes vivos con cáncer. Se reconoce clínicamente en hasta el 8% de todos los pacientes con cáncer. Existen explicaciones por el aumento de incidencia de CL, debido a los métodos mejorados de neuroimagen, los tratamientos que prolongan la supervivencia de los pacientes con cáncer y el uso de agentes anticancerosos sistémicos que no atraviesan la barrera hematoencefálica pueden desempeñar un papel vital2,3.
El cáncer de mama es la causa de mayor frecuencia en la CL a pesar de que el compromiso cerebral de cáncer de mama e supratentoriales en el 85% y del 10 al 15% a nivel del cerebelo. Y solo del 3 al 5% de los pacientes con cáncer de mama desarrollan afectación leptomeníngea1,2. La proporción de pacientes con CL también difiere según el subtipo. Mientras el subtipo triple negativo es el más asociado con compromiso leptomeníngeo, aproximadamente en el 40%4 se sabe que el subtipo HER2 positivo tiene una propensión a la metástasis cerebral; sin embargo, esta asociación no se refleja en la CL. Los datos retrospectivos muestran que la enfermedad HER2 positivo es menos frecuente que los subtipos luminales y triple negativo en pacientes con CL, lo que representa aproximadamente el 10-15% de los casos5. Los pacientes con subtipo HER2 positivo y metástasis cerebral tienen un pronóstico favorable en comparación con otros subtipos. Sin embargo, en pacientes con enfermedad leptomeníngea no existe una diferencia significativa en la supervivencia global entre los subtipos HER2 positivo versus receptor hormonal positivo/HER2 negativo6.
La presentación clínica puede ser sutil o aislada y finalmente pasada por alto. Se informan con frecuencia migrañas, alteraciones mentales, signos cerebelosos, dolor de espalda y debilidad en las piernas el momento de la presentación inicial7. Recordar que una historia clínica completa es vital, ya que el CL debe diferenciarse de otras entidades que pueden presentarse con trastornos neurológicos, como meningitis infecciosa, encefalopatías metabólicas y tóxicas, sarcoidosis, síndromes paraneoplásicos o efectos secundarios de la quimiorradiación1,7. Sin embargo, esta paciente presentó convulsión generalizada por el edema y la irritación cortical, con signo neurológico focal permanente postictal, expresado por la cuadrantopsia, sin otro hallazgo neurológico, que indica lesión que está comprometiendo al cuneus occipital izquierdo.
La RM es fundamental en el proceso de evaluación inicial de las enfermedades leptomeníngeas. La sensibilidad de la RM para el diagnóstico de CL varía del 76 al 100%8. Dado que estas neoplasias metastásicas pueden afectar a todo el SNC, se recomienda el uso de imágenes del cerebro con imágenes de toda la columna en secuencia T1 y T2 contrastada con realce meníngeo. Los hallazgos característicos de la RM se ubican en la base del cerebro, la médula espinal dorsal y la cola de caballo; incluyen realce u obliteración del surco, realce ependimario lineal, realce de la raíz del nervio craneal y nódulos hiperintensos, en particular, en la cola de caballo1. El otro estudio que ayuda al diagnóstico es el estudio del LCR, dicho estudio debe realizarse al menos en 3tiempos diferentes para aumentar la sensibilidad del 60 al 90%; sin embargo, un análisis retrospectivo de 200 pacientes con enfermedad leptomeníngea reveló que el 53% de los pacientes fueron diagnosticados por RM, el 23% por citología y el 24% por ambos métodos7, por lo que se concluye que ambos métodos utilizado de forma separada no es suficiente para descartar el compromiso leptomeníngeo. En el caso de la paciente con el antecedente del inicio de cáncer de mama metastásico a hígado, se planteó la enfermedad intracraneal. La RM de cerebro evidenció la lesión focal de la meninge, por lo que se replanteó los posibles diagnósticos de metástasis meníngea, segundo primario como meningioma grado iii, o más alejado una infección meníngea. De este modo, ambas condiciones, la CL y la meningitis infecciosa, son potenciales explicaciones para el cuadro clínico de la paciente, lo cual implica realizar investigaciones oportunas, como estudio del LCR, para el descarte de ambos escenarios, probablemente no identificamos las células malignas por no presentar diseminación en el resto del neuroaxis. La CL se define como la infiltración leptomeníngea, que incluye la piamadre, el espacio aracnoideo y subaracnoideo de un tumor primario sólido8. En el caso, la biopsia de la lesión meníngea nos confirma el diagnóstico de lesión metastásica por el mismo patrón de inmunohistoquímica que el primario y el compromiso de las membranas aracnoideas.
A pesar de los avances en las intervenciones por imágenes y terapéuticas, la CL sigue siendo una complicación clásica y bien conocida del cáncer de mama. La mediana de tiempo de intervalo desde la determinación del tumor sólido primario inicial hasta la afectación leptomeníngea es de aproximadamente 24 meses6,9. Siendo este hallazgo compatible con el caso. Desde la aparición de la terapia blanco con un anticuerpo monoclonal contra HER2 (trastuzumab), ha demostrado mejorar la sobrevida10. En adyuvancia, las recurrencias disminuyeron en un 50% y en términos absolutos mejoró la sobrevida libre de enfermedad entre un 8 y un 11%; en neoadyuvancia la respuesta patológica se da entre el 22 y el 70%11. La paciente recibió trastuzumab solo como adyuvancia, si la paciente hubiera recibido trastuzumab en la neoadyuvancia, es probable que hubiera incrementado el periodo libre de enfermedad, así como de sobrevida global.
Una vez que se ha confirmado la CL, las opciones de tratamiento siguen siendo escasas y la mediana de supervivencia global es de aproximadamente 4 a 6 semanas sin tratamiento, que puede prolongarse hasta 12 meses con tratamiento multimodal agresivo6. Niwińska et al. ha propuesto la puntuación INDEX mediante su fórmula, que correlaciona la supervivencia general con la edad menor a 53 años (1 punto), el estado funcional mayor a 70 (1 punto), el subtipo luminal (1 punto), radioterapia (2 puntos), tratamiento intratecal (1 punto) y tratamiento sistémico (2 puntos). Los pacientes clasificados como de mal pronóstico (fórmula=5 a 8) presentaron una mediana de supervivencia global de 1,5 meses en comparación con los pacientes con buen pronóstico (fórmula=1) experimentaron una mediana de supervivencia global de 9,6 meses12.
Actualmente, para la CL primaria de mama, no existe un estándar de atención aceptado. El tratamiento estándar para la CL es una combinación de metotrexato intratecal más QT sistémica con o sin radioterapia localizada2. Debido a estas modalidades de tratamiento, la supervivencia media ha mejorado de aproximadamente un mes a 3y 6meses2.
En el tratamiento sistémico, se han descrito varios regímenes con respuesta clínica y de imagen que incluyen capecitabina, ciclofosfamida, 5-fluorouracilo, metotrexato, vincristina, cisplatino, etopósido, vinorelbina, gemcitabina, carboplatino y paclitaxel. La mayoría de los centros administran tratamiento sistémico de forma concurrente o posterior tratamiento intratecal6. Así mismo, se reporta el uso de inmunoterapia en HER2, como lapatinib y trastuzumab emtansina en casos de progresión a CL, con resultados esperanzadores6,13.
La radioterapia puede ser útil para resolver la alteración del flujo del LCR en la enfermedad leptomeníngea voluminosa9. Sin embargo, los tumores leptomeníngeos metastásicos rara vez progresan a una enfermedad voluminosa localizada. Recordar que los factores de pronóstico podrían ayudar a seleccionar mejor a los pacientes para un tratamiento intensivo. Sin embargo, en algunos pacientes, el diagnóstico de CL es el evento final de la enfermedad y obliga a los pacientes a buscar cuidados paliativos. La irradiación como teleterapia permite la normalización del flujo del LCR, al menos en el 30 y el 50%, los bloqueos ubicados a nivel espinal e intracraneal respectivamente. A la vez, ayuda a la QT intratecal, mejorando la eficacia y reduciendo la toxicidad de la terapia. Los pacientes con un estado funcional deficiente generalmente se tratan con irradiación holocraneal aislada. En el caso, si utilizamos la fórmula INDEX, presentaba una valoración de 3, con una mediana sobrevida de 3,9 meses. Por presentar lesión focalizada, y rechazar tanto la QT intratecal como la sistémica, recibió radioterapia hipofraccionada localizada con técnica de intensidad modulada (IMRT), para preservar la funcionalidad del resto del parénquima cerebral no comprometido, ya que un riesgo importante del tratamiento de estos pacientes son los déficits visuales iatrogénicos, incluida la ceguera cortical, comparados con los déficits conferidos por la propia enfermedad14. La disminución del tamaño y del edema mejoró el estado neurológico y la calidad de vida, obteniéndose un periodo libre de progresión de la lesión metastásica meníngea de 10 meses.
Nuestro caso fue catalogado como una paciente con expectativa de vida menos de 6 meses, por rechazar el tratamiento a base de QT al inicio. Sin embargo, solo con la radioterapia externa alcanzó el control local de la lesión metastásica meníngea con resolución de los síntomas neurológicos por más de 9 meses. Se necesitan con prontitud más ensayos prospectivos para abordar mejor el impacto de las modalidades de tratamiento disponibles en la supervivencia general y la calidad de vida en pacientes con CL relacionada con el cáncer de mama.
ConclusiónEl conocimiento de la CL permite una detección y un tratamiento más temprano, mantiene la calidad de vida y prolonga la supervivencia. Ante un cáncer de mama con cuadro clínico de lesión neurológico focal deben efectivizarse todos los exámenes que se han mencionado: RM de cerebro-columna total y estudio de LCR. Además, apoyarse de los factores pronósticos para identificar el subgrupo de pacientes que serían candidatos para un enfoque de manejo intensivo. Sin embargo, se necesita más investigación para determinar las mejores opciones de tratamiento.
FinanciaciónEste estudio fue financiado por el departamento de radioterapia del Instituto Regional de Enfermedades Neoplásicas del Centro.
Conflicto de interesesNo existen potenciales conflictos de intereses con esta investigación.
Los autores agradecen a la Dirección Regional de Salud de Junín, Instituto Regional de Enfermedades Neoplásicas del Centro, y a la Universidad Peruana Los Andes.