Existen reportes de mioclonus, extrapiramidalismo y neuropatía periférica asociados a anticuerpos anti GAD, pero no existen reportes de todas estas características en un solo paciente.
Caso clínicoPaciente mujer de 30 años, diabética. Consulta por cuadro de retención urinaria e hipotensión ortostática. Al examen presentaba extrapiramidalismo, polimioclonus y signos de neuropatía sensoriomotora.
Los anticuerpos anti GAD por ELISA en suero y líquido cefalorraquídeo fueron positivos.
La paciente fue tratada con dos ciclos de inmunoglobulina endovenosa y azatioprina, con reversión de los síntomas.
DiscusiónEn pacientes con patologías autoinmunes y síntomas neurológicos multifocales debería sospecharse un síndrome por anticuerpos anti GAD.
There are reports of myoclonus, extrapyramidal, peripheral neuropathy associated with anti GAD antibodies, but no reports of all these features in a single patient.
Clinical case30 years old female patient, diabetic. She complained of urinary retention and orthostatic hypotension. Phyisical examination showed extrapyramidal signs, polimioclonus and sensorimotor neuropathy signs.
Anti GAD antibodies (ELISA) in serum and cerebrospinal fluid were positive.
The patient was treated with 2 cycles of intravenous immunoglobulin and azathioprine, showing clinical improvement.
DiscussionIn patients with autoimmune diseases and multifocal neurological symptoms, an anti-GAD syndrome should be suspected.
La enzima ácido glutámico descarboxilasa (65 Kda) cataliza la conversión de glutamato a ácido gamma amino butírico (GABA), encontrándose en el sistema nervioso central y en el páncreas.
Los anticuerpos anti ácido glutámico descarboxilasa (GAD) son considerados marcadores de autoimunidad en diabetes mellitus tipo 1 (se encuentran en el 80% de estos pacientes), incluso pueden ser encontrados en el suero de estos pacientes antes del inicio de la diabetes1,2. El rol patogénico de estos anticuerpos es desconocido. Los anticuerpos anti GAD también han sido encontrados en diversos desórdenes neurológicos1–7.
Existen reportes de mioclonus, extrapiramidalismo y neuropatía periférica asociados a anticuerpos anti GAD3, pero no existen reportes de todas estas características en un solo paciente.
Nuestro objetivo es describir un caso de polimioclonus, extrapiramidalismo, neuropatía periférica y disautonomía asociado a anticuerpos anti GAD.
Caso clínicoPaciente de 30 años, de sexo femenino, con antecedentes de osteoporosis, diabetes insulino-dependiente con inicio a los 23 años, amenorrea secundaria, anemia con volumen elevado y dosis baja de vitamina B12. Antecedentes familiares desconocidos; niega el consumo de tóxicos. Consultó inicialmente por palpitaciones, y fue evaluada constatándose taquicardia sinusal, que se interpretó como probable trastorno disautonómico. Luego comenzó con molestias urinarias que fueron progresando hasta que presentó episodios de retención urinaria, sin lograr diuresis espontánea, con necesidad de sondaje intermitente. Concomitantemente relata la aparición de sacudidas musculares bruscas y breves en los cuatro miembros. Posteriormente notó sensación de lentitud y menor motilidad en las manos. Finalmente presentó registros de hipotensión arterial y sensación de parestesias en guante en los miembros superiores (MMSS) inicialmente y después en los miembros inferiores, en los muslos, con irradiación a la región externa de la pierna y el dorso de ambos pies.
En el contexto de ingreso por infección de tracto urinario (ITU) y mal control de glucemias se solicitó evaluación neurológica. El cuadro clínico había comenzado de forma lentamente evolutiva desde hacía tres meses.
Examen físicoReflejo nasociliar inagotable, leve hipomimia, arreflexia de miembros inferiores con fuerza conservada, mioclonías posturales multifocales que disminuyen en reposo en los 4 miembros. El examen de la sensibilidad fue normal; rigidez en rueda dentada en MMSS 3/4 a la izquierda y 1/4 a la derecha, sin bradicinesia.
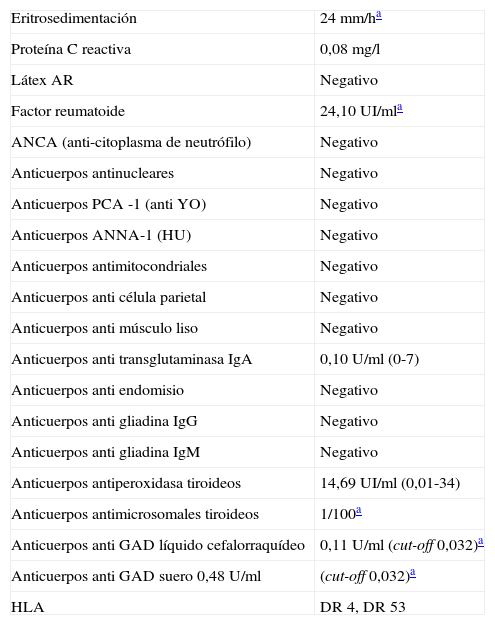
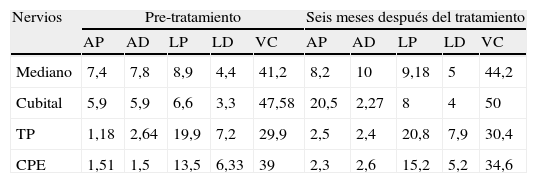
Exámenes complementariosDiscreta anemia con ionograma, CPK (creatinfosfoquinasa) función renal y hepatograma normales. Ácido fólico y homocisteína normales con discreta disminución de la dosis de vitamina B12. Se solicitaron parámetros de laboratorio para el estudio de enfermedades autoinmunes sistémicas (tabla 1) y se realizó punción lumbar (tabla 2). En la ecografía transvaginal se observaron quistes ováricos simples, con el resto dentro de parámetros fisiológicos. La resonancia magnética (RM) de cráneo, columna cervical, dorsal y lumbar estuvo dentro de los parámetros de la normalidad. El electromiograma (EMG) puso de manifiesto neuropatía mielínica de miembros superiores y axonomielínica de miembros inferiores (se presenta tabla comparativa de cuatro nervios con un estudio basal y un control a los 6 meses en tabla 3). El electroencefalograma (EEG) fue normal. La biopsia de estómago mostró signos de inflamación crónica leve sin atrofia ni displasia.
Parámetros de laboratorio: estudios inmunológicos
| Eritrosedimentación | 24mm/ha |
| Proteína C reactiva | 0,08mg/l |
| Látex AR | Negativo |
| Factor reumatoide | 24,10 UI/mla |
| ANCA (anti-citoplasma de neutrófilo) | Negativo |
| Anticuerpos antinucleares | Negativo |
| Anticuerpos PCA -1 (anti YO) | Negativo |
| Anticuerpos ANNA-1 (HU) | Negativo |
| Anticuerpos antimitocondriales | Negativo |
| Anticuerpos anti célula parietal | Negativo |
| Anticuerpos anti músculo liso | Negativo |
| Anticuerpos anti transglutaminasa IgA | 0,10 U/ml (0-7) |
| Anticuerpos anti endomisio | Negativo |
| Anticuerpos anti gliadina IgG | Negativo |
| Anticuerpos anti gliadina IgM | Negativo |
| Anticuerpos antiperoxidasa tiroideos | 14,69 UI/ml (0,01-34) |
| Anticuerpos antimicrosomales tiroideos | 1/100a |
| Anticuerpos anti GAD líquido cefalorraquídeo | 0,11 U/ml (cut-off 0,032)a |
| Anticuerpos anti GAD suero 0,48 U/ml | (cut-off 0,032)a |
| HLA | DR 4, DR 53 |
Parámetros electromiográficos iniciales y en la evolución (lado izquierdo)
| Nervios | Pre-tratamiento | Seis meses después del tratamiento | ||||||||
| AP | AD | LP | LD | VC | AP | AD | LP | LD | VC | |
| Mediano | 7,4 | 7,8 | 8,9 | 4,4 | 41,2 | 8,2 | 10 | 9,18 | 5 | 44,2 |
| Cubital | 5,9 | 5,9 | 6,6 | 3,3 | 47,58 | 20,5 | 2,27 | 8 | 4 | 50 |
| TP | 1,18 | 2,64 | 19,9 | 7,2 | 29,9 | 2,5 | 2,4 | 20,8 | 7,9 | 30,4 |
| CPE | 1,51 | 1,5 | 13,5 | 6,33 | 39 | 2,3 | 2,6 | 15,2 | 5,2 | 34,6 |
AD: amplitud distal; AP: amplitud proximal; CPE: ciático poplíteo externo; LD: latencia distal; LP: latencia proximal; TP: tibialposterior; VC: velocidad de conducción.
El fondo de ojo, evaluado por Oftalmología, no mostró evidencia de retinopatía diabética.
EvoluciónSe constató empeoramiento clínico con hipotensión ortostática que obligaba al decúbito, mal control de glucemias, bradicinesia con alteración en la prueba de los dedos y puño, aumento de parestesias con alodinia en bota y guantes, debilidad en flexoetensión de los dedos y muñecas y arreflexia de MMSS. Presentó infecciones del tracto urinario a repetición con rescate de gérmenes multirresistentes. Presentaba también síntomas depresivos e insomnio.
Se inició tratamiento con fludrocortisona (hasta 0,4mg/día), fluoxetina 10mg/día, gabapentina 1.800mg/día, clonacepam 2mg/día, insulina ultrarrápida y lenta y quetiapina 25mg/día.
Se solicitó anticuerpos anti GAD con resultado en el líquido cefalorraquídeo: 0,11 U/ml (valor de corte 0,032) y en suero: 0,48 U/ml (valor de corte 0,032)12.
Se decidió tratamiento con plasmaferésis (tres ciclos) con mejoría parcial durante 7 días.
Paulatinamente comienza con empeoramiento insidioso. Un mes después del primer ciclo de plasmaferésis se realizó infusión de 115 g de inmunoglobulina endovenosa (IgEV). Se mantuvo sin cambios durante 15 días, cuando presentó mejoría llegando a poder caminar sin hipotensión ortostática y constatándose reaparición de reflejos en MMSS. Esta mejoría se mantuvo por 15 días con empeoramiento posterior a su estado previo al primer ciclo de inmunoglobulinas; sin embargo se mantuvo estable su control de glucemias y se normalizó su nivel de vitamina B12 con reemplazo oral.
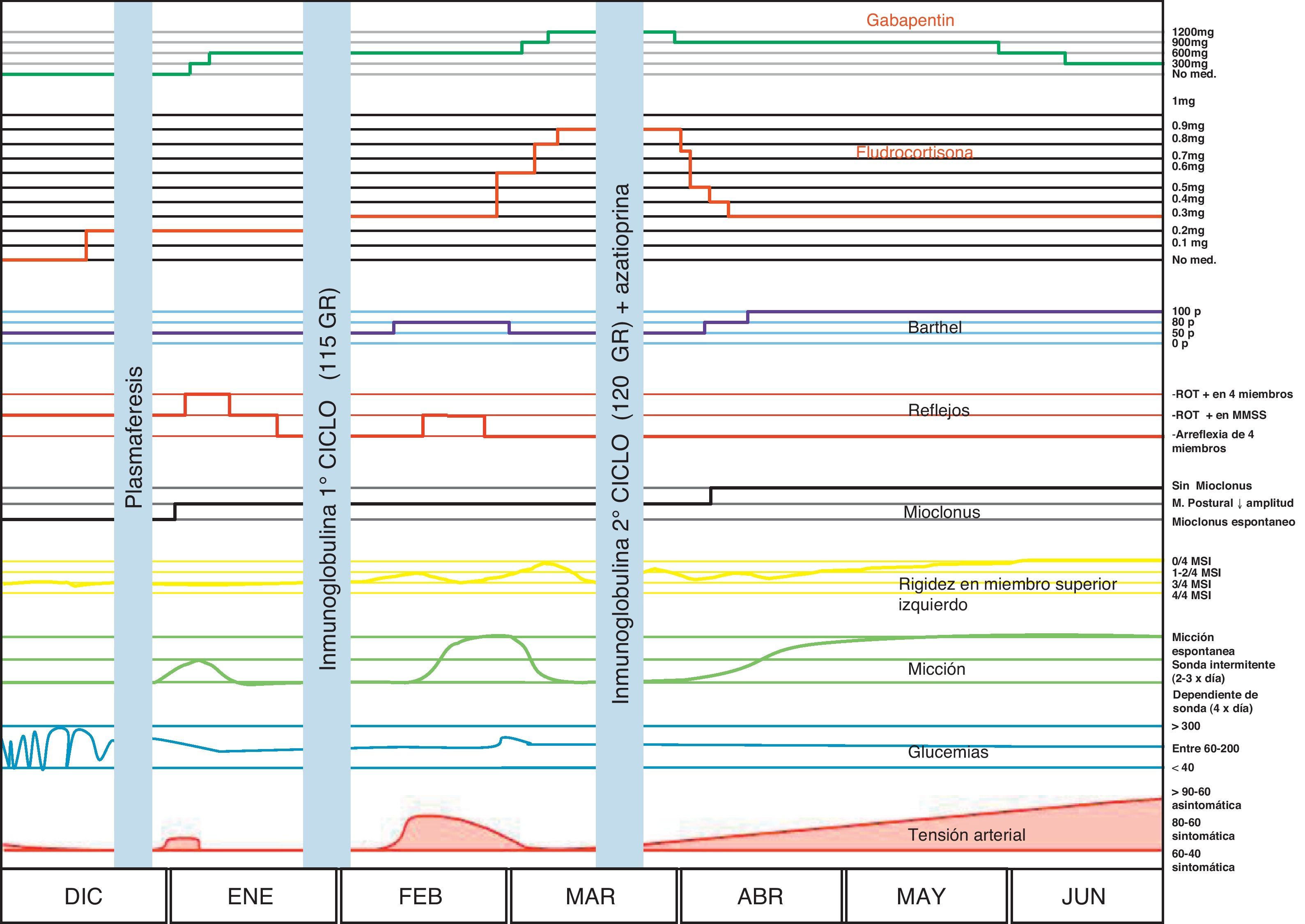
Se decidió realizar un nuevo ciclo de IgEV y se inició tratamiento con azatioprina hasta 1,5mg/kg/día. Recibió un segundo ciclo de 120 g, sin complicaciones. A los 10 días presentó franca mejoría caracterizada por paulatina desaparición de síntomas extrapiramidales, micción espontánea sin requerimiento de sondaje intermitente, con residuo posmiccional de 5 cc y pseudopólipos (se interpretó como cambios secundarios a vejiga de lucha), desaparición del polimioclonus, normalización del hemograma, normalización de la fuerza muscular, buen control de glucemias con hemoglobina glucosilada de 6,1mg/dl, mejoría de parestesias con requerimiento de 300mg/día de gabapentina, la paciente realiza actividad deportiva manteniendo dosis de 0,3mg/día de fludrocortisona con aislados registros asintomáticos de TA de 80/60mm Hg. Esta mejoría se mantiene hasta el día de la fecha, encontrándose aún bajo tratamiento con azatioprina. La evolución se resume en la figura 1.
DiscusiónEl rol patogénico de los anticuerpos anti GAD es discutido. Sin embargo, se sabe que los títulos de anticuerpos son significativamente más altos que en los pacientes con diabetes tipo 1 o síndromes poliglandulares1.
Los anticuerpos anti GAD se asocian con enfermedades neurológicas en algunos casos, pudiéndose demostrar la síntesis intratecal de los mismos, y no así en pacientes con diabetes tipo 1 solamente1,8. El cuadro clínico que más se asocia a anticuerpos anti GAD es el síndrome del hombre rígido; los anticuerpos son positivos en suero hasta en un 60-80% de los casos y el LCR hasta en un 60%7,8. Es más frecuente en mujeres.
Existe también una forma de ataxia cerebelosa subaguda asociada a estos anticuerpos1. También se ha reportado compromiso cortical con síndromes que incluyen epilepsia y encefalitis con síntomas cognitivos4,13. Una serie de casos de 65 pacientes publicada en 20063 reportó un 63% de afectación cerebelosa, un 29% de compromiso de tronco cerebral, un 31% de compromiso cortical, un 8% de compromiso medular, un 6% de afección de nervios periféricos, un 16% de compromiso extrapiramidal y un 3% de mioclonus.
El compromiso extraneurológico es también frecuente. Además de diabetes tipo 1 existe una asociación con diversas enfermedades autoinmunes: tiroiditis autoinmune, psoriasis, vitíligo, anemia perniciosa, miastenia gravis, insuficiencia suprarrenal y sensibilidad al gluten1,3,7,9. Es frecuente la asociación con síndromes poliglandulares autoinmunes. Existen tres tipos de síndromes poliglandulares; el tipo III se caracteriza por tiroiditis autoinmune y la presencia de diabetes, anemia perniciosa o hipogonadismo primario sin adrenalitis autoinmune10,11,13.
Nuestra paciente presenta diabetes tipo 1 y anticuerpos antimicrosomales tiroideos positivos. Presentaba déficit de vitamina B12 que mejoró con suplemento vitamínico oral, los anticuerpos y la biopsia descartaron gastritis atrófica. La amenorrea se interpretó como secundaria.
Neurológicamente comenzó con síntomas de disautonomía. Se desconoce el rol patogénico de estos anticuerpos en la génesis de alteración disautonómica. La hipotensión fue el síntoma mas discapacitante, obligando a la paciente a permanecer en decúbito varias semanas y a recibir altas dosis de mineralocorticoides. El compromiso vesical provocó importante morbilidad (ITU) e incapacidad funcional y social. Debido a las infecciones no pudo realizarse estudio urodinámico, aunque la sospecha fue vejiga neurogénica por compromiso nervioso periférico. Los síntomas neurológicos mejoraron siempre con el tratamiento instaurado, lográndose una mejoría sostenida con el segundo ciclo de IgEV y azatioprina.
El compromiso nervioso periférico fue compatible con patrón axono-mielínico en MMII y mielínico en MMSS agregando compromiso axonal en la evolución. La mejoría clínica fue evidente, sin embargo la paciente persiste con arreflexia y compromiso neurofisiológico.
Existe discusión acerca de si el compromiso del sistema nervioso periférico podría deberse a su diabetes, que inicialmente fue de difícil control. La ausencia de daño en otro órgano blanco (nefropatía, retinopatía) y la respuesta al tratamiento inmunosupresor hacen esta hipótesis menos probable, aunque no se puede descartar que el daño axonal observado en las pruebas neurofisiológicas pueda ser secundario a la diabetes.
El polimioclonus y el extrapiramidamismo fueron mejorando paulatinamente y hablan de un compromiso del sistema nervioso central.
El método diagnóstico utilizado fue ELISA; esta técnica fue validada en Argentina y se utiliza como técnica inicial, pues tiene menor sensibilidad que el radioinmunoanálisis, pero una especificidad del 97%. Los valores tanto en suero como el LCR superaron a los valores de corte por más de dos desviaciones estándar12 (Laboratorio de Inmunoendocrinología, CONICET-UBA).
El tratamiento para la diabetes asociada a la presencia de anticuerpos anti GAD no demostró ser efectivo14.
Se proponen esquemas terapéuticos como corticoideotrapia, considerados de primera línea para el tratamiento del síndrome de la persona rígida7. El tratamiento con corticoides se reportó poco efectivo para pacientes con otros síndromes neurológicos distintos del síndrome de la persona rigida3, con algunos beneficios con plasmaferésis e inmunoglobulina endovenosa. Una publicación propone la inmunoglobulina como primera línea de tratamiento para las ataxias autoinmunes15, siendo altamente efectiva en el 57% de los pacientes tratados. Se han reportado casos de epilepsia con buen control con ciclofosfamida y azatioprina6,16.
En nuestro caso se realizó tratamiento con plasmaferésis que resultó en breve mejoría. Ante la recaída se decidió realizar tratamiento con inmunoglobulina con una primera regular respuesta, sin embargo ante la segunda recaída se decidió agregar azatioprina al tratamiento como terapia de mantenimiento. Los corticiodes no parecieron una opción razonable debido a la diabetes, y la ciclofosfamida nos pareció arriesgada debido al compromiso vesical. La paciente ha mantenido su mejoría. La pregunta por responder es si esta tendencia se mantendrá y por cuánto tiempo deberá continuar con azatioprina.
ConclusiónEn todo paciente con patologías autoinmunes sistémicas y síntomas neurológicos multifocales debería sospecharse un síndrome por anticuerpos anti GAD.-
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.