En la actualidad existen diversas alternativas terapéuticas para modificar el curso de la esclerosis múltiple con un sólido sustento de guías de práctica y ensayos clínicos publicados; sin embargo, no existe un consenso unívoco en cuanto a los criterios de suspensión de la terapia, y son escasos los estudios abocados a este tema. Identificadas las razones para suspender la terapia modificadora de la enfermedad, esta revisión aborda este problema desde tres perspectivas: la plausibilidad biológica (edad, tiempo libre de actividad, evolución a formas progresivas, características de la medicación), la evidencia publicada (guías de práctica clínica, ensayos clínicos, estudios observacionales) y los valores y expectativas del paciente (participación en la toma de decisiones, postura del médico, costos para el sistema de salud). Se pretende, por lo tanto, identificar un perfil de paciente apto para la suspensión de la terapia mediante esta aproximación multidimensional.
At present time, there are several therapeutic alternatives to modify the course of multiple sclerosis, with a solid support of published practice guidelines and clinical trials. However, there is no univocal consensus regarding the criteria for the discontinuation of therapy, and there are few studies referring to this topic. After identifying the reasons for discontinuing the disease-modifying therapy, this review addresses this issue from three different perspectives: biological plausibility (age, time free of activity, evolution to progressive forms, characteristics of the medication), published evidence (clinical practice guidelines, clinical trials, observational studies), and patient values and expectations (involvement in decision-making, doctor's position, costs for the health system). The aim, therefore, is to identify a patient profile suitable for the discontinuation of therapy through this multi-dimensional approach.
En los últimos años la información nueva acerca de las alternativas terapéuticas en esclerosis múltiple (EM) ha crecido en forma exponencial (tabla 1). Entre los artículos que se pueden encontrar publicados existen excelentes datos, muchos de ellos de calidad, acerca de mecanismos de acción, aspectos farmacocinéticos, eficacia y perfil de seguridad. Incluso existe información comparativa entre fármacos que permite establecer cierta jerarquía en cuanto a perfiles de eficacia y seguridad. Toda esta información reunida permite tanto al médico como al paciente decidir cuál es la mejor alternativa de tratamiento para iniciar, e incluso cuáles serían las mejores opciones de cambio en caso de falla terapéutica.
Terapias modificadoras de la enfermedad utilizadas en la actualidad
| Fármaco | Vía y frecuencia de administración |
|---|---|
| Interferón beta 1 a | Subcutáneo 3 veces por semana |
| Intramuscular 1 vez por semana | |
| Interferón beta 1 b | Subcutáneo día por medio |
| Peginterferón beta 1 a | Subcutáneo cada 2 semanas |
| Acetato de glatiramer | Subcutáneo una vez por día |
| Subcutáneo 3 veces por semana | |
| Teriflunomida | Oral una vez por día |
| Dimetilfumarato | Oral dos veces por día |
| Fingolimod | Oral una vez por día |
| Natalizumab | Endovenoso una vez por mes |
| Alemtuzumab | Endovenoso dos ciclos separados por un año |
| Ocrelizumab | Endovenoso cada 6 meses |
| Cladribine | Oral dos ciclos separados por un año |
De todos modos, en contraste a esta plétora de información, existe una llamativa ausencia de información acerca de la suspensión de tratamiento. Frecuentemente los pacientes preguntan al médico tratante acerca de la perpetuidad o no de la terapia modificadora de la evolución de la enfermedad (TME), y en buena parte de los casos el médico no tiene la misma fuerza de recomendación para elegir si suspender o no un tratamiento, y cuál sería el momento oportuno para hacerlo. Esto deja en claro una realidad: es más fácil iniciar un tratamiento que suspenderlo.
ObjetivoLa siguiente revisión pretende estudiar el tema de suspensión del tratamiento modificador de la enfermedad desde una perspectiva multidimensional, mediante una exhaustiva revisión bibliográfica, construyendo tres enfoques básicos para responder a esta pregunta: cuál sería la plausibilidad biológica para suspender un tratamiento, cuál es la mejor evidencia publicada que responda a esa pregunta, y cuáles son los valores y expectativas del paciente que entran en juego al tomar esta decisión.
Razones para discontinuar una TMEEn primer lugar, debe considerarse si el diagnóstico es correcto y si el paciente realmente necesita el tratamiento que está recibiendo. El error diagnóstico en EM es muy frecuente, y hasta un 95% de los especialistas refieren haberse encontrado en al menos una oportunidad con una situación así1. En estas circunstancias, corresponde al médico tratante recomendar la discontinuación de la TME, conociendo los desafíos que implica desetiquetar a un paciente con una enfermedad crónica2.
Una razón para discontinuar el tratamiento es por la aparición de un evento adverso relacionado con el tratamiento, particularmente cuando amenaza la vida del paciente, considerando que la EM de por sí no lleva a un incremento significativo en la mortalidad3. En una serie publicada en pacientes que recibían tratamientos inyectables los efectos adversos representaron el 52% de las razones para suspenderlo4. Las TME, sobre todo las más nuevas, exponen a los pacientes a un riesgo aumentado de complicaciones infecciosas, hematológicas, cardíacas y posiblemente neoplásicas que son potencialmente letales y deben ser estrictamente monitorizadas5.
Ocasionalmente, se decide la interrupción de la TME por precaución, determinada por factores que se saben que pueden incrementar el riesgo de algunos eventos adversos; por ejemplo, el riesgo de leucoencefalopatía multifocal progresiva en pacientes con serología JC positiva, exposición previa a inmunosupresores, y más de 2años de tratamiento con natalizumab. O el riesgo de infecciones oportunistas en pacientes tratados con fingolimod o dimetilfumarato con linfopenia persistente3.
Una cuarta razón para suspender el tratamiento es la sospecha o evidencia del incumplimiento del tratamiento. Ocasionalmente pacientes que no observan un beneficio sintomático con la TME o que no perciben cambios en el tiempo pueden reducir la adherencia al tratamiento indicado. La falta de adherencia está descripta como factor de riesgo para un pobre control de la actividad de la enfermedad y progresión, por lo que si no puede revertirse o controlarse, la TME debería ser discontinuada6.
Por último, la transición a formas progresivas de la enfermedad, con empeoramiento en las escalas de discapacidad, sin evidencia de actividad inflamatoria o recaídas, puede ser un motivo de suspensión3.
Plausibilidad biológica de la suspensión de una TMELa EM es una enfermedad autoinmune que se caracteriza, en etapas tempranas, por lesiones inflamatorias multifocales en el sistema nervioso7. El blanco de la mayor parte de los tratamientos actuales es la reducción de la actividad inflamatoria. Con el tiempo, la actividad inflamatoria tiende a atenuarse, con un patrón neurodegenerativo en ascenso. Esto explica la reducción de frecuencia de brotes o lesiones nuevas en resonancia, en consonancia con una progresión de la discapacidad y disminución del volumen cerebral. Esto habla de mecanismos diferentes puestos en juego, que podrían llevar a una falta de respuesta terapéutica del fármaco luego de un tiempo de su uso8.
EdadUn factor fundamental para considerar, por lo tanto, es la edad. Existe evidencia de que la actividad por recaídas se reduce con la edad, siendo muy infrecuente luego de los 60años, independientemente de la edad de inicio o el curso de la enfermedad9. Además, en la población normal sana el sistema inmunológico se vuelve menos funcional a esa edad, concepto conocido como inmunosenescencia10.
En un metaanálisis de ensayos clínicos aleatorizados a doble ciego entre TME y placebo o comparador activo se demostró inequívocamente que la eficacia de la TME disminuye con la edad. La edad es mejor predictora de inhibición de progresión de discapacidad por una TME que la escala expandida de discapacidad (EDSS)11.
Otros factores para tener en cuenta al utilizar TME en pacientes de más de 60años son la potencial predisposición a infecciones o la mayor frecuencia de comorbilidades.
En una cohorte retrospectiva de 600 pacientes mayores de 60años7, de los cuales se discontinuó la medicación en el 30%, se encontró que la discontinuación es más exitosa cuando se considera la edad, en comparación con la sola estabilidad. En este estudio la tasa de reinicio de tratamiento fue cercana al 10%, mayoritariamente por preferencia de los pacientes. Estos resultados están en concordancia con un estudio reciente que comparó dos grupos de pacientes con EM: el primero incluía 77 sujetos con EM secundaria progresiva (EMSP) sin evidencia de actividad inflamatoria por 2 a 20años, a los que se les recomendó suspender la TME, y el otro grupo consistió en 17 pacientes con EM forma recaídas remisiones (EMRR) que suspendieron la TME por su cuenta. Ambos grupos fueron seguidos por al menos un año luego de la suspensión del tratamiento. No se observó actividad en el 88% de los mayores de 60años cuando no habían mostrado actividad previa por más de 2años. Cerca del 60% del grupo de pacientes con EMRR evidenciaron recurrencia de actividad12.
Tiempo libre de actividadOtro escenario en el que se podría plantear la suspensión de las TME es el período libre de actividad medido por recaídas o resonancia magnética (RMI). Como se comentó anteriormente, podría plantearse la situación de que la actividad inflamatoria de la enfermedad es mayor durante los primeros años de enfermedad, por lo cual tendría sentido el planteo de suspender el tratamiento una vez pasado ese período de mayor inflamación. En una cohorte retrospectiva de 1.300 pacientes del registro internacional MSBase13 en pacientes libres de actividad por más de 5años se encontró que el tiempo a la primera recaída entre los que suspendieron y los que mantuvieron las TME fue similar, mientras que el tiempo para progresión confirmada de discapacidad fue significativamente menor para el grupo en tratamiento (aHR 1,47; IC95%: 1,18- 1,84). El riesgo de recaídas entre los que suspendieron fue mayor en pacientes más jóvenes y menos discapacitados, consistente con los estudios mencionados de relación entre edad y actividad. Estos hallazgos podrían interpretarse como una respuesta a las TME que va más allá de la actividad inflamatoria, modificando también la progresión de la discapacidad13.
De acuerdo con lo observado en una serie prospectiva estadounidense, de los pacientes con un EDSS menor a 3 a los 10años de inicio de la enfermedad el 83% mantenían deambulación sin asistencia los siguientes 10años14. A este grupo particular de pacientes se le podría considerar como un grupo de pronóstico favorable, y se le debería exigir un alto grado de actividad en recaídas y nuevas lesiones como para justificar la continuación con TME luego de 10años.
Podría ser razonable pensar que el beneficio potencial del tratamiento declina con el tiempo y que puede existir un punto en el que ya no agrega ventajas al paciente, independientemente de que haya ingresado o no en una fase progresiva de la enfermedad. La decisión sobre cómo actuar en esta situación es compleja, al no haberse realizado ensayos clínicos aleatorizados sobre este punto, y al no encontrar guías de práctica con fuerzas de recomendación significativa. De todos modos, debido a la ausencia de evidencia sólida al respecto, no se pueden ofrecer recomendaciones sobre la discontinuación en pacientes luego de un período libre de enfermedad, dejándose a criterio del médico tratante y a las preferencias del paciente.
Formas secundarias progresivasHay estudios publicados que muestran diferencias entre EMRR y EMSP en términos de entorno inflamatorio, respuestas celulares y localización de lesiones encefálicas y medulares. A medida que la EM progresa, la frecuencia de recaídas y los indicadores de inflamación en RMI declinan, en la medida que la discapacidad empeora. Este fenómeno ha sido explicado por la sucesión de procesos degenerativos combinados con mecanismos inflamatorios compartimentalizados y relacionados con un sistema mediado por inmunidad innata15. De todos modos, existe aún el debate acerca de si las formas con recaídas y secundarias debieran considerarse como dos entidades nosológicas diferentes o como solo dos fases de la misma enfermedad, aunque se acepta que forman parte de un continuo16. En la EMRR se observa daño axonal extenso en las lesiones agudas, pero los déficits clínicos en estas recaídas son mayoritariamente reversibles, en la medida que el sistema nervioso tiene una enorme capacidad de compensar la pérdida neuronal. Con el tiempo y la actividad inflamatoria en curso, la pérdida axonal puede llevar a la conversión a formas EMSP, cuando el cerebro agota su capacidad de compensar tanta pérdida neuronal. La entrada a esta fase representa un cambio insidioso en la persona afectada por EMRR, y la recuperación de las recaídas comienza a ser inefectiva17. Entonces existe un grupo importante de pacientes que evolucionan de una EMRR a una EMSP, independientemente del tratamiento con TME.
Una publicación evaluó el potencial beneficio en estos pacientes y sugiere que las recaídas en los primeros años del inicio de la EM pueden contribuir a la discapacidad, especialmente en los primeros años de progresión18. Las TME orientadas al mecanismo inflamatorio podrían, basándonos exclusivamente en la plausibilidad biológica, ser razonablemente discontinuadas una vez que el paciente ingresa en la forma secundaria progresiva, a no ser que se demuestre clínicamente, o por imágenes, evidencia de un proceso inflamatorio en curso (fig. 1). Actualmente podría considerarse la suspensión de las TME como una decisión extremadamente personal e individual. Esta decisión podría considerar no solo la actividad de la enfermedad en términos de recaídas y carga lesional, sino en escalas de calidad de vida e independencia para las actividades de la vida diaria19.
Características de la TMEDe las alternativas terapéuticas de las que se dispone actualmente, cada una tiene un particular mecanismo de acción, por lo que se podría asumir que biológicamente no es equivalente el efecto de la suspensión entre ellas. Se ha descripto que la suspensión de interferones o acetato de glatiramer se acompaña de estabilidad luego de 2años en un 65%, mientras que para natalizumab se pudo obtener solo en un 23%, considerando que un tercio de los pacientes mostraron incremento de la actividad de rebote20.
Es probable que tanto fingolimod como natalizumab no alteren la respuesta autoinmune subyacente a la EM, sino que la mantienen alejada del sistema nervioso central. Por lo tanto, no parecería razonable suspender estas drogas sin ofrecer una terapia alternativa21,22.
Consecuencias potenciales de la suspensión inadecuada de la TMELa suspensión en etapas tempranas de la enfermedad puede resultar en un regreso de la actividad inflamatoria. Los pacientes con EMRR que fueron tratados con interferón beta y luego discontinuaron volvieron aproximadamente a los 2años a la actividad previa de base23. En una cohorte de pacientes con EMRR se observó un retorno a la actividad de enfermedad previa a los 7meses de discontinuación de la TME24. En el caso puntual del natalizumab, está claramente definido el incremento de la actividad de la enfermedad luego de su suspensión25. En una serie retrospectiva de 201 pacientes que discontinuaron natalizumab, el 12% experimentaron un fenómeno de rebote a los 12meses, especialmente en aquellos con baja actividad antes del inicio de la terapia26. También existen reportes del mismo efecto con fingolimod, donde se describió un retorno a la actividad pretratamiento dentro de los 3meses en 6 pacientes, con un incremento de rebote en uno de ellos22.
Evidencia publicadaGuías de práctica clínicaEn las guías recientemente publicadas por la American Academy of Neurology27 se discute la problemática de la suspensión. Con un nivel de recomendaciónB (debería hacerse) se propone que en pacientes con EMRR estables con una TME que quieren discontinuar la terapia se sugiere aconsejarlos acerca de la necesidad de seguimiento y reevaluación periódica de la decisión de discontinuarlo. Con el mismo nivel de evidencia se recomienda al médico insistir al paciente estable con continuar el tratamiento a no ser que se lo enrole en un estudio de suspensión de tratamiento. Además, se recomienda con nivelB evaluar la probabilidad de recaídas futuras en individuos con EMSP, considerando edad, duración de la enfermedad, historia de recaídas y actividad en RM. Puede recomendarse suspensión en pacientes con EMSP que no han tenido recaídas y que no deambulan (EDSS 7 o más) por al menos 2años (nivel C: podría hacerse). En pacientes con síndrome desmielinizante aislado (CIS) que no presentaron posteriormente evidencia de actividad, se recomienda con nivelB discutir los riesgos y beneficios de suspender la TME, aunque no especifica cuánto tiempo debería esperarse para discutir el tema con el paciente.
Las guías de la Association of British Neurologists28, desarrolladas sin métodos explícitos y sin recomendaciones basadas en evidencia, reconocen el lugar central de la decisión del paciente y argumentan que no es posible hacer indicaciones obligatorias de suspensión que apliquen a todos los casos. Recomiendan considerar la suspensión cuando hay desarrollo de formas progresivas y en efectos adversos significativos (en este caso con planteo de utilizar TME alternativas).
Ensayos clínicosNo hay estudios que evalúen en forma directa la continuación versus la suspensión de TME en poblaciones comparables. Una revisión de efectividad comparativa29 incluyó 12 estudios observacionales sobre discontinuación de las TME. De la información obtenida, se concluyó que, debido a la gran variación en reportes de discontinuación, no se puede realizar una agregación útil de estudios. También se encontró que todos los estudios reportaron uno o más efectos adversos, ineficacia o progresión de la discapacidad como razones de discontinuación, y que no se exploraron las razones de los pacientes para discontinuar.
Estudios observacionales de adherencia y persistenciaExisten diversos estudios que apuntan a la suspensión del tratamiento desde la óptica de la adherencia, generalmente medida por la cantidad de días que el paciente realmente recibe la medicación sobre los días totales que se espera que la reciba; y de la persistencia, definida como el tiempo hasta la discontinuación de la TME30. En este aspecto, los estudios publicados difieren en cuanto a las características socioeconómicas de los pacientes, acceso al sistema de salud y metodología utilizada, por lo que puede que la validez externa no sea la más aplicable. Un estudio basado en bases de datos poblacional en Canadá30, donde se incluyeron 4.830 pacientes que recibían interferones o acetato de glatiramer, mostró una adherencia del 76,4% (IC95%: 69,1-82,4) con una mediana de discontinuación de la TME inicial de 1,9años (IC95%: 1,6-2,1). En un estudio retrospectivo de casi 1.500 pacientes que recibían TME orales, tomando las bases MarketScan Commercial y Medicare Supplemental, se encontró que el hazard ratio (HR) para discontinuación fue de 1,93 (IC95%: 1,44-2,59) para dimetilfumarato y de 2,27 (1,57-3,28) comparado con fingolimod31.
Estudios observacionales en formas secundarias progresivasAunque existen estudios que sugieren que las TME tienen un impacto positivo evitando la EMSP o demorando su inicio32, muchos pacientes desarrollan EMSP con una discapacidad significativa luego de 10-15años de enfermedad y continúan usando TME cuando ya no es clínicamente efectiva. En una serie prospectiva de 100 pacientes con EMSP33, con ese fenotipo desde al menos 2años, bajo TME durante al menos 6meses, con suspensión del tratamiento, se encontró que la tasa anualizada de recaídas se mantuvo estable hasta los 3años de suspensión del tratamiento. Dieciséis pacientes tuvieron recaídas y 19 tuvieron nuevas lesiones con realce al contraste durante el seguimiento. Los factores predictores de actividad luego de la suspensión fueron lesiones activas los 3años previos a la suspensión y un puntaje en la escala EDSS menor a 6.
Estudios observacionales de factores predictores de ausencia de actividad luego de la suspensiónEn una serie de 221 pacientes que discontinuaron las TME durante más de 12meses34 y que tuvieron un seguimiento documentado de más de 2años luego de la discontinuación se encontró que los predictores independientes de ausencia de recaídas fueron: edad mayor a 45años (HR 0,47; IC95%: 0,23-0,95), ausencia de recaídas por más de 4años bajo tratamiento con TME (HR 0,29; IC95%: 0,1-0,82) y ausencia de lesiones con realce al contraste (HR 0,46; IC95%: 0,28-0,78). Un predictor mayor fue la combinación de edad mayor a 45años y ausencia de recaídas por más de 4años bajo tratamiento (HR 0,06; IC95%: 0,01-0,44). La discapacidad medida por EDSS a la discontinuación, la edad mayor a 45años y la mayor duración de la enfermedad estuvieron significativamente asociadas con progresión de la discapacidad luego de la discontinuación.
Estudios observacionales del perfil del paciente que suspende el tratamientoLa respuesta esperable, como se ha comentado, no es homogénea para todos los pacientes, por lo que se podría armar un perfil de predicción de respuesta terapéutica, que sería de ayuda para determinar si el paciente se beneficia del tratamiento o no. En un metaanálisis de 6 ensayos clínicos de pacientes con EMRR35 en el que se usó como medida de efecto el efecto relativo (ER), definido como el efecto terapéutico en el subgrupo relativo al efecto general, se encontró que el efecto de la TME era mayor en pacientes jóvenes que en mayores (RE 0,83 vs. 1,30; p<0,001), en pacientes con lesiones con realce al gadolinio (RE 0,86 vs. 1,15; p=0,005) y en pacientes con menor EDSS (RE 0,96 vs. 1,23; p=0,02).
En una serie publicada en Polonia en 2011, sobre pacientes a quienes el sistema de salud les cubría sólo 2años de tratamiento, se observó un retorno a la actividad previa de la enfermedad tan sólo 6meses después de suspender el interferón23.
De la base de datos MSBase se condujo un análisis multivariado de supervivencia para determinar los factores predictores de discontinuación de tratamiento en pacientes con CIS y EM temprana, y se obtuvo que el 40% suspendieron su primera TME durante el período de seguimiento (mediana 2,7años). Los factores predictores encontrados fueron sexo femenino (HR 1,36; IC95%: 1,11-1,68), mayor EDSS (HR 1,12 por punto en EDSS; IC95%: 1,14-1,28), como también el lugar de residencia (más en Australia), y el tratamiento elegido (más con interferones que con acetato de glatiramer)36.
Una serie noruega de 424 pacientes con EMRR, de los cuales el 12,5% suspendieron el tratamiento, mostró como predictores de suspensión un nivel educativo de más de 13años (OR 2,9; IC95%: 1,19-7) y factores asociados a la TME (efectos adversos, ausencia de percepción de beneficio)37.
Valores y expectativas del pacienteLas preferencias y opiniones de los pacientes son claves a la hora de determinar la discontinuación de una TME. Por ejemplo, las expectativas de los pacientes con respecto a lo que esperan de un tratamiento pueden diferir de las del médico. En una serie española, los principales atributos que buscaban los pacientes en un tratamiento eran la menor posibilidad de tener efectos adversos, seguida por una reducción en la progresión de la discapacidad38, valores claramente diferentes de lo que el médico ofrece en virtud de los resultados de los ensayos clínicos: reducción de la tasa de recaídas y reducción de la actividad en RM.
La identificación de barreras para el uso de TME provee una oportunidad para identificar dificultades en los pacientes en el uso de estas terapias. Un prescriptor equipado con estos conocimientos puede preventivamente desarrollar estrategias para asegurar la persistencia y, por ende, los beneficios del tratamiento. Los pacientes pueden tener dificultades para desarrollar y mantener expectativas realistas. En un estudio que valoró las razones por las cuales los pacientes discontinuaban los tratamientos inyectables, la principal fue la percepción de falta de eficacia. Otras razones fueron tolerabilidad, frecuencia de aplicación y fobia a las agujas39.
En una serie alemana de 396 pacientes que suspendieron su TME, el 75% lo hicieron por cuenta propia, sin consultar con su médico. La razón más frecuente fue falta de eficacia demostrada o supuesta en el 51%, efectos adversos en el 58%, y quejas de fatiga o depresión, sin poderse identificar un perfil de pacientes en cuanto a sexo, duración del tratamiento o TME elegida. El 50% que suspendieron TME y no quisieron reiniciar otro tratamiento refirieron como razones la falta de convicción de que una terapia pudiera influenciar la enfermedad, miedo a las inyecciones, miedo a recordar regularmente la enfermedad y dudas en el diagnóstico40. Los datos expuestos sugieren que la adherencia puede promoverse cultivando un entorno terapéutico adecuado con cada paciente.
Las tasas reportadas de discontinuación de TME son muy variables en la literatura, fundamentalmente por las grandes diferencias entre poblaciones estudiadas, desenlaces elegidos y metodología utilizada. La razón principal para discontinuar un tratamiento dentro del primer año suelen ser los efectos adversos, y luego de un año de terapia, la ausencia de percepción de mejoría por parte del médico o del paciente15. Muchos pacientes esperan sentirse mejor una vez iniciado el tratamiento, pero esto no es lo que se pretende con el uso de la TME. Este simple concepto, que debería ser bien comprendido por los médicos, no siempre se traduce en una comprensión acabada por parte del paciente.
Dos estudios examinaron la búsqueda y el proceso de información por parte de los pacientes, pasos necesarios para la toma de decisiones41,42. El tipo y el tiempo de información buscada por pacientes con EM difirió dependiendo en la orientación individual hacia esa información, si la persona es buscadora de información básica (blunters) o más detallada (monitors). Los buscadores detallistas prefieren un alto ingreso de información antes que un evento estresante y sufrir menos excitación psicosocial cuando llega la información, mientras que los básicos prefieren menos información y sufren más excitación cuando llega un alto ingreso de información. La tendencia de una persona hacia una u otra tendencia difiere de acuerdo con el tiempo de diagnóstico. Los detallistas querían información tempranamente, mientras que los básicos preferían información más específica a medida que pasaba el tiempo con EM. Estos resultados sugieren que los pacientes llegan a la consulta con diferentes orientaciones hacia la información requerida para realizar una decisión compartida.
Diversos estudios muestran que los pacientes prefieren participar del proceso de toma de decisiones43-45. En estas series, la mayoría prefería una participación activa (68 al 79%). Las personas con EM mostraron una tendencia mayor a esa participación, en relación con pacientes con hipertensión arterial, depresión mayor, cáncer de mama o esquizofrenia. Y los que preferían el rol activo también tenían una mayor tendencia a conocer mejor los potenciales riesgos.
Los pacientes con EM y compromiso cognitivo pueden tener dificultades en la comprensión de las características del tratamiento. En esta situación, el reaseguro de la comprensión, la repetición de la información y el reconocimiento de señales llevó a una comprensión similar al nivel del grupo de controles sin deterioro42.
El médico, obviamente, también es un actor principal en el proceso de decisiones compartidas. Los médicos tienden a sobreestimar la preferencia del paciente por participar, y sus predicciones individuales no se correlacionan bien con las preferencias individuales de los pacientes44. De hecho, tanto los pacientes como observadores externos calificaron a sus médicos como con habilidades limitadas para incluir a los pacientes en el proceso de toma de decisiones46.
Una encuesta acerca de la experiencia en discontinuación de TME, basada en una muestra internacional de médicos47, mostró que las principales razones fueron ausencia de recaídas, evidencia de progresión de la enfermedad y EDSS de 6 a 8. Estas medidas fueron consideradas como indicadores de falta de eficacia, aunque en muchos países las políticas de reembolso también influían. La mayoría refirieron el desafío de optar entre discontinuar una TME si es tolerada, incluso si aparentaba una falta de eficacia. Los médicos tienden a dejar la elección a los pacientes en esta situación.
Costos para el sistema de saludLas TME representan aproximadamente el 75% del costo total de cuidado en pacientes con EM bajo tratamiento48. En la medida que aparecen nuevas opciones terapéuticas, estos costos se incrementan también. Considerando algunos aspectos discutidos, como pérdida de eficacia en el tiempo y tratamiento de pacientes con formas secundarias progresivas, el cociente costo-beneficio también se modifica a lo largo de la vida del paciente. Este elemento también tiene que ser considerado en las decisiones compartidas con el paciente.
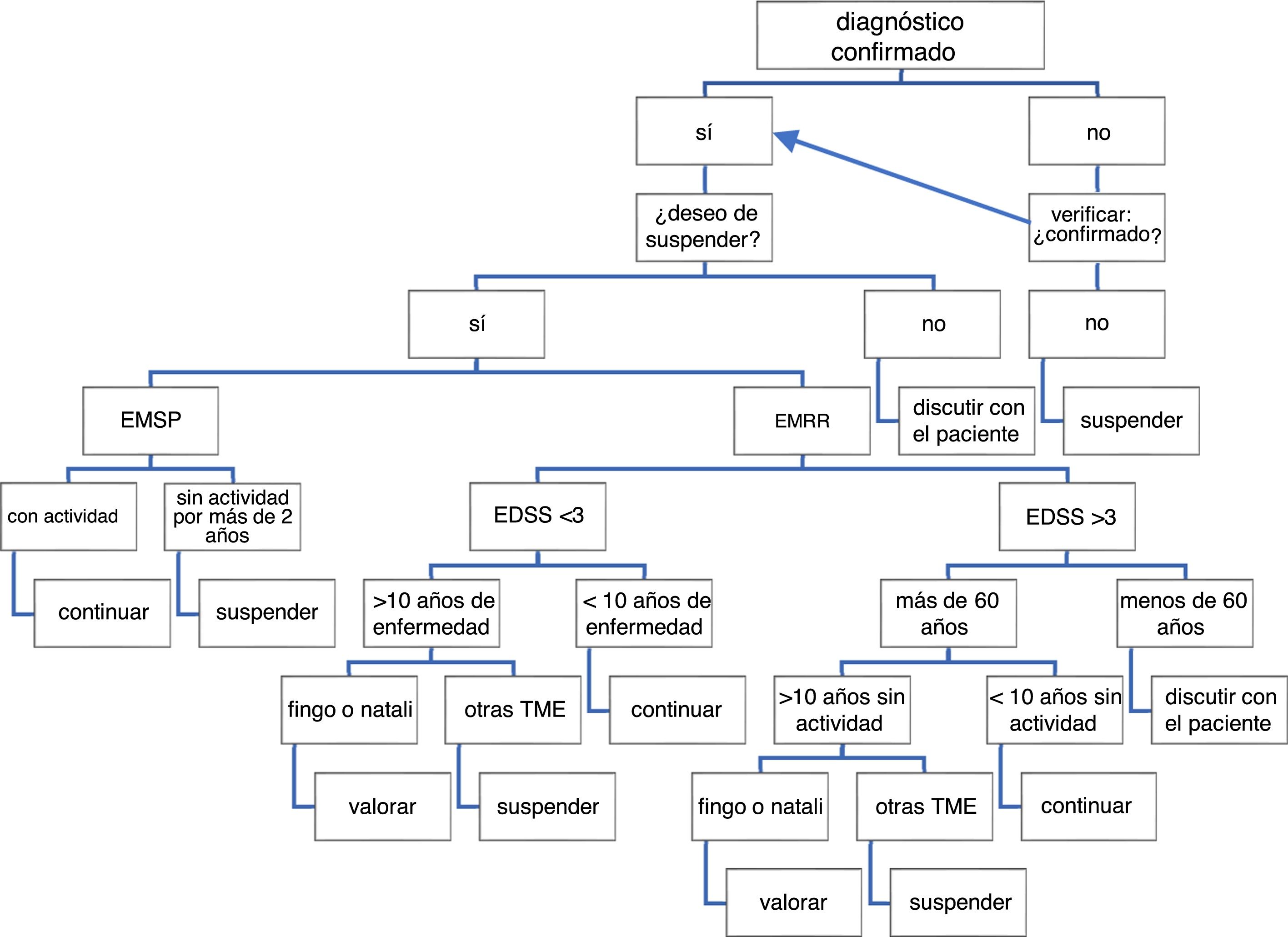
ConclusionesEn ausencia de evidencia sólida proveniente de ensayos clínicos, la decisión de suspender una TME es compleja y se basará en decisiones informadas compartidas con el paciente, considerando los datos incompletos con los que se cuenta. Esta discusión incluirá la información sobre los beneficios y riesgos potenciales de la decisión a tomar. Debe considerarse que no se puede garantizar completamente la ausencia de recaídas o la progresión imagenológica o de discapacidad, pero el perfil de paciente que probablemente no muestre actividad será aquel que haya experimentado un curso progresivo por más de 5años, particularmente si es mayor de 60años, y que no muestre nuevas lesiones en resonancia en T2 o con realce al gadolinio. La discontinuación temprana, fundamentalmente en pacientes con enfermedad activa, puede incrementar esta actividad, independientemente del tratamiento que reciben. La suspensión de la TME debe acompañarse de un seguimiento clínico e imagenológico posterior para reforzar la decisión que se tomó. En la figura 2 se muestra una propuesta basada en los hallazgos descriptos en esta revisión, en un intento asistir al médico en el complejo proceso de suspensión de la TME.
Algoritmo propuesto para el análisis de decisión de suspensión de una TME.
EDSS: escala expandida de discapacidad; EMRR: esclerosis múltiple recaída remisión; EMSP: esclerosis múltiple secundaria progresiva; fingo: fingolimod; natali: natalizumab; TME: terapia modificadora de enfermedad.
Esta revisión no recibió apoyos ni financiación para su realización.
Conflicto de interesesHe recibido honorarios y becas por asesoramiento, capacitación e investigación por parte de Biogen, Merck, Novartis, Genzyme, Teva, Bayer, Gador, Bagó y Raffo.
A los doctores Juan Ignacio Rojas y Mireia Sospedra, por las sugerencias y correcciones en la revisión del manuscrito.