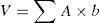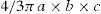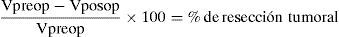El tratamiento quirúrgico de los tumores gliales del sistema nervioso central es un marcador pronóstico y uno de los pilares respecto del tiempo libre de progresión y sobrevida del paciente. Sin embargo, el riesgo de secuelas neurológicas posquirúrgicas aumenta con el grado de resección y localización del tumor. Basándonos en las características de las neuroimágenes tumorales y posquirúrgicas, confeccionamos esta guía para la planificación prequirúrgica, incluyendo algunos comentarios del acto quirúrgico y el seguimiento posquirúrgico, con el objetivo de clasificar y definir porcentajes de resección adecuadamente.
The extent of resection in gliomas is a prognostic marker. Extensive tumor resection is associated to longer time to tumor progression and longer overall survival. However, the risk of postoperative neurological sequelae may increase with the extent of resection, depending on tumor location. We developed this guide to be used for preoperative planning; we include comments related to surgery, and recommendations for postoperative follow-up. This guide is based in the pre and post-surgical imaging characteristics of the tumors and is aimed at classifying and defining extent of resection.
En los últimos 30 años el tratamiento neuroquirúrgico de los tumores gliales del sistema nervioso central (SNC) presentó grandes avances gracias al advenimiento de nuevas técnicas y estrategias. Sin embargo, persiste la dificultad para determinar los límites tumorales debido al carácter infiltrativo de los gliomas1.
La «mayor resección posible» es uno de los pilares claves para aumentar la sobrevida libre de progresión y el tratamiento de los síntomas asociados, tanto al tumor per se como al efecto de masa que este genere2–10.
A continuación se detallan: a) la secuencia en la planificación del tratamiento quirúrgico; y b) cómo definir el porcentaje de resección tumoral.
Planificación preoperatoriaPara la planificación preoperatoria se necesita de la resonancia magnética (RM) con un protocolo que determine las características del tumor cerebral: topografía, morfología, volumen, infiltración, realce después de la captación con el gadolinio (Gd), edema perilesional y efecto de masa. Las secuencias de RM empleadas son: T1 sin y con Gd, T2, FLAIR, gradiente de ECO y difusión. La espectroscopia, perfusión, RM funcional (RM-f), tensor de difusión y la tractografía, y las técnicas de reconstrucción volumétrica son procedimientos complementarios que el neurocirujano podrá considerar de utilidad en determinados casos1,3,11,12.
En los tumores que no realcen o lo hagan pobremente con el contraste paramagnético (por ejemplo gliomas de bajo grado), el volumen preoperatorio se calcula8,9,12–19:
V: volumen; ΣA: sumatoria de todas las áreas del tumor en los cortes axiales, obtenidas con los diámetros mayores ortogonales del área de hiperintensidad en la secuencia FLAIR (preferentemente) o T2; b: espesor de todos los cortes donde se visualiza el tumor, incluyendo los intervalos entre cada corte (gap).En caso de tumores de alto grado, dicha área corresponde a la región de interés que realza en T1 después de la administración de Gd7,20,21. Cuando el realce es heterogéneo o en anillo, en la práctica diaria el cálculo se hará de la misma forma3,12,22–28.
Otros centros utilizan la fórmula del elipsoide29:
Donde a, b y c son los diámetros mayores ortogonales.Para determinar el volumen tumoral en ensayos clínicos se puede utilizar un software semiautomatizado de segmentación tumoral y enfoque perimetral del refuerzo con Gd, con el cual se sustrae del volumen total la porción que no realza (componente quístico o necrótico)3,12,22,23.
En los casos que exista compromiso de un área elocuente la RM-f permite localizar el área anatómica de una función cortical (la representación funcional también denominada «paradigma» pie, mano o lengua, lenguaje, memoria, etc.) respecto del tumor1,28,30.
Planificación intraoperatoriaEl objetivo del acto operatorio es la exéresis o resección, total o completa macroscópica del tumor en algunos casos, y en otros solo será de resección biopsia; entre estos 2 los porcentajes varían8–10.
Se denomina «resección funcional» a la máxima resección tumoral que respeta el/las área/s elocuente/s minimizando el riesgo de secuela neurológica1.
Posterior a la craneotomía y apertura dural, el neurocirujano localiza las estructuras anatómicas, y la lesión a simple vista o subyacente. En ocasiones, y dependiendo de la localización del tumor, se vale de la ayuda de la marcación estereotáctica preoperatoria, un programa de reconstrucción en 3D con fusión de imágenes, de la ultrasonografía o del neuronavegador electromagnético y de la estimulación magnética transcraneal31.
En algunos casos se realiza monitorización neurofisiológica por medio de mapeo cortical con estimulación directa con el paciente despierto, o potenciales evocados motores y somatosensitivos y registro electromiográfico con el paciente sedado. Tras la exéresis o resección tumoral se realiza nuevamente estimulación directa, esta vez de tractos subcorticales para verificar que se han conservado las funciones1,31–34.
Colaboran en la resección el uso de aspirador ultrasónico y técnicas de fluorescencia con ácido 5-aminolevulínico4,5,35. La ultrasonografía y la RM intraoperatoria son útiles para objetivar remanente tumoral. Así, de ser factible, se procede a una resección complementaria inmediata, cuidando de no agregar morbilidad6,7,36.
Durante la cirugía se produce una distorsión cerebral (brain shift) que dificulta la interpretación sobre la extensión del tumor. Este fenómeno es causado por: a) entrada de aire; b) salida de líquido cefalorraquídeo; c) posición variable de la cabeza con el consiguiente desplazamiento cerebral; d) edema secundario al acto anestésico o por la manipulación directa; y e) fenómeno de re-expansión1,7,30,37.
Planificación posoperatoriaEn el posoperatorio inmediato la tomografía computarizada (TC) de cerebro sin contraste y con ventana ósea permite visualizar áreas de hemorragia, edema cerebral, desplazamiento y hernias, fragmentos óseos y situación de la plaqueta.
Se recomienda realizar una RM cerebral antes de las 72h (idealmente dentro de las 24h) con secuencias T1 sin y con Gd, T2, FLAIR, gradiente de ECO y difusión; esto permite diferenciar el componente inflamatorio posquirúrgico inmediato, el sangrado y la isquemia de los restos tumorales3,11,38. Para el seguimiento se realiza una nueva RM a las 4 u 8 semanas.
Una vez analizadas las imágenes, es necesario definir la ausencia o presencia de realce con Gd en la región de interés, y valorar cuantitativamente el porcentaje de remanente tumoral. Con ello se estima si la resección macroscópica fue completa o no.
En el caso de contar con un software semiautomatizado, se calcula el porcentaje de resección tumoral aplicando la siguiente fórmula3,8–10,12:
Vpreop: volumen preoperatorio del tumor; Vposop: volumen posoperatorio del tumor.Las imágenes por RM pre y posoperatorias deben ser efectuadas en lo posible con el mismo equipo, preferentemente 1,5 tesla o más.
Para el seguimiento de estos pacientes neurooncológicos se debe utilizar un mismo protocolo de neuroimágenes3 (MacDonald 199022, RECIST 200039, RANO 201112), o el propuesto por el Grupo de Trabajo de Neurooncología de la SNA11. De esta forma se observa la respuesta a los tratamientos radiante, quimioterápico u otros. En caso de tratamiento con fármacos antiangiogénicos (por ejemplo bevacizumab) se deben usar protocolos que tienen en cuenta la extensión de la lesión en FLAIR y T2 (como el de RANO12), porque el tratamiento antiangiogénico disminuye o elimina la captación de contraste.
Berger et al. definen 4 tipos de exéresis macroscópica en función del porcentaje de resección en tumores gliales8–10.
- •
Total: 100%.
- •
Subtotal: 90-99%.
- •
Parcial: 50-89%.
- •
Subóptima o resección-biopsia <50%.
Algunos autores, en los casos con glioblastoma, consideran la resección como significativa, en cuanto a la evolución y sobrevida se refiere, cuando aquella fue ≥78%. Se aclara que a mayor porcentaje de resección mejor sobrevida10,40.
Un comentario adicional respecto de los oligodendrogliomas que captan Gd: independientemente del grado histológico y estado molecular 1p19q, es marcador pronóstico la resección total o completa de todo el tumor que capta el Gd41.
Desde un punto de vista práctico, resección total o completa se aplica cuando, en el caso de un glioma de bajo grado, en la RM de control posoperatoria en las secuencias T2 y FLAIR no se observa hiperintensidad residual; en los tumores de alto grado cuando la lesión que captaba Gd no se observa en la RM de control posoperatorio en la secuencia T1 con Gd42.
Se debe considerar además, dentro de los procedimientos neuroquirúrgicos para el diagnóstico histológico y la planificación preoperatoria, la biopsia estereotáctica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.