La polineuropatía del paciente crítico (PPC) representa entre el 50 y 70% de los pacientes sépticos, es sensitiva, motora, axonal, aguda y se ha relacionado a aumento de la morbimortalidad.
Pacientes y métodosEstudio transversal, observacional, desarrollado entre mayo del 2015 y mayo del 2016 en el Sanatorio Allende de Córdoba, Argentina. Se incluyó a pacientes con diagnóstico de sepsis, a quienes se les realizó un estudio electrofisiológico entre el día 3 y 7 del diagnóstico de la sepsis a fin de emitir un diagnóstico precoz de PPC.
ResultadosSobre 1.176 pacientes ingresados en la Unidad de Cuidados Críticos, 176 (14,96%) cumplieron los criterios diagnósticos para sepsis. De estos, solo 48 (27,3%) pacientes cumplieron los criterios de inclusión para ser enrolados en el estudio. La tasa de incidencia de sepsis fue de 1,5 por cada 10 ingresos a la unidad, con una tasa de detección de polineuropatía en 0,8 de cada 10 pacientes sépticos mediante un estudio electrofisiológico precoz. La sensibilidad diagnóstica fue del 48% y la especificidad del 89%, con un alto valor predictivo positivo (88%) y un bajo valor predictivo negativo (48%).
ConclusiónEl diagnóstico de PPC en forma precoz es dificultoso y no existen herramientas útiles citadas en la bibliografía; es posible hacer diagnóstico temprano en un porcentaje de pacientes mediante un estudio electrofisiológico a fin de establecer medidas terapéuticas lo más rápido posible y de disminuir la morbilidad agregada en estos pacientes.
Polyneuropathy in critically-ill patients (PPC) accounts for 50-70% of septic patients, is sensory, motor, axonal, acute in nature, and has been related to increased morbidity and mortality.
Patients and methodsA cross-sectional, observational study, conducted between May 2015 and May 2016 at Sanatorio Allende in Córdoba, Argentina. Patients with diagnosis of sepsis who received electrophysiological examination between Day 3 and Day 7 of a diagnosis of sepsis in order to make an early diagnosis of PPC were included in this study.
ResultsOut of the 1,176 patients admitted to the Critical Care Unit, 176 (14.96%) met the diagnostic criteria for sepsis. Of them, only 48 (27.3%) patients met the inclusion criteria to be enrolled in our study. The incidence of sepsis was 1.5 for every 10 admissions to the unit, with a polyneuropathy detection rate among septic patients of 0.8, based on early electrophysiological examination. The diagnostic sensitivity was 48% and specificity of 89%, with high positive predictive value (88%) and low negative predictive value (48%).
ConclusionThe diagnosis of polyneuropathy in critically-ill patients at an early stage is difficult and there are no useful tools cited in the literature. Early diagnosis by electrophysiology is possible in a portion of patients and is useful to establish therapeutic measures as quickly as possible and to reduce aggregate morbidity among these patients.
La polineuropatía del paciente crítico (PPC) se describió por primera vez en 1984, por Bolton et al.1 y su incidencia de acuerdo con las series oscila entre el 50 y el 70% de los pacientes sépticos2,3. Esta puede definirse como una neuropatía sensitivo motora axonal aguda, que aparece durante el tratamiento de pacientes con patologías severas y, a su vez, puede ser un hallazgo temprano en la fallo multiorgánico4-7.
El 70 al 80% de los pacientes con sepsis presentan alteraciones en los estudios neurofisiológicos compatibles con PPC, pero solo la mitad de ellos presenta debilidad clínicamente detectable4,6. Diagnosticar la PPC es difícil porque tanto la enfermedad de base como sus complicaciones pueden causar también debilidad muscular6. Los estudios de conducción motora pueden mostrar degeneración de fibras motoras y sensitivas sin desmielinización8,9 lo cual es de utilidad para realizar el diagnóstico.
Durante la tercera semana suelen aparecer potenciales de fibrilación y ondas agudas positivas acompañadas por pérdida de unidades motoras y signos de reinervación en la EMG3,4,9,10. Estos cambios en la EMG pueden detectarse tan pronto como a las 24-48 h después de la aparición de la sepsis, y a menudo preceden a los hallazgos clínicos en estos pacientes, por lo cual es necesario el diagnóstico precoz1,11,12.
El objetivo del siguiente trabajo consiste en establecer la utilidad de la EMG en el diagnostico precoz de esta patología a fin de aportar evidencia que justifique el inicio de rehabilitación precoz y sistemática en los pacientes sépticos, con el objetivo de disminuir la movilidad de mencionada entidad.
Pacientes y métodosEstudio prospectivo de cohorte transversal, desarrollado entre los meses de mayo del 2015 y mayo del 2016 en la Unidad de Cuidados Críticos del Sanatorio Allende Córdoba, Argentina.
PacientesSe incorporó al estudio a aquellos pacientes mayores de 18 años con diagnóstico de sepsis, que ingresen en la Unidad de Cuidados Críticos (UCI) y cuyos familiares otorgaron el consentimiento informado correspondiente de acuerdo con lo establecido en la Declaración de Helsinki13.
Fueron excluidos los integrantes con historia de polineuropatía periférica ya documentada de cualquier etología, diabéticos, historia de adicción alcohólica o falla hepática secundaria a este, déficit nutricional relacionado con polineuropatía e hiperuremia crónica con o sin polineuropatía documentada. También edema extremo, internación prolongada con varios impactos sépticos, amputaciones de 2 o más miembros o traumatismo severo de 2 o más miembros que impida la realización del estudio.
MétodoSe realizó una base de datos en donde se registraron la edad y sexo, y se los clasificó según la gravedad del cuadro séptico de acuerdo con las definiciones de ACCP/SCCM, y según el Acute Physiology and Chronic Health Evaluation System (APACHE) II14,15. A cada participante se le realizó estudio electrofisiológico con equipo Bionerve 2010 de 4 canales, para determinar las amplitudes y las velocidades de conducción, así como la latencia motora y latencia sensitiva de inicio como pico de los potenciales de acción sensitivos y motores, según un protocolo preestablecido (nervio mediano, cubital, ciático poplíteo interno y externo, ambos nervios surales) entre las 72 h de iniciada la sepsis y antes del séptimo día del inicio de la misma.
Los parámetros que se consideraron para realizar el diagnóstico de PPC fueron una disminución de las amplitudes motoras o sensitivas, junto con descenso de la velocidad de conducción no menor del 70% de la normalidad en 2 o más nervios periféricos en territorios metaméricos diferentes, que debían correlacionarse con debilidad documentada por la escala de Medical Research Council (MRC) para fuerza muscular.
Se documentaron también la presencia de fallo multiorgánico con el score de Sepsis-related Organ Failure Assessment (SOFA)16-18; por último, se tuvieron en cuenta los días de asistencia ventilatoria mecánica (AVM) y los días de internación en Unidad de Terapia Intensiva (UTI), así como la mortalidad en UTI.
ResultadosSobre un total de 1.176 pacientes ingresados a la UTI, 176 (14,96%) cumplieron criterios diagnóstico para sepsis según la ACCP/SCCM25,26 durante el periodo de estudio. Solo 48 (27,3%) pacientes cumplieron los criterios de inclusión para ser enrolados (tabla 1).
Distribución por edad sexo y gravedad de los casos incluidos en el estudio
| Edad (años) | Sexo (M/F) | PPCa | APACHE II | SOFA |
|---|---|---|---|---|
| Media: 58,5 | F=28, M = 20 | PPC: 16 | Media: 20,92 | Media: 8,42 |
APACHE II: Acute Physiology and Chronic Health Evaluation System; F: femenino; M: masculino; PPC: polineuropatía del paciente crítico; SOFA: Sepsis-related Organ Failure Assessment.
La edad promedio ± desviación estándar fue de 58,5 ± 27,9 años, de los cuales 28 (58,33%) fueron de sexo femenino, APACHE con una media de 20,92 ± 6,4 y SOFA con una media de 8,42 ± 4,29 (tabla 1).
La tasa de incidencia de sepsis en nuestra UCI es de 1,5 por cada 10 ingresos a la unidad.
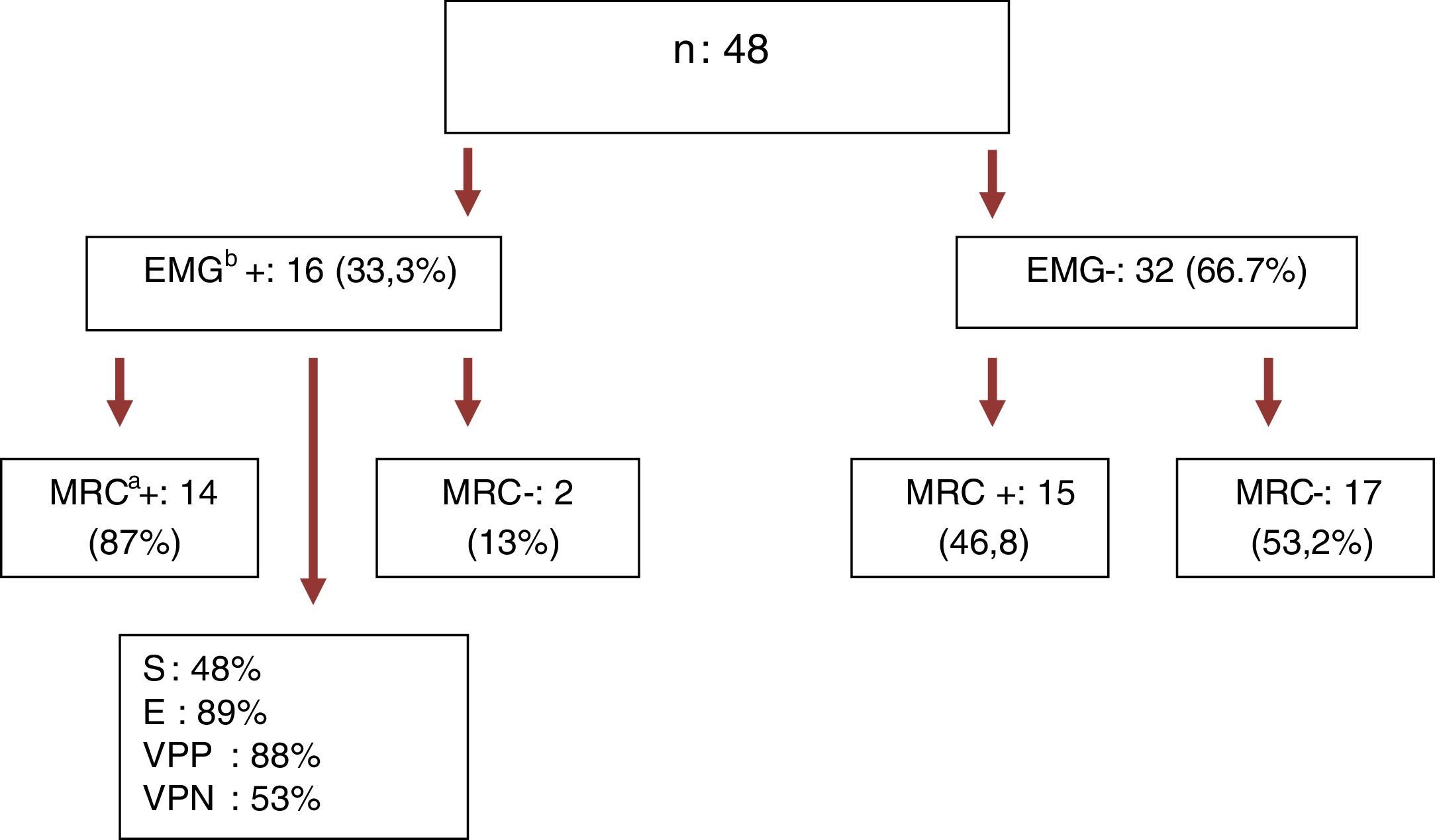
De los 48 pacientes enrolados, 16 (33,3%) presentaron alteraciones electrofisiológicas compatibles con PPC, 14 (87%) desarrollo debilidad documentada por medio de la escala MRC de fuerza muscular, lo cual determina una tasa de incidencia de PPC es de 0,8 de cada 10 pacientes sépticos; el estudio demostró una sensibilidad (S) del 48% y una especificidad (E) del 89%, con un valor predictivo positivo (VPP) del 88% y un valor predictivo negativo del 53% (tablas 2 y 3).
Correlación entre debilidad valorada por escala de MRC y EMG positivo para PPC
| Total | MRC+atotal | EMGb positiva | EMG negativa | Sc | Ed | ||
|---|---|---|---|---|---|---|---|
| 48 (n) | 29 (60,41%) | 16 (33,3%) | 32 (66,7%) | 48% | 89% | ||
| MRC+ 14 (87%) | MRC–: 2 (13%) | MRC+ 15 (46,8%) | MRC–: 17 (53,2%) | ||||
Correlación entre debilidad valorada por escala de MRC y EMG positiva para PPC
E: especificidad; EMG: electromiografía; MRC: Medical Research Council; PPC: polineuropatía del paciente crítico; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
a Escala MRC para fuerza muscular. MRC (+): presencia de debilidad muscular clínicamente constatada por esta escala. MRC (–): ausencia de debilidad Muscular clínicamente constatada por esta escala.
b EMG con velocidades de conducción nerviosa.
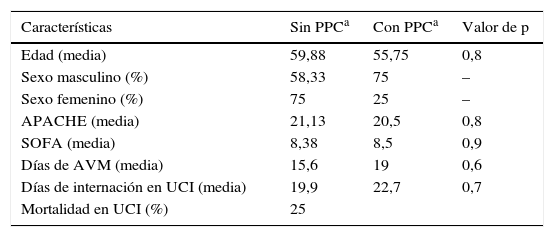
La gravedad de la sepsis en los grupos que presentaron compatibilidad clínica y EMG de PPC, cuantificada por los valores del APACHE II y el SOFA, no presentó diferencias significativas, así como con el uso de corticoides o bloqueo neuromuscular tampoco se observó un aumento significativo en los días de internación en UTI o los días de AVM, aunque de este último el valor de p es de 0,6, con una media de 19 días en los paciente con PPC en comparación con 15,6 días en los que no presentaron alteraciones electrofisiológicos (tabla 4).
Comparación de los grupos con y sin desarrollo de PPC, principales resultados y su correspondiente valor de p
| Características | Sin PPCa | Con PPCa | Valor de p |
|---|---|---|---|
| Edad (media) | 59,88 | 55,75 | 0,8 |
| Sexo masculino (%) | 58,33 | 75 | – |
| Sexo femenino (%) | 75 | 25 | – |
| APACHE (media) | 21,13 | 20,5 | 0,8 |
| SOFA (media) | 8,38 | 8,5 | 0,9 |
| Días de AVM (media) | 15,6 | 19 | 0,6 |
| Días de internación en UCI (media) | 19,9 | 22,7 | 0,7 |
| Mortalidad en UCI (%) | 25 |
AVM: asistencia ventilatoria mecánica; PPC: polineuropatía del paciente crítico; UCI: Unidad de Cuidados Críticos.
Se puede considerar que la electromiografía con velocidades de conducción nerviosa presenta un alto VPP para el diagnóstico de PPC clínicamente significativa, siendo también útil como herramienta diagnóstica para detectar precozmente los pacientes con polineuropatía asociada a sepsis.
Hay ciertos factores técnicos que pueden interferir con las pruebas de los estudios de conducción nerviosa, como el edema local severo y la temperatura de las extremidades11,19-22, lo cual puede inferir en la real incidencia de esta patología, evidenciándose por el bajo valor de n obtenido en nuestro estudio, pero la presencia de potenciales de bajo voltaje sin la presencia de estas condiciones es altamente indicativa de PPC1.
Existen factores claramente establecidos, de los cuales uno de los más importantes es la hiperglucemia11,23,24.
No existen tratamiento específico para esta patología más que el tratamiento de la enfermedad de base: el tratamiento de la glucemia en forma intensiva puede tener efecto beneficioso11,25 pero hay que tener en cuenta que el estudio Nice-Sugar en 2009 no demostró diferencia significativa en la estancia en UCI o los días de AVM, al igual que en el grupo de pacientes presentados en este estudio24-28.
La mortalidad está aumentada en este grupo de pacientes y se aproxima al 50%2,3,29; en nuestra serie, se observó un porcentaje menor al reportado en las series publicadas.
Los protocolos actuales para la evaluación de la PPC incluyen control de la fuerza muscular mediante la escala de MCR30, el correcto examen neurológico, los antecedentes de sepsis, la ausencia de factores de riesgo para neuropatía previa, laboratorio que incluya dosaje de CK total31.
En la mayoría de los estudios que evalúan esta patología no se incluye la EMG como parte del protocolo y en ningún estudio se incluye la valoración precoz de esta entidad con EMG para su diagnóstico, quizás por lo dificultoso de realizar el estudio en la UCI, dada las características propias de los pacientes crítico.
Ya que la única terapéutica demostrada en el manejo de esta entidad es la rehabilitación precoz, aun con altos niveles de sedoanalgesia, identificar a pacientes de alto riesgo a fin de implementarla precozmente cobra un valor de importancia en el manejo de los pacientes sépticos y debe ser tenido en cuenta a la hora del abordaje general a fin de disminuir la morbimortalidad de esta patología.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.