Desde finales del siglo xx, en la década de los 80, se iniciaron estudios sobre la relación entre la distribución geográfica de la esclerosis múltiple, la exposición a la luz solar y el metabolismo de la vitamina D (VD). Es así como se reportó que en las regiones más lejanas al Ecuador la luz solar durante el invierno no es suficiente para que el cuerpo humano produzca una cantidad adecuada de VD, lo que origina un mayor riesgo de padecer esclerosis múltiple (EM), en personas susceptibles.
La EM ha desarrollado muchas hipótesis de estudio. Una es la relación de los antioxidantes y la VD (su ingesta deficiente o inadecuada) en la patogénesis de la EM, por lo que aquí se presenta un desglose de lo que es la VD y su interacción en el desarrollo de la enfermedad. La plausibilidad biológica de una función de la VD en la EM radica en sus propiedades inmunomoduladoras.
La deficiencia de VD puede ser un factor de riesgo modificable de EM. Asimismo, la EM se ha asociado con otras enfermedades con un fuerte componente autoinmune o inflamatorio tales como diabetes tipo 1, artritis reumatoide, enfermedad cardiovascular, algunas enfermedades infecciosas y algunos cánceres, padecimientos que a su vez se han asociado con la deficiencia de VD.
Finalmente, parece prometedora una función protectora de la VD con relación al riesgo y desarrollo de EM. Sin embargo, se requieren más estudios clínicos cuidadosamente controlados y con dosis óptimas de VD para valorar esta pregunta, la cual sigue vigente.
Since the ends of the 20th century, in the decade of 80's, studies began on the relation between the geographical distribution of the multiple sclerosis, the exposition to the solar light and the metabolism of the vitamin D (VD). Some studies showed that in the most distant regions to the Ecuador the solar light during the winter is not sufficient in order that the human body produces a suitable quantity of VD, which the major one originates in major risk of suffering multiple sclerosis (MS), in capable persons.
The MS has developed many hypotheses of study. One is the relation of the antioxidants and VD (his deficient or inadequate ingestion), in the development of the MS. The biological plausibility of a function of the VD in MS is related to his inmuno-modulating properties.
The deficiency of VD can be a modifiable risk factor of MS. Likewise, the EM has associated with other diseases with a strong autoimmune or inflammatory component such as diabetes type 1, rheumatoid arthritis, cardiovascular disease, some infectious diseases and some cancers, sufferings that in turn have associated with the deficiency of VD.
Finally, there seems to be promising a protective function of the VD with relation to the risk and development of MS. Nevertheless, there are needed more clinical carefully controlled studies and with ideal doses of VD to value this benefits against the disease.
Desde mediados del siglo xix se identificaron las propiedades curativas de la vitamina D (VD) para tratar enfermedades originadas por deficiencia de calcio como el raquitismo. Hasta inicios del siglo xxi se documenta su acción pleiotrópica (cuando existen genotipos que afectan a más de un fenotipo), incluyendo un rol en el sistema inmunológico, específicamente el papel inmunorregulador de la forma activa de la VD, la 1,25 dihidroxivitamina D3 −1,25(OH)2D3−1.
Por otra parte, hace unos 20 años, se iniciaron estudios sobre la relación entre la distribución geográfica de la esclerosis múltiple (EM), la exposición a la luz solar y el metabolismo de la VD. Así, en las regiones más lejanas al Ecuador la luz solar durante el invierno no es suficiente para que el cuerpo humano produzca una cantidad adecuada de VD, lo que les confiere un riesgo mayor de padecer EM, en comparación con personas que tienen una mayor exposición al sol entre las que la prevalencia de EM es menor. Tanto la remisión con la aparición de nuevas lesiones observadas en la EM, suele ser más frecuentes durante la primavera, debido a que los niveles de almacenamiento de la VD y su metabolito (25OH), se encuentran bajos2,3.
Sin embargo, la evidencia reciente sugiere otras asociaciones y otros mecanismos, los cuales están siendo investigados actualmente. El objetivo del estudio es revisar la literatura científica sobre la asociación entre la VD y la EM.
La EM ha desarrollado muchas hipótesis de estudio. Una es la relación de los antioxidantes y la VD (su ingesta deficiente o inadecuada) en la patogénesis de la EM.
Aspectos clínicos de la esclerosis múltipleLa EM fue descrita por primera vez hacia la segunda mitad del siglo xix por el médico francés J.M. Charcot, quien propuso la tríada de Charcot: diplopía, disartria y ataxia; complementado con estudios de necropsia definió la patología «esclerosis en placas». Aunque se han propuesto diversas hipótesis y factores etiológicos y patogénicos, su causa permanece desconocida2.
La EM se considera una patología compleja del sistema nervioso central (SNC) que incluye aspectos inmunológicos, inflamatorios, genéticos y clínicos, con la consecuente discapacidad neurológica en pacientes adultos jóvenes (menores de 40 años)8.
Mouzaky et al.4, Alemany-Rodríguez et al.5 y otros investigadores han descrito una gran variedad de eventos, que apuntan a que el sistema inmune desempeña un papel importante en la patogenia de la enfermedad. La respuesta inmune de esta enfermedad tiene 2 componentes principales: un proceso inflamatorio y una fase neurodegenerativa (esclerosis). Estos hechos se han documentado al estudiar fenómenos específicos, que contribuyen a establecer la historia natural de la enfermedad, como proponen Alemany-Rodríguez et al.5 en el siguiente esquema3–7:
- 1.
La disfunción progresiva en estos pacientes.
- 2.
La recuperación rápida tras sufrir los brotes.
- 3.
Los diferentes patrones de daño de la mielina.
- 4.
La inespecificidad y variabilidad ínter e intrapaciente de la respuesta de los autoanticuerpos frente a proteínas de mielina.
- 5.
Los distintos patrones patológicos entre las formas evolutivas de la enfermedad.
- 6.
La pobre relación entre la efectividad de tratamientos para reducir brotes y la progresión de la enfermedad.
- 7.
La fuerte correlación entre los indicadores de daño axonal en imágenes de RM y discapacidad8,10.
Diversos autores, como Kremenchutzky15 y Ebers8, han descrito componentes de la historia natural de la EM, incluyendo la evolución del padecimiento, desde el inicio con síntomas inespecíficos iniciales, sin tratamiento, hasta la progresión a etapas más definidas (brote-remisión o progresiva). Con estos elementos, se ha considerando la frecuencia y severidad de los ataques, discapacidad y déficit neurológico, factores que han constituido una propuesta de clasificación con 4 tipos básicos de EM:
- 1.
EM, recaída remisión: brotes claramente definidos con completa recuperación o efectos residuales; períodos libres de enfermedad sin progresión de la enfermedad.
- 2.
EM secundaria: inicialmente en fase de recaída/remisión, seguida por progresión de la enfermedad.
- 3.
EM primaria progresiva: enfermedad aguda con rápida progresión.
- 4.
EM progresiva remitente: enfermedad progresiva con ataques agudos, con o sin recuperación de la funcionalidad8,20.
La mayoría de los casos (85-90%) se diagnostican dentro del primer grupo, (esclerosis múltiple, recaída remisión) y pueden seguir así, por más de 10 años, y cambiar el curso de su evolución a las variantes primaria o secundaria progresiva, según los criterios pronósticos y tratamiento recibido20.
Por otra parte, se han desarrollado otros criterios formales para diagnosticar EM, que han sido útiles teniendo en cuenta la gran variabilidad de esta enfermedad. Además de los criterios clínicos (Fazekas et al.9, McAlpine et al.11), otros se vinculan a factores paraclínicos y terapéuticos (Poser et al.12). Por ejemplo, la introducción de la RM para el diagnóstico por imágenes, en la década de los años 70, originó una revolución en el diagnóstico de la EM, incrementando la precisión del mismo (hasta un 95% de sensibilidad), utilizando en la actualidad esta técnica como un marcador de progresión y actividad de la enfermedad. Así, los nuevos criterios para el diagnostico de EM introducidos por el comité MacDonald (2005) incorporaron estudios de potenciales evocados, neuroimágenes (RM) y análisis del líquido cefalorraquídeo8–13.
Otras entidades neurológicas deben considerarse en el diagnóstico diferencial de la EM. Estos trastornos se diferencian por su cronicidad y su severidad e incluyen mielitis transversas agudas, encefalomielitis aguda diseminada, enfermedad de Devic, mielitis inflamatoria recurrente y mielopatía crónica progresiva; además, la EM puede estar presente en una forma absolutamente asintomática14,20.
Epidemiología de la esclerosis múltipleEn la última década se ha desarrollado mayor consenso con relación a los factores clínicos que predicen el curso de la EM. Por ejemplo, características clínicas que resultan favorables para la no progresión de la EM son: edad de inicio menor de 40 años, sexo femenino, compromiso óptico o sensitivo al inicio, un curso en recaídas y remisiones, y una frecuencia de ataques relativamente baja (menos de 3 al año). En contrapartida, características desfavorables para la EM son: edad de inicio mayor de 40, sexo varón, inicio con síntomas motores o cerebelosos, curso progresivo y un número alto de ataques (más de 3 al año)14–16.
Por otra parte, se ha documentado también la variabilidad epidemiológica, de acuerdo a la situación geográfica, siendo su ocurrencia más frecuente en países del norte de Europa, EE. UU. y Canadá17.
Esta incidencia se ha atribuido a una baja exposición solar y consecuente deficiencia de VD disponible en el cuerpo humano18.
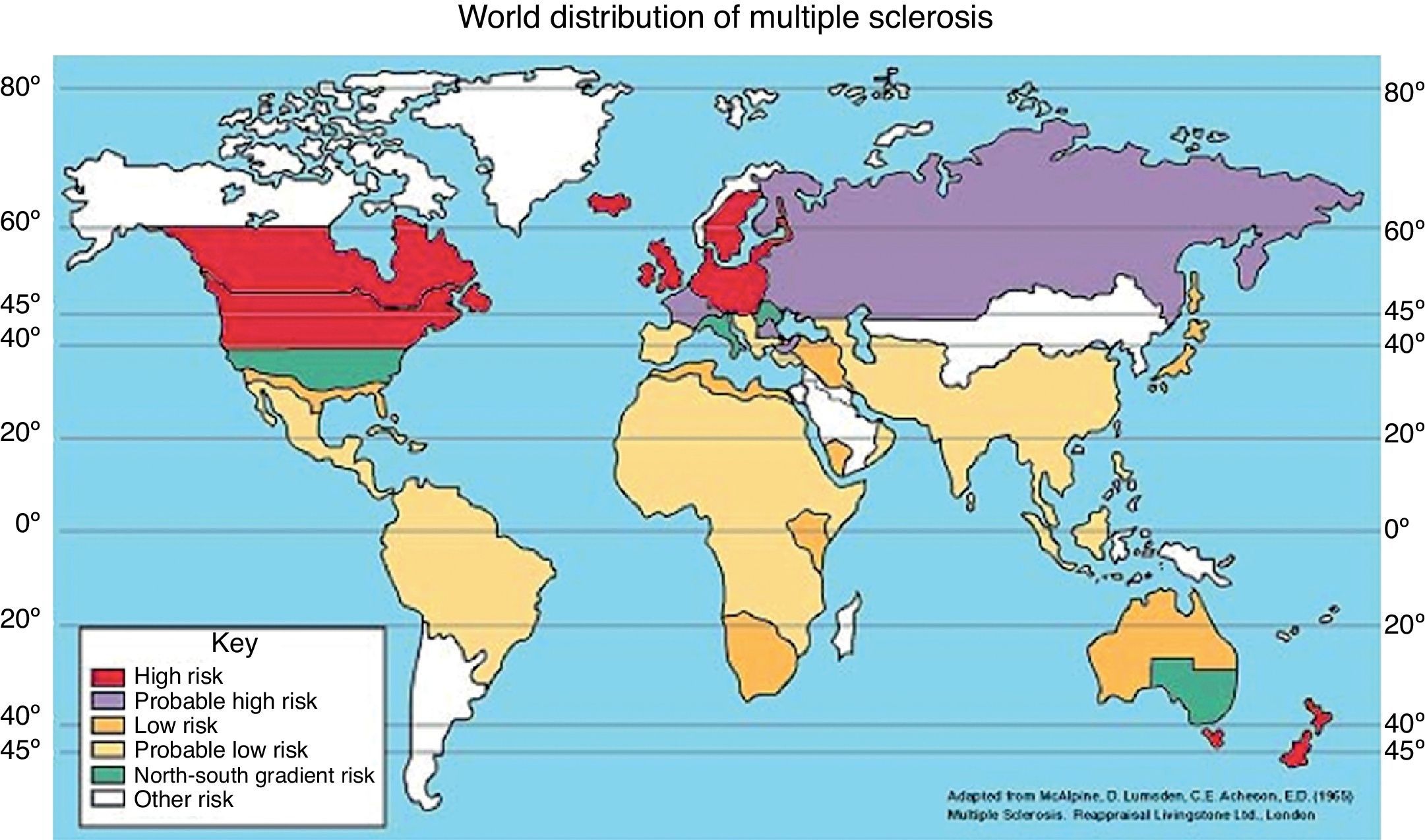
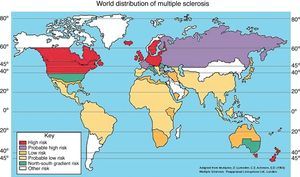
Los primeros estudios realizados sobre esta hipótesis fueron realizados por Kurtzke et al.19 (1975), donde plantearon la teoría de que el área geográfica de nacimiento y residencia se relaciona con la incidencia y prevalencia de EM, de tal manera que la prevalencia de la enfermedad aumenta conforme se aleja del Ecuador la zona geográfica de estudio. De ahí, se propusieron 3 zonas de riesgo de EM en función de la prevalencia.
- 1.
Zona de alto riesgo: la prevalencia es mayor o igual a 30 casos por 100.000 habitantes. Comprende las latitudes entre 43-65o latitud norte y 33-34o (incluye poblaciones del norte de Europa y EE. UU. y Canadá) y entre 33-44o latitud sur (incluye poblaciones de Australia y Nueva Zelanda).
- 2.
Zona de riesgo medio: la prevalencia es de 5-29 casos por 100.000 habitantes, y corresponde al sureste de EE. UU., sur de Europa y la zona meridional de Australia.
- 3.
Zona de bajo riesgo: la prevalencia es de menos de 5 casos por 100.000 habitantes e incluye Asia, América Latina, África y regiones próximas al Ecuador (fig. 1)1,20.
Figura 1.Distribución geográfica de la esclerosis múltiple según prevalencia de la enfermedad.
Obtenida de: The Multiple Sclerosis Resource Centre. Adaptada de: McAlpine et al.11.
(0.3MB).
En México, aunque la prevalencia se considera baja, el proceso de desarrollo económico e incremento de zonas urbanizadas también ha generado inquietudes sobre la causalidad y comportamiento de esta enfermedad, en población mexicana, que ha llevado a la realización de diversos estudios epidemiológicos. Así, en el año 1995 se llevó a cabo el primer estudio de una serie de casos, y en el 2003 se realizó el primer estudio multicéntrico nacional en 337 pacientes. En ambos estudios se describieron las principales características sociodemográficas y clínicas de los casos de EM: más frecuente en mujeres jóvenes, menores de 30 años21,22.
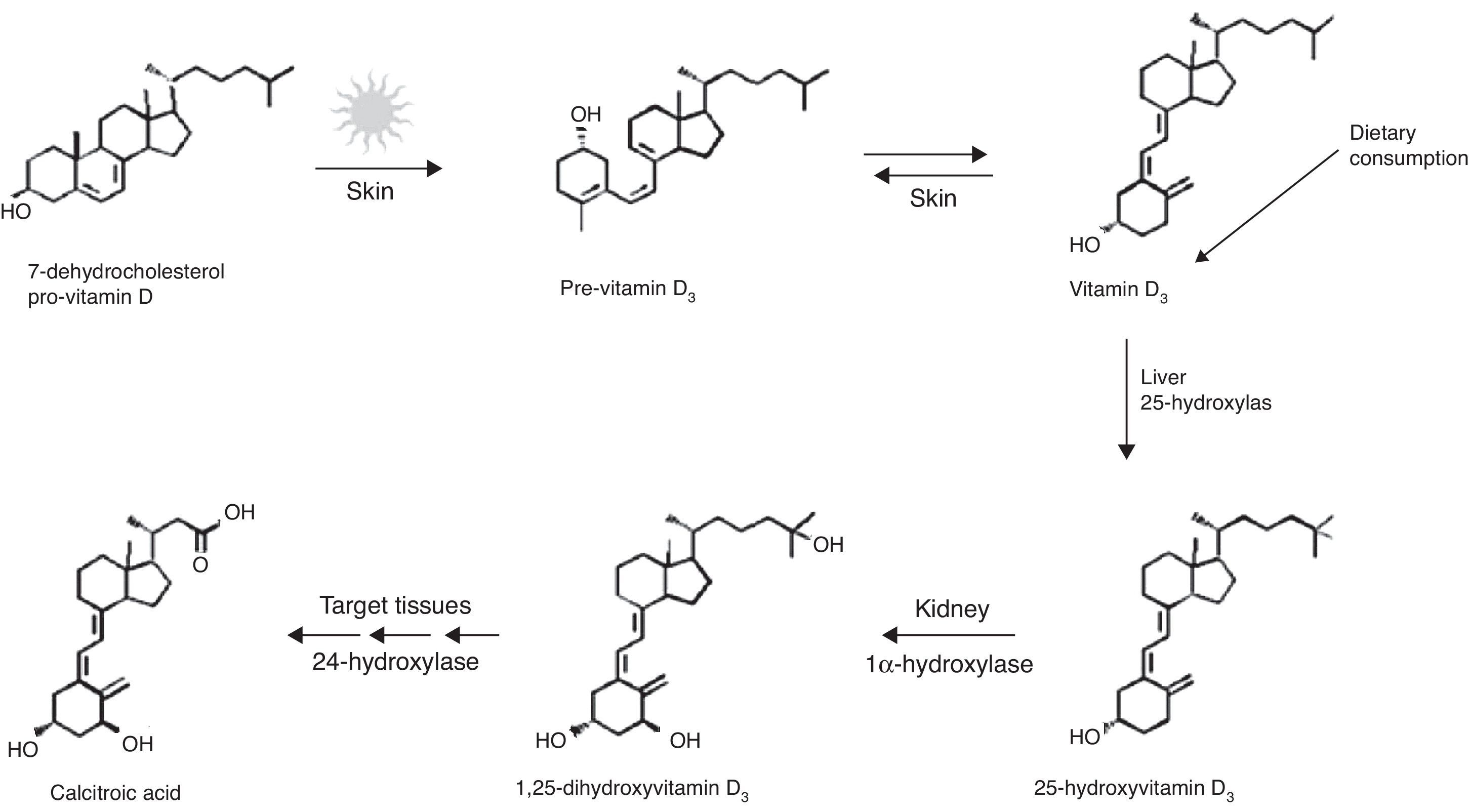
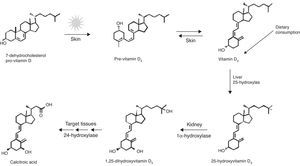
Generalidades de la vitamina D.La VD es un compuesto liposoluble, que puede ser producida en la piel por acción de los rayos solares u obtenida de la dieta. Esta vitamina es el precursor de la hormona 1,25-(OH)D (fig. 2)2,23.
Síntesis de vitamina D. Tomada de: Dusso et al.24.
Los rayos UV del rango B (290-320nm de longitud de onda) fotolisan al 7-dihidrocolestero o provitamina D3, encontrado en la piel, convirtiéndolo en previtamina D3, la cual mediante un proceso térmico es transformada en vitamina D3. Una prolongada exposición solar ocasiona una fotodegradación de la previtamina D3 y la vitamina D3, para evitar una posible hipervitaminosis. Niveles excesivamente altos de los metabolitos de la VD son transformados por la 24-hidroxilasa, a ácido calcitroico, que es desechado por vía renal1,20.
La mayoría de los efectos biológicos de la 1,25(OH)2D están regulados por el receptor de la vitamina D (VDR). Se ha investigado que la VD ejerce diferentes efectos en el sistema inmune: acción inmunorreguladora; aumenta la proliferación de los linfocitos y disminuye la producción de citocinas proinflamatorias. En el SNC se ha descrito la expresión de VDR en diversas células, así como de la 1α-hidroxilasa y la 24-hidroxilasa. Por ello, el SNC puede ser un sitio de acción, metabolismo y catabolismo de la VD2,3.
Varias investigaciones han demostrado que la exposición con 1,25(OH)2D incrementa la función fagocítica de los monocitos; asimismo, es posible observar una disminución en los niveles de interleucinas (IL) IL-6, IL-12, TNF-α y la secreción de la prostaglandinas E2 de los monocitos. Un estudio in vitro demostró una inhibición de TNF- α, IL-6 y óxido nítrico en las células de la microglía y las células presentadoras de antígeno, dentro del SNC. La maduración de las células presentadoras de antígeno y la producción de citocinas proinflamatorias son inhibidas por la 1,25(OH)2D2.
La 1,25(OH)2D tiene un efecto inhibitorio directo sobre la proliferación de los linfocitos T, citocinas y la progresión del ciclo celular, así como sobre la producción de citocinas IL-2, IL-6, IFN-γ y el factor de estimulación de colonias de granulocitos y monocitos por las células Th1, así como sobre la diferenciación y proliferación2.
La vitamina D3 es biológicamente inactiva, se puede almacenar en el tejido adiposo o ser convertida en el hígado por acción de la enzima 25-hidroxilasa en 25OHD. La 25OHD es el principal metabolito circulante de la VD y la concentración de este metabolito en sangre es un indicador de los niveles de VD en el cuerpo1,2, ya sea por producción cutánea ya por consumo dietario.
Los niveles séricos de 25OHD se encuentran entre los 25-130nmol/L; en los pacientes con EM es posible observarlos en promedio 20-37,5nmol/L por debajo de lo normal. Se ha definido una deficiencia de 25OHD con niveles séricos menores de 50nmol/L1.
La 25OHD puede ser almacenada en el hígado, o ser convertida en el riñón, por acción enzimática de la 1α-hidroxilasa, en 1,15-(OH)2D3 o calcitriol, que es el metabolito biológicamente activo de la VD. Esta reacción también puede ser realizada en tejidos extrarrenales, en el cerebelo o la corteza cerebral y los nódulos linfáticos1,2.
En la dieta, la VD se encuentra en 2 formas, la vitamina D2 o ergocalcifeol (forma activa del ergosterol, de origen vegetal) y la vitamina D3 o colecalciferol (de origen animal). Se puede considerar la dieta como una fuente secundaria de VD, ya que con una adecuada exposición solar las necesidades fisiológicas de la vitamina se encuentran cubiertas25. Sin embargo, durante el inverno o regiones en donde la luz solar no es suficiente para producir una adecuada cantidad de VD, la dieta desempeña un papel fundamental1,3.
Entre los efectos secundarios de sobreingesta de la VD se encuentran la hipercalcemia y la posible ocurrencia de arritmias cardiacas. Estos efectos colaterales son provocados por un consumo superior a 1.000μg/día de la vitamina3.
Relación entre dieta, metabolismo y esclerosis múltipleExiste una gran cantidad de literatura que sugiere una relación entre dieta y EM. El consumo de granos con alto contenido de ácido fítico (garbanzo, lentejas, granos integrales), carnes, grasas saturadas y leche se asocia a una mayor prevalencia de EM; mientras que el consumo de arroz (bajo en ácido fítico), pescados, aceites, leche descremada, frutas y verduras se correlaciona con una menor prevalencia de EM. Tanto las grasas saturadas como el ácido fítico influyen en la biodisponibilidad de los metabolitos de la VD1,26.
Goldberg27 sugirió que puede haber un vínculo entre el metabolismo de lípidos de la mielina y la VD. Es posible que la mielina presente anormalidades en su estructura debido a cambios en la concentración de ciertas clases de lípidos (p. ej., inositol disminuido y cerebrósidos altos), cambios en la conformación de la fosfatidil etanolamina (ácidos grasos 14:0, 16:1, 18:1 bajo y ácidos grasos 20:4 y 22:6 altos), cantidades elevadas en cerebrósidos de C24:1 y C26:1 y de C24:1 en la esfingomielina. Este tipo de anormalidades ocurren durante el desarrollo del SNC, debido a un abasto insuficiente de VD durante el proceso de mielinización. Algunos descubrimientos han demostrado el efecto estimulatorio de la VD en los fosfolípidos. El metabolismo de 3 clases de lípidos (etanolamina-, serina- e inositol-glicerofosfato) que son afectados en la sustancia blanca del cerebro en pacientes con EM es acelerado por la VD. Los cambios inducidos por la vitamina se pueden deber a la alteración del contenido lipídico en la membrana así como del perfil lipídico entre los varios tipos de fosfolípidos4.
Se ha propuesto que al no haber una cantidad disponible de vitamina D para el metabolismo lipídico normal, resulta en un cambio en la concentración o tipo de ácidos grasos, que ocasiona alteraciones en la mielina4.
Por otra parte, Farinotti et al.27 y otros investigadores han observado que la EM se asocia frecuentemente con factores ambientales, por lo que la dieta podría desempeñar un papel importante en la etiología de esta enfermedad. Repetidamente se ha sugerido que los factores dietéticos podrían explicar este fenómeno, sin embargo, hasta la fecha, la evidencia epidemiológica respecto a la asociación de la dieta con el riesgo de EM es inconsistente28. Existe evidencia consistente de que el consumo elevado de grasas saturadas de origen animal incrementa el riesgo de EM25. De igual manera, hay abundante evidencia de estudios realizados en animales que sugieren un efecto protector asociado a la ingestión de grasas insaturadas y poliinsaturadas, en especial ácidos grasos omega-3 y omega-6; sin embargo, los resultados en estudios epidemiológicos hasta la fecha aún no son concluyentes29.
La vitamina D en el sistema nervioso centralLa forma más activa de la VD es el 1,25(OH)2D3 (calcitriol) y se encuentra implicada tanto en el desarrollo como en la funcionalidad cerebral en humanos. Los efectos biológicos de esta hormona esteroidea se traducen por medio de un receptor nuclear (VDR), un factor transcripcional activado por el ligando, ampliamente localizado en el SNC30–32.
La localización reciente de la D3-25-hidroxilasa y la 25-hidroxiD3 α-hidroxilasa, y la distribución de VDR en el tejido cerebral, sugieren que la VD puede tener propiedades autocrinas y paracrinas para la bioactivación de la previtamina D3, como se estableció en los cultivos de las células de la microglía en la producción de 1,25(OH)2D3 y sus precursores. También se ha evidenciado el catabolismo de la hormona a través de la 24-hidroxilasa33.
La evidencia del papel de la VD en la función cerebral se comenzó a recabar desde hace 25 años aproximadamente con estudios de autorradiografía de cerebros de roedores con 1,25(OH)2D3 marcados con tritio, lo cual permitió mostrar los lugares destino de la VD en ciertas neuronas del cerebro anterior, metencéfalo, la médula espinal y los ganglios sensoriales. Tanto los resultados de las autorradiografías como de los estudios de inmunohistoquímica demostraron la presencia del VDR en las células de la hipófisis y la expresión del ARN mensajero y de la proteína VDR en la glándula pituitaria humana, lo que sugiere un posible papel de la VD en la regulación del sistema endocrino cerebral34,35.
Resultados de estudios en animales e in vitro confirman la presencia de VDR y 1α-hidroxilasa en el cerebro. Estudios en animales han revelado la presencia del VDR tanto en procesos de maduración como de desarrollo cerebral36–38.
Los estudios inmunohistoquímicos revelaron que la distribución de VDR en los cerebros humanos y de roedores es bastante similar39,40. El VDR se ha encontrado en la microglía, astrocitos, oligodendrocitos y células de Schwann41,42. Todos estos datos apoyan la función neurorreguladora de la VD. La presencia del VDR en el sistema límbico, la corteza y el cerebelo de los roedores y seres humanos respalda la posibilidad de un papel funcional de VD en la regulación de la conducta y las funciones cognitivas43,44.
El VDR se encuentra en los sistemas sensoriales olfativo, visual y auditivo, lo que sugiere que el sistema somatosensorial es también un objetivo de 1,25(OH)2D3. Por medio de inmunorreactividad se ha localizado al VDR en el núcleo vestibular, que extiende sus eferencias a las células de Purkinje del cerebelo y la parte del tálamo del sistema vestibular y del núcleo ventrolateral; esto sugiere que el sistema vestibular es también un objetivo de la VD45–47.
Asimismo, la expresión del VDR en neuronas motoras sugiere un papel en la regulación de las funciones motoras. El VDR se ha detectado en el cerebro de pollo, lo que permite suponer que la 1,25(OH)2D3 podría actuar al igual que otras hormonas neuroactivas en la modulación de la actividad neuronal y de los receptores de los neurotransmisores. Se ha determinado mediante microscopia de fluorescencia que el VDR y las enzimas catalíticas están colocalizadas en el cerebro, lo que proporciona evidencia de una función autocrina/paracrina de la VD. Estos resultados apoyan un posible papel funcional de esta vitamina en el cerebro humano48–50.
Varios estudios han demostrado que la VD confiere beneficios de regulación de la homeostasis del Ca2+ neuronal y que esta les confiere protección a las neuronas cuando existe entrada excesiva de calcio en el cerebro. La regulación de la homeostasis del calcio en el cerebro se produce a través de la regulación negativa de los canales de Ca2+ dependientes de voltaje tipo L en las neuronas del hipocampo cultivadas, lo que contribuye a la protección de la muerte celular excitotóxica51.
Estos cambios benéficos protegen las neuronas durante los eventos isquémicos o excitotóxicos. El efecto neuroprotector del 1,25(OH)2D3 puede también ocurrir a través de la reducción de la toxicidad del Ca2+ por la estimulación de expresión de Ca2+ unido a proteínas, apoyando así la idea de que la VD regula la homeostasis neuronal y puede impedir el envejecimiento neuronal. Existe evidencia de que el tratamiento con 1,25(OH)2D3 en ratas ancianas restaura las neuronas envejecidas52,53.
El envejecimiento es el factor de riesgo más común para el desarrollo de enfermedades neurodegenerativas. La pérdida de células neuronales del hipocampo y el envejecimiento se han atribuido a la alta densidad de los canales de Ca2+ dependientes de voltaje tipo L y a la neurotoxicidad de glucocorticoides54.
La 1,25(OH)2D3 participa en la modulación de las vías de desintoxicación del SNC a través de la regulación de γ-glutamil transpeptidasa (γ-GT), una enzima que regula al alza el glutatión (GTH), concentra y reduce la producción de especies reactivas de nitrógeno en los astrocitos. El aumento de los niveles de GTH en el cerebro a través del 1,25(OH)2D3 también protege contra la toxicidad en cultivos de neuronas del mesencéfalo55–57.
La γ-GT está implicada en la eliminación de especies reactivas de oxígeno. El estrés oxidativo también puede contribuir a la fisiopatología de las enfermedades neurodegenerativas58. La forma activa de la VD puede inhibir la síntesis de sintasa inducible de óxido nítrico, una enzima que se produce en respuesta a estímulos inflamatorios y que puede tener efectos dañinos sobre el SNC. Estos datos sugieren que la VD podría ser útil en el tratamiento de las enfermedades neurodegenerativas asociadas con el envejecimiento y el estrés oxidativo55,59–61.
La 1,25(OH)2D3 tiene efectos inmunosupresores en los distintos modelos de enfermedades autoinmunes. Asimismo, la VD puede proteger la estructura y la integridad de las neuronas a través de neurotrofinas, la síntesis del factor de crecimiento nervioso y la regulación de elementos tróficos como el factor neurotrófico derivado de la línea de células gliales en la corteza y el cuerpo estriado, así como de las células cancerígenas del cerebro. Las neurotrofinas son proteínas necesarias para la supervivencia neuronal en el envejecimiento y las condiciones neuropatológicas62,63.
Es de suma importancia el hecho de que se ha demostrado experimentalmente en animales que el 1,25(OH)2D3 bloquea la progresión de la encefalomielitis recurrente; dicho modelo es considerado un modelo de estudio para la EM63.
En resumen, la VD es importante en el SNC y ejerce funciones inmunomoduladoras y protectoras contra el daño neuronal, el estrés oxidativo y el envejecimiento. Esta evidencia sustenta la plausibilidad biológica para el uso de la VD en la EM64,65.
Deficiencia de vitamina D y riesgo de esclerosis múltipleSe han estudiado diversos factores con la finalidad de dilucidar la etiología de la EM. Algunos investigadores como Hernández (2000)2 han planteado que existe una relación entre área geográfica, especialmente con relación a la latitud, y prevalencia de EM: «alta latitud-alta prevalencia». Este hallazgo ha sido confirmado por Simpson et al.66, quienes reportaron una asociación positiva estadísticamente significativa entre prevalencia de EM y latitud geográfica. Es probable que esta asociación se explique porque a mayores latitudes hay menos exposición a la luz solar, lo que disminuye importantemente la síntesis de la VD en tejido subcutáneo. Otros estudios han observado un fenómeno estacional con relación al nacimiento y el riesgo subsecuente de EM, tanto en el hemisferio norte como en el sur. A la relación entre la latitud y la EM se la conoce como factor de incidencia. En conclusión, es posible afirmar que existen estudios observacionales que evidencian que los niveles bajos de VD se asocian con mayor riesgo de EM1,67,68.
Varias investigaciones experimentales han sugerido una relación entre la EM y los niveles séricos de 25(OH)D. Estudios realizados por Mahon et al. (2003) reportaron que el 48% de los pacientes con EM tienen deficiencia de VD1,69. Otras investigaciones han concluido que pacientes que cursan con EM recaída remisión presentaban niveles bajos de 25(OH)D durante los períodos de remisión2.
Estudios epidemiológicos recientes han documentado asociaciones entre exposición solar, consumo de VD y ocurrencia de EM66. Por ejemplo, Dickinson et al.70 encontraron la presencia de 3 polimorfismos de la vitamina D (VDR) en pacientes con EM: rs11574010 (Cdx-2A > G), rs10735810 (Fok1T > C) y rs731236 (Taq1C > T), asociados con antecedente de exposición solar durante el invierno (valor p:0,012). Este hallazgo se ha confirmado por estudios que han encontrado niveles diferenciales de VD comparando época de invierno con época de verano −25(OH)D−, en personas con EM20,71. Otros genes candidatos que se relacionan con la susceptibilidad a presentar EM son los del VDR, de la enzima 1α-hidroxilasa (CYP27B1), los genes de la proteína de unión de vitamina D y finalmente los de la enzima 24-hidroxilasa (CYPP24)72.
En un estudio ecológico basado en registros de casos de EM en Australia, se evaluó la exposición a luz UV ambiental durante el primer trimestre del embarazo en 1.524 pacientes con EM, nacidos entre 1920 y 1950. Se observó un patrón de riesgo de EM para aquellos nacidos en noviembre-diciembre, comparados con los que nacieron entre mayo y junio (razón de tasas de incidencia=1,32; IC 95%: 1,10-1,58). Cuando se ajustó por exposición ambiental a la luz UV, desapareció la asociación con mes de nacimiento. Lo anterior coincide con los meses de menor exposición a la luz solar durante el primer trimestre de embarazo, dado que en el hemisferio sur las estaciones están revertidas con respecto al hemisferio norte. Los autores concluyen que la baja exposición a la luz UV, y por consecuencia el estado inadecuado de VD durante el embarazo, puede ser un importante factor de riesgo para el desarrollo de EM67.
La deficiencia de VD puede ser un factor de riesgo modificable de EM. Asimismo, la EM se ha asociado con otras enfermedades con un fuerte componente autoinmune o inflamatorio tales como diabetes tipo 1, artritis reumatoide, enfermedad cardiovascular, algunas enfermedades infecciosas y algunos cánceres, padecimientos que a su vez se han asociado con la deficiencia de VD73.
La plausibilidad biológica de una función de la VD en la EM radica en sus propiedades inmunomoduladoras, descritas anteriormente. Así, el calcitriol –la forma activa de la VD– ha sido altamente efectivo en el tratamiento de modelos experimentales de enfermedades autoinmunes, lo cual refuerza su uso potencial en la EM. Estas acciones parecen estar mediadas por medio de la capacidad de VD para inducir la IL-1074.
Asimismo, polimorfismos en el CYP27B1, el gen que codifica la 1α-hydroxylasa –la enzima que convierte la forma activa de la VD– se han asociado con la susceptibilidad a EM. Por otra parte, se ha evidenciado que la VD puede modificar el curso de la EM. En un estudio de cohorte prospectiva de pacientes con EM, los niveles de VD se asociaron inversamente con las exacerbaciones de la enfermedad en un período de observación de 6 meses75,76.
También se han documentado anomalías en el metabolismo de la VD en pacientes con EM. Por su parte, estudios experimentales han mostrado diferencias entre sexos en el metabolismo de VD, el cual puede afectarse por los estrógenos, promoviendo una explicación plausible para la preponderancia de EM observada en el sexo femenino73.
ConclusionesA pesar de que existe evidencia sugerente desde el punto de vista ecológico, epidemiológico, clínico y biomédico, una revisión reciente de 5 estudios de suplementación con VD en EM no encontró un efecto benéfico en 4 de los 5 estudios Sin embargo, la heterogeneidad de las dosis y de las variables de desenlace, pequeño tamaño de muestra y posibles sesgos hacen que por el momento no exista evidencia concluyente sobre la utilidad de la suplementación con VD como terapia coadyuvante en la EM77.
Para probar el efecto de la VD en esta enfermedad se requeriría administrar altas dosis de VD a miles de jóvenes adultos, o quizá incluso a mujeres embarazadas, y seguirlos por varias décadas. Este esfuerzo solo podría ser realizado por un gran equipo interdisciplinario a nivel quizá de varios países74.
Dado que el coste y las complicaciones de una suplementación con VD en estos pacientes serían muy bajos, podría darse el beneficio de la duda a dicha estrategia. Sobre todo debido a que la deficiencia e insuficiencia de VD son frecuentemente observadas en adultos con EM. Esto podría traer innegables beneficios en otros aspectos, por ejemplo, para la salud ósea. Se requieren estudios controlados en pacientes con EM para evaluar la utilidad terapéutica de la VD sobre la progresión de la enfermedad. Hasta la fecha, solamente estudios a pequeña escala han sido realizados sobre este particular74.
En conclusión, parece prometedora una función protectora de la VD con relación al riesgo y desarrollo de EM. Sin embargo, se requieren más estudios clínicos cuidadosamente controlados y con dosis óptimas de VD para valorar esta cuestión, la cual sigue vigente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.