Los tests de memoria que incluyen una tarea de reconocimiento sí/no cuentan con sistemas de puntuación únicamente para el número total de ítems correctamente reconocidos. Sin embargo,muchos pacientes con deterioro cognitivo leve y demencia tipo Alzheimer presentan una fuerte tendencia de respuestas «sí» en la tarea de reconocimiento, generando una tasa alta de palabras correctas y de falsas alarmas, ya que no son capaces de reconocer o discriminar los ítems distractores.
Objetivos: El objetivo del presente trabajo fue investigar el desempeño en memoria de reconocimiento utilizando un índice de discriminabilidad en una muestra de pacientes con deterioro cognitivo leve tipo amnésico (n = 45) y demencia tipo Alzheimer (n = 51), y compararlo con un grupo control (n = 43).
Sujetos y métodosTodos los participantes fueron evaluados con la Prueba de aprendizaje verbal auditivo de Rey y una batería neuropsicológica extensa.
ResultadosEl índice de discriminabilidad mostró que el grupo control tiene un mejor desempeño en la tarea de reconocimiento que los pacientes con deterioro cognitivo leve y demencia (p < 0,001). Aunque ambos grupos de pacientes tuvieron un bajo índice total y de falsas alarmas, la diferencia no fue estadísticamente significativa.
ConclusionesLos resultados indican que el índice de discriminabilidad representa una medida útil para distinguir el desempeño en memoria de reconocimiento entre controles y pacientes. Se discuten los alcances de estos resultados en la práctica clínica y las teorías de memoria de reconocimiento como indicador de severidad del trastorno de memoria.
Clinical memory tests that included a yes/no recognition format have provided scores only for the total number of target items correctly endorsed. However, many patients with mild cognitive impairment and Alzheimer's dementia present a strong «yes» response bias in recognition tests, yielding both high hit and false alarm rates because they cannot reject distractor items.
ObjectivesThe objective of this study was to investigate recognition memory performance using a Recognition Discrimination Index in a sample of amnestic mild cognitive impairment (n=45) and Alzheimer's dementia (n=51) participants and to compare this said sample with a control group (n=43).
Patients and methodsAll individuals were submitted to the Rey auditory verbal learning test and to an extensive battery of neuropsychological tests.
ResultsThe discrimination index showed that controls demonstrated better discrimination of the words from List A than the patients with mild cognitive impairment and dementia. Although both patient groups were impaired on total index and false alarms, the differences were not statistically significant.
ConclusionsThe results indicate that the discrimination index represents a useful measure in distinguishing the recognition performance of controls and patients. Implications of these results for clinical practice and theories of recognition memory such as marker of severity of the memory disorder are discussed.
La enfermedad de Alzheimer (EA) es un síndrome que se caracteriza por una disminución progresiva de múltiples funciones cognitivas. La alteración en la memoria episódica es la característica más prominente en el curso de la EA, que en la mayoría de los casos ya está presente en las fases tempranas de la enfermedad, a menudo referida como el deterioro cognitivo leve tipo amnésico (DCLa)1-3. Puede incluso preceder al desarrollo de la atrofia en las estructuras temporales mediales4,5 y puede ser tan severa como en la fase de demencia de la enfermedad1,6.
El patrón típico del compromiso de la memoria episódica en la EA se caracteriza por la presencia de un recuerdo libre y total disminuido que no se normaliza con claves o con tests de reconocimiento después de que se controló una codificación efectiva de la información; gran cantidad de intrusiones y falsos reconocimientos7,8. Este patrón característico se conoce como perfil hipocampal, propuesto como parte integral de los criterios de investigación de EA8, ya que demostró su papel en distinguir el perfil cognitivo de la EA con respecto a otros tipos de demencia y está asociado a la proliferación de los ovillos neurofibrilares y placas seniles en el lóbulo temporal medial9,10. Investigaciones recientes se centran en este punto con el objetivo de anticipar, tan seguro como sea posible, aquellos individuos que desarrollarán demencia en un futuro11.
Existe evidencia de que la puntuación en el recuerdo diferido en tareas de aprendizaje de listas de palabras, como la Prueba de aprendizaje verbal auditivo de Rey12,13, es el mejor parámetro neuropsicológico para discriminar a los pacientes con EA de los controles sanos14. La Prueba de Rey es una prueba de memoria ampliamente utilizada y validada. Permite la evaluación de la curva de aprendizaje, el recuerdo después de la tarea de interferencia, y el patrón de aprendizaje (efectos en serie de posición serial), así como la medición de la memoria de reconocimiento15.
Clásicamente, la memoria de reconocimiento ha sido definida como la capacidad para evaluar con precisión que un estímulo se ha visto antes. En los tests de recuerdo libre, los sujetos deben reproducir los ítems estudiados en ausencia de cualquier clave externa. En contraste, la tarea de reconocimiento incluye estímulos que sirven como claves para el recuerdo de los ítems estudiados. En los tests de memoria de reconocimiento con el formato sí/no, los ítems estudiados previamente (viejos) son mezclados con ítems distractores (nuevos). La tarea del sujeto es decidir si cada ítem es viejo (al responder «sí») o nuevo (al responder «no»)16. Un desempeño deficitario en este tipo de tarea sí/no se ha estudiado tanto en pacientes con DCL17,18 y demencia tipo Alzheimer (DTA)19,20 como en controles sanos. Los tests de memoria que incluyen un formato de elección forzada también son deficitarios, tanto en DCL21 como en DTA22,23.
Po otro lado, se sabe que los pacientes con EA obtienen clásicamente puntuaciones bajas en medidas de memoria de reconocimiento, mientras que pacientes con disfunción subcortical predominante24 tienen una mejoría desproporcionada en memoria de reconocimiento en comparación con el recuerdo libre sin claves9,25,26. Estos perfiles indican que la clave en el deterioro de memoria puede deberse a una dificultad en el proceso de recuperación del material en los síndromes demenciales subcorticales y a un déficit en la codificación/almacenamiento en la DTA9,25,27-30.
Se supone que si el paciente reconoce los elementos de la lista de reconocimiento normalmente, esto se debe a que la información ya ha sido correctamente codificada y almacenada en el sistema, lo que conduce a descartar la existencia de un déficit en los procesos de codificación. Sin embargo, este resultado podría ser insuficiente para descartar alteración en los procesos de codificación y aprendizaje. Una mayor dificultad en rechazar palabras distractoras (elementos que no forman parte de la lista de aprendizaje) de la lista de reconocimiento se interpretaría como una falla en los mecanismos de análisis interítem e intraítem, necesarios para un aprendizaje discriminado. Estos mecanismos de discriminación serían fundamentales para una codificación exitosa.
Los tests de memoria que incluyen tares de reconocimiento con un formato sí/no proveen normativas únicamente para el número total de palabras correctamente identificadas como pertenecientes a la lista aprendida. El inconveniente con este sistema de puntuación es que pacientes con trastornos de memoria severos (p. ej., EA y el síndrome de Korsakoff) presentan típicamente una fuerte tendencia de decir «sí» en la tarea de reconocimiento, provocando una tasa alta de respuestas correctas pero también de falsas alarmas. Considerar únicamente este sistema antiguo de puntuación puede conducir a confusión al no detectar alteraciones severas en la tarea de reconocimiento26.
Por estos motivos, es necesario incorporar una única puntuación en tareas de memoria de reconocimiento que reflejen la habilidad del sujeto en discriminar e identificar los ítems correctos y rechazar los ítems distractores.
El objetivo primordial del trabajo es evaluar el desempeño en memoria de reconocimiento utilizando un índice de discriminabilidad en una muestra de pacientes con DCLa y DTA leve, y compararlo con un grupo control.
Sujetos y métodosDiseño del estudio y participantesEstudio descriptivo transversal de todos los sujetos que consultaron por queja cognitiva al Departamento de Neurología Cognitiva del Instituto de Investigaciones Neurológicas Raúl Carrea, FLENI, de la Ciudad Autónoma de Buenos Aires, Argentina, entre el mes de enero y marzo del 2012.
La población de estudio (n=139) se dividió en un grupo con DCLa (n=45), otro con DTA de grado leve (n=51) y un grupo control (n=43).
Los participantes fueron evaluados por médicos neurólogos y/o psiquiatras expertos en enfermedad cognitiva.
Se aplicaron los criterios diagnósticos para el subtipo amnésico de DCL1,31. Se consideró el diagnóstico de DCLa si la historia clínica y el rendimiento cognitivo arrojaban una puntuación en la Clinical Dementia Rating Scale (CDR) de 0,5, con una puntuación obligatoria en el ítem de memoria de 0,5. Esta clasificación se obtuvo a partir de una entrevista semiestructurada.
Para el diagnóstico de EA probable, se utilizaron los criterios revisados de la cuarta edición del Manual diagnóstico y estadístico de los trastornos mentales (DSM-IV-TR)32 y los criterios clínicos de diagnóstico propuestos en 1984 por el Instituto Nacional para los Desórdenes Neurológicos y los Desórdenes Relacionados de Estados Unidos33. Todos los pacientes con EA incluidos estaban en una etapa leve de la enfermedad según la escala de severidad CDR (CDR=1).
Para la comparación, también se incluyó un grupo control constituido por sujetos normales (CDR=0), sin historia previa de enfermedades neurológicas y/o psiquiátricas, y sin queja cognitiva previa.
El diagnóstico clínico y el subtipo de demencia se determinó por consenso, involucrando neurólogos, psiquiatras y neuropsicólogos, basados en anamnesis, laboratorio, neuroimágenes y una batería neuropsicológica, métodos utilizados rutinariamente en la evaluación clínica de los individuos con queja cognitiva.
Se excluyó a todos los individuos con evidencia clínica (o por imágenes) de enfermedad cerebro vascular; otros tipos de demencias neurodegenerativas; enfermedad de Parkinson y otras enfermedades neurodegenerativas; episodio depresivo mayor; antecedentes de lesión cerebral (traumatismo encefalocraneano, anoxia, neurocirugías, infecciones, consumo de drogas, exposición a tóxicos); sida/VIH; demencias reversibles; tratamientos con benzodiacepinas, antipsicóticos o antiepilépticos; Mini-Mental State Examination (MMSE) menor o igual a 21; depresión, y abuso de alcohol.
Herramientas y administraciónLa batería neuropsicológica administrada a cada uno de los participantes del estudio incluyó el MMSE34-37; la Batería de memoria lógica inmediata, diferida y reconocimiento de Weschler37-39; el Test de denominación de Boston37,40,41; la Fluencia verbal semántica y fonológica37,20; la Repetición de dígitos directos e inversos37,38; el Trail Making Test partes A y B37,42; Copia, recuerdo y reconocimiento de la Figura compleja de Rey12; Functional Assessment Questionnaire (español)41,43; Behavioral Assessment-Geriatric Depression Scale (español)41,44, y Behavioral Assessment-Neuropsychiatric Inventory Questionnaire (español)41,45. La batería neuropsicológica utilizada es una adaptación local del protocolo común de los centros de Alzheimer de EE. UU.37.
Los puntuaciones brutos de cada participante se transformaron en puntuaciones estándar utilizando los datos normativos según la edad y el nivel educativo. La normalización de los datos limita la influencia de los efectos de la edad, la educación y el género. Las puntuaciones z estándar se utilizaron para todos los análisis estadísticos descritos en este artículo.
Test de aprendizaje auditivo verbal de ReyPara la evaluación del rendimiento en memoria de reconocimiento, se aplicó la Prueba de aprendizaje verbal de la lista de palabras de Rey (Rey Auditory Verbal Learning Test, en inglés)12,13.
Consiste en la lectura, por parte del examinador, de una lista de 15 palabras utilizando 5 ensayos de presentación (lista A) que son seguidos de la evocación libre por parte del sujeto, de la mayor cantidad de palabras de la lista que recuerde. Luego de los 5 ensayos se presenta por única vez una lista de interferencia (lista B) y se le solicita al sujeto que nombre las palabras que recuerda de esta lista. Inmediatamente después, se solicita al sujeto que recupere la mayor cantidad de palabras de la lista A (sin que el examinador vuelva a leerla) y, a continuación de un intervalo de 20 min, se le solicita que vuelva a recordar la misma lista A.
Finalmente, se realiza una tarea de reconocimiento de las palabras presentadas previamente en la lista A, planteadas de manera oral o escrita, junto con palabras que funcionan como distractores (el total de las listas A y B, más 20 palabras que son similares fonética y/o semánticamente). La prueba analiza la evocación inmediata, el aprendizaje verbal de la lista y la capacidad de retención después de una labor de interferencia no mnésica.
PuntuaciónEl recuerdo fue evaluado utilizando las mediciones estándar (número total, perseveraciones e intrusiones). En la tarea de reconocimiento, «respuestas correctas» se refiere al número de palabras correctamente identificadas como pertenecientes a la lista A; «intrusiones de la lista B» se refiere a las palabras de la lista B incorrectamente reconocidas como pertenecientes de la lista A; «falsos positivos» se refiere a las palabras extra lista (no A, no B) incorrectamente identificadas pertenecientes a la lista A, y «falsas alarmas» se refiere a todas las palabras incorrectamente identificadas como pertenecientes a la lista A (suma de intrusiones de la lista B y falsos positivos).
En la tarea de reconocimiento, las respuestas correctas y las falsas alarmas no pueden evaluarse en forma separada ya que están influidas por el sesgo de respuesta del sujeto. Por ejemplo, una tendencia a responder «sí» aumentaría tanto la tasa de respuestas correctas como la tasa de falsas alarmas, mientras que una tendencia a decir «no» resultaría en una baja tasa de respuestas correctas y falsas alarmas16. Los métodos de la teoría de detección de señal46 son utilizados para estimar la habilidad del sujeto para distinguir las respuestas correctas de los distractores independientemente del sesgo de respuesta.
Se utilizó una medida de reconocimiento basada en la teoría de detección de señal46, denominada «d prime» (d′), como índice de discriminabilidad, con el objetivo de evaluar la capacidad del sujeto para identificar las palabras correctas de las incorrectas (falsas alarmas). La puntuación cruda de d′ es análoga a la puntuación z reflejando la diferencia absoluta en desvíos estándar entre la tasa de respuestas correctas (señal) y la tasa de falsas alarmas (ruido)30. Se incluyó una corrección si la proporción de respuestas correctas era igual a 1 (1–1/2n) y si la proporción da falsas alarmas era igual a 0 (1/2n)47.
Se consideraron 3 índices de la tarea de reconocimiento de la lista de Rey:
- –
Índice de discriminabilidad total (d’): mide la capacidad para reconocer los 15 ítems de la lista A y descartar los 35 distractores (falsas alarmas).
- –
Índice de discriminabilidad de la lista B (d’B): mide la capacidad para reconocer los 15 ítems de la lista A y descartar los 15 distractores de la lista B (intrusiones de la lista B).
- –
Índice de discriminabilidad de falsos positivos (d’FP): mide la capacidad para reconocer los 15 ítems de la lista A y descartar los 20 distractores que no pertenecen a la lista A ni a la lista B (falsos positivos, palabras no A, no B).
Los datos demográficos y los resultados de prueba de rendimiento neuropsicológico se analizaron con la aplicación del análisis de varianza de un factor (ANOVA), seguido de la prueba de Bonferroni post hoc para determinar el efecto de fuente. Se evaluó la asunción de homogeneidad de variancias mediante el test de Levene.
Se realizó el análisis de la curva característica de funcionamiento del receptor (ROC) para evaluar la capacidad de discriminación entre los diferentes índices de discriminación (d’). El área bajo la curva (AUC) se utilizó como una medida del rendimiento curva ROC general (intervalo de confianza [IC] del 95%). El método de Delong (análisis no paramétrico para muestras correlacionadas) se utilizó para determinar si existían diferencias estadísticas en los valores de AUC. Por último, se calcularon los puntos de corte de la curva ROC con mejor sensibilidad y especificidad.
El análisis estadístico se realizó con el programa SPSS versión 19.0 y la versión 9.2 del software MedCalc; p<0,05 fue considerado significativo, y los IC del 95% se calcularon para todas las variables del estudio.
Aspectos formalesEl estudio fue aprobado por el comité de Ética e Investigación del Instituto de Investigaciones Neurológicas FLENI. El diseño y la presentación de resultados del estudio se presentaron cumpliendo las recomendaciones STARD48 para los estudios de pruebas diagnósticas.
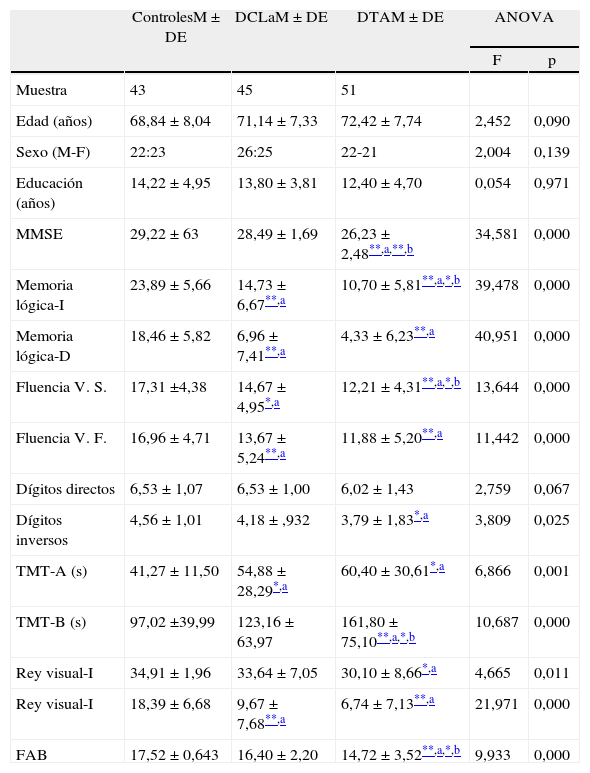
ResultadosCaracterísticas básicas demográficas y neuropsicológicas de los sujetosLa información demográfica, MMSE, otros tests de memoria (memoria lógica y visual) y el resto de los tests neuropsicológicos se presentan en la tabla 1. Como se muestra en la tabla, los 3 grupos no difirieron en edad, años de educación y sexo. Los 3 grupos mostraron un continuo en su desempeño cognitivo. Los sujetos controles mostraron desempeños dentro de los esperado para la edad y nivel educativo. Comparados al grupo control, los pacientes con DCLa mostraron déficits principalmente en memoria lógica, recuerdo diferido y reconocimiento de la lista de Rey, y el recuerdo diferido de la Figura compleja de Rey (p<0,001), confirmando el compromiso de la memoria episódica como síntoma predominante en estos sujetos. Comparados con el grupo control y el grupo de DCLa, los pacientes con DTA leve (p<0,001 vs. p<0,05) mostraron déficits en casi todos los dominios cognitivos evaluados (MMSE, memoria episódica, atención, velocidad psicomotora, funciones ejecutivas y habilidades visuoespaciales).
Características sociodemográficas y rendimiento neuropsicológico de los participantes del estudio
| ControlesM±DE | DCLaM±DE | DTAM±DE | ANOVA | ||
| F | p | ||||
| Muestra | 43 | 45 | 51 | ||
| Edad (años) | 68,84±8,04 | 71,14±7,33 | 72,42±7,74 | 2,452 | 0,090 |
| Sexo (M-F) | 22:23 | 26:25 | 22-21 | 2,004 | 0,139 |
| Educación (años) | 14,22±4,95 | 13,80±3,81 | 12,40±4,70 | 0,054 | 0,971 |
| MMSE | 29,22±63 | 28,49±1,69 | 26,23±2,48**,a,**,b | 34,581 | 0,000 |
| Memoria lógica-I | 23,89±5,66 | 14,73±6,67**,a | 10,70±5,81**,a,*,b | 39,478 | 0,000 |
| Memoria lógica-D | 18,46±5,82 | 6,96±7,41**,a | 4,33±6,23**,a | 40,951 | 0,000 |
| Fluencia V. S. | 17,31 ±4,38 | 14,67±4,95*,a | 12,21±4,31**,a,*,b | 13,644 | 0,000 |
| Fluencia V. F. | 16,96±4,71 | 13,67±5,24**,a | 11,88±5,20**,a | 11,442 | 0,000 |
| Dígitos directos | 6,53±1,07 | 6,53±1,00 | 6,02±1,43 | 2,759 | 0,067 |
| Dígitos inversos | 4,56±1,01 | 4,18±,932 | 3,79±1,83*,a | 3,809 | 0,025 |
| TMT-A (s) | 41,27±11,50 | 54,88±28,29*,a | 60,40±30,61*,a | 6,866 | 0,001 |
| TMT-B (s) | 97,02 ±39,99 | 123,16±63,97 | 161,80±75,10**,a,*,b | 10,687 | 0,000 |
| Rey visual-I | 34,91±1,96 | 33,64±7,05 | 30,10±8,66*,a | 4,665 | 0,011 |
| Rey visual-I | 18,39±6,68 | 9,67±7,68**,a | 6,74±7,13**,a | 21,971 | 0,000 |
| FAB | 17,52±0,643 | 16,40±2,20 | 14,72±3,52**,a,*,b | 9,933 | 0,000 |
Los valores están expresados en medias ± desviación estándar; excepto para muestra y sexo.
Mini-Mental State Examination Test34-36; Memoria lógica inmediata, diferida38; Test de denominación de Boston Naming Test40,41; Fluencia verbal semántica y fonológica20; Span de dígitos directos e inversos39; Trail Making Test A y B42; Figura compleja de Rey y Osterrieth inmediata y diferida12; Frontal Assessment Battery48.
M: media; DE: desviación estándar; FAB: Frontal Assessment Battery; MMSE: Mini-Mental State Examination Test; TMT: Trail Making Test A y B.
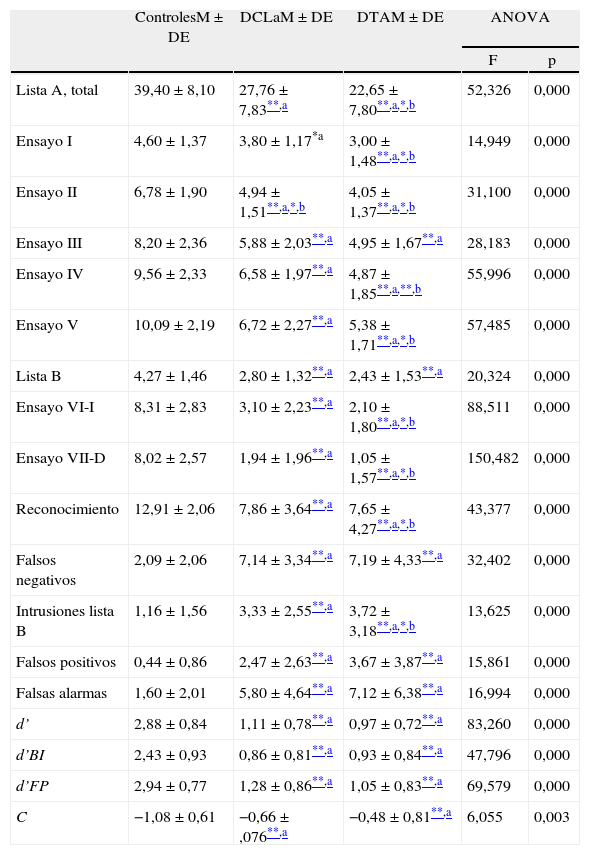
La comparación de las diferentes tareas de la lista de Rey entre los 3 grupos se muestra en la tabla 2. Hubo diferencia estadísticamente significativa (p<0,001) entre los 3 grupos en el número total de palabras recordadas en cada uno de los 5 ensayos y en el recuerdo inmediato y diferido de la lista de palabras.
Estadística descriptiva para las diferentes tareas de la lista de Aprendizaje verbal de Rey en cada uno de los grupos de estudio
| ControlesM±DE | DCLaM±DE | DTAM±DE | ANOVA | ||
| F | p | ||||
| Lista A, total | 39,40±8,10 | 27,76±7,83**,a | 22,65±7,80**,a,*,b | 52,326 | 0,000 |
| Ensayo I | 4,60±1,37 | 3,80±1,17*a | 3,00±1,48**,a,*,b | 14,949 | 0,000 |
| Ensayo II | 6,78±1,90 | 4,94±1,51**,a,*,b | 4,05±1,37**,a,*,b | 31,100 | 0,000 |
| Ensayo III | 8,20±2,36 | 5,88±2,03**,a | 4,95±1,67**,a | 28,183 | 0,000 |
| Ensayo IV | 9,56±2,33 | 6,58±1,97**,a | 4,87±1,85**,a,**,b | 55,996 | 0,000 |
| Ensayo V | 10,09±2,19 | 6,72±2,27**,a | 5,38±1,71**,a,*,b | 57,485 | 0,000 |
| Lista B | 4,27±1,46 | 2,80±1,32**,a | 2,43±1,53**,a | 20,324 | 0,000 |
| Ensayo VI-I | 8,31±2,83 | 3,10±2,23**,a | 2,10±1,80**,a,*,b | 88,511 | 0,000 |
| Ensayo VII-D | 8,02±2,57 | 1,94±1,96**,a | 1,05±1,57**,a,*,b | 150,482 | 0,000 |
| Reconocimiento | 12,91±2,06 | 7,86±3,64**,a | 7,65±4,27**,a,*,b | 43,377 | 0,000 |
| Falsos negativos | 2,09±2,06 | 7,14±3,34**,a | 7,19±4,33**,a | 32,402 | 0,000 |
| Intrusiones lista B | 1,16±1,56 | 3,33±2,55**,a | 3,72±3,18**,a,*,b | 13,625 | 0,000 |
| Falsos positivos | 0,44±0,86 | 2,47±2,63**,a | 3,67±3,87**,a | 15,861 | 0,000 |
| Falsas alarmas | 1,60±2,01 | 5,80±4,64**,a | 7,12±6,38**,a | 16,994 | 0,000 |
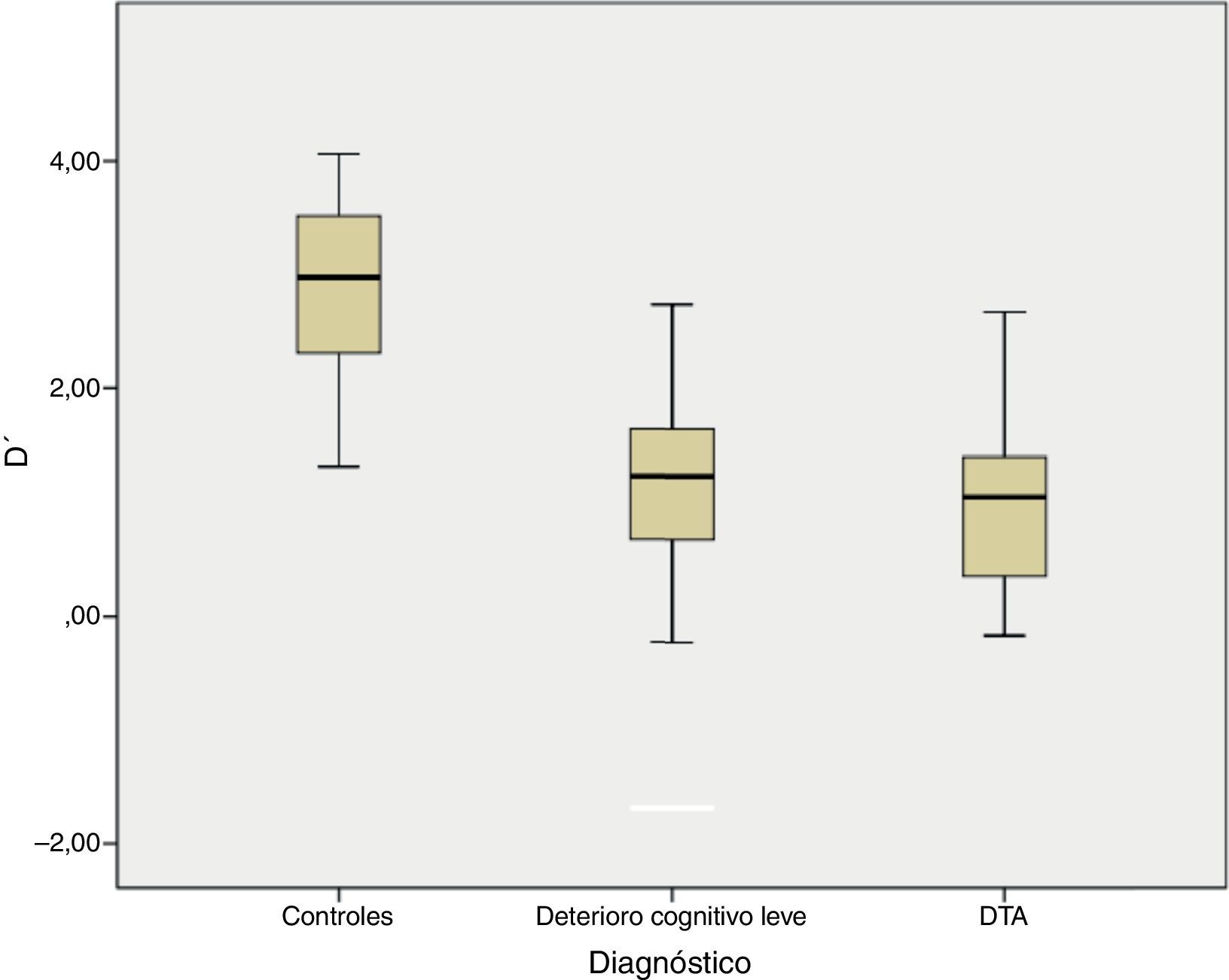
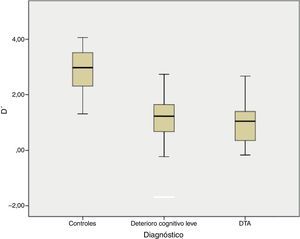
| d’ | 2,88±0,84 | 1,11±0,78**,a | 0,97±0,72**,a | 83,260 | 0,000 |
| d’BI | 2,43±0,93 | 0,86±0,81**,a | 0,93±0,84**,a | 47,796 | 0,000 |
| d’FP | 2,94±0,77 | 1,28±0,86**,a | 1,05±0,83**,a | 69,579 | 0,000 |
| C | −1,08±0,61 | −0,66±,076**,a | −0,48±0,81**,a | 6,055 | 0,003 |
Los valores están expresados en media ± desviación estándar.
C: sesgo de respuesta; d’: índice de discriminabilidad total; DE: desviación estándar; d’B: índice de discriminabilidad de la lista B; d’FP: índice de discriminabilidad de falsos positivos; Ensayo VI-I: recuerdo inmediato; Ensayo VII-D: recuerdo diferido; M: media.
Todos los grupos mostraron un mejor desempeño en la tarea de reconocimiento que en el recuerdo diferido (p<0,001). Las puntuaciones obtenidas en los grupos de pacientes indicaron un mejor desempeño de los pacientes con DCLa que con DTA leve en el recuerdo inmediato (p=0,02) y diferido (p=0,01). Aunque ambos grupos presentaron un desempeño por debajo de lo esperado en memoria de reconocimiento, las diferencias no fueron significativas.
Hubo menos respuestas correctas y más falsas alarmas en los pacientes con DCLa y DTA comparados con los controles (p<0,001). Se utilizaron los métodos estadísticos de la teoría de detección de señal para definir la seguridad y la precisión en discriminar las respuestas correctas de los ítems distractores (d’), independientemente del sesgo de respuesta (c). Valores altos de d’ indican mayor capacidad de discriminabilidad, mientras que un valor de d’ igual a cero indica menor capacidad.
En la tarea de reconocimiento sí/no hubo diferencias significativas entre los 3 grupos grupo para d’, F (2)=83,26 p< 0,001 (fig. 1) y para el sesgo de respuesta (C), F (2)=6,05, p=0,003. Ambos grupos afectados (DCLa y DTA) tuvieron peor desempeño que los controles en los índices de discriminabilidad (p<0,001) y sesgo de respuesta (p=0,03), aunque no se observaron diferencias entre los grupos de DCLa y DTA.
Con respecto al tipo de errores en la tarea de reconocimiento (intrusiones de la lista B y falsos positivos), los controles presentaron menores errores que los grupos de pacientes (p<0,001). Aunque los grupos de DCLa y DTA presentaron índices de discriminabilidad total, de intrusiones de la lista B y de falsos positivos bajos, la diferencia no fue estadísticamente significativa.
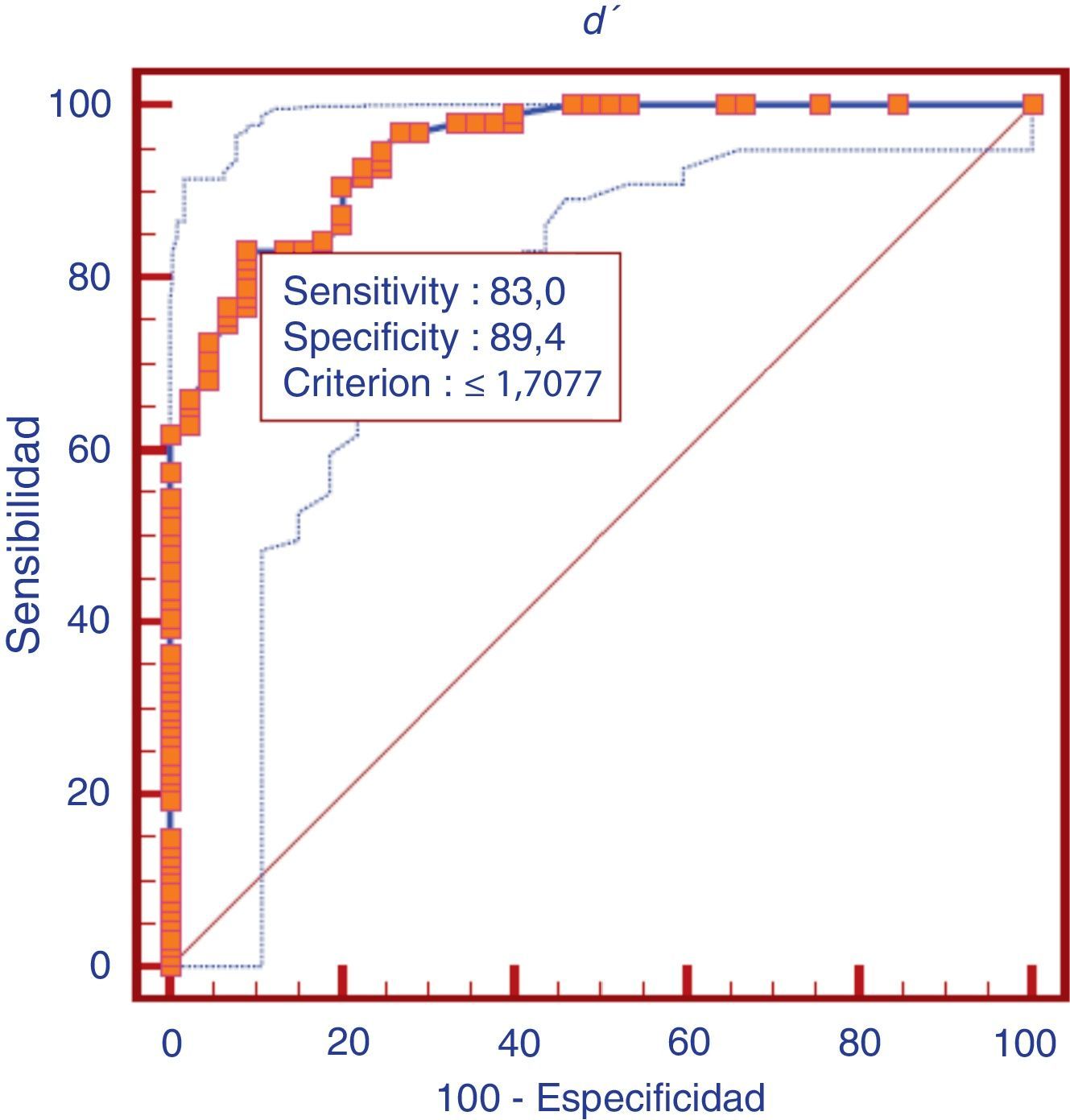
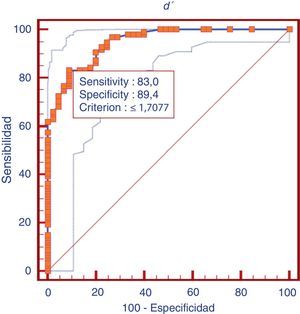
Validez de discriminaciónLa validez de discriminación del índice de discriminabilidad (d’) fue analizada como una prueba para valorar y diferenciar deterioro cognitivo en general (DCLa y DTA) de controles. La relación entre sensibilidad y especificidad del índice de discriminabilidad (d’) como prueba para diferenciar deterioro cognitivo en general (DLCa y DTA) frente a los controles, se presenta en la curva ROC correspondiente (fig. 2). El área bajo la curva ROC (ABC) es considerada como un índice útil para valorar el rendimiento de una prueba de diagnóstico. El ABC para diferenciar deterioro cognitivo en general de controles fue de 0,94 en este estudio. El ABC para diferenciar DTA fue de 0,95, y el de DCLa fue de 0,94.
DiscusiónUna considerable cantidad de estudios de investigación clínica y neuropsicológica permitieron identificar los cambios cognitivos que en forma fidedigna permiten distinguir pacientes con DCL del envejecimiento normal, particularmente cuando el DCL se considera un estadio predemencia de la EA. La mayoría de los estudios identifican al trastorno de memoria episódica como la manifestación más temprana de la EA49.
Aunque existe evidencia considerable que la declinación en memoria episódica es una manifestación temprana de la EA, hay menos evidencia respecto a los aspectos específicos de la memoria que están afectados en la enfermedad. Un mejor entendimiento de la naturaleza del déficit de memoria en DCL podría mejorar la capacidad para determinar si el déficit es probablemente debido a un proceso neurodegenerativo subyacente49.
De acuerdo con este punto, numerosos estudios demostraron que el déficit de memoria episódica en pacientes con DCLa se caracteriza, en la mayoría de los casos, por un perfil de memoria, conocido como «síndrome amnésico de tipo hipocámpico»8, caracterizado por fallas en recuerdo diferido con intrusiones y alteración en tareas de reconocimiento50. Este perfil se debe a una falla en la codificación y almacenamiento de nueva información.
No sorprendentemente, los resultados de nuestro grupo de pacientes con DCLa fueron similares a los déficits hallados en el aprendizaje, en recuerdo libre diferido y reconocimiento en pacientes con DTA. Una probable explicación podría estar vinculada con los criterios de inclusión específicos considerados en este trabajo. El grupo de DCLa cumplía criterios para el subtipo amnésico puro de DCL, basados en la queja cognitiva y el trastorno de memoria objetivado en la evaluación neuropsicológica, con preservación de actividades de la vida diaria. Los sujetos con DCL multidominio fueron excluidos del análisis.
Surge la pregunta de si el grupo de DCLa descrito en este trabajo representa un continuo de un único proceso conductual/patológico con una alteración clínicamente severa y significativa (≤ 1,5 desviación estándar) en recuerdo diferido y memoria de reconocimiento con preservación de las actividades de la vida diaria en una fase de predemencia con una progresión inexorable a DTA con los años. El análisis de los biomarcadores del proceso neuropatológico subyacente de la EA en esta muestra de pacientes permitirá responder este interrogante.
La Prueba de memoria de reconocimiento sí/no analiza únicamente la tasa de aciertos, es decir, la cantidad de palabras que el sujeto reconoce como pertenecientes a la lista aprendida, pero no considera las falsas alarmas, es decir, las palabras incorrectamente identificadas como pertenecientes a la lista estudiada. Considerar únicamente la tasa de aciertos podría ser insuficiente para el estudio integral del proceso de memoria de reconocimiento. Por lo tanto, es importante la inclusión de un índice que permita evaluar la capacidad de discriminar las palabras aprendidas de las distractoras.
Los resultados de este estudio permiten confirmar que los sujetos con DCLa y DTA muestran una pobre discriminabilidad y un sesgo de respuesta liberal, comparado con el grupo control. El análisis de estos índices no difiere entre los sujetos con DCLa y DTA. Los resultados observados indican que los sujetos evaluados presentan un déficit en la codificación y almacenamiento de la información generalizado, afectando a todos los aspectos de la memoria de reconocimiento, probablemente como resultado de una enfermedad temporo-mesial extendida.
El hecho de que los sujetos con DCLa y DTA difieran significativamente en el desempeño en la tarea de reconocimiento, considerando únicamente la puntuación de aciertos en la tarea sí/no, pero no haya diferencias en el índice de discriminabilidad, el cual considera además de los aciertos las falsas alarmas, indica que existe un gradiente de severidad del déficit de memoria. Por este motivo, nuestros resultados indican que el índice de discriminabilidad podría ser una medida útil en discriminar pacientes con DCLa con una alteración en memoria de reconocimiento menos severa e incluso con una puntuación normal basada únicamente en el número de aciertos, pero con un índice de discriminabilidad alterado de manera similar que los sujetos con DCLa más severos y los sujetos con DTA.
Esta hipótesis debe ser confirmada en estudios longitudinales, que incluyan a sujetos con DCLa con tarea de reconocimiento normal comparados con tarea de reconocimiento anormal basados en la puntuación del número de aciertos. Por lo tanto, delimitar los sujetos con DCLa con recuerdo libre diferido alterado pero con una memoria de reconocimiento normal o levemente comprometida, podría ser objeto de futuras investigaciones con respecto a la neurobiología de DCL y EA prodrómica.
Las mayores diferencias entre los grupos de DCLa podrían estar vinculadas a los distintos grados de severidad del déficit de memoria. Se postula que las diferencias entre los pacientes con alteración o conservación de la memoria de reconocimiento está relacionada a la extensión de sutil pero significativo daño o disfunción fuera del hipocampo51. Interesantemente, Baxter y Murray52, publicaron un metaanálisis de 3 estudios realizados con monos acerca de los efectos de las lesiones hipocampales sobre la memoria de reconocimiento. Se encontró una correlación negativa entre la extensión del daño hipocampal y la severidad del déficit de reconocimiento de objetos. Basados en un metaanálisis de casos únicos y estudios de grupos pequeños, Aggleton y Shaw53 postularon que el daño a otras estructuras, tales como la corteza perirrinal, era necesario para afectar a la memoria de reconocimiento54.
En resumen, se postula que el daño hipocampal produce un déficit únicamente en recuerdo diferido, mientras que la lesión de la corteza perirrinal afecta a la memoria de reconocimiento también. La posibilidad de que el respeto total de la memoria de reconocimiento en lesiones hipocampales refleje un compromiso más leve de la memoria no puede excluirse54. Chang et al.55 también argumentan en contra de usar una única medida de memoria para diagnosticar el DCL. El trabajo de Anastasi y Urbina56 indica que múltiples medida de un mismo dominio cognitivo proveen una estimación más real del constructo cognitivo subyacente más que una medida aislada. Es necesario la incorporación en los criterios diagnósticos de DCL, el perfil cognitivo característico y los puntajes y puntos de corte sugeridos para incrementar la especificidad diagnóstica del constructo y la predicción de conversión a demencia.
La presente investigación presenta ciertas limitaciones. En primer lugar, nuestros datos surgen de un estudio de corte transversal, sin seguimiento longitudinal necesario para determinar la progresión de la enfermedad. En segundo lugar, todos los participantes del estudio fueron seleccionados de un centro de memoria. Este punto puede resultar en sesgo. Es necesario un estudio poblacional para asegurar la generalización de los resultados en la población general. En tercer lugar, no incluimos biomarcadores en esta muestra. Los nuevos criterios para DCL debido a EA propuestos57 ponen especial énfasis en la importancia de los biomarcadores para predecir y diagnosticar la EA50. Los biomarcadores ofrecen una herramienta útil, consistente y de gran valor para homogeneizar el subgrupo de pacientes con DCL, quienes ya tienen EA en una fase predemencia con una progresión inexorable a demencia por EA con los años58.
Proponemos una medida compuesta de aprendizaje verbal y memoria, que incluya un índice de discriminabilidad en la tarea de memoria de reconocimiento para evaluar todos los procesos de memoria episódica. Son necesarios futuros estudios que combinen el análisis de los resultados de evaluaciones neuropsicológicas y biomarcadores para identificar subgrupos de individuos con DCL que ya tienen un proceso neurodegenerativo subyacente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.