El término camptocormia hace referencia a la flexión marcada de la columna toraco- lumbar que desaparece en posición supina, sin existencia de deformidad fija1. Su presencia se ha asociado con diversas etiologías como síndromes parkinsonianos, miopatías paraespinales, distonías, enfermedades de neurona motora y trastornos funcionales1-3. De un modo excepcional puede verse asociada a mutaciones del gen POLG.
Varón de 52 años, con antecedente de retraso psicomotor leve desde la infancia e historia familiar de padre con enfermedad de Parkinson de inicio tardío y madre con temblor esencial. Tiene dos hermanos mayores asintomáticos. Fue remitido por un cuadro de cuatro años de evolución de antero-flexión progresiva del tronco, que le dificulta a la marcha, asociado a torpeza y lentitud de movimientos de predominio en extremidades derechas, llegando a ser muy incapacitante. No presentaba disautonomía, salvo estreñimiento.
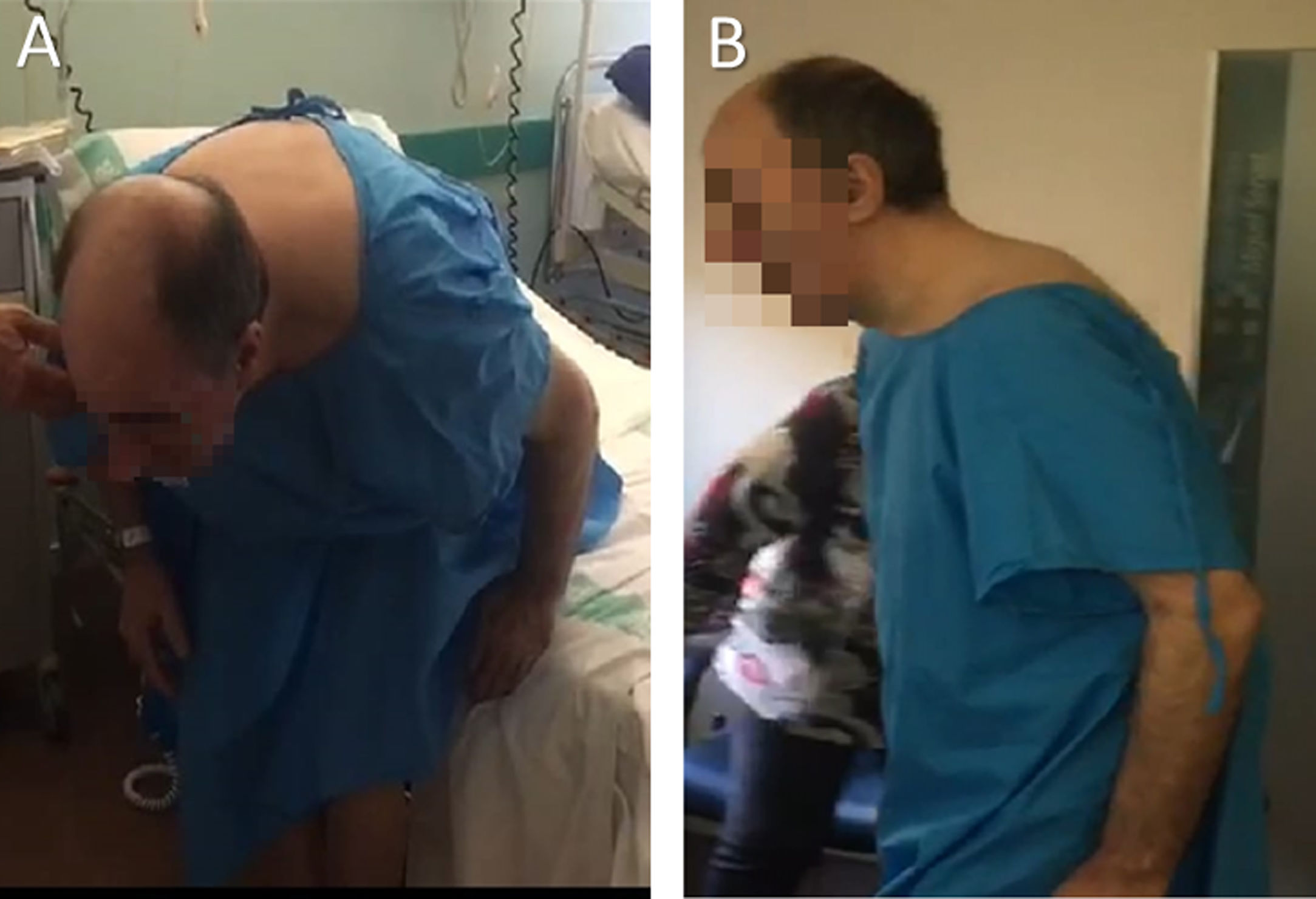
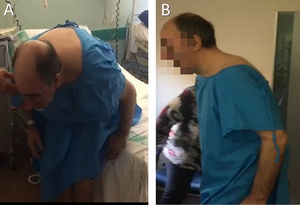
La exploración neurológica mostró hipomimia facial, bradicinesia moderada bilateral de predomino en extremidades derechas y un temblor de reposo derecho de baja amplitud. No se objetivó restricción en los movimientos oculares. En bipedestación, el paciente adoptaba postura de antero-flexión forzada del tronco de unos 70° sobre la cintura (fig. 1). En decúbito, era capaz de corregir la postura quedando plano sobre la camilla.
Un análisis sanguíneo completo con metabolismo del cobre, enzimas musculares y lactato fueron normales, así como las serologías de lúes y VIH. La resonancia magnética cerebral no aportó datos de interés. Un DaTSCAN reveló ausencia de actividad del transportador dopaminérgico en ambos putámenes e hipocaptación en el núcleo caudado izquierdo.
Ante dichos hallazgos, se inició tratamiento con levodopa en dosis crecientes hasta 250 mg cada seis horas, con respuesta subóptima, presentando tras carga de 350 mg de levodopa una mejoría de la exploración motora UPDRS III superior al 30% respecto a la basal, con mejoría y estabilización de la postura, desapareciendo la postura extrema de antero-flexión de tronco (fig. 1) y permitiendo la deambulación cautelosa de unos 20 metros sin ayuda.
Dado el antecedente de retraso psicomotor y el cuadro de parkinsonismo atípico, se solicitó una secuenciación de exoma que mostró mutación en heterocigosis con cambio de sentido en el exón 20 del cromosoma 15 del gen POLG (C.3218c >T; p (Pro1073Leu)), previamente registrada en las bases de datos ClinVar y HGMD como una variante patogénica. Además, estudios funcionales han demostrado que esta variante afecta a la replicación del ADN mitocondrial4.
Tras el diagnóstico, a pesar de la ausencia de sintomatología evidente, se completó el estudio con un electroneuromiograma que fue normal y con una valoración multidisciplinar que reveló catarata bilateral leve e hipoacusia mixta de predominio neurosensorial bilateral.
El gen POLG codifica la subunidad catalítica del ADN polimerasa gamma, responsable de la replicación del genoma mitocondrial5. Las mutaciones en el mismo se asocian a un amplio continuo de síndromes neurológicos, tanto de inicio en la infancia como en la adultez, entre los que destacan la epilepsia, trastornos psiquiátricos, polineuropatía, miopatía, ataxia y oftalmoplejia externa progresiva, variablemente asociados a otras enfermedades no neurológicas como cataratas, sordera neurosensorial o fallo ovárico precoz5,6.
Más infrecuentemente, las mutaciones del gen POLG pueden asociarse a parkinsonismo7, normalmente precedido en varios años de fenotipos clásicos, fundamentalmente oftalmoplejia externa progresiva (PEO)8 y, menos frecuentemente, neuropatía atáxica sensitiva, disartria y oftalmoparesia (SANDO)9. En estos pacientes, además, el parkinsonismo suele ser asimétrico, de inicio sobre los 40 años y con buena respuesta a la levodopa8,10. Nuestro paciente desarrolló un síndrome parkinsoniano atípico, sin evidencia de otras características neurológicas asociadas a las mutaciones del gen POLG, con una camptocormia prominente como síntoma más llamativo. Una ampliación del estudio tras el diagnóstico mostró cataratas bilaterales y sordera neurosensorial leve, hallazgos asociados a la mutación. Esta forma de presentación, en la que el síndrome parkinsoniano no se precede de oftalmoparesia, es excepcional, y ha sido únicamente descrita previamente en dos pacientes, asociada a neuropatía periférica11, y en un paciente con otra co-mutación patogénica en el gen de la glucocerebrosidasa12. En nuestro caso, consideramos que la naturaleza de la camptocormia era el propio parkinsonismo, ya que el paciente mostró una severa flexión anterior del tronco en ausencia de posturas anormales de cabeza y cuello (como se describe en las camptocormias distónicas) y presentó mejoría (aunque subóptima) de la postura con levodopa. Además, el electromiograma no mostró hallazgos miopáticos.
En definitiva, describimos un fenotipo único en las mutaciones del gen POLG con campotocormia secundaria a parkinsonismo atípico no precedido de PEO o SANDO, hecho escasamente descrito en la literatura13. Las mutaciones del gen POLG deben incluirse en el diagnóstico diferencial del parkinsonismo atípico, incluso en ausencia de oftalmoparesia o polineuropatía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.