El uso de activador tisular del plasminógeno (rt-PA) a dosis bajas fue propuesto inicialmente en países asiáticos en atención a particularidades raciales relacionadas con la funcionalidad del fibrinógeno y factores de coagulación que contribuyen al riesgo de hemorragias intracerebrales, así como a la intención de ahorrar costos. Ante la controversia sobre el uso de rt-PA por debajo de la dosis estándar, realizamos una revisión de la literatura sobre los estudios que motivaron su uso y aquellos dirigidos a comparar diferentes dosis de rt-PA.
DesarrolloSe revisaron 198 resúmenes relacionados con los términos de búsqueda. Se revisaron 52 publicaciones de texto completo de los últimos 30 años. Se incluyeron 13 ensayos clínicos aleatorizados dirigidos a determinar la eficacia y seguridad del uso de rt-PA a diferentes dosis en el ictus agudo, 14 estudios de cohorte observacionales, 5 metaanálisis y 3 revisiones sistemáticas.
ConclusionesNo se cuenta con evidencia suficiente para catalogar la dosis baja de alteplase como superior o al menos no inferior que el tratamiento estándar en el manejo del ictus agudo en población occidental. Se requieren más ensayos clínicos para determinar, si el uso de dosis bajas es beneficioso en pacientes con contraindicaciones relativas de terapia trombolítica u otras circunstancias particulares que eleven el riesgo de hemorragias intracerebrales.
The use of low doses of recombinant tissue plasminogen activator (rt-PA) was initially proposed in Asian countries in response to racial peculiarities related to the functionality of fibrinogen and coagulation factors that potentially increased the risk of intracerebral haemorrhage, and with a view to saving costs. In view of the controversy over the use of rt-PA below the standard dose, we conducted a literature review of studies promoting the use of low doses or comparing different doses of rt-PA.
DevelopmentWe reviewed 198 abstracts related to the search terms and the full texts of 52 studies published in the last 30 years. We finally included 13 randomised clinical trials aiming to determine the efficacy and safety of the use of rt-PA at different doses in acute stroke, 14 observational cohort studies, 5 meta-analyses, and 3 systematic reviews.
ConclusionsThere is insufficient evidence to classify low doses of rt-PA as superior or at least not inferior to the standard treatment in the management of acute stroke in western populations. More clinical trials are required to determine whether the use of low doses is beneficial in patients with relative contraindications for thrombolytic therapy or other particular circumstances that may increase the risk of intracerebral haemorrhage.
Después que el estudio del Instituto Nacional de los Desórdenes Neurológicos e Ictus (NINDS)1 demostrara el beneficio del activador tisular del plasminógeno (rt-PA) (0,9mg/kg) administrado dentro de las 3h, la agencia americana de administración de fármacos y alimentos (FDA) aprobó en 19962 su uso para el tratamiento del ictus isquémico agudo. El uso de rt-PA a dosis bajas fue propuesto inicialmente en algunos países asiáticos en atención a las particularidades raciales relacionadas con la funcionalidad del fibrinógeno y factores de coagulación que elevan el riesgo de hemorragias intracerebrales (HIC), así como a la intención de aminorar costos3. En Japón, la preferencia por bajas dosis de rt-PA está basada principalmente en ensayos clínicos de eficacia y seguridad que utilizaron diferentes dosis de dulteplase (rt-PA), actualmente retirado del mercado4–6; y de múltiples estudios con alteplase (rt-PA) de tipo observacionales cuyos resultados han sido comparados con aquellos obtenidos en series de pacientes extraídas de estudios con alteplase a dosis estándar7,8.
Ante la controversia sobre el uso de rt-PA por debajo de la dosis estándar, realizamos una revisión de la literatura sobre los estudios que motivaron su uso y aquellos dirigidos a comparar diferentes dosis de rt-PA.
MétodoCon el objetivo de identificar todos los estudios potenciales relacionados con trombolisis intravenosa a diferentes dosis, se realizó una búsqueda sistemática de la literatura utilizando las bases de datos de PubMed, SCOPUS, EMBASE y BIREME. Se determinó como margen de tiempo al periodo comprendido entre la publicación de los primeros ensayos clínicos pilotos de comparación de dosis de medicamentos trombolíticos en adelante (enero de 1992 a enero 2018). Fueron usados los siguientes términos de búsqueda para publicaciones en español: «ictus», «fibrinólisis», «activador tisular del plasminógeno», «dosis bajas», «dosis estándar»; y los siguientes términos para publicaciones en inglés: «thrombolitic therapy», «alteplase», «standard dose», «thrombolysis», «tissue plasminogen activator», «fibrinolytic agents». Se excluyeron aquellos estudios que no habían sido sometidos a revisión por pares o cuya metodología no estaba claramente reportada. Además aquellos destinados a establecer periodos de ventana mayores a 4,5h y aquellos que usaron medicamentos trombolíticos de eficacia inferior comprobada. Se realizó una selección inicial de títulos y resúmenes. Luego, se revisaron los textos completos. Los estudios fueron incluidos de acuerdo a los siguientes criterios: aquellos realizados bajo el diseño de ensayo clínico controlado aleatorizado (ECA), cohortes, serie de casos, estudios ecológicos, revisiones sistemáticas y metaanálisis. Estudios publicados en inglés o español. La información obtenida fue organizada por los autores en el presente trabajo.
ResultadosSe revisaron 198 resúmenes relacionados con los términos de búsqueda. Se revisaron 52 publicaciones de texto completo de los últimos 30 años; se excluyeron 6 estudios por haber sido cancelados prematuramente y por estar dirigidos a establecer periodos de ventana después de las 4,5h de inicio de los síntomas. Asimismo, se excluyeron 12 estudios por haber utilizado fármacos trombolíticos de eficacia inferior comprobada. Se incluyeron 13 ECA dirigidos a determinar la eficacia y seguridad del uso de alteplase a diferentes dosis en el ictus agudo, 14 estudios de cohorte observacionales, 5 metaanálisis y 3 revisiones sistemáticas
Trombolisis a 0,9mg/kg (dosis estándar)Múltiples estudios han demostrado el beneficio del uso de alteplase a dosis estándar durante las 4,5 primeras horas de enfermedad9. Uno de los primeros, el estudio NINDS (0,9mg/kg de rt-PA intravenoso frente a placebo), mostró mejor desenlace funcional a los 3 meses si el tratamiento se administraba dentro de las 3h de iniciados los síntomas (escala de Rankin modificada [mRs] 0-1; OR: 1,7; p=0,019) aunque con un mayor índice de HIC (6,4 vs. 0.6%; p<0,001).
Asimismo, se llevaron a cabo estudios dirigidos a identificar el periodo de ventana más adecuado para la administración de rt-PA en el manejo del ictus agudo10–13. En un metaanálisis que incluyó 3 de los ECA más importantes hasta ese momento (ATLANTIS, ECASS y NINDS) se observó resultados favorables con trombolisis a dosis estándar incluso entre las 3 y 4,5h (OR: 1,4 (1,1-1,9)1,12,14,15. Ya en el año 2008, el estudio ECAS III13 mostró los beneficios del alteplase a dosis 0,9mg/kg con niveles significativos de eficacia hasta las 4,5h de iniciados los síntomas sin un aumento significativo de la mortalidad (7,7 vs. 8,4%; p=0,68). No obstante, la evidencia señala que a mayor tiempo transcurrido antes del inicio de la terapia trombolítica, menor es la eficacia observada. Una revisión sistemática de 9 ECA mostró que la probabilidad de un resultado funcional favorable es proporcional a la prontitud de administración (OR: 2,55; intervalo de confianza al 95% [IC 95%]: 1,44-4,52 para 0-90min; hasta un OR: 1,22; IC 95%: 0,92-1,61 para 271-360min)16.Es así que después de las 4,5h los riesgos suelen sobrepasar los beneficios y su uso está habitualmente contraindicado2,9,17.
La edad avanzada, la severidad del ictus, los antecedentes combinados de ictus y diabetes mellitus, así como el uso de anticoagulación oral han sido considerados por muchos años criterios de exclusión de terapia trombolítica entre las 3 y las 4,5h de enfermedad17. Estos criterios habían sido extraídos de la lista de criterios de exclusión del estudio ECAS III considerados arbitrariamente por los autores como factores de alto riesgo de HIC. Sin embargo, la terapia fibrinolítica a dosis estándar ahora puede considerarse efectiva y segura en estos grupos de pacientes, de acuerdo a estudios y guías de práctica clínica de reciente publicación9,18,19.
Trombolisis a dosis bajasEn Japón, a inicio de la década de 1990, varios ECA de comparación de dosis de rt-PA mostraron que 20MIU de dulteplase (0,6mg/kg de alteplase) era efectivo para pacientes con ictus embólico agudo, sin aumentar significativamente el riesgo de hemorragia4,5. Poco después, un estudio más grande (N: 113) mostró que las dosis bajas de 20UI de dulteplase, además de tener una eficacia similar en cuanto a recanalización arterial comparado con 30UI de dulteplase (0,9mg/kg de alteplase), presenta una incidencia significativamente menor de HIC (3,6 vs. 13,8%)6. Conocidos estos resultados, la utilización de dosis superiores a 20MUI de dulteplase o su dosis equivalente en alteplase estuvo limitada en Japón.
Tras la aprobación del uso de alteplase para el manejo del ictus agudo por la FDA en 1996 y tras la suspensión de la distribución del dulteplase por problemas legales relativos a la patente, en Japón surgió la necesidad de comprobar la eficacia y seguridad de alteplase a diferentes dosis. Dadas las restricciones éticas de usar un grupo placebo o control, surgieron estudios de serie de caso cuyos resultados fueron comparados con series de pacientes tomadas de ensayos clínicos y series occidentales con dosis estándar («grupo control histórico»)7,8,20,21.
Uno de los estudios más importantes publicados fue el estudio J-ACT8. Ciento 3 pacientes con ictus agudo predominantemente cardioembólico fueron tratados con 0,6mg/kg de alteplase intravenoso. Los resultados fueron comparados con los de un metaanálisis de estudios internacionales y con el brazo de tratamiento del estudio NINDS para su publicación. En este estudio, la proporción de pacientes con mRs de 0-1 a los 3 meses fue del 36,9% (IC al 90%: 29,1-44,7%) y la incidencia de HIC dentro de las 36h fue del 5,8% (IC al 90%: 2-9,6%), ambos índices, comparables a los extraídos del brazo de tratamiento del estudio NINDS (tabla 1) y del metaanálisis de referencia1,8,12,22–28. Sin embargo la mortalidad a los 3 meses fue menor en el estudio J-ACT (9,7 vs. 17% NINDS vs. 10-17% metaanálisis referencial). A pesar de las limitaciones de un diseño observacional, el estudio mostró que la dosis de 0,6mg/dl de alteplase era al menos tan efectiva y segura como la dosis estándar para su población8.Con estos resultados, las autoridades sanitarias japonesas aprobaron la dosis de alteplase a 0,6mg/kg para el tratamiento del ictus agudo. Al mismo tiempo, se ordenó la realización de una segunda etapa del estudio20 y un registro de trombolisis posmercadeo con alteplase a dosis bajas J-MARS7 cuyos resultados serían comparados con el registro de trombolisis SIST-MOST de la Unión Europea al momento de su publicación.
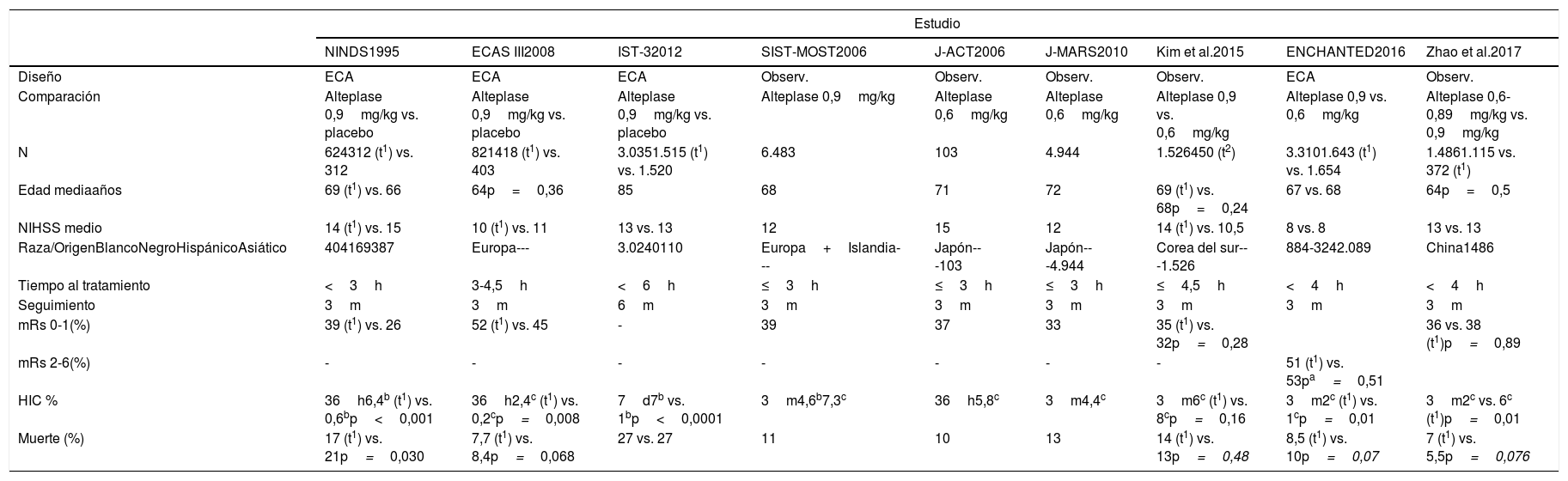
Características de los estudios dirigidos a determinar eficacia y seguridad de alteplase a diferentes dosis
| Estudio | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| NINDS1995 | ECAS III2008 | IST-32012 | SIST-MOST2006 | J-ACT2006 | J-MARS2010 | Kim et al.2015 | ENCHANTED2016 | Zhao et al.2017 | |
| Diseño | ECA | ECA | ECA | Observ. | Observ. | Observ. | Observ. | ECA | Observ. |
| Comparación | Alteplase 0,9mg/kg vs. placebo | Alteplase 0,9mg/kg vs. placebo | Alteplase 0,9mg/kg vs. placebo | Alteplase 0,9mg/kg | Alteplase 0,6mg/kg | Alteplase 0,6mg/kg | Alteplase 0,9 vs. 0,6mg/kg | Alteplase 0,9 vs. 0,6mg/kg | Alteplase 0,6-0,89mg/kg vs. 0,9mg/kg |
| N | 624312 (t1) vs. 312 | 821418 (t1) vs. 403 | 3.0351.515 (t1) vs. 1.520 | 6.483 | 103 | 4.944 | 1.526450 (t2) | 3.3101.643 (t1) vs. 1.654 | 1.4861.115 vs. 372 (t1) |
| Edad mediaaños | 69 (t1) vs. 66 | 64p=0,36 | 85 | 68 | 71 | 72 | 69 (t1) vs. 68p=0,24 | 67 vs. 68 | 64p=0,5 |
| NIHSS medio | 14 (t1) vs. 15 | 10 (t1) vs. 11 | 13 vs. 13 | 12 | 15 | 12 | 14 (t1) vs. 10,5 | 8 vs. 8 | 13 vs. 13 |
| Raza/OrigenBlancoNegroHispánicoAsiático | 404169387 | Europa--- | 3.0240110 | Europa+Islandia--- | Japón---103 | Japón---4.944 | Corea del sur---1.526 | 884-3242.089 | China1486 |
| Tiempo al tratamiento | <3h | 3-4,5h | <6h | ≤3h | ≤3h | ≤3h | ≤4,5h | <4h | <4h |
| Seguimiento | 3m | 3m | 6m | 3m | 3m | 3m | 3m | 3m | 3m |
| mRs 0-1(%) | 39 (t1) vs. 26 | 52 (t1) vs. 45 | - | 39 | 37 | 33 | 35 (t1) vs. 32p=0,28 | 36 vs. 38 (t1)p=0,89 | |
| mRs 2-6(%) | - | - | - | - | - | - | - | 51 (t1) vs. 53pa=0,51 | |
| HIC % | 36h6,4b (t1) vs. 0,6bp<0,001 | 36h2,4c (t1) vs. 0,2cp=0,008 | 7d7b vs. 1bp<0,0001 | 3m4,6b7,3c | 36h5,8c | 3m4,4c | 3m6c (t1) vs. 8cp=0,16 | 3m2c (t1) vs. 1cp=0,01 | 3m2c vs. 6c (t1)p=0,01 |
| Muerte (%) | 17 (t1) vs. 21p=0,030 | 7,7 (t1) vs. 8,4p=0,068 | 27 vs. 27 | 11 | 10 | 13 | 14 (t1) vs. 13p=0,48 | 8,5 (t1) vs. 10p=0,07 | 7 (t1) vs. 5,5p=0,076 |
ECA: ensayo clínico aleatorizado; mRs: escala de Rankin modificada; Observ.: estudio observacional.
(t1) En referencia a alteplase a dosis estándar.
(t2) En referencia a la dosis 0,6mg/kg.
pa: Valor de «p» para la hipótesis de no inferioridad.
En los resultados del registro J-MARS7 la proporción de pacientes con HIC a los 3 meses y la proporción de desenlaces favorables fueron comparables con lo observado en el registro con alteplase a dosis estándar SIST-MOST. Sin embargo, la proporción de HIC reportadas, de manera similar a lo observado en otros estudios de Asia del Este29,30, fue proporcional a la experiencia acumulada en trombolisis de cada uno de los centros de reclutamiento de pacientes7,31. A pesar de la limitación de haber tenido una gran pérdida de pacientes en el periodo de seguimiento, los resultados mostraron que la dosis de 0,6mg/kg en Japón tiene bajos índices de HIC con eficacia y seguridad comparables a la dosis estándar en Europa.
Curiosamente, en otras regiones de Asia se realizaron múltiples estudios observacionales de comparación de dosis de alteplase cuyos resultados no respaldaban la hipótesis de una menor incidencia de HIC con bajas dosis de alteplase. En Corea del Sur, un estudio que comparó ambas dosis de alteplase en 1.526 pacientes21 mostró índices de eficacia y seguridad similares para ambas dosis basado en la incidencia de HIC (8,4% baja dosis vs. 6,4% dosis estándar; p=0,16) y la ocurrencia de muerte (12,7% baja dosis vs. 14% dosis estándar; p=0,48). Asimismo, un metaanálisis de estudios observacionales provenientes de China, Vietnam, Singapur, Tailandia y Corea32 mostró que no hubo diferencia significativa entre dosis bajas (0,6-0,85mg/kg) y dosis estándar en cuanto a desenlace funcional favorable (mRs 0-1) a los 3 meses (OR: 0,88; IC 95%: 0,71-1,11); HIC (OR: 1,19; IC 95%: 0,.76-1,87); y mortalidad a los 3 meses (OR: 0,91; IC 95%: 0,73-1,12).
Recientemente, se publicaron los resultados del estudio Control de Hipertensión ligado a Trombolisis (ENCHANTED) que incluyó a pacientes menores de 80 años con ictus leve a moderado (escala de severidad del Ictus NIHSS promedio: 8 puntos)33. El 63% de los pacientes se reclutaron en Asia y solo el 10% en América Latina. El estudio comparó 0,6mg/kg de alteplase con la dosis estándar. La hipótesis de no inferioridad planteada por los autores quedaría demostrada si el límite superior del IC 95% para muerte o discapacidad severa hubiera sido menor o igual a 0,14 (valor delta extraído de revisiones Cochrane). Aunque la incidencia de HIC fue significativamente menor en el grupo de bajas dosis, los índices de mortalidad fueron similares. Además, el estudio falló en demostrar que la dosis baja de alteplase era al menos no inferior que la dosis estándar con una tasa menor de muerte y discapacidad severa a favor de la dosis estándar (51,1 vs. 53,2%; OR: 1,09; IC 95%: 0,95-1,25; p=0,51 para no inferioridad). Resultados similares mostró un estudio observacional retrospectivo reciente de 1.486 pacientes realizado en China, en el cual no se encontraron diferencias en cuanto a desenlace funcional y muerte a los 90 días entre pacientes que recibieron dosis de alteplase de 0,9mg/kg y los que recibieron dosis menores, con una incidencia de HIC significativamente menor a favor de las dosis menores a 0,9mg/kg33,34.
Perspectivas futurasTrombolisis en Ictus Agudo del Despertar y de Inicio No claro con Alteplase a 0,6mg/kg (THAWS) es un ECA que se lleva a cabo en Japón. Es la contraparte del estudio WAKE UP e intenta enrolar 300 pacientes seleccionados para trombolisis en base a criterios de resonancia magnética con ictus agudo de tiempo de enfermedad no claro e ictus al despertar. Los investigadores utilizan 0,6mg/kg de alteplase intravenoso en pacientes que tengan Secuencia de Difusión/puntuación de Alberta Stroke Program Early Tomography Score (DWI/ASPECTS)≥5, y ausencia de hiperintensidad en secuencias FLAIR como indicadores de ictus de menos de 4,5h de evolución. El objetivo del estudio previsto de concluirse en marzo del 2020 es determinar la eficacia y seguridad del tratamiento trombolítico con dosis bajas en estos pacientes.
ConclusiónNo se cuenta con evidencia suficiente para catalogar la dosis baja de alteplase como superior o al menos no inferior que el tratamiento estándar en el manejo del ictus agudo en población occidental. Ningún estudio revisado reportó reducción significativa de la mortalidad con el uso de dosis bajas de alteplase en comparación con la dosis estándar.
Las tasas bajas de HIC reportadas con el uso de rt-PA a bajas dosis indican que su uso parece razonable en pacientes de origen asiático. Se requieren más estudios que respalden su beneficio en aquellos pacientes con contraindicaciones relativas de trombolisis intravenosa, en aquellos tributarios de terapia trombolítica que vayan a ser sometidos a procedimientos intraarteriales u otras circunstancias que eleven el riesgo de HIC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.