La variante conductual de la demencia frontotemporal (DFT vc) es el síndrome clínico más frecuente de las demencias frontotemporales (DFT) y se caracteriza por una alteración progresiva de la personalidad y la conducta. En las últimas 2 décadas, los avances en biología molecular y genética han contribuido a un mayor conocimiento de esta entidad, que puede ser el modo de presentación de diferentes enfermedades neurodegenerativas.
DesarrolloSe revisan los principales aspectos epidemiológicos, clínicos, diagnósticos y terapéuticos de la DFT vc. La mayoría de los casos son esporádicos, iniciándose en torno a los 58 años de media. Los criterios diagnósticos vigentes establecen 3 niveles de certeza diagnóstica: posible, probable y definitivo. El diagnóstico clínico se basa en la anamnesis detallada de familiares, complementada con la realización de test neuropsicológicos dirigidos. Hasta la fecha, los tratamientos empleados son solo sintomáticos y de eficacia controvertida. Se están diseñando fármacos dirigidos contra dianas moleculares específicas implicadas en la patogenia de las degeneraciones lobares frontotemporales.
ConclusionesLa DFT vc es una causa frecuente de demencia. Se trata de un síndrome amplio, heterogéneo desde el punto de vista histopatológico y biomolecular. La definición de subtipos clínicos y la identificación de biomarcadores podrían ayudar a predecir la afección subyacente, lo que junto con el desarrollo de fármacos dirigidos contra dianas moleculares ofrece nuevas posibilidades terapéuticas.
Behavioural variant frontotemporal dementia (bvFTD) is the most frequent presentation in the clinical spectrum of frontotemporal dementia (FTD) and it is characterised by progressive changes in personality and conduct. Major breakthroughs in molecular biology and genetics made during the last two decades have lent us a better understanding of this syndrome, which may be the first manifestation in many different neurodegenerative diseases.
DevelopmentWe reviewed the main epidemiological, clinical, diagnostic and therapeutic aspects of bvFTD. Most cases manifest sporadically and the average age of onset is 58 years. Current criteria for bvFTD propose three levels of diagnostic certainty: possible, probable, and definite. Clinical diagnosis is based on a detailed medical history provided by family members and caregivers, in conjunction with neuropsychological testing. Treatments which have been used in bvFDT to date are all symptomatic and their effectiveness is debatable. New drugs designed for specific molecular targets that are implicated in frontotemporal lobar degeneration are being developed.
ConclusionsBvFDT is a frequent cause of dementia. It is a non-specific syndrome associated with heterogeneous histopathological and biomolecular findings. The definition of clinical subtypes complemented by biomarker identification may help predict the underlying pathology. This knowledge, along with the development of drugs designed for molecular targets, will offer new treatment possibilities.
Desde el primer caso descrito por Pick en 1892, transcurrió casi un siglo hasta que la Neurología centró de nuevo su interés en las demencias frontotemporales (DFT)1. En los últimos 20 años, el desarrollo de la biología molecular y la genética ha supuesto una auténtica revolución en el conocimiento de las DFT y ha permitido un notable progreso en la comprensión de sus mecanismos causales. Todo ello, ha conducido a la elaboración de nuevos criterios diagnósticos y clasificaciones que configuran el esquema actual de las DFT.
Las DFT constituyen la tercera causa de demencia degenerativa, después de la enfermedad de Alzheimer (EA) y la demencia con cuerpos de Lewy, y la segunda en menores de 65 años2,3. La prevalencia de la DFT en estudios poblacionales varía desde 2,7/100.000 (con un pico de 9,4/100.000 en el grupo de 60-69 años) en Holanda3 hasta 15,1/100.000 en adultos por debajo de 65 años en Cambridge (Reino Unido), donde hallan la misma prevalencia de EA en este grupo estario2. Aunque clásicamente se ha considerado una causa de demencia rara después de los 65 años, es probable que sea más frecuente de lo que se piensa y para algunos autores podría suponer en torno al 20-25% de todos los casos de demencia en mayores de 65 años2,4,5. La edad de presentación habitual es la sexta década, aunque existe un amplio rango de variabilidad, pudiendo presentarse desde la tercera a la novena décadas2,4,5.
La falta de homogeneidad en la terminología ha sido durante años un factor de confusión. El término demencia frontotemporal es un concepto clínico que hace referencia al conjunto de síndromes que se caracterizan por una alteración progresiva del comportamiento o lenguaje, en relación con una atrofia focal de los lóbulos frontal y temporal. En función de los síntomas predominantes o de su momento de aparición en la evolución de la enfermedad, se distinguen 3 síndromes clínicos principales: la DFT variante conductual (DFT vc), la demencia semántica (DS) y la afasia primaria progresiva no fluente (APPNF)6. En los pacientes en que la DFT se asocia a signos de enfermedad de la motoneurona el cuadro se denomina DFT-EMN7,8. Además, existen otros 2 síndromes en estrecha relación con las DFT, el síndrome corticobasal y el síndrome de parálisis supranuclear progresiva. Estos 6 síndromes clínicos están vinculados a un grupo heterogéneo de afecciones moleculares caracterizadas por presentar neurodegeneración cortical, con pérdida neuronal y microespongiosis de los lóbulos frontal y temporal, que se denominan degeneraciones lobares frontotemporales (DLFT). Así pues, mientras que el término DFT es un concepto clínico, DLFT hace alusión a un concepto patológico. En este artículo revisaremos los aspectos clínicos, diagnósticos y terapéuticos de la DFT vc.
Aspectos clínicos de la demencia frontotemporal variante conductualLa DFT vc constituye el síndrome clínico más frecuente de las DFT. Se caracteriza por la aparición precoz (en los primeros 3 años) de cambios insidiosos en la personalidad y conducta. En función de las áreas prefrontales afectadas, se distinguen 3 subtipos clínicos: dorsolateral (disejecutivo, seudodepresivo o de la convexidad), orbitomedial (desinhibido, seudomaniaco o seudopsicopático) y mesiofrontal (apático, hipocinético o de la circunvolución cingulada)9,10. La enfermedad comienza habitualmente antes de los 65 años, con una edad media al inicio en torno a los 58 años4, aunque es frecuente que el inicio de la clínica sea difícil de precisar, ya que estos pacientes presentan una baja capacidad de introspección y la detección de los primeros síntomas depende del grado de observación de familiares y cuidadores.
Como se ha referido, la DFT vc se caracteriza por cambios insidiosos en la personalidad, conducta interpersonal y modulación emocional, resultado de la desintegración progresiva de los circuitos neurales implicados en la cognición social, la regulación de las emociones, la motivación y la toma de decisiones11-15. La apatía es un síntoma muy común y se manifiesta como una pérdida de la motivación y el interés por las actividades personales, y un aislamiento social progresivo. Algunos autores indican que es un síntoma más frecuente en los casos de DFT vc de inicio tardío16, aunque existen resultados contradictorios en este aspecto17.
En otros casos, predomina la desinhibición, que conduce a la realización de actos impulsivos, como gastar dinero en exceso o comportarse de forma indiscreta o sexualmente inapropiada. Se han descrito conductas de ludopatía o, más raro, de hiperreligiosidad como primera manifestación de una DFT vc18,19. Se han reportado incluso conductas sociopáticas y delictivas, como violaciones de las normas de tráfico o asaltos físicos, en algunos pacientes20,21.
La perseveración, con conductas repetitivas y estereotipadas (tendencia a repetir actos motores, frases, historias o bromas), es también un hallazgo característico. Estos pacientes suelen presentar rigidez y escasa flexibilidad mental, por lo que es habitual la falta de adaptación a nuevas situaciones o rutinas. Los trastornos afectivos oscilan desde el aplanamiento afectivo y la frialdad emocional hasta el afecto expansivo con rasgos de hipomanía. Es frecuente encontrar trastornos de la conducta alimentaria, tanto hiperfagia, falta de saciedad y apetencia por alimentos dulces, como pérdida de apetito e hiporexia22. Aunque se desconocen los mecanismos exactos, estos cambios podrían estar en relación con una disfunción hipotalámica23. Los síntomas psicóticos son muy raros, y se han asociado a formas con enfermedad de la motoneurona o a casos de DLFT con enfermedad asociada a la proteína de fusión en sarcoma (DLFT-FUS) de inicio temprano, en los cuales están presentes hasta en el 50%24-27.
De todas las manifestaciones conductuales mencionadas, la desinhibición social, la euforia, las conductas motoras estereotipadas y los cambios en la conducta alimentaria son las más específicas para distinguir la DFT vc de otras enfermedades degenerativas como la EA28,29. Por ello, una evaluación detallada del comportamiento es crucial en el diagnóstico de la DFT vc.
En fases tempranas, a pesar de existir alteraciones conductuales y de personalidad acusadas, los test neuropsicológicos pueden ser normales30, dado que reflejan más la disfunción frontal dorsolateral que la ventromedial. Por ello, puede ser útil completar la valoración con escalas neuropsiquiátricas31.
El Mini Mental State Examination no es sensible para el diagnóstico de DFT vc. El examen cognitivo de Addenbrooke muestra alteraciones en hasta un 90% de los casos al inicio32. Recientemente, se ha validado la versión española de este test, con una sensibilidad del 92% para la detección de demencia y adecuada discriminación entre EA y DFT vc33,34, por lo que puede constituir una buena herramienta de cribado. Estos pacientes suelen estar orientados, a diferencia de los pacientes con EA35. La evaluación neuropsicológica debe incluir la valoración de las funciones ejecutivas y del resto de dominios cognitivos, que serán útiles en el diagnóstico diferencial, como la memoria, el lenguaje y las funciones visuoespaciales36. En España, estos aspectos pueden ser evaluados mediante diferentes subtest incluidos en el Test Barcelona37, así como las diferentes pruebas neuropsicológicas normalizadas en el proyecto NEURONORMA38,39. Para los diferentes ámbitos de la función ejecutiva destacan el Span verbal (dígitos), los Cubos de Corsi, el Trail Making Test40,41, las fluencias verbales42,43, el test de interferencia palabra-color de Stroop y la Torre de Londres44,45. La presencia de perseveración y confabulación durante la realización de los test es muy característica y puede ayudar a distinguir la DFT vc de otros trastornos46,47.
Clásicamente, se creía que en la DFT vc en fases tempranas predominaba una alteración atencional, de la memoria de trabajo y una disfunción ejecutiva con relativa preservación del lenguaje, memoria episódica y funciones visuoespaciales. De hecho, la alteración de la memoria episódica se consideraba un criterio de exclusión48. Recientemente, se ha sugerido que los déficits de la memoria episódica pueden ser más frecuentes de lo que se pensaba49,50 y algunas series de DLFT con confirmación histológica han encontrado que hasta un 10-15% de los pacientes debutan con alteraciones mnésicas graves al inicio51,52, lo que podría cuestionar el criterio de «relativa preservación de la memoria episódica en comparación con las funciones ejecutivas» que aparece en los criterios diagnósticos vigentes.
En los últimos años, se ha observado que existen pacientes que comienzan con rasgos clínicos de DFT vc pero finalmente no progresan a demencia53. Estos casos, que se han denominado «fenocopias», son en su mayoría hombres y pueden mantenerse estables durante años o incluso mejorar54,55. Se diferencian de los verdaderos casos de DFT vc por la ausencia de disfunción ejecutiva en los test neuropsicológicos, la preservación de la memoria y de la cognición social y la ausencia de atrofia (resonancia magnética) o hipometabolismo (tomografía por emisión de positrones) en la neuroimagen23,54-56.
El reconocimiento de las emociones, especialmente de las negativas como el miedo, la tristeza o la ira, se altera desde fases precoces57,58, aunque las respuestas fisiológicas a estímulos emocionales (como la conductividad de la piel) pueden estar conservadas59. También puede existir dificultad para el reconocimiento de emociones más complejas, como la vergüenza60. Estos cambios no son específicos de la DFT vc y también pueden observarse en otros subtipos de DFT, como la DS.
Los pacientes con DFT vc también presentan alteraciones en diferentes aspectos de la cognición social. La ausencia de empatía y la frialdad emocional son frecuentes y pueden evidenciarse a través de test específicos61. Es común que estos pacientes presenten dificultades para intuir las intenciones de otros, entender el punto de vista de los demás, identificar el sarcasmo o entender situaciones que requieran un juicio moral62-64.
Las actividades de la vida diaria (AVD) se alteran de forma más grave y precoz que en las variantes con afectación del lenguaje o en la EA32,65,66, independientemente de la duración de los síntomas o los resultados en los test neuropsicológicos32,65 y muchos pacientes pueden mostrar alteraciones en las AVD desde fases iniciales.
Criterios diagnósticos de la demencia frontotemporal variante conductualLa DFT vc supone un reto diagnóstico, especialmente en estadios precoces, dado que muchos de los síntomas son idénticos a los que se pueden encontrar en cuadros psiquiátricos o en otras demencias25. Recientemente, en un intento de mejorar la precisión diagnóstica de la DFT vc, se han propuesto unos nuevos criterios diagnósticos (tabla 1)67. Estos criterios, más flexibles y menos restrictivos, han demostrado ser más sensibles que los previos48,68, aunque parece que en mayores de 65 años la sensibilidad disminuye.
Criterios de consenso para el diagnóstico clínico de la variante conductual de la DFT (Rascovsky, 2007)67
| Enfermedad neurodegenerativa |
| Deterioro progresivo del comportamiento y/o cognición evidenciado mediante la observación o la historia clínica |
| Posible DFT vc |
| Al menos 3 de los siguientes síntomas cognitivos o conductuales, de forma persistente o recurrente (A-F): |
| A. Desinhibición conductual precoz (3 años) |
| B. Apatía o inercia precoz (3 años) |
| C. Pérdida de empatía precoz (3 años) |
| D. Conducta perseverante, estereotipada, compulsiva o con rituales |
| E. Hiperoralidad y cambios en la dieta |
| F. Perfil neuropsicológico: Déficits en la función ejecutiva con relativa preservación de la memoria y habilidades visuoespaciales |
| Probable DFT vc |
| Todos los siguientes deben estar presentes |
| A. Cumplir criterios de DFT vc posible |
| B. Deterioro funcional significativo |
| C. Hallazgos compatibles en neuroimagen: atrofia (TC o RM) o hipoperfusión (SPECT)/hipometabolismo (PET) frontal y/o temporal anterior |
| DFT vc definitiva |
| Debe cumplirse el criterio A y estar presentes el B o el C |
| A. Cumplir criterios de DFT vc posible o probable |
| B. Evidencia histopatológica de DLFT en biopsia o autopsia |
| C. Presencia de una mutación patogénica conocida |
| Criterios de exclusión de DFT vc |
| A. Presencia de enfermedad médica o neurológica no degenerativa que explique mejor los déficits |
| B. Presencia de enfermedad psiquiátrica que justifique la alteración conductual |
| C. Presencia de biomarcadores altamente sugestivos de enfermedad de Alzheimer u otra enfermedad neurodegenerativaa |
DFT vc: variante conductual de la demencia frontotemporal; DLFT: degeneración lobar frontotemporal; PET: tomografía por emisión de positrones; RM: resonancia magnética; SPECT: tomografía computarizada por emisión de fotón único; TC: tomografía computarizada.
La supervivencia mediana de la DFT se ha estimado en 6-11 años desde el inicio de los síntomas y 3-4 años desde el diagnóstico69-71. La mayoría de los estudios indican que en la DFT la supervivencia es menor y el deterioro cognitivo y funcional más rápido que en la EA70,71, aunque existen otros estudios que no apuntan lo mismo72. En la DFT vc, se han propuesto como factores que reducen la supervivencia la asociación con EMN (supervivencia de 2,4-4,9 años desde el inicio y 1,2-1,4 años desde el diagnóstico)71 y la presencia de alteración del lenguaje al diagnóstico73.
A pesar de haber sido empleada en la mayoría de los estudios realizados, la escala Clinical dementia rating (CDR)74, concebida inicialmente para EA, valora fundamentalmente la alteración de la memoria y tiende a infraestimar la gravedad de la demencia en la DFT vc75. Existe una versión adaptada, que incluye dominios del lenguaje y de la conducta (FCDR) y parecer ser sensible para detectar cambios en la mayoría de pacientes con DFT75. Recientemente, se ha desarrollado una escala específica para DFT (FRS), que considera también los cambios conductuales y en las AVD76. Según esta escala, los pacientes con DFT vc tienden a mostrar una mayor gravedad y una progresión más rápida que los pacientes con variantes del lenguaje, independientemente de la duración de los síntomas76.
Josephs et al.77 estudiaron a 86 pacientes con DFT vc y analizaron posibles variables predictoras de la evolución de la enfermedad, observando que el subtipo anatómico fue el factor predictor más potente del curso evolutivo. Así, los pacientes que progresaban más rápido (según la escala DRS-SB) presentaban un patrón de atrofia frontotemporal o frontal predominante y una menor pérdida de volumen lobar temporal. Otros factores predictores de rápida progresión fueron: mayor edad al inicio, peor función ejecutiva, lenguaje y habilidades visuoespaciales, menor desinhibición, agitación, agresividad y conductas nocturnas al inicio y presencia de mutaciones del gen «microtubule-associated protein» (MAPT)77.
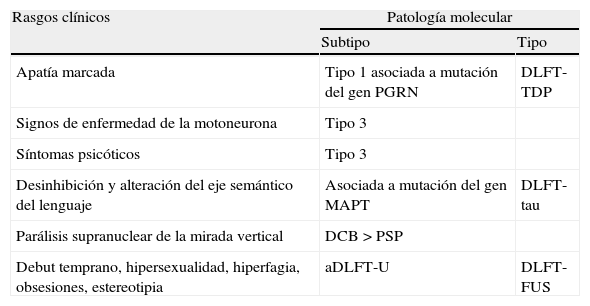
Más allá de la clínicaLa clínica es esencial para el diagnóstico de la DFT vc pero no suficiente. En primer lugar, el diagnóstico temprano de DFT vc puede resultar muy difícil: los cambios en la cognición social pueden pasar inadvertidos antes de que comiencen a afectar a los cuidadores, el funcionamiento cognitivo ser normal en las primeras etapas, y a veces los síntomas neuropsiquiátricos atribuirse erróneamente a un trastorno psiquiátrico primario. Además, como hemos mencionado, existen algunos pacientes con rasgos compatibles con DFT vc que finalmente no progresan a demencia (fenocopias) y otros que aunque cumplen criterios clínicos de DFT vc en la autopsia presentan patología no DLFT78. En segundo lugar, dado que los nuevos fármacos que se están desarrollando para el tratamiento de estas enfermedades, son agentes dirigidos contra dianas moleculares específicas, realizar una estimación in vivo de la patología y biología molecular de la enfermedad resulta de especial importancia. Algunos fenotipos clínicos muestran una fuerte asociación a subtipos histopatológicos específicos, pero en el caso de la DFT vc no existe una clara correlación con ninguno en particular78,79. Así, del mismo modo que se han identificado algunos rasgos clínicos que orientan a subtipos moleculares concretos (tabla 2)79, es posible que exista una correlación entre diferentes subtipos y determinados rasgos anatómicos o bioquímicos78.
Rasgos clínicos que orientan a subtipos biomoleculares determinados en la DFT vc
| Rasgos clínicos | Patología molecular | |
| Subtipo | Tipo | |
| Apatía marcada | Tipo 1 asociada a mutación del gen PGRN | DLFT-TDP |
| Signos de enfermedad de la motoneurona | Tipo 3 | |
| Síntomas psicóticos | Tipo 3 | |
| Desinhibición y alteración del eje semántico del lenguaje | Asociada a mutación del gen MAPT | DLFT-tau |
| Parálisis supranuclear de la mirada vertical | DCB > PSP | |
| Debut temprano, hipersexualidad, hiperfagia, obsesiones, estereotipia | aDLFT-U | DLFT-FUS |
Los subtipos DLFT-TDP 1 y 3 se han nombrado según el esquema de Mackenzie.
Obtenido a partir de los datos de Josephs et al. 200779.
aDLFT-U: degeneración lobar frontotemporal atípica con inmunorreactividad exclusiva a ubicuitina; DCB: degeneración corticobasal; DLFT-FUS: degeneración lobar frontotemporal asociada a la proteína de fusión en sarcoma; DLFT-tau: degeneración lobar frontotemporal asociada a tau; DLFT-TDP: degeneración lobar frontotemporal asociada a la proteína fijadora del ADN TAR 43; MAPT: «microtubule-associated protein tau»; PGRN: progranulina; PSP: parálisis supranuclear progresiva.
En el momento actual, no disponemos en la práctica clínica de intervenciones terapéuticas específicas para la DFT. El tratamiento es fundamentalmente sintomático o de soporte y su objetivo principal es aliviar los síntomas de la enfermedad y mejorar la calidad de vida del paciente, especialmente cuando las alteraciones conductuales son tan marcadas que interfieren con su cuidado80. En ausencia de una terapia efectiva, a menudo se emplean fármaco psicoactivos fuera de indicación para aliviar los síntomas81,82, siendo las más utilizadas los inhibidores selectivos de la recaptación de la serotonina (ISRS) y los antipsicóticos, lo que indica la existencia de alteraciones serotonérgicas y dopaminérgicas asociadas a la DFT83-85.
Los ISRS se han empleado en el tratamiento de los síntomas conductuales, la impulsividad-desinhibición y las alteraciones en la conducta alimentaria en pacientes con DFT, con resultados variables86-89. A pesar de la falta de evidencia científica, los antipsicóticos atípicos también se han empleado en el tratamiento de los síntomas de la DFT, especialmente de la agitación y la desinhibición. Existe un caso en la literatura tratado con risperidona90 y un ensayo abierto con olanzapina a favor de su uso91. Otros fármacos potenciadores del sistema dopaminérgico, como la selegilina (IMAO-B)92, se han empleado con éxito para reducir los síntomas neuropsiquiátricos. El metilfenidato también se ha probado en la DFT vc con resultados satisfactorios93.
Los inhibidores de la colinesterasa y la memantina se emplean también con frecuencia en la DFT94,95, debido a su acción en la EA y por los datos procedentes de ensayos clínicos no controlados, abiertos y de pequeño tamaño. Sin embargo, los resultados desfavorables con donepezilo junto con los controvertidos de galantamina y rivastigmina96–100, han conducido a la recomendación general de evitar los anticolinesterásicos en la DFT80–82. La identificación de 3 casos de DFT vc101 que mejoraron los resultados en el test NPI tras tratamiento con memantina impulsó la realización de ensayos clínicos. Se han llevado a cabo 2 ensayos clínicos, abiertos no controlados con memantina. En el primero de ellos, realizado en 16 pacientes con DFT vc102, la memantina no mostró beneficios de los síntomas conductuales a dosis de 20mg/kg/día. En el segundo, se administró el fármaco a la misma dosis a 21 pacientes con DFT vc, 13 pacientes con DS y 9 con APPNF103. Los pacientes con DFT vc presentaron una mejoría inicial transitoria en el test NPI, aunque en el seguimiento posterior no se apreciaron otros beneficios. Actualmente, se están llevando a cabo 2 ensayos clínicos prospectivos, aleatorizados, multicéntricos, doble ciego y controlados con placebo (un ensayo fase iv en Estados Unidos y un ensayo fase ii en Francia).
Tratamiento modificador de la enfermedadEl campo más prometedor se centra en la producción de fármacos que se unan a una diana molecular específica. En el caso de las DLFT, las principales dianas terapéuticas serían la proteína tau, la proteína fijadora de ADN TAR-43 (TDP-43) y, en menor medida, la proteína FUS. La proteína tau está implicada en la patogénesis de la EA, así como de un importante porcentaje de las DLFT, por lo que los nuevos fármacos que se están desarrollando en la EA dirigidos a evitar la agregación de tau pueden resultar también interesantes en el tratamiento de las DLFT-tau80,82,104.
Las mutaciones de la progranulina (PGRN) producen una haploinsuficiencia por pérdida de función proteica y están asociadas a algunos casos de DLFT, fundamentalmente DLFT-TDP105. En estos casos, se ha visto que los niveles plasmáticos de PGRN están bajos105-107 por lo que la normalización de los mismos podría ser una estrategia terapéutica interesante. Recientemente, se ha conseguido aumentar los niveles de PGRN in vitro mediante micro-ARN-29b108. Otras posibles dianas terapéuticas son la inhibición de la hiperfosforilación, la ubicuitinación, la escisión o la translocación del núcleo al citoplasma de TDP-43109.
ConclusionesLas DFT son una causa frecuente de demencia. En los últimos 20 años, se ha avanzado de forma notable en su conocimiento gracias a los progresos de la biología molecular y la genética. La DFT vc es el síndrome clínico más frecuente y se caracteriza por cambios insidiosos en la personalidad y conducta. Se trata de una entidad devastadora que típicamente comienza a edades medias, afectando a individuos con una vida activa desde el punto de vista familiar, social y laboral. El diagnóstico clínico temprano a menudo es difícil y, dada la baja capacidad de introspección de los pacientes, la anamnesis a familiares es de vital importancia. Se trata de una entidad heterogénea desde el punto de vista histopatológico y biomolecular y, hasta la fecha, predecir la enfermedad subyacente «in vivo» continúa siendo complicado. Es posible que este síndrome sea un concepto demasiado amplio, por lo que la identificación de rasgos diferenciales que permitan definir «subtipos clínicos» podría ser útil para mejorar la correlación clinicopatológica. La identificación de biomarcadores y el desarrollo de fármacos dirigidos contra dianas moleculares específicas son estrategias fundamentales que abren las puertas a nuevos horizontes terapéuticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.