La depresión post ictus (DPI) es el trastorno afectivo más frecuente tras un ictus y el principal factor que limita la recuperación y rehabilitación de los pacientes, además de poder incrementar su mortalidad hasta 10 veces.
DesarrolloLa DPI se presenta en uno de cada 3 pacientes con ictus y en más de la mitad de los casos no se diagnostica ni se trata. En su etiopatogenia son varios los mecanismos implicados: biológicos, conductuales y sociales.
Los síntomas suelen aparecer en los primeros 3 meses tras el ictus (DPI «precoz») y menos frecuentemente más tarde (DPI «tardía»). Los síntomas son similares a los de otras depresiones, aunque con algunas diferencias, como presentar más trastornos del sueño, síntomas vegetativos e introversión para las relaciones sociales.
Para su diagnóstico se recomienda mantener una actitud vigilante y emplear herramientas diagnósticas específicas, como el Patient Health Questionaire-2 (PHQ-2).
Finalmente, el tratamiento de elección son los inhibidores selectivos de la recaptación de serotonina (ISRS). No obstante, aún son muchas las cuestiones por resolver en el tratamiento de la DPI, como cuándo es el mejor momento para iniciar el tratamiento o el efecto de los antidepresivos sobre la cognición y la función motora, entre otros.
ConclusionesLos neurólogos desempeñan un papel fundamental en la recuperación de los enfermos con ictus. Es necesario que estén familiarizados con la detección temprana y el tratamiento de la DPI, para así facilitar la recuperación funcional del paciente, su reinserción social y la mejora en la calidad de vida del enfermo y su familia.
Post-stroke depression (PSD) is the most common mood disorder following a stroke, and also the main factor limiting recovery and rehabilitation in stroke patients. In addition, it may increase mortality by up to ten times.
DevelopmentPSD occurs in 1 in 3 stroke patients and more than half of all cases are neither diagnosed nor treated. Several mechanisms, including biological, behavioral, and social factors, are involved in its pathogenesis. Symptoms usually occur within the first three months after stroke (early onset PSD), and less frequently at a later time (late onset PSD). Symptoms resemble those of other types of depression, although there are some differences: PSD patients experience more sleep disturbances, vegetative symptoms, and social withdrawal.
For PSD diagnosis, we recommended vigilance and use of specific diagnostic tools such as the Patient Health Questionnaire-2 (PHQ-2). The treatments of choice are selective serotonin reuptake inhibitors (SSRI). However, there are still many unanswered questions in the treatment of PSD, such as the best time to start treatment or the effects of antidepressants on cognition and motor function, among others.
ConclusionsNeurologists play a pivotal role in the care and management of patients recovering from stroke. They must be familiar with methods for early detection and treatment of PSD, as this can facilitate a patient's functional recovery and social reintegration, and improve quality of life for patients and their families.
Tradicionalmente, se ha considerado el ictus como una enfermedad con repercusión eminentemente motora y, de esta manera, los sistemas de atención hospitalaria, de rehabilitación y de seguimiento se han focalizado casi exclusivamente en esta área. No obstante, más recientemente se ha comprobado que otras áreas del paciente con ictus, como la cognición, el comportamiento o la afectividad, entre otros, van a adquirir un papel primordial en la repercusión que la enfermedad cerebrovascular provoca en estos enfermos.
Dentro de la esfera afectivo-cognitiva, cabe destacar el papel central que la depresión va a tener en estos enfermos. Hoy sabemos que la depresión es la complicación neuropsiquiátrica más frecuente tras un ictus1,2. No obstante, además de la depresión post ictus (DPI), son muchos otros los síntomas neuropsiquiátricos que pueden aparecer tras un ictus: ansiedad, irritabilidad, agitación, incontinencia emocional, modificación de la experiencia emocional, alteraciones del sueño, alteraciones del comportamiento como desinhibición, apatía, fatiga y síntomas psicóticos como delirios y alucinaciones1-3.
También sabemos que la DPI es el principal factor de mal pronóstico en la recuperación funcional tras un ictus, asociándose su aparición a una peor recuperación funcional y cognitiva, un mayor deterioro en las actividades de la vida diaria, en la vida social e interpersonal, peor calidad de vida y mayor mortalidad, hasta 10 veces mayor que los sujetos que no la presentan3,4.
Además, hoy día sabemos que existen numerosos factores de riesgo para la aparición de la DPI, como son una mayor severidad del déficit motor, una mayor discapacidad o un peor apoyo social, entre otros, que a su vez pueden ser identificados y que nos van a permitir establecer la aplicación precoz de estrategias de prevención y tratamiento1.
No obstante, aunque la prevalencia de la DPI es elevada, como veremos a continuación, la DPI está a menudo infradiagnosticada y habitualmente infratratada.
Por lo tanto, es importante conocer los factores de riesgo para la aparición de DPI e identificar lo más precozmente posible a los pacientes que la presentan, ya que es una complicación frecuente, claramente previsible, tratable y con importantes repercusiones negativas en el paciente y su entorno.
Prevalencia de la depresión post ictusNo resulta sencillo estimar la prevalencia real de la DPI debido a la diferente metodología utilizada en los estudios realizados1,2. En primer lugar, los criterios diagnósticos de depresión no coinciden en todos los estudios, aunque ciertamente, la mayoría de ellos ha utilizado una entrevista estructurada y aplicado los criterios del DSM-IV (Manual diagnóstico y estadístico de los trastornos mentales, cuarta edición).
En segundo lugar, las escalas aplicadas para evaluar los resultados también varían de unos estudios a otros (algunos emplean escalas específicas para la DPI, mientras otros utilizan escalas más generales, como la de Hamilton; unos utilizan escalas autoaplicadas y otros no, etc.).
En tercer lugar, los criterios de inclusión de pacientes también han sido muy variables, excluyéndose en algunos estudios a pacientes que otros estudios incluían (p. ej., pacientes afásicos o demenciados), centrándose en diferentes momentos temporales (ictus en fase aguda vs. crónica) o centrándose en ciertas poblaciones o de una edad concreta.
Y, finalmente, se ha comprobado que la prevalencia de la DPI depende del lugar en el que se encuentren los pacientes que son examinados5.
En general, la prevalencia de la DPI varía desde el 25 hasta el 79%, según las diferencias en diferentes criterios utilizados5,6.
La tasa más baja de prevalencia se da en los pacientes en la comunidad, donde el 14% de los pacientes presentaban depresión mayor y el 9%, depresión menor. En los hospitales, englobando enfermos agudos y en rehabilitación, la prevalencia de depresión mayor fue del 21,6% y la de depresión menor del 20,0%. En los pacientes dados de alta, con una variabilidad de entre 3 meses y 3 años tras el ictus, la prevalencia para depresión mayor fue del 24,0% y para depresión menor del 23,9%. Otros estudios exponen cifras similares, aunque con menor porcentaje de pacientes con depresión mayor que el de aquellos diagnosticados de depresión menor7.
Recientemente, White et al.8 han publicado, como resultado del estudio SPS3 (Secondary Prevention of Small Subcortical Strokes), datos de pacientes que presentaban exclusivamente ictus lacunares. Examinaron la prevalencia de depresión, su correlación con varios factores y el curso de la misma a lo largo del tiempo en una cohorte de 2.477 pacientes con antecedentes de ictus lacunares. Obtuvieron una prevalencia de depresión a los 4 meses siguientes al evento cerebral del 19%. La edad elevada, el género masculino y no presentar deterioro cognitivo se asociaron a un menor riesgo de depresión. Contrariamente, la incapacidad funcional, vivir junto con esposa o familiar y poseer factores de riesgo cerebrovasculares se asociaron con un riesgo alto de depresión. El estudio indicó que la probabilidad de presentar depresión disminuía con la edad, 1,12 veces por cada año de vida (IC del 95%, 1,06-1,17)8.
No obstante, la influencia de algunos factores sobre la prevalencia de la DPI es un tema controvertido. Así, algunos trabajos han encontrado una mayor prevalencia de DPI en pacientes con deterioro cognitivo, pero otros no1. Lo mismo ocurre con la edad, que para muchos autores, y en contra de los resultados del estudio SPS3, constituye un factor de riesgo para la DPI, aumentando la prevalencia de DPI en edades avanzadas5,6.
Diagnóstico de la depresión post ictusEl diagnóstico de la DPI está dificultado por la frecuente presencia de otros síntomas, especialmente aquellos derivados del daño cognitivo, como pueden ser la afasia, la agnosia, la apraxia y las alteraciones de la memoria1. Además, existe un solapamiento de signos y síntomas del ictus y depresión, siendo indistinguibles algunos de los que son consecuencia del ictus o propios de la depresión. Algunos síntomas son comunes a ambos, como las alteraciones del sueño, la dificultad de concentración y la reducción de apetito, pudiendo ocurrir una sobreestimación de la depresión en pacientes con ictus9. En otras ocasiones, muchos de los síntomas no se reconocen como consecuentes a la depresión, y se tiende a pensar que son consecuencia del ictus o «propios» de la edad si se trata de pacientes ancianos, lo que podría conducir a una subestimación del diagnóstico2,10.
Estas dificultades diagnósticas hacen que hasta el 50-80% de los casos de DPI no sean identificados por médicos no psiquiatras6,9.
Algunos estudios han comparado varias herramientas diagnósticas, con el objetivo de encontrar la más conveniente. Algunos autores proponen la GDS (Geriatric Depression Scale) como la mejor herramienta diagnóstica comparada con otras escalas como, por ejemplo, la HADS (Hospital Anxiety and Depression Scale)11. La GDS resulta más útil cuando se aplica a pacientes con un elevado nivel de funcionamiento y un deterioro cognitivo leve12.
Quaranta et al.13 evaluaron la precisión diagnóstica de la PDRS (Poststroke Depression Rating Scale), una herramienta específica para diagnosticar la depresión tras un ictus, en comparación con la HRSD (Hamilton Rating Scale for Depression). Ambas escalas resultaron adecuadas, mostrando buena sensibilidad y especificidad. La escala de Hamilton se vio muy influida por el deterioro cognitivo, mientras que la PDRS se vio afectada por la edad del paciente. Healey et al.14 compararon 3 escalas de depresión: la BDI-FS (Beck Depression Inventory-Fast Screen), BASDEC (Brief Assessment Schedule Depression Cards) y la HADS. La escala BASDEC mostró tener mayor validez y precisión. De forma similar, Berg et al.15 compararon diferentes instrumentos de cribado, concluyendo que las escalas de depresión de Beck y Hamilton (BDI-FS y HRSD), junto con la escala CGI (Clinical Global Impression), llevadas a cabo por profesionales son, junto con los criterios diagnósticos de la DSM (DSM-III-R u otras versiones), herramientas útiles en la evaluación de depresión, sin diferencias significativas entre ellas. Además, no recomiendan el uso de la escala VAMS (Visual Analogue Mood Scale) en pacientes con afasia y otros daños cognitivos.
Otros autores16 han demostrado que se puede establecer con éxito el diagnóstico de DPI empleando entrevistas neuropsiquiátricas estructuradas o semiestructuradas de acuerdo con los criterios actuales del DSM, no siendo necesarias herramientas diagnósticas específicas. Generalmente, se realiza el diagnóstico de la DPI siguiendo estos criterios, distinguiendo en ocasiones entre depresión mayor y depresión menor.
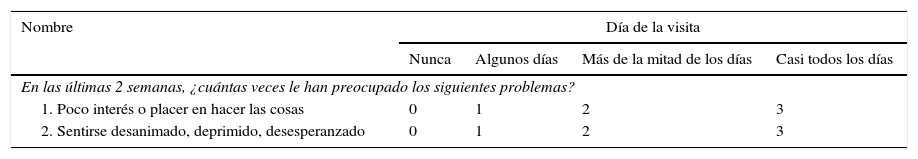
Sin embargo, recientemente, ha sido publicado un estudio en la revista Stroke17 en el que se investiga el valor diagnóstico del PHQ (Patient Health Questionnaire) en sus variantes de 2 ítems (PHQ-2) y 9 ítems (PHQ-9), y se compara con otras escalas, como la HADS, la BDI-II (Beck Depression Inventory II), la DT (Distress Thermometer) y la Kessler-10 (K-10), en pacientes con ictus agudos y capacidad comunicativa conservada. El PHQ-9 incluye los 9 síntomas de depresión que establece el DSM, mientras que PHQ-2 incluye únicamente anhedonia y humor depresivo. Se ha encontrado un buen valor diagnóstico para PHQ-9>9 10 y PHQ-2>2. Recomiendan utilizar PHQ-2 en todos los pacientes y PHQ-9 solo en aquellos con resultados positivos en PHQ-2, ya que así se obtienen los resultados de mayor sensibilidad. Proponen estas 2 herramientas de cribado en pacientes con ictus por su brevedad y facilidad de realización, teniendo como limitación la imposibilidad de ser utilizada en pacientes con alteración cognitiva y verbal importantes (tabla 1).
Cuestionario de calidad de vida PHQ-2 (Patient Health Questionnaire)
| Nombre | Día de la visita | |||
|---|---|---|---|---|
| Nunca | Algunos días | Más de la mitad de los días | Casi todos los días | |
| En las últimas 2 semanas, ¿cuántas veces le han preocupado los siguientes problemas? | ||||
| 1. Poco interés o placer en hacer las cosas | 0 | 1 | 2 | 3 |
| 2. Sentirse desanimado, deprimido, desesperanzado | 0 | 1 | 2 | 3 |
Patológico > 2.
El DSM IV-TR18 categoriza la DPI como un trastorno del humor debido a una afección médica general, en este caso el ictus, que puede tener diversos subtipos: manifestaciones depresivas, episodio depresivo mayor y síntomas mixtos (manía, depresión). De acuerdo con esta clasificación, el cuadro depresivo debe ser una consecuencia directa fisiológica del ictus.
Por tanto, generalmente con el término DPI nos referiremos al episodio depresivo mayor tras un ictus. Y para el diagnóstico de DPI es necesario tener evidencias por la historia clínica, por los hallazgos en el examen clínico y por las pruebas complementares que la DPI es una consecuencia fisiológica directa de la enfermedad vascular cerebral.
Sobre la base de los criterios diagnósticos del DSM-IV-TR, deben estar presentes 5 o más síntomas durante al menos 2 semanas para el diagnóstico de depresión mayor.
Mecanismos fisiopatológicos de la depresión post ictusEn la actualidad, los mecanismos fisiopatológicos de la DPI no se conocen con total certeza. Se cree que están implicados factores biológicos, conductuales y sociales, tratándose, por tanto, de un proceso multifactorial.
Dentro de los factores biológicos podríamos distinguir varios aspectos: localización del ictus, el tipo de ictus, las vías neurobiológicas implicadas, el mecanismo de inflamación y la apoptosis, y los factores genéticos.
Localización del ictus y depresión post ictusLos primeros estudios sobre la génesis de la DPI se centraron en la relación existente entre la localización de la lesión cerebrovascular y la DPI. Así, por ejemplo, Robinson et al.19 fueron los primeros en sugerir una relación entre la DPI y la lesión en el hemisferio cerebral izquierdo, localizando las lesiones causales de DPI, supuestamente, en las regiones corticales frontal y dorso-lateral izquierdas, así como en los ganglios basales izquierdos. Posteriormente, otros muchos estudios han corroborado esta asociación6,20. Otros investigadores21 han encontrado que las lesiones situadas en el lóbulo fronto-lateral izquierdo, caudado o putamen tenían significativamente mayor probabilidad de producir depresión durante el periodo post ictus agudo que aquellas lesiones similares situadas en el lado derecho. Sin embargo, son varios los estudios que no han podido confirmar dicha relación: un metaanálisis no encontró evidencia de relación entre la localización del ictus ni lateralización del mismo con el riesgo de presentar DPI22, y otro estudio23 señaló que, aunque el riesgo de DPI se correlacionaba con lesiones frontales y de los ganglios basales, no existe relación en cuanto a la lateralización de la misma. Del mismo modo, una revisión posterior sobre las limitaciones metodológicas de los estudios sobre localización del ictus y DPI observó que la relación existente entre el desarrollo de DPI y las lesiones frontales y de los ganglios basales variaba dependiendo de si la muestra examinada correspondía a pacientes ingresados o no, siendo dicha asociación mayor en estudios de base hospitalaria que en aquellos de base comunitaria24. En un estudio reciente, Nishiyama et al.25 han señalado que la presencia de infarto en la cápsula lenticular izquierda es, junto con la hipertensión y el nivel de educación, un predictor independiente de síntomas depresivos tras un ictus.
Por todo ello, dados los resultados contradictorios obtenidos en los diferentes estudios, en numerosas ocasiones debidos a sesgos metodológicos, no existen evidencias suficientes para establecer una relación entre la lateralización del ictus y el riesgo de presentar DPI.
Otra estructura que ha sido estudiada en relación con la DPI es la amígdala. Hoy es bien sabido que la amígdala está implicada en la regulación del humor y las emociones. En un estudio, el Sydney Stroke Study26, Sachdev et al. demostraron que aquellos pacientes que habían presentado un ictus o accidente isquémico transitorio (AIT) poseían una amígdala de menor tamaño, especialmente aquellos pacientes con indicios de daño cognitivo.
Tipo de ictus y depresión post ictusDe forma general, la hipótesis vascular de la depresión establece que el daño vascular cerebral de origen isquémico (agudo, crónico, infartos silentes, o leucoaraiosis, entre otros) puede afectar secundariamente al sistema de regulación del humor y del afecto, e inducir una depresión tardía a lo largo de la vida. Algunos autores, basados en esta hipótesis, postulan que la DPI puede conducir a un deterioro cognitivo de origen vascular, y provocar, a su vez, nuevos síntomas depresivos. De este modo, se establecería una relación bidireccional entre depresión e isquemia cerebral27.
De forma más concreta, vamos a exponer la influencia de los diferentes tipos de ictus en la aparición de DPI. Por una parte, la afectación de la sustancia blanca en forma de leucoaraiosis o pequeños infartos lacunares parece desempeñar un papel en la génesis de la DPI. Las hiperintensidades de la sustancia blanca se han asociado a depresión y disfunción ejecutiva28, siendo frecuente encontrar infartos silentes e hiperintensidad de la sustancia blanca en pacientes deprimidos de avanzada edad. Se ha demostrado que los factores de riesgo vascular y las lesiones cerebrovasculares influyen en el curso de la depresión, especialmente en aquellos pacientes de edad más avanzada, lo que sugiere que, además de la participación de vasos de mediano y gran calibre, están implicadas lesiones de pequeño vaso29. De hecho, Chen et al.30 estudiaron la DPI en pacientes con pequeños infartos subcorticales comparando sus 2 etiologías: aquellos resultantes de enfermedad de pequeño vaso y aquellos derivados de lesiones de grandes arterias intra y extracraneales. Encontraron que la DPI es más frecuente en aquellos pacientes con pequeños infartos subcorticales provocados por afectación de grandes vasos; lo que sugiere que la perfusión cerebral desempeña un importante papel en el desarrollo de la DPI.
Santos et al.31 analizaron mediante autopsia 41 casos de pacientes que habían tenido un primer episodio depresivo en los 2 años siguientes a un ictus. Como resultado, obtuvieron que la localización de los macroinfartos no se relacionaba con la existencia de DPI en todas las localizaciones estudiadas. Los ictus lacunares en el tálamo y los ganglios basales sí aparecían con más frecuencia en los pacientes con PDI, asociándose a un mayor riesgo de presentar DPI. Sin embargo, los microinfartos y la desmielinización periventricular y difusa no aparecían con más frecuencia en los pacientes con DPI. Como conclusión, exponen que el daño ocasionado por la acumulación de infartos lacunares crónicos en el tálamo, los ganglios basales y la sustancia blanca profunda puede ser un predictor de DPI más importante que la localización un solo infarto.
En un estudio reciente, Tang et al.32 examinaron la asociación entre DPI (definida por un GDS>7) y la existencia de microhemorragias cerebrales, evaluadas mediante resonancia, en 235 pacientes 3 meses después de haber presentado un ictus. Se observó que, en comparación con los pacientes no deprimidos, aquellos con DPI tenían más probabilidad de tener microhemorragias lobares, estableciéndose estas últimas como factores predictores independientes de DPI.
Vías neurobiológicas y depresión post ictusTambién se ha estudiado la relación entre las lesiones en diferentes vías cerebrales y la DPI. Así, se sabe que la lesión de las vías monoaminérgicas fronto-subcorticales disminuyen la liberación de neurotransmisores y da como resultado un aumento de la probabilidad de depresión33.
Probablemente, otro mecanismo implicado sea la alteración de la transmisión glutamatérgica tras el ictus, puesto que se han observado, mediante espectroscopia por resonancia magnética, cambios en los niveles de glutamato/glutamina en el lóbulo frontal de pacientes con DPI34.
Por otro lado, se ha observado que en el 40% de los pacientes que presentaban un ictus se producía una disregulación del eje hipotálamo-hipofisiario-adrenal, siendo la hiperactividad adrenocortical un hecho casi inmediato tras el evento. La hipercortisolemia resultante mantenida se ha asociado al desarrollo de depresión, peor pronóstico y aumento de la mortalidad35.
Inflamación y depresión post ictusLos procesos inflamatorios también parecen estar implicados en la génesis de la DPI. Se ha puesto de manifiesto que la isquemia cerebral provoca un incremento de la producción de citocinas proinflamatorias, tales como interleucina beta (IL-beta), factor de necrosis tumoral alfa (TNF-α) o IL-18 que, a su vez, puede dar lugar a una depleción de serotonina en ciertas áreas cerebrales, favoreciendo la aparición de depresión36. Concretamente, los niveles periféricos de IL-18 parecen relacionarse con la gravedad de la depresión37.
Una revisión reciente sobre los procesos de inflamación en pacientes post ictus corrobora que tanto la depresión como la isquemia están relacionadas con procesos inflamatorios, encontrándose en ambas un incremento de los niveles circulantes de citocinas proinflamatorias. Exponen que, dado el papel mediador de las citocinas en la muerte celular por isquemia y la asociación existente entre apoptosis en regiones límbicas y depresión, es muy probable que la inflamación isquémica contribuya al desarrollo de DPI38. Un reciente estudio39 ha encontrado un incremento de los niveles de las citocinas IL-6, IL-10, TNF-α, interferón-γ (INF-γ) y de las ratios de IL-6/IL-10 y TNF-α/IL-10 en pacientes con DPI comparado con aquellos pacientes post ictus no deprimidos.
No obstante, algunos autores no encuentran una clara relación entre un aumento en los marcadores de inflamación y la aparición de DPI40.
De cualquier forma, es interesante la aportación de otros estudios41,42, donde se evidencian los efectos antiinflamatorios de los antidepresivos, los cuales pueden reducir los síntomas depresivos actuando sobre marcadores inflamatorios implicados en la regulación del humor. Concretamente, se ha demostrado en modelos animales que los antidepresivos reducen los niveles de interleucinas proinflamatorias IL-1 e IL-2, e incrementan la interleucina antiinflamatoria IL-10. Además, inhiben la expresión de IL-6, TNF-α e INF-γ.
Factores genéticos y depresión post ictusLa variabilidad genética también parece estar implicada en la DPI. Por ejemplo, los pacientes con el polimorfismo s/s del gen trasportador de serotonina 5-HTTLPR tienen 3,1 veces más probabilidad de presentar DPI que aquellos con la variante 1/1 o 1/χ1. Y pacientes con las variantes 9/12 o 12/12 del transportador de serotonina STin2 tienen 4,1 más probabilidad de presentar depresión que aquellos con la variante 10/1043. Un reciente estudio44 ha encontrado una asociación entre el genotipo s/s de la región promotora del gen 5-HTT y la incontinencia emocional post ictus. Y otro estudio45 expresa que la homocigosis s/s para el gen transportador de serotonina SLC6A4 puede estar implicada en la aparición de DPI.
Por tanto, parece que ciertas características genéticas confieren una mayor vulnerabilidad a presentar depresión.
Clínica de la depresión post ictusAunque la DPI puede aparecer poco después del evento cerebrovascular, generalmente acontece en los primeros meses tras el ictus1,2. En un estudio de 100 pacientes que habían tenido un ictus, se identificaron síntomas de DPI en el 46% de los pacientes durante los primeros 2 meses y solo un 12% experimentaron los primeros síntomas 12 meses después del ictus46. Se ha propuesto como DPI «precoz» aquella que aparece en los primeros 3 meses tras el ictus y DPI «tardía» aquella que aparece más tarde1. Los pacientes con DPI precoz parecen presentar más signos depresivos somáticos que síntomas psicológicos27.
Aunque, en general, los síntomas depresivos son similares, se han encontrado algunas diferencias entre los pacientes con DPI y aquellos con depresión sin enfermedad neurológica asociada. Los pacientes con DPI, especialmente aquellos en los que el daño cerebral se produce en el hemisferio derecho, tienen menor probabilidad de presentar disforia y más probabilidad de presentar signos y síntomas vegetativos, comparada con otras formas de depresión de inicio tardío5,47. También se ha visto mayor introversión para las relaciones sociales y menor agitación psicomotriz en pacientes ancianos con depresión e ictus previo, que en aquellos con depresión y otras enfermedades médicas5,48. Un estudio posterior49 ha encontrado que los pacientes con DPI presentan mayor «incapacidad para sentir» y trastornos del sueño que aquellos pacientes deprimidos sin ictus previo.
Es importante, a su vez, realizar un diagnóstico diferencial con una serie de síndromes cognitivo-conductuales que cursan con cambios en el humor y en el afecto tras un ictus, cuya sintomatología puede confundirse con una depresión postictus27. Entre ellos destacan los síndromes de labilidad emocional, el síndrome de pérdida de autoactivación psíquica, la abulia y la apatía, la aprosodia afectiva y los síndromes disejecutivos frontales. Además, ciertos trastornos autonómicos, un patrón de sueño post ictus alterado, la disminución del apetito o de la libido, los síntomas vegetativos de ansiedad y la fatiga subjetiva post ictus pueden aparecer en ausencia de DPI. Gusev y Bogolepova50 exponen que, aproximadamente, el 2-3% de los pacientes sin ictus previo pueden presentar una depresión «enmascarada» (síntomas depresivos sin humor depresivo asociado) con manifestaciones somáticas, alteraciones del ritmo biológico y somatizaciones, especialmente, distonía vascular autonómica, vértigo y diversos fenómenos disálgicos. Estos síntomas, comunes al ictus y depresión, pueden llevar a una sobreestimación de depresión en pacientes con ictus9. Aunque, por esta misma razón, lo que ocurre más frecuentemente es un infradiagnóstico de la DPI debido a la escasa identificación de síntomas depresivos, a pesar, como hemos dicho, de su alta incidencia y prevalencia51.
Tratamiento de la depresión post ictusVarios antidepresivos han mostrado mejoría cognitiva y recuperación funcional en la DPI, siendo los inhibidores de la recaptación de serotonina (ISRS) y los antidepresivos tricíclicos (ADT) los más estudiados.
El primer estudio sobre el tratamiento de la DPI fue llevado a cabo por Lipsey et al.52 y demostró mejoría en la escala de depresión de Hamilton en 11 pacientes tratados con nortriptilina (25-100mg/día) durante 6 semanas frente a placebo.
El primer estudio que utilizó los ISRS53 mostró que los pacientes tratados con citalopram presentaban una mayor mejoría sintomática (reducción en la escala de depresión de Hamilton a las 3-6 semanas) que aquellos tratados con fluoxetina. Sin embargo, ambos, citalopram y fluoxetina, se mostraron eficaces en el tratamiento de DPI en 2 estudios doble-ciego, controlados frente a placebo, durante 6 semanas con 64 y 31 pacientes, respectivamente54,55. Un estudio controlado frente a placebo56 examinó durante 12 semanas a 104 pacientes que recibieron tratamiento con nortriptilina o fluoxetina, demostrándose mayor efectividad de la nortriptina (mayor descenso en la escala HDRS) comparada con fluoxetina y placebo. Otro estudio57 demostró que los pacientes tratados con fluoxetina o nortriptilina presentaban una tasa de mortalidad significativamente menor que aquellos tratados con placebo.
Rampello et al.58 obtuvieron un descenso mayor en la escala de depresión de Hamilton en aquellos pacientes tratados con reboxetina frente a los que recibieron placebo.
Los estudios más recientes se centran en el estudio de la efectividad de los ISRS. Ried et al. realizaron un estudio retrospectivo59 examinando la mortalidad y obtuvieron como resultado que el tratamiento con ISRS, tanto antes como después de presentar un ictus, previene la mortalidad durante el año siguiente al accidente cerebrovascular (HR = 0,31; IC del 95%, 0,11 a 0,86), aunque, contrariamente, aumenta la mortalidad tras 7 años. Concluyen que el tratamiento con ISRS está asociado a una mayor supervivencia, por lo que recomiendan iniciar o reanudar el tratamiento con ISRS tras un ictus, especialmente en aquellos pacientes con historia de depresión o que lo tomaban antes de presentar el ictus. Otro reciente estudio60 concluyó que el abandono de escitalopram puede incrementar los síntomas depresivos tras un ictus (en los 6 meses tras su discontinuación), comparado con placebo y terapia cognitivo-conductual (TCC). Jorge et al.61 demostraron en un estudio controlado, doble ciego, en 129 pacientes, que aquellos pacientes que recibieron escitalopram tras un ictus mostraron mejoría en las funciones cognitivas superiores, especialmente en las funciones verbales y de memoria visual (valoradas con la escala RBANS [Repeatable Battery for the Assesssment of Neuropsychological Status]) frente a aquellos que recibieron placebo o TCC. Este efecto beneficioso del escitalopram fue independiente de su efecto en los síntomas depresivos. De modo similar, se ha demostrado que la fluoxetina mejora la calidad de vida de los pacientes que presentan alteraciones emocionales (entre ellas, la DPI) tras un ictus62. En un reciente estudio63, Cramer examina los efectos de la fluoxetina administrada a pacientes a los 5-10 días tras un ictus, hallando una mejoría en la función motora a los 90 días tras el ictus (medida con la escala FMA [Fugl-Meyer Assessment of Sensorimotor Recovery After Stroke]). Estos pacientes mostraron, además, menor discapacidad (medida con la escala modificada de Ranking).
También se ha investigado la efectividad de otros fármacos no antidepresivos. Por ejemplo, se estudiaron algunos fármacos estimulantes, como las anfetaminas y el metilfenidato, en pacientes con depresión grave y rápido deterioro cognitivo, obteniéndose resultados contradictorios64. El nimodipino, un antagonista del calcio, mostró, en los pacientes con DPI, mejoría sintomática y bajo riesgo de recurrencia65.
Finalmente, aun cuando se recomienda el tratamiento farmacológico con ISRS, no existen estudios que evidencien una superioridad de un fármaco específico sobre otro27. Sin embargo, los ISRS son más seguros, con menos efectos secundarios, con un inicio de acción relativamente rápido de 7-10 días, y además son ansiolíticos, lo que hacen que sean los antidepresivos de primera línea, especialmente en los pacientes con ictus, con frecuencia ancianos, polimedicados, con el consabido problema de interacciones (tabla 2) y con otros problemas cardiovasculares de base.
Interacciones farmacológicas con relevancia clínica de los antidepresivos en ancianos polimedicados
| ADT |
| Antiarrítmicos: el riesgo de arritmias ventriculares aumenta si los ADT se administran junto con: amiodarona, flecainida, procainamida, quinidina, propafenona, betabloqueadores |
| Antibióticos: el riesgo de arritmias ventriculares aumenta si ADT se administran junto con el moxifloxacino |
| Anticoagulantes: los ADT pueden aumentar o reducir el efecto de los anticoagulantes |
| Antiepilépticos: los ADT antagonizan el efecto anticonvulsivante de los antiepilépticos (disminución del umbral convulsivo) |
| Antihistamínicos: los efectos antimuscarínicos y sedantes aumentan si los ADT se administran junto con antihistamínicos |
| Diuréticos: el riesgo de hipotensión postural aumenta si los ADT se administran junto con diuréticos |
| ISRS* |
| Analgésicos: el riesgo de hemorragia aumenta si los ISRS se administran junto con AINE o ácido acetilsalicílico |
| Antiarrítmicos: la fluoxetina aumenta la concentración plasmática de flecainida; la paroxetina posiblemente inhibe el metabolismo de la propafenona (aumentando el riesgo de toxicidad) |
| Anticoagulantes: los ISRS posiblemente potencian el efecto de los anticoagulantes |
| Antiepilépticos: los ISRS antagonizan el efecto anticonvulsivante de los antiepilépticos (disminución del umbral convulsivo) |
| Antiulcerosos: la concentración plasmática de citalopram, escitalopram y sertralina es aumentada por la cimetidina; la concentración plasmática de escitalopram se ve aumentada por el omeprazol |
| Betabloqueadores: la paroxetina posiblemente aumenta la concentración plasmática de metoprolol; el citalopram y el escitalopram aumentan la concentración plasmática de metoprolol; la fluvoxamina aumenta la concentración plasmática de propranolol |
| Teofilina: la fluvoxamina aumenta la concentración plasmática de teofilina |
ADT: antidepresivos tricíclicos; AINE: antiinflamatorios no esteroideos; ISRS: inhibidores selectivos de la recaptación de serotonina.
*Las interacciones de los ISRS están condicionadas fundamentalmente por su actividad inhibidora del citocromo P450. Entre los ISRS, la sertralina, el citalopram y el escitalopram son los que presentan menor inhibición del citocromo P450.
No obstante, aún son muchas las incógnitas y las cuestiones sin resolver en el tratamiento de la DPI, como cuándo es el mejor momento para iniciar el tratamiento, la acciones de los antidepresivos en áreas diferentes a la afectividad, como la cognición y función motora, y la importancia de los antidepresivos en la reducción de la mortalidad entre los pacientes que han presentado un ictus, entre otras.
ConclusiónTradicionalmente, se ha considerado el ictus como una enfermedad con repercusión eminentemente motora y, de esta manera, los sistemas de atención hospitalaria, de rehabilitación y de seguimiento se han focalizado casi exclusivamente en esta área. Por el contrario, hoy se sabe que la DPI es un problema muy frecuente en la clínica diaria, se presenta en uno de cada 3 pacientes con ictus, y que es el principal factor que limita la recuperación y la rehabilitación de los pacientes, además de incrementar su morbimortalidad. No obstante, en más de la mitad de los casos no se diagnostica ni se trata. Los neurólogos desempeñan un papel fundamental en la atención y la gestión de la recuperación de los enfermos con ictus. Por tanto, es necesario que estén familiarizados con la detección temprana y el tratamiento de la DPI, para así facilitar la recuperación funcional del paciente, su reinserción social y la mejora en la calidad de vida del enfermo y su familia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.