En la literatura médica existen descripciones de casos, y algunas series en las que se presenta la asociación de una polineuropatía desmielinizante inflamatoria crónica (CIDP), con desmielinización del sistema nervioso central, y casos de esclerosis múltiple (EM) asociados a neuropatías desmielinizantes1–3. En la población pediátrica destaca el frecuente comienzo agudo de la sintomatología en ambas localizaciones4. En los últimos años se intentan aunar estos procesos como CCPD, acrónimo de Combined central and peripheral demyelinization5, entidad de la que no existe una definición formal, ni hay establecido una etiopatogenia clara.
Dentro de los distintos fenotipos de la CIDP, el síndrome de Lewis-Sumner o Multifocal adquirid demyelinating sensory and motor neuropathy (MADSAN) se caracteriza por la asimetría, afectando predominantemente a miembros superiores. No hemos encontrado la asociación de esta variante con desmielinización central. Se describe un caso de una paciente que fue diagnosticada de una variante de CIDP (síndrome de Lewis-Sumner o MADSAN) en la que a aparecieron datos de desmielinización central, lo que modifica el diagnóstico y un futuro manejo.
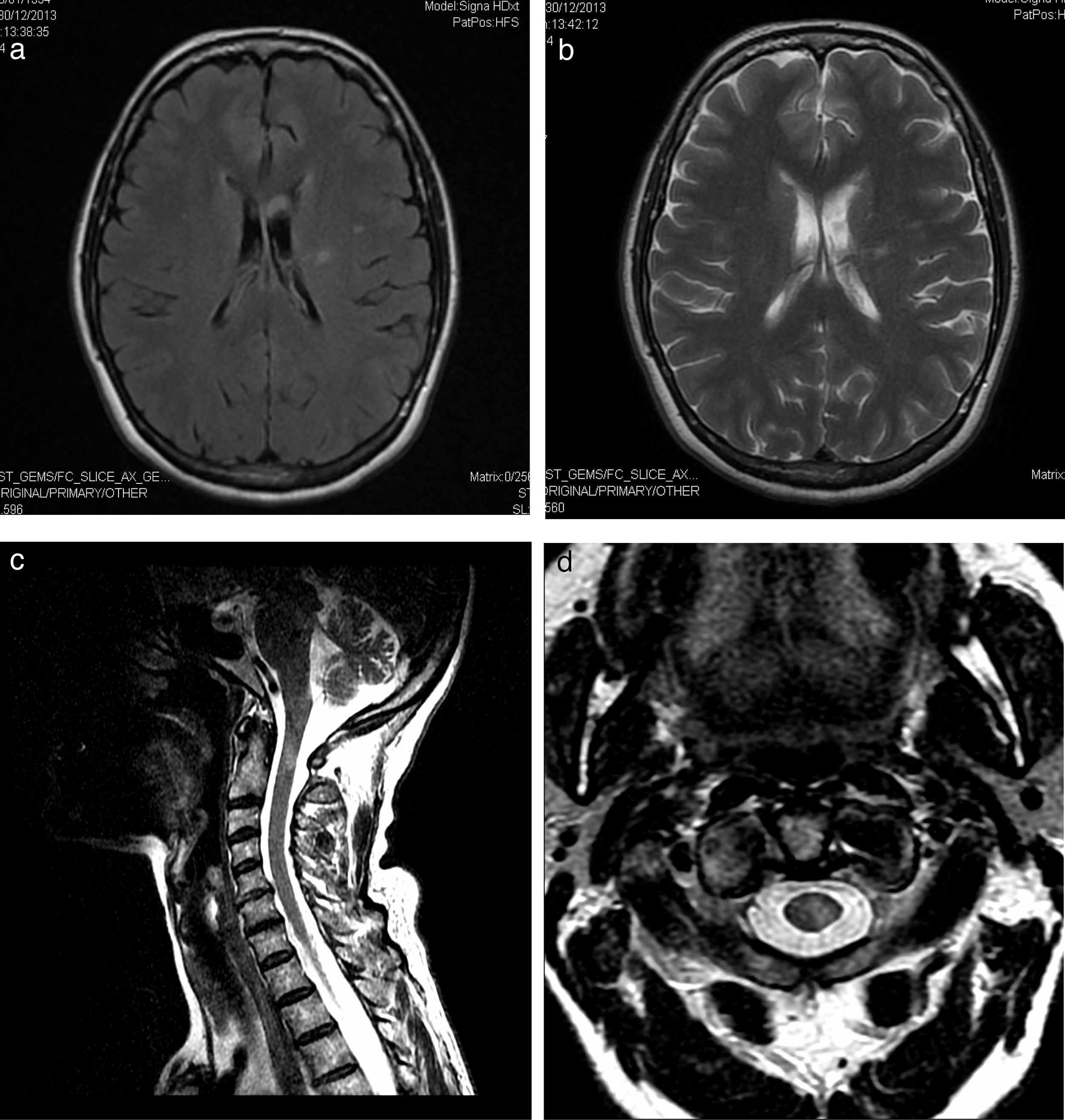
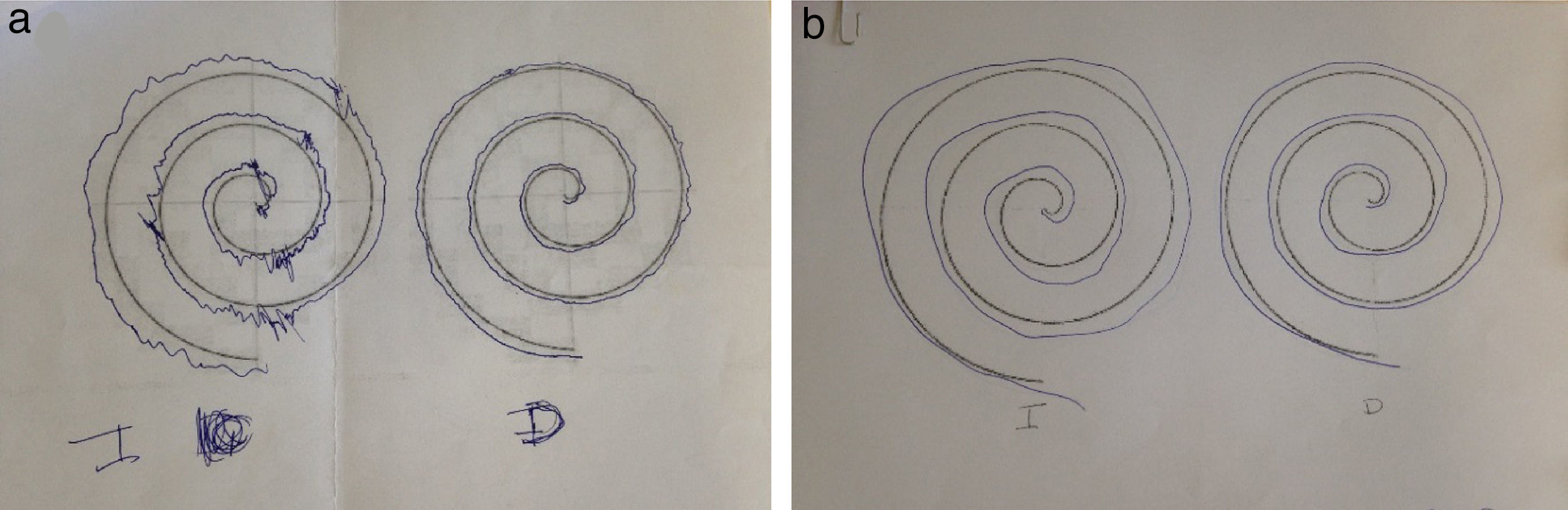
Paciente de 58 años con antecedentes de tiroiditis de Hashimoto, y un ingreso en otro centro hospitalario por un cuadro de instauración subaguda de alteración de sensibilidad en mano derecha, con extensión al resto de extremidades. El estudio neurofisiológico fue informado como afectación mixta axonal y desmielinizante de predominio motor y carácter asimétrico, siendo diagnosticada de multineuritis, y tras la administración de inmunoglobulinas (IG) mejoraron los síntomas. Acude a nuestra consulta por disestesias en mano derecha con extensión a la otra mano, región distal del pie izquierdo, zona costal y laterocervical izquierda de un mes de instauración. En la exploración destacaba un balance muscular de 4+/5 en interóseos derechos, 4/5 en extensor de los dedos e interóseos izquierdos; tibial anterior y gemelo izquierdos de 4+/5 y de 5−/5 en el lado derecho con abolición de ROT de forma universal, sin alteración sensitiva. Danza de tendones en el Romberg y marcha normal. El estudio etiológico no mostró alteraciones en las analíticas exhaustivas con serologías, ni en el perfil de autoinmunidad, exceptuando anti-TPO de 5.631. Punción lumbar con ausencia de células y proteínas de 97mg/dl. El estudio de conducción mostró una polineuropatía desmielinizante sensitivo-motora proximal y distal, predominantemente en miembros superiores, asimétrica (más en miembro superior izquierdo). La RM craneal mostró 2 zonas hiperintensas en T2 y FLAIR (figs. 1a y b). Se le administra un primer ciclo de IG con mejoría. Durante el seguimiento apareció debilidad distal, ataxia de la marcha y temblor en manos, de predominio izquierdo (fig. 2). La RM de plexo braquial y lumbosacro fueron normales, objetivando de forma incidental una zona medular hiperintensa en T2 (figs. 1c y d). Potenciales evocados visuales con prolongación de latencia de onda P100 izquierda. Anti-neurofascina 155 negativos. Mejoría tras ciclos de IG y propranolol (fig. 2).
Hiperintensidad de señal en la sustancia blanca periventricular izquierda, con extensión hacia la corona radiada y centro semioval izquierdo, secuencias FLAIR (a) y T2 (b), probable área de malacia-gliosis. Lesión medular cervical, hipertensa en T2 a la altura del tercio medio de la apófisis odontoides de 5×4×1,3mm, corte sagital T2 (c) y axial (d).
Se trata de una paciente diagnosticada de un síndrome de Lewis-Sumner, que ha seguido un curso inicial con brotes. Al solicitar RM de plexos, por la asociación descrita de hiperintensidad de señal y/o hipertrofia de los mismos en pacientes con MADSAN5, se visualizó una zona medular hiperintensa de probable naturaleza inflamatoria. No hemos encontrado en la literatura la asociación de esta variante de CIDP con lesiones desmielinizantes centrales, aunque síi lesiones cervicales de la misma naturaleza en el contexto de lesiones extensas parenquimatosas como en el ADEM6 asociadas a polineuropatías desmielinizantes tipo CIDP o AIDP7.
La coexistencia de desmielinización del sistema nervioso central (SNC) y del sistema nerviosos periférico (SNP) se denominó por primera vez como «Combined central and peripheral demyelinization» por Amit et al.8 en 1992 en un niño, aunque existen varias descripciones con diferentes nombres: CIDP con afectación del SNC, neuropatía periférica con EM, y enfermedad recurrente remitente del SNC y SNP9. Kawamura et al.10 encuentran anticuerpos antineurofascina en pacientes con CCPD, proponiendo un mecanismo fisiopatológico común. Ogata et al.11 publican la serie más larga de CCPD que incluye a 40 pacientes. Realizan una descripción de variables demográficas y de laboratorio, neuroimagen y de PEV, en un intento de definir esta entidad, y diferenciando 2 subtipos en función de la aparición simultánea (en menos de 2 meses) o secuencial (en más de 2 meses) de los síntomas en las 2 localizaciones. El primero donde los síntomas periféricos y centrales son de inicio simultáneo, en el que la discapacidad sería severa, hay más frecuentemente alteración respiratoria, y las lesiones cerebrales y medulares son más extensas; el segundo subtipo de CCPD sería el de inicio secuencial de los síntomas periféricos y centrales (temporalmente separado, a veces años), en el que existe alta frecuencia de afectación del nervio óptico. La paciente que se presenta cumple los criterios de Ogata et al.11 con un inicio secuencial de la afectación periférica y central; y en este caso se confirma la afectación de los potenciales visuales como signo frecuentemente asociado a este subtipo. En cuanto al temblor que sí está descrito su asociación con la CIDP12, no hemos encontrado su asociación a CCDP ni a MADSAN.
En resumen, la correcta clasificación de nuestra paciente como CCPD tiene importancia de cara a un tratamiento inmunomodulador futuro, en caso de la aparición de nuevos brotes (centrales o periféricos) dado el diferente comportamiento de esta entidad que en casos de desmielinización aislada en una sola localización.
Este trabajo ha sido presentado como póster en la LXVI Reunión anual de Neurología 2015.