Los síntomas de un ictus minor o un ataque isquémico transitorio (AIT) son leves y de corta duración. A pesar de la naturaleza pasajera de los síntomas focales y la ausencia de lesiones cerebrales visibles en algunos pacientes, muchos experimentan problemas cognitivos persistentes posteriormente. Nuestro objetivo es establecer el poder discriminativo del Montreal Cognitive Assessment (MoCA, «Evaluación Cognitiva de Montreal») en la detección del deterioro cognitivo (DC) dentro de los 90 días posteriores al AIT.
MétodoSe incluyeron un total de 50 pacientes con ictus minor y AIT. Se les aplicó la prueba MoCA y una batería neuropsicológica formal. El DC se definió clínicamente según los hallazgos de las pruebas neuropsicológicas.
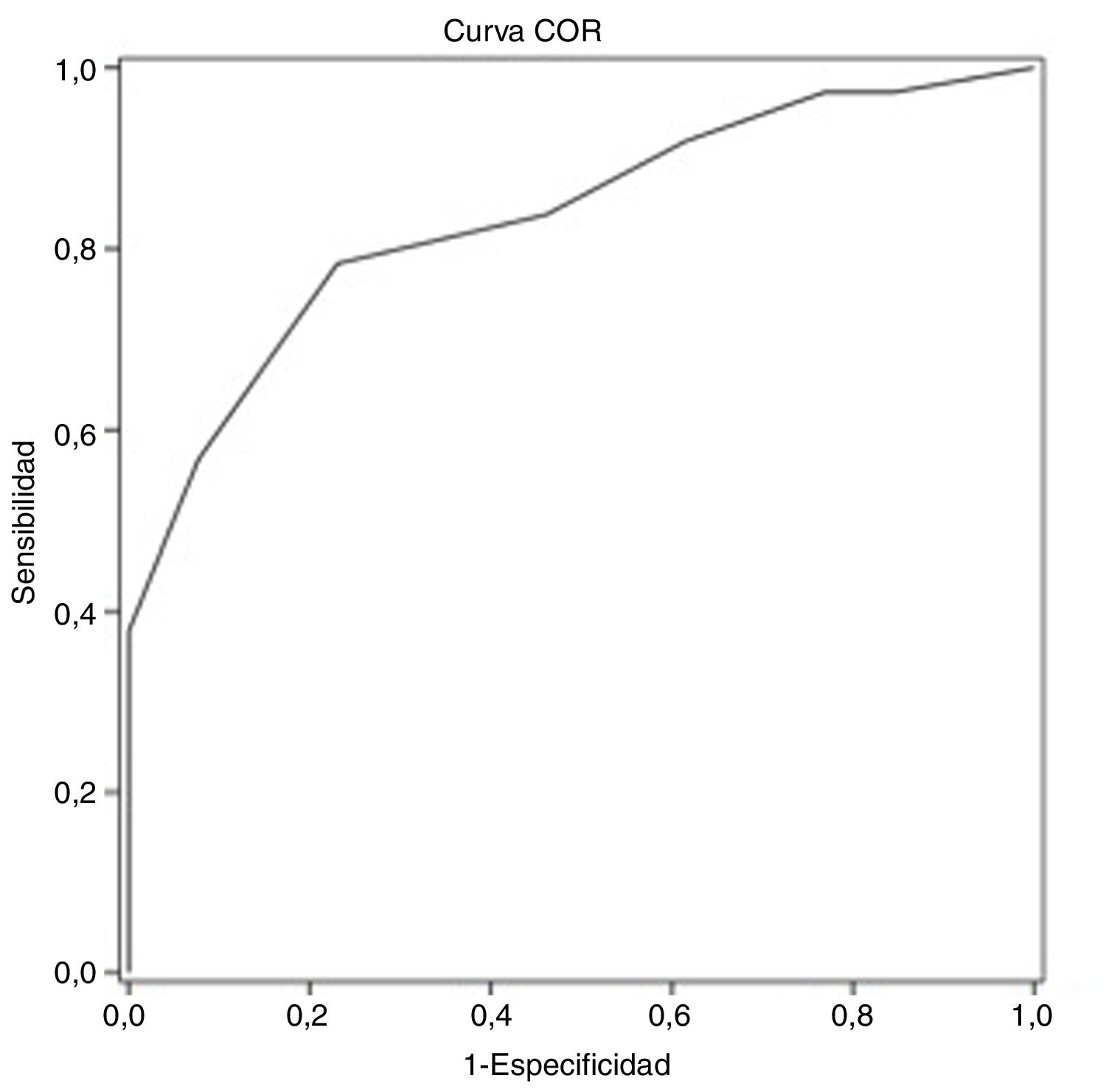
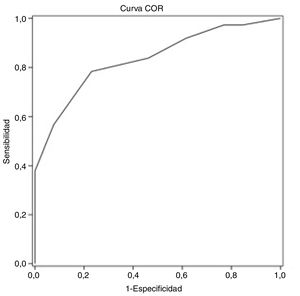
ResultadosLa edad promedio de los pacientes seleccionados fue de 57,7±8,0 años, siendo la mayoría de ellos varones (70,0%). Todos los pacientes tenían un nivel educativo igual o superior al primario. Treinta y siete (74,0%) sujetos presentaron DC. Mediante el análisis de la curva característica del receptor se obtuvo un punto de corte del test MoCA de 25 puntos para discriminar entre sujetos con y sin DC, siendo el área bajo la curva de 0,835 (intervalo de confianza del 95% [IC 95%] 0,720 a 0,949), la sensibilidad, del 78,4% (IC 95% 62,8-88,6%), la especificidad, del 76,9% (IC 95% 49,7-91,8%), el valor predictivo positivo, del 90,6% (IC 95% 81,0-95,6%) y el negativo, del 55,6% (IC 95% 39,5-70,4%).
ConclusionesMás de la mitad de la muestra presentaba DC según lo determinado por la batería formal de pruebas neuropsicológicas. Un punto de corte de 25 en el MoCA es lo suficientemente sensible y específico para detectar DC tras un ictus minor o AIT y podría implementarse en la práctica clínica como método de cribado.
The symptoms of minor stroke and transient ischemic attack (TIA) are temporary and mild. Despite the transient nature of the focal symptoms and the absence of visible brain lesions in some patients, many experience persistent cognitive problems subsequently. We aimed to establish the discriminant capacity of the Montreal Cognitive Assessment (MoCA) in screening for cognitive impairment (CI) within 90 days of TIA.
MethodA total of 50 patients with minor stroke or TIA were recruited. Patients were administered the MoCA test and a formal neuropsychological test battery. CI was defined clinically according to neuropsychological test findings.
ResultsThe average age of recruited patients was 57.7±8.0 years; 70.0% were men; all patients had completed at least primary education. Thirty-seven patients (74.0%) presented CI. Receiver operating characteristic curve analysis obtained an optimal MoCA cut-off point of 25 for discriminating between patients with CI and those without, with an area under the curve of 0.835 (95% confidence interval [95% CI] 0.720-0.949), sensitivity of 78.4% (95% CI 62.8-88.6%), specificity of 76.9% (95% CI 49.7-91.8%), positive predictive value of 90.6% (95% CI 81.0-95.6%), and negative predictive value of 55.6% (95% CI 39.5-70.4%).
ConclusionsMore than half of the patients presented CI as determined by the formal battery of neuropsychological tests. A MoCA cut-off point of 25 is sufficiently sensitive and specific for detecting CI after minor stroke or TIA, and may be implemented as a screening technique in routine clinical practice.
El ictus minor y el ataque isquémico transitorio (AIT) son eventos cerebrovasculares no discapacitantes, generalmente de duración corta y síntomas neurológicos leves. Estos pacientes tienen un mayor riesgo de recurrencia de ictus más graves y su atención sanitaria se focaliza en la búsqueda etiológica, un tratamiento de prevención secundaria específico y el control de los factores de riesgo1.
A pesar de la naturaleza transitoria de los síntomas focales asociados al ictus minor, e incluso en ausencia de lesiones cerebrales visibles, los pacientes con AIT pueden experimentar problemas cognitivos persistentes2. La gravedad de los síntomas, el volumen de la lesión y la localización del infarto son los principales determinantes relacionados con el deterioro cognitivo (DC) posterior al ictus isquémico establecido3, evidencias que difícilmente lo explicarían tras un AIT o ictus minor.
La prevalencia de disfunción cognitiva objetiva y el perfil de la misma no están claros y están siendo objeto de estudio en los últimos años4. Aproximadamente uno de cada 3 pacientes con AIT tiene deterioro de al menos un dominio cognitivo durante los 3 meses posteriores al episodio5. La disfunción cognitiva no reconocida puede afectar notablemente a la calidad de la vida; sin embargo, su valoración no suele incluirse en el manejo rutinario del AIT o ictus minor6. Considerando que actualmente la prevalencia oscila entre el 21 y el 70% según las series, sería necesario o recomendable implementar estrategias de detección y seguimiento en la práctica clínica rutinaria4.
La exploración neuropsicológica sigue desempeñando un papel crucial en el proceso diagnóstico de la demencia o de cualquier otro fenómeno de DC en el ámbito de la enfermedad cerebrovascular7. Pero es importante contar con test o pruebas cortas y de fácil aplicación que permitan llevar a cabo el primer proceso de cribado. Actualmente, existen pruebas e instrumentos de evaluación estandarizados que permiten detectar el DC y la demencia8. El Montreal Cognitive Assessment (MoCA, «Evaluación Cognitiva de Montreal») es un instrumento elaborado como método de cribado de DC con buenos resultados9; ha sido traducido y adaptado a diferentes idiomas y validado en población española10. Además, está siendo utilizado para la detección de DC en la enfermedad cerebrovascular11,12 y, en este sentido, varios estudios han demostrado que es una herramienta superior al Mini-Mental State Examination (MMSE)8,13.
En este trabajo nos proponemos como objetivo establecer el punto de corte del MoCA en la detección del DC dentro de los 90 días posteriores a un ictus minor o AIT. El DC se evalúa mediante una entrevista estructurada junto con los hallazgos psicométricos de una batería neuropsicológica formal.
MétodoLos pacientes fueron seleccionados consecutivamente de la Unidad de Ictus del Servicio de Neurología del Hospital Universitario Infanta Cristina de Badajoz, entre el 1 de diciembre de 2015 y el 1 de diciembre de 2016. Los criterios de inclusión fueron: pacientes mayores de 18 años de edad y menores de 70 años, con un primer ictus isquémico minor (NIHSS menor de 3 puntos al ingreso) o AIT, con estudio etiológico completo y confirmación mediante resonancia magnética (RM). Se excluyeron los pacientes con recurrencias de ictus, AIT dudosos, depresión grave, DC documentado previo al evento vascular, analfabetismo o cualquier condición mental que pudiera impedir una correcta evaluación cognitiva.
Asimismo, se recogió información sobre las variables demográficas (edad, sexo, nivel de educación, nivel económico y área de residencia), los factores de riesgo cardiovascular y los subtipos etiológicos de ictus isquémico (aterotrombóticos, embolia cardiogénica, lacunar, tipo indeterminado y causa inhabitual). Todos los pacientes fueron sometidos a una RM cerebral como parte del protocolo habitual de estudio.
Examen neuropsicológicoPara el diagnóstico de DC se utilizó la batería Neuronorma, que es una batería de evaluación neuropsicológica compuesta por 13 pruebas que abarcan los dominios cognitivos de atención-velocidad de procesamiento, memoria de trabajo, lenguaje, capacidades visuoperceptivas y constructivas, memoria verbal y visual y funciones ejecutivas14. El tiempo total de administración de todos los test incluidos en la batería es de aproximadamente una hora y media. Se recogieron las puntuaciones brutas y las puntuaciones escalares de todos los test. Las predicciones de afección cerebral se establecen a partir de un punto de corte estadístico que se corresponde con la puntuación escalar 6. En la tabla 1 se detallan los test específicos que forman parte de la batería.
Test que componen la batería Neuronorma
| Span Verbal (Span de dígitos) |
| Span Visuo-espacial (Test de los cubos Corsi) |
| Trail Making Test |
| Symbol Digit Modalities Test |
| Boston Naming Test |
| Token Test |
| Visual Object and Space Perception Battery |
| Judgment of Line Orientation |
| Test de la Figura Compleja de Rey |
| Free and Cued Selective Reminding Test |
| Fluencia verbal |
| Test de Stroop de interferencia palabra-color |
| Test de la Torre de Londres-versión Drexel University |
El DC fue diagnosticado de acuerdo con los criterios establecidos en el Manual diagnóstico y estadístico de los trastornos mentales, 5.a edición, en concreto, con los criterios del «trastorno neurocognitivo menor de causa vascular». En nuestro estudio consideramos que existe alteración en un dominio cognitivo cuando hay una puntuación deficitaria (definida como puntuación escalar menor de 6) en al menos una de las pruebas que evalúan dicho dominio, excepto en el caso de la atención, la velocidad de procesamiento y la función ejecutiva, en las que se precisan al menos 2 puntuaciones deficitarias. Por tanto, un paciente se consideró sin DC (NDC) cuando las puntuaciones quedaban incluidas en el rango normal (es decir, escalares≥6) en todos las pruebas que forman la batería neuropsicológica o con déficit en una sola prueba de atención, velocidad de procesamiento y/o función ejecutiva.
Descripción del instrumentoEl test MoCA valora 6 dominios cognitivos. La puntuación total es de 30 puntos y el tiempo de administración es de 10min aproximadamente. Los ítems del MoCA se distribuyen de la siguiente forma: Memoria, que consta de 2 ensayos de aprendizaje de 5 palabras (no puntúan) y se preguntan de forma diferida a los 5min aproximadamente (5 puntos); Capacidad visuoespacial, que se evalúa con el test del reloj (3 puntos) y la copia de un cubo (un punto); Función ejecutiva, que se evalúa con diferentes tareas: una tarea de alternancia gráfica adaptada del Trail Making Test B (un punto), una de fluencia fonémica (un punto) y 2 ítems de abstracción verbal (2 puntos); Atención/concentración/memoria de trabajo, que se evalúa mediante una tarea de atención sostenida (un punto), una serie de sustracciones (3 puntos) y una de dígitos (2 puntos); Lenguaje, que se valora con 3 ítems de denominación por confrontación visual de 3 animales de bajo grado de familiaridad (3 puntos), repetición de 2 frases complejas (2 puntos) y la tarea de fluencia antes mencionada; y el último dominio valorado, la Orientación, que se evalúa por la orientación en tiempo y espacio (6 puntos). El test debe ser ajustado por el tiempo de escolarización del sujeto. En la versión original el punto de corte para el DC es de 26.
Análisis estadísticoEl análisis estadístico se realizó con SPSS® Statistics versión 21.0 (SPSS Inc., Chicago, IL, EE. UU). Las variables continuas, si se distribuyeron normalmente, se presentan como medias±DE y se comparan con una prueba t de 2 colas entre 2 grupos. Las variables continuas, si no se distribuyeron normalmente, se presentan como mediana (RIC) y se comparan con pruebas no paramétricas. Las variables categóricas se comparan con una prueba de χ2. Como indicadores estadísticos que evalúan el grado de eficacia inherente a la prueba diagnóstica se ofrecen la sensibilidad, la especificidad, los valores predictivos y las razones de verosimilitud para el mejor punto de corte. Se utilizó el análisis de curva característica del receptor con área bajo la curva para comparar la capacidad discriminatoria del MoCA en la detección de DC.
El estudio fue aprobado por el Comité de Ética del hospital y se obtuvo el consentimiento escrito informado de todos los participantes. El centro dispone de copia legal y hojas de respuesta de los test que componen la batería de exploración neuropsicológica.
ResultadosUn total de 50 pacientes fueron incluidos en el estudio. Su edad promedio fue de 57,7 (DE 8,0) años, siendo la mayoría varones (70%). La mediana de la puntuación NIHSS en los pacientes con ictus minor fue de 1,00 punto (RIC 2,00). Las características de los participantes del estudio, desde el punto de vista etiológico, fueron las siguientes: 9 (18%) aterotrombóticos; 4 (8%) cardioembólicos; 12 (24%) de tipo lacunar; 22 (44%) de causa indeterminada con estudio completo y 3 (6%) de causa inhabitual (disección carotídea).
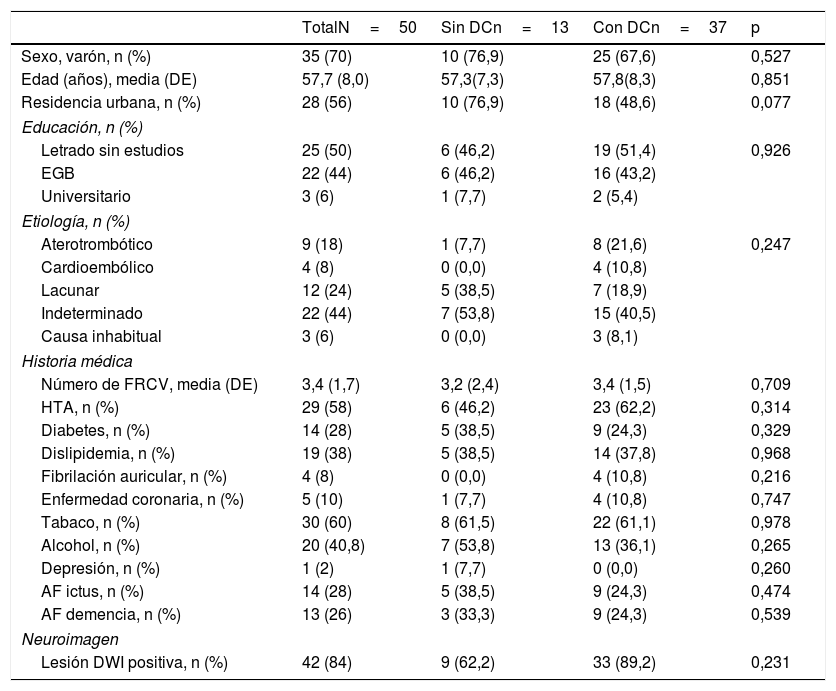
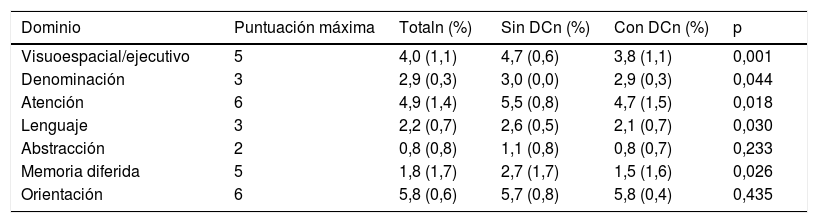
Un 74,0% (intervalo de confianza del 95% [IC 95%] 60,4-84,1%) tenían DC según lo determinado por la batería formal de pruebas neuropsicológicas. No hubo diferencias significativas en cuanto a las variables sociodemográficas (edad, sexo, nivel de educación, nivel económico o área de residencia), factores de riesgo vascular, depresión, antecedentes familiares, etiología del ictus o datos de neuroimagen entre el grupo DC y el NDC (tabla 2). La puntuación del MoCA fue de 27 (DE 1,9) en el grupo DC y de 22,4 (DE 3,4) en el grupo NDC; el análisis según los dominios cognitivos del examen MoCA se ofrece en la tabla 3.
Características clínicas de los pacientes
| TotalN=50 | Sin DCn=13 | Con DCn=37 | p | |
|---|---|---|---|---|
| Sexo, varón, n (%) | 35 (70) | 10 (76,9) | 25 (67,6) | 0,527 |
| Edad (años), media (DE) | 57,7 (8,0) | 57,3(7,3) | 57,8(8,3) | 0,851 |
| Residencia urbana, n (%) | 28 (56) | 10 (76,9) | 18 (48,6) | 0,077 |
| Educación, n (%) | ||||
| Letrado sin estudios | 25 (50) | 6 (46,2) | 19 (51,4) | 0,926 |
| EGB | 22 (44) | 6 (46,2) | 16 (43,2) | |
| Universitario | 3 (6) | 1 (7,7) | 2 (5,4) | |
| Etiología, n (%) | ||||
| Aterotrombótico | 9 (18) | 1 (7,7) | 8 (21,6) | 0,247 |
| Cardioembólico | 4 (8) | 0 (0,0) | 4 (10,8) | |
| Lacunar | 12 (24) | 5 (38,5) | 7 (18,9) | |
| Indeterminado | 22 (44) | 7 (53,8) | 15 (40,5) | |
| Causa inhabitual | 3 (6) | 0 (0,0) | 3 (8,1) | |
| Historia médica | ||||
| Número de FRCV, media (DE) | 3,4 (1,7) | 3,2 (2,4) | 3,4 (1,5) | 0,709 |
| HTA, n (%) | 29 (58) | 6 (46,2) | 23 (62,2) | 0,314 |
| Diabetes, n (%) | 14 (28) | 5 (38,5) | 9 (24,3) | 0,329 |
| Dislipidemia, n (%) | 19 (38) | 5 (38,5) | 14 (37,8) | 0,968 |
| Fibrilación auricular, n (%) | 4 (8) | 0 (0,0) | 4 (10,8) | 0,216 |
| Enfermedad coronaria, n (%) | 5 (10) | 1 (7,7) | 4 (10,8) | 0,747 |
| Tabaco, n (%) | 30 (60) | 8 (61,5) | 22 (61,1) | 0,978 |
| Alcohol, n (%) | 20 (40,8) | 7 (53,8) | 13 (36,1) | 0,265 |
| Depresión, n (%) | 1 (2) | 1 (7,7) | 0 (0,0) | 0,260 |
| AF ictus, n (%) | 14 (28) | 5 (38,5) | 9 (24,3) | 0,474 |
| AF demencia, n (%) | 13 (26) | 3 (33,3) | 9 (24,3) | 0,539 |
| Neuroimagen | ||||
| Lesión DWI positiva, n (%) | 42 (84) | 9 (62,2) | 33 (89,2) | 0,231 |
AF: antecedente familiar; DC: deterioro cognitivo; DE: desviación estándar; DWI: Diffusion weighted imaging; EGB: Educación General Básica; FRCV: factores de riesgo vascular; HTA: hipertensión arterial.
Puntuación de los dominios del test Evaluación Cognitiva de Montreal en el total de pacientes con ictus minor y ataque isquémico transitorio y según la presencia o no de deterioro cognitivo en función del examen neuropsicológico
| Dominio | Puntuación máxima | Totaln (%) | Sin DCn (%) | Con DCn (%) | p |
|---|---|---|---|---|---|
| Visuoespacial/ejecutivo | 5 | 4,0 (1,1) | 4,7 (0,6) | 3,8 (1,1) | 0,001 |
| Denominación | 3 | 2,9 (0,3) | 3,0 (0,0) | 2,9 (0,3) | 0,044 |
| Atención | 6 | 4,9 (1,4) | 5,5 (0,8) | 4,7 (1,5) | 0,018 |
| Lenguaje | 3 | 2,2 (0,7) | 2,6 (0,5) | 2,1 (0,7) | 0,030 |
| Abstracción | 2 | 0,8 (0,8) | 1,1 (0,8) | 0,8 (0,7) | 0,233 |
| Memoria diferida | 5 | 1,8 (1,7) | 2,7 (1,7) | 1,5 (1,6) | 0,026 |
| Orientación | 6 | 5,8 (0,6) | 5,7 (0,8) | 5,8 (0,4) | 0,435 |
DC: deterioro cognitivo.
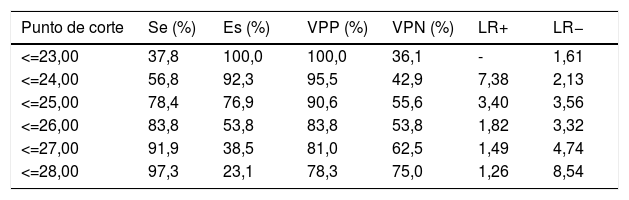
Mediante el análisis de la curva característica del receptor se obtiene un punto de corte del test MoCA≤25 puntos para discriminar mejor entre DC y NDC (tabla 4). El área bajo la curva del MoCA fue de 0,835 (IC 95% 0,720-0,949), con una sensibilidad del 78,4% (IC 95% 62,8-88,6%), una especificidad del 76,9% IC 95% 49,7-91,8%), un valor predictivo positivo del 90,6% (IC 95% 81,0-95,6%) y un valor predictivo negativo del 55,6% (IC 95% 39,5-70,4%), así como una razón de verosimilitud positiva de 3,40 (fig. 1).
Índices de discriminación de deterioro cognitivo según la Evaluación Cognitiva de Montreal a los 90 días en pacientes con ictus minor y ataque isquémico transitorio
| Punto de corte | Se (%) | Es (%) | VPP (%) | VPN (%) | LR+ | LR− |
|---|---|---|---|---|---|---|
| <=23,00 | 37,8 | 100,0 | 100,0 | 36,1 | - | 1,61 |
| <=24,00 | 56,8 | 92,3 | 95,5 | 42,9 | 7,38 | 2,13 |
| <=25,00 | 78,4 | 76,9 | 90,6 | 55,6 | 3,40 | 3,56 |
| <=26,00 | 83,8 | 53,8 | 83,8 | 53,8 | 1,82 | 3,32 |
| <=27,00 | 91,9 | 38,5 | 81,0 | 62,5 | 1,49 | 4,74 |
| <=28,00 | 97,3 | 23,1 | 78,3 | 75,0 | 1,26 | 8,54 |
Es: especificidad; LR+: razón de verosimilitud positiva; LR−: razón de verosimilitud negativa; Se: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Las características principales del perfil de deterioro neuropsicológico se muestran en la tabla 5. Los dominios cognitivos predominantemente afectados fueron: memoria 29 (58%), función ejecutiva 23 (46%), capacidad visuoespacial y función visuoconstructiva 16 (32%) y atención/concentración 10 (20%). Del total de sujetos con DC, 14 (38%) tenían un solo dominio cognitivo afectado y 23 (62%) tenían 2 o mas.
Porcentaje de cada dominio cognitivo alterado según el examen neuropsicológico en el total de pacientes con ictus minor y ataque isquémico transitorio
| n (%) | |
|---|---|
| Dominio afectado | |
| Atención y concentración | 10 (20) |
| Memoria | 29 (58) |
| Función ejecutiva | 23 (46) |
| Función visuoespacial y visuoconstructiva | 16 (32) |
| Memoria de trabajo | 2 (4) |
| Lenguaje | 0 (0) |
| Número de dominios afectados | |
| 1 | 14 (28) |
| 2 | 9 (18) |
| 3 | 8 (16) |
| 4 | 6 (12) |
Este estudio determina las propiedades psicométricas de la puntuación total del test MoCA para el diagnóstico de DC a los 90 días tras un ictus minor o un AIT, basado en el diagnóstico clínico como mejor estándar. Nuestros resultados indican que el MoCA presenta unas capacidades psicométricas adecuadas que pueden hacerlo útil para la detección del DC en la práctica clínica rutinaria. Un punto de corte de 25 puntos o inferior nos permite diferenciar sujetos con DC. El punto de corte obtenido por el autor9 es un punto mayor que el obtenido para nuestra población de estudio.
Estudios similares que han utilizado el mismo instrumento de cribado cognitivo en pacientes con ictus y AIT apuntan también discrepancias en cuanto al punto de corte del MoCA frente al convencional recomendado por Nasreddine et al.9,11. Un estudio realizado en Francia y otro en Pekín informaron de un punto de corte igual o menor de 22, con buenos datos de sensibilidad y especificidad15,16. Un reciente metaanálisis sobre la exactitud del MoCA en la detección del DC posterior al ictus en diferentes etapas que incluye 12 estudios (con más de 2.100 pacientes) indica que el área bajo la curva de los límites de puntuación 20/19, 21/20 y 26/25 es 0,90, 0,90 y 0,95, respectivamente, mostrando una alta validez predictiva para el cribado de DC dentro del primer mes, aunque el mejor índice de Youden lo obtienen las puntuaciones más bajas17.
Frente a otro método de cribado ampliamente utilizado como es el MMSE, varios estudios recientes han demostrado que en pacientes con enfermedad cerebral vascular, y en concreto para el estudio de ictus minor y AIT, el MoCA es más sensible que el MMSE para detectar el DC15,18,19.
La prevalencia de DC en adultos menores de 70 años en la población general española se sitúa entre el 3,7 y el 7,2%20. Algunas revisiones sistemáticas realizadas en los últimos años apuntan que el DC tras un ictus minor o un AIT es frecuente, no solamente en grado leve (29-68%), sino también grave (8-22%)4,21. Estas diferencias y la considerable heterogeneidad en los datos de prevalencia probablemente vienen ocasionadas por el uso de criterios no uniformes para el diagnostico del DC y el uso de diferentes instrumentos de medida21.
En cuanto al perfil de DC de este tipo de pacientes, la información de la que disponemos es limitada. Sin embargo, en aquellos estudios en los que se ha valorado mediante baterías neuropsicológicas, parece consistente con un DC tipo vascular donde hay déficits más prominentes en la función ejecutiva, la atención y la velocidad de procesamiento de la información; es decir, un perfil no amnésico, impulsado por un daño lesional más subcortical y frontal22,23. En nuestro trabajo predomina el DC multidominio, y aunque el dominio más afectado es la memoria, también está comprometida significativamente la función ejecutiva, las capacidades visuoespaciales y visuoconstructiva, así como la atención y la concentración. Los perfiles detectados por el estudio de los subdominios del MoCA están generalmente alineados con los resultados de las baterías neuropsicológicas cuando se ha usado como método de comparación24–26.
Con respecto a la disfunción cognitiva observada tras un ictus minor o AIT, se puede explicar hipotéticamente en relación con el daño tisular, aunque esta explicación se tendría que confirmar con estudios más específicos5. Este tipo de ictus, a pesar de la naturaleza transitoria de los síntomas focales, puede causar un daño cerebral permanente, lo que alteraría las redes involucradas en procesos cognitivos que conducirían al deterioro27. Esta teoría sería parcialmente apoyada por la presencia de isquemia en los estudios de RM, siendo frecuente encontrar lesiones DWI compatibles con infarto reciente28. La nueva propuesta de definición del AIT basada en el daño tisular más que en el tiempo discrimina entre pacientes con y sin signos de infarto reciente3. Esta última categoría sería la que realmente cumpliría con los criterios de AIT. En nuestra muestra, el 84% de los pacientes presentó lesiones DWI en la RM, aunque sin diferencias significativas entre el grupo DC y NDC. Sería muy interesante desarrollar futuros estudios para valorar si hay diferencia en la función cognitiva entre pacientes con síntomas transitorios sin y con lesión en las secuencias DWI de RM.
Nuestro estudio tiene algunas limitaciones. Las principales son el reducido tamaño de la muestra y que nuestra cohorte de estudio es de edad más joven que la de otros estudios, ya que limitamos la entrada de pacientes mayores de 70 años para evitar incluir de alguna manera el DC degenerativo. El MoCA posee un alto sesgo educacional y está influido por la edad; por lo tanto, nuestros hallazgos hay que interpretarlos con cautela, ya que pueden no ser aplicables a todos los pacientes.
Existen muy pocas validaciones del MoCA en población española10 y no ha sido validado en pacientes españoles con ictus, de ahí que nuestro trabajo tenga especial relevancia. Además, el estándar de armonización del National Institute of Neurological Disorders and Stroke-Canadian Stroke Network y otras agencias han propuesto el MoCA como herramienta de cribado de DC en pacientes con ictus7 y su uso se está ampliando a muchos ensayos clínicos en sustitución del MMSE29.
En conclusión, los resultados preliminares de la versión en castellano del MoCA aplicada a pacientes con ictus minor o AIT indican que puede ser una prueba eficaz para la detección de DC. Más de la mitad de la muestra presentaba DC según lo determinado por la batería formal de pruebas neuropsicológicas. Un punto de corte de 25 en el MoCA es lo suficientemente sensible y específico para detectar DC tras un ictus minor o AIT y podría implementarse en la práctica clínica como método de cribado. La escala es lo suficientemente operativa como instrumento rápido y fácil de aplicar en estos pacientes y ayudaría en la detección temprana de la disfunción cognitiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.