Revisar los principios actuales para el diagnóstico de las categorías de deterioro cognitivo vascular, con énfasis en la nomenclatura, los criterios diagnósticos y los hallazgos clínico-radiológicos diferenciales.
DesarrolloLos principios para el diagnóstico del deterioro cognitivo vascular han evolucionado, pero los criterios disponibles fueron diseñados básicamente para diferenciar la demencia vascular de la demencia tipo Alzheimer, y para propósitos de investigación. Sin embargo, en la práctica clínica se requieren elementos precisos para: 1) el diagnóstico clínico de la demencia y el deterioro cognitivo leve, 2) la identificación clínica y por neuroimagen de las diversas lesiones cerebrovasculares asociadas con la disfunción cognitiva, y 3) la formulación de una relación etiopatogénica entre el deterioro cognitivo y las lesiones cerebrovasculares. Por esta razón se revisaron los elementos diagnósticos de las categorías de deterioro cognitivo vascular, su clasificación y características más relevantes. Se enfatizó en las características que permiten el diagnóstico de la demencia multi-infarto, la demencia por infarto estratégico, la demencia por enfermedad de pequeño vaso cerebral, la demencia mixta y el deterioro cognitivo leve vascular.
ConclusionesSe requiere de la estandarización, por un grupo multidisciplinario de expertos, de la nomenclatura y criterios para el diagnóstico del espectro completo del deterioro cognitivo vascular, y especialmente para la demencia vascular y sus categorías.
A review of current criteria for the diagnosis of categories related with vascular cognitive impairment, in particular the nomenclature, diagnostic criteria, and differential clinical-radiological findings.
DevelopmentThe criteria for the diagnosis of vascular cognitive impairment have evolved, but available criteria were designed basically for differentiating between vascular dementia and dementia due to Alzheimer disease, and for research purposes. Nevertheless, in clinical practice precise elements are required for: 1) Clinical diagnosis of dementia and mild cognitive impairment; 2) Clinical and neuroimaging criteria for identification of the various cerebrovascular lesions associated with cognitive dysfunction, and 3) A formulation of the aetiogenic-pathogenic relationship between cognitive impairment and cerebrovascular lesions. For this reason, a review was carried out on the diagnostic elements of vascular cognitive impairment categories, classification, and their most relevant characteristics. It highlights the characteristic for the diagnosis of multi-infarction dementia, strategic single infarct dementia, small vessel disease with dementia, mixed dementia, and vascular mild cognitive impairment.
ConclusionsStandardisation is required, by a multidisciplinary expert team, as regards nomenclature and criteria for the diagnosis of the full spectrum associated with vascular cognitive impairment and especially for vascular dementia and its categories.
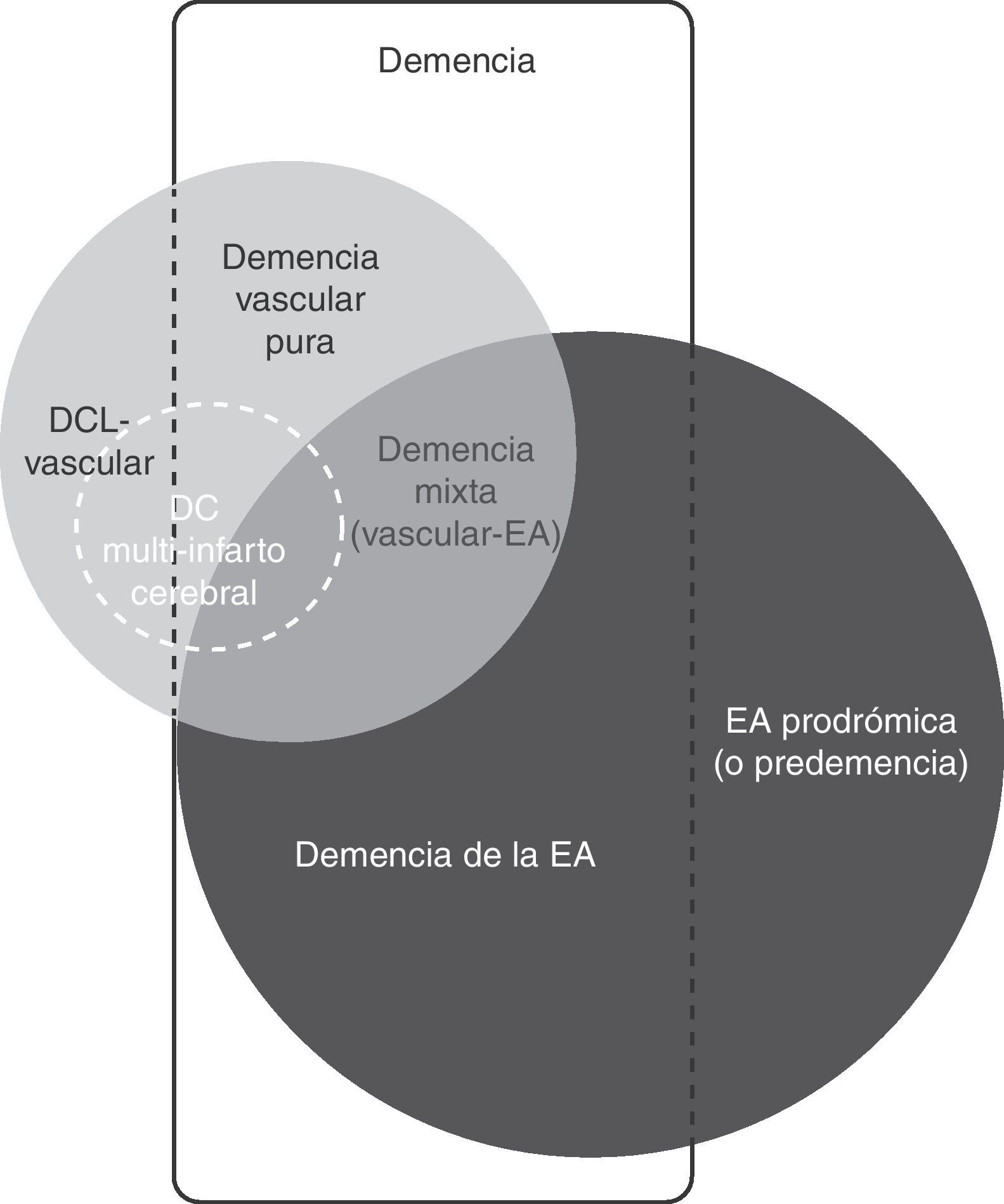
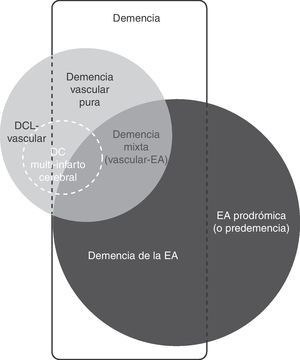
El deterioro cognitivo vascular (DCV) es un término amplio que incluye la demencia y el deterioro cognitivo leve (DCL) asociado o causado por una lesión cerebrovascular (fig. 1). Ambas entidades tienen un elevado interés para los clínicos e investigadores porque engloban un problema común y que posiblemente se puede prevenir1–7.
Esta revisión constituye una actualización de los principios para el diagnóstico de las categorías de DCV, con énfasis en la nomenclatura, los criterios diagnósticos de las diversas categorías incluidas y los hallazgos clínico-radiológicos diferenciales. Los artículos se identificaron principalmente a través de búsquedas en PubMed con los términos: «deterioro cognitivo vascular», «demencia vascular», «demencia post-ictus», «deterioro cognitivo leve». Se seleccionaron las investigaciones originales y revisiones de los últimos 5 años, y que emiten valoraciones específicas sobre los aspectos diagnósticos señalados. También se añadieron algunas referencias del archivo de los autores.
Diagnóstico del síndrome de demenciaEl diagnóstico del síndrome de demencia tiene bases puramente clínicas, específicamente la historia clínica y el examen clínico neuropsíquico8–10. La definición del síndrome cognitivo-conductual que identifica de forma general la demencia, y en particular el subtipo vascular, es un elemento clave para su diagnóstico. La escala isquémica clásica de Hachinski y su versión modificada, la escala isquémica de Rosen, no incluyen la definición del síndrome cognitivo11. Los criterios desarrollados posteriormente para definir el síndrome cognitivo se fundamentan en alguno de los siguientes elementos centrales: 1) el deterioro de la memoria, 2) el deterioro cognitivo parcheado, 3) la disfunción ejecutiva, y 4) el deterioro cognitivo multifácetico.
El deterioro de la memoria es un elemento central u obligatorio en la definición del síndrome cognitivo de la demencia vascular para el Manual de Diagnóstico y Estadística de los Trastornos Mentales, cuarta edición (DSM-IV) y el Instituto Nacional de Trastornos Neurológicos e Ictus-Asociación Internacional para la Investigación y Educación en Neurociencias (NINDS-AIREN), de igual manera que para el diagnóstico de la forma sintomática típica de la enfermedad de Alzheimer (EA)12,13. La selección de la pérdida de la memoria como criterio central impide la identificación adecuada de los restantes patrones de pérdida cognitiva vascular. La pérdida prominente de la memoria con frecuencia no es el deterioro cognitivo más importante asociado con la enfermedad cerebrovascular y no es necesariamente el primer síntoma de la demencia vascular3,11,14. Una fracción sustancial de los casos con demencia vascular presenta un déficit severo en la función ejecutiva, función del lenguaje y razonamiento visuoespacial con preservación relativa del recuerdo tardío en el examen formal1,6,15,16.
La clasificación estadística de las enfermedades de la Organización Mundial de la Salud, décima revisión (ICD-10) tiene la reputación de ser un instrumento vagamente definido y poco útil para la detección precoz de la demencia17. En el caso concreto de la demencia vascular la ICD-10 requiere una distribución desigual o parcheada del déficit en las funciones cognitivas superiores (algunos dominios cognitivos afectados y otros relativamente preservados)11,18. Este patrón «parcheado» solamente se debe esperar en la demencia donde existan muy pocos (2 o 3) infartos corticales. Dicho hallazgo probablemente es un «artefacto» producido al incluir los pacientes con varios cambios neuropatológicos cerebrovasculares en un solo grupo11. Además, un perfil neuropsicológico parcheado o desigual no es específico de la demencia vascular. Cuando el déficit «parcheado» puede ser medido no se hallan diferencias cuantitativas entre la demencia vascular y la demencia de la EA19. Varios trastornos neurodegenerativos, como la demencia por cuerpos de Lewy, la demencia semántica, la afasia primaria progresiva y la demencia frontotemporal impactan de forma diferenciada las regiones cerebrales en un momento dado y pueden mostrar un déficit cognitivo heterogéneo20,21.
En los pacientes con demencia vascular, la disfunción ejecutiva (lentitud del procesamiento de la información, deterioro de la capacidad para cambiar de una tarea a otra, y déficit en la capacidad para mantener y manipular la información) es más típica en comparación con el déficit de memoria y lenguaje1,6,14–16,22–24. En el criterio DSM-IV se menciona la pérdida de la función de control ejecutivo como un elemento secundario para el diagnóstico de la demencia, y algunos investigadores lo señalan como un criterio esencial8. Este último enfoque debe interpretarse con precaución debido a:
- -
Posibles inexactitudes en la determinación del subtipo de demencia y la pérdida de precisión que puede resultar al agrupar subgrupos heterogéneos de pacientes.
- -
Dificultades para identificar un perfil cognitivo en pacientes que requieren la presencia de deterioro de memoria y otro déficit para cumplir el criterio de demencia.
- -
Uso de baterías de pruebas cuyas propiedades psicométricas son comprendidas de forma incompleta5,11.
La estipulación de la afectación de más de un dominio cognitivo diferencia la demencia del déficit de un dominio único como la afasia debida a ictus, o la amnesia de la enfermedad de Korsakoff. El criterio de los Centros de Diagnóstico y Tratamiento de la EA en el estado de California (ADDTC) no especifica ni el número ni el tipo de déficit cognitivo que debe presentarse. En su lugar demanda un deterioro progresivo de múltiples funciones corticales superiores (más de un dominio o categoría específica) y que la pérdida sea suficiente para interferir con la conducta del paciente en los asuntos usuales de la vida25. Esta definición resulta menos restrictiva y probablemente es la que mejor abarca el deterioro cognitivo causado por las lesiones vasculares y la demencia vascular11. Una perspectiva similar ha sido utilizada recientemente por McKhann et al. para el diagnóstico de la demencia tipo Alzheimer y por otras causas26.
Considerando la heterogeneidad de la presentación clínica de la demencia vascular, el perfil neuropsicológico también debe ser diferente. Ningún patrón de déficit cognitivo específico define la demencia vascular. La atención, la función ejecutiva, el lenguaje, las habilidades visuoespaciales, la memoria y el aprendizaje pueden afectarse en grado variable y en combinaciones acorde al tamaño y localización de la lesión cerebrovascular (tabla 1). Por ejemplo, los infartos estratégicos únicos producen un déficit cognitivo y de otras funciones neurológicas que dependen de la localización de la lesión. En contraste, el perfil neuropsicológico en la enfermedad vascular isquémica subcortical se considera que frecuentemente incluye un deterioro precoz de la atención y función ejecutiva, con lentitud del rendimiento motor y procesamiento de la información6,15,16.
Criterios diagnósticos de las principales categorías de deterioro cognitivo
| Demencia• Deterioro de la función cognitiva-conductual que involucra un mínimo de 2 de los siguientes dominios:a) Memoria (deterioro de la habilidad para adquirir y recordar nueva información manifestado por preguntas o conversaciones repetitivas, pérdida de pertenencias personales, olvido de eventos o citas, sentirse perdido en una ruta familiar)b) Razonamiento y manejo de tareas complejas, juicio pobre (pobre entendimiento de los peligros, incapacidad para manejar las finanzas, pobreza en la toma de decisiones, incapacidad para planear actividades complejas o secuenciales)c) Procesamiento visuoespacial complejo (incapacidad para reconocer las caras u objetos comunes o para encontrar los objetos visibles directamente a pesar de una buena agudeza visual, incapacidad para operar implementos simples, u orientar la ropa del cuerpo)d) Lenguaje (dificultad para pensar en palabras comunes mientras se habla, vacilación, errores en el habla, ortografía y escritura)e) Personalidad, conducta o comportamiento (fluctuaciones atípicas con agitación, deterioro de la motivación, falta de iniciativa, apatía, pérdida de energía, aislamiento social, disminución del interés en las actividades previas, pérdida de empatía, conductas compulsivas u obsesivas, conductas socialmente inaceptables)• Este deterioro debe ser: a) adquirido (representa una declinación de los niveles previos de funcionamiento y actuación teniendo en cuenta la edad y nivel educacional del paciente), b) detectable (el deterioro se diagnostica a través de la combinación de la historia brindada por el paciente o informador fiable, y el examen del estado mental o neuropsicológico), c) persistente durante semanas o meses, y d) constatado en un paciente con nivel de conciencia normal hasta las fases terminales• Asociación de deterioro significativo en las actividades usuales del paciente, incluyendo el funcionamiento social y ocupacional, que es independiente de algún trastorno sensitivo-motor• El deterioro no se explica por la presencia de delirio u otro trastorno psiquiátrico mayorDeterioro cognitivo leve• Deterioro de uno o varios de los siguientes dominios: a) memoria, b) función ejecutiva, c) atención, d) lenguaje, e) procesamiento visuoespacial complejo• Este deterioro debe ser: a) adquirido (representa una declinación de los niveles previos de funcionamiento y actuación teniendo en cuenta la edad y nivel educacional del paciente), b) detectable (el deterioro se diagnostica a través de la combinación de la historia brindada por el paciente o informador fiable, y el examen del estado mental o neuropsicológico)*, c) persistente durante semanas o meses, y d) constatado en un paciente con nivel de conciencia normal• Preservación de la independencia en las actividades funcionales de la vida diaria (por ejempo, bañarse, vestirse, comer), con necesidad de ayuda o asistencia mínima. Pueden existir problemas ligeros en las tareas funcionales complejas que acostumbraba a realizar (por ejemplo, demora o errores al manejar las finanzas, preparar la comida, realizar compras, viajar), pero son independientes de la presencia de algún trastorno sensitivo-motor• Ausencia de deterioro significativo en el funcionamiento social u ocupacional (la severidad es insuficiente para diagnosticar una demencia)• El deterioro no se explica por la presencia de delirio u otro trastorno psiquiátrico mayor |
Fuente: citas27–31.
Los trastornos más comunes que necesitan diferenciarse de la demencia incluyen las preocupaciones benignas (individuos preocupados por sus funciones mentales, pero con examen normal), DCL, delirio, depresión y otros trastornos psiquiátricos (trastorno obsesivo-compulsivo, psicosis de inicio tardío), crisis epilépticas, abuso de drogas o alcohol, efectos adversos de medicamentos, y déficit cognitivo de dominio único (afasia causada por ictus o amnesia de la enfermedad de Korsakoff)27–32. De igual modo, aparte de ciertas enfermedades demenciales que comienzan con apraxia como componente aislado prominente, la apraxia por un ictus no debe malinterpretarse como demencia31.
El delirio o la confusión mental es un criterio de exclusión estándar. El criterio NINDS-AIREN es más riguroso al descartar a los pacientes con deterioro de la conciencia, delirio, psicosis, afasia severa, o deterioro sensitivomotor que impida el examen mental y trastornos sistémicos u otras enfermedades cerebrales como la EA que pueden causar déficit en las funciones cognitivas, especialmente de la memoria12. Sin embargo, muchos casos de demencia vascular pueden excluirse falsamente al descartar a los pacientes con deterioro de la función sensitivomotora o con afasia causada por un ictus4. Además, los síntomas depresivos son comunes en el DCV33.
Tampoco es lógico definir la demencia en función de velocidad de inicio, ritmo de evolución, severidad, reversibilidad o duración. Como señalan Robles et al., podría resultar inadecuado establecer una duración mínima del trastorno, como los 6 meses establecidos en los criterios ICD-10, puesto que muchas demencias (enfermedad de Creutzfeldt-Jakob, hidrocefalia crónica del adulto, hematoma subdural crónico, etc.) pueden desarrollarse en un plazo de tiempo inferior. Por otra parte, algunos síndromes confusionales transitorios pueden prolongarse durante varias semanas y deben diferenciarse de las demencias30.
Diagnóstico de la causa cerebrovascularAcorde a G. Román et al., la tendencia de obviar la demencia vascular como entidad es particularmente nociva porque crea la perspectiva de que no son necesarias las investigaciones al respecto. La demencia vascular es una entidad que se observa comúnmente en los ámbitos clínicos, en particular después del ictus, es una forma de demencia fácilmente reconocible en el anciano y representa una causa importante de pérdida funcional e institucionalización34. Otra tendencia impropia es brindar la impresión de que la demencia vascular es una sola entidad patológica que puede tener diferentes fenotipos clínicos, como ocurre en la enfermedad de Parkinson o la EA. En realidad, la demencia vascular es una entidad con expresiones clínicas y lesiones heterogéneas debidas a un sustrato patogénico-estructural multifactorial9,15.
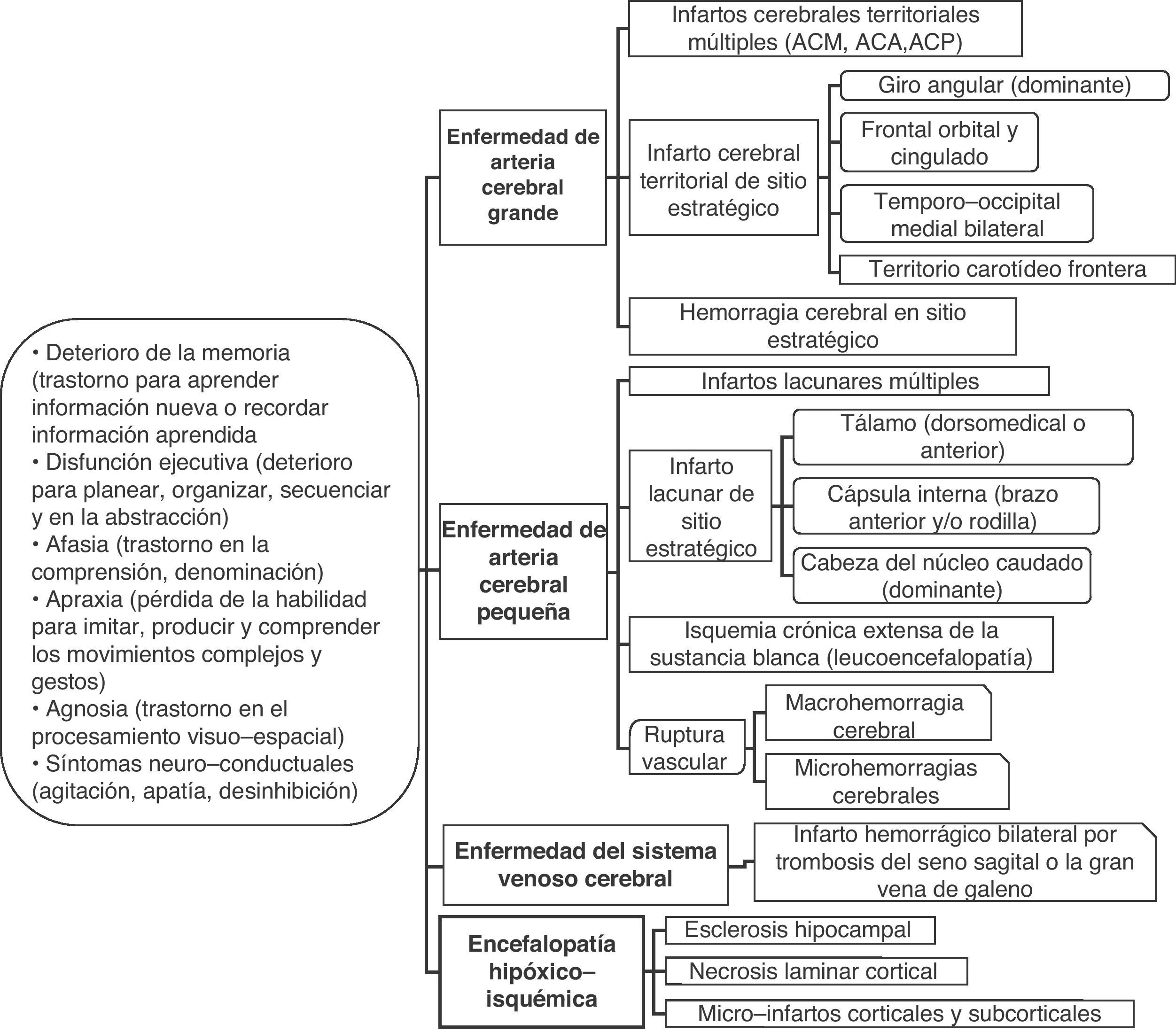
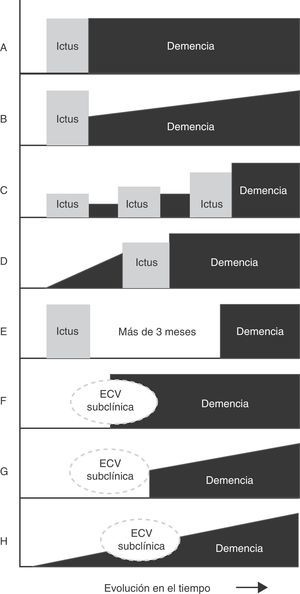
El deterioro cognitivo puede ser causado por diversas lesiones cerebrales isquémicas y/o hemorrágicas (fig. 2). Es recomendable considerar la demencia vascular como la denominación de un grupo, como es el caso del ictus, y cada una de las entidades incluidas en el conjunto con su definición propia (tabla 2)9,35,36. El ejemplo típico es la demencia producida por una serie de infartos debido a la oclusión de vasos de calibre mayor (demencia multi-infarto «clásica») o por la enfermedad de los vasos pequeños con múltiples infartos lacunares (estado lagunar) e isquemia crónica de la sustancia blanca. Asimismo, la demencia puede resultar de un infarto o hemorragia que lesiona un área cerebral cortical o subcortical de importancia estratégica para las funciones cognitivas (por ejemplo, giro angular del hemisferio dominante, tálamo anterior).
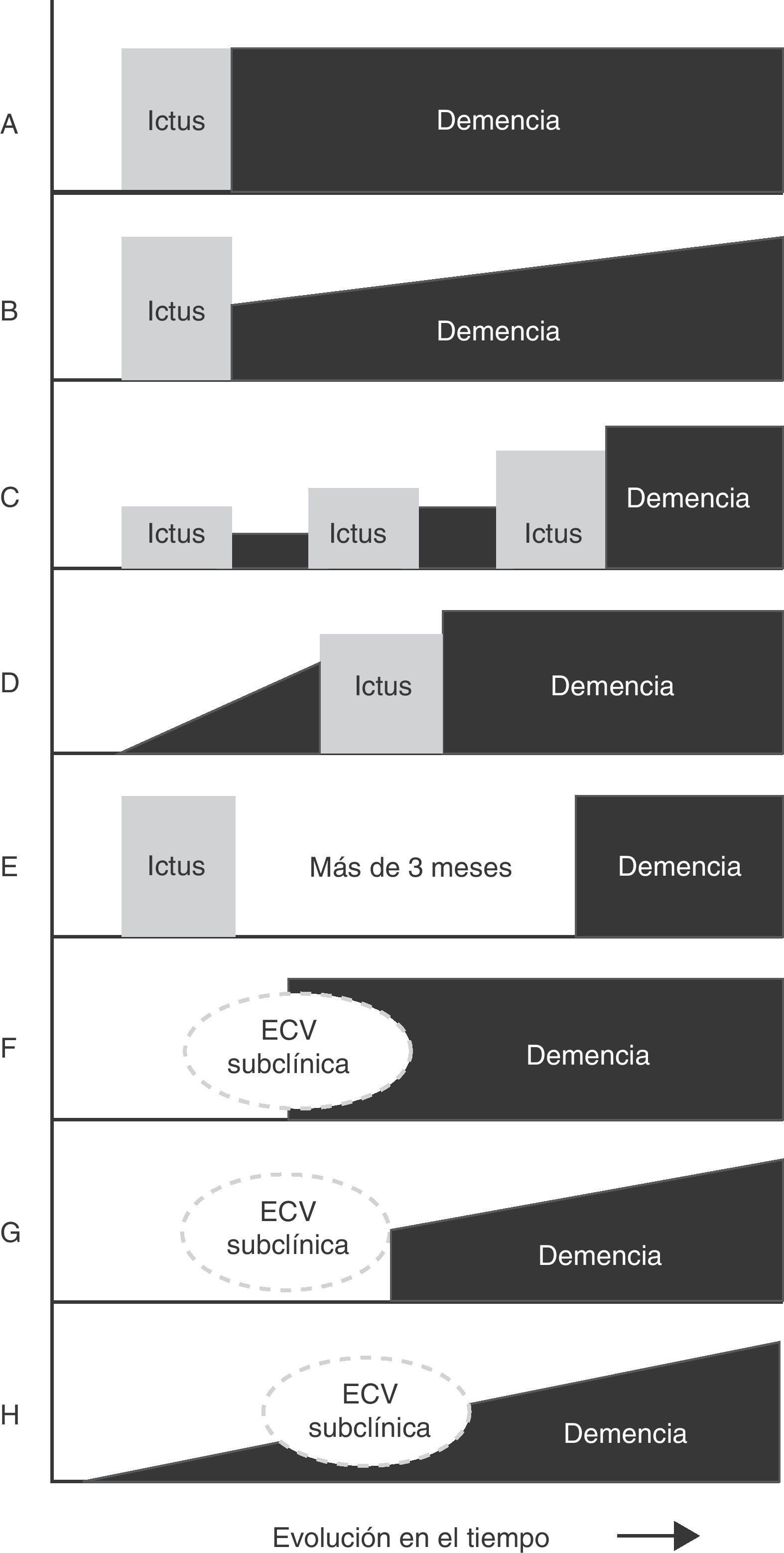
Principales patrones de relación temporal entre el inicio de la demencia y la lesión cerebrovascular. A. Demencia post—ictus (forma estática). B. Demencia post—ictus (forma progresiva). C. Demencia post—ictus múltiples. D. Demencia pre—ictus. E. Demencia sin relación temporal con el ictus. F. Demencia post—enfermedad cerebrovascular (ECV) subclínica. G. Demencia progresiva post—ECV subclínica. H. Demencia progresiva con ECV subclínica.
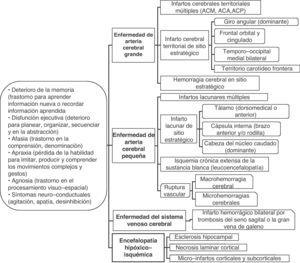
Principales categorías etiopatogénicas de lesiones vasculares asociadas con deterioro cognitivo
| I. Encefalopatía multi-infarto clásica (o por enfermedad de múltiples vasos grandes). Múltiples infartos cerebrales grandes en las áreas corticales y sustancia blanca/ganglios basales por la oclusión de arterias de calibre grande o mediano (usualmente por trombosis ateroesclerótica o embolismo cardiaco)II. Infarto de sitio estratégico (o por infarto único estratégico en área cortical o subcortical). Infarto cerebral pequeño o mediano en sitio estratégico (tálamo, sustancia blanca frontal, cabeza del núcleo caudado, brazo anterior y/o rodilla de la cápsula interna, giro angular, corteza frontocingular, área temporal medial, hipocampo). Se atribuye a las causas usuales de oclusión/estenosis arterial críticaIII. Enfermedad isquémica de pequeñas arterias cerebrales (o enfermedad isquémica de vasos pequeños, multimicroangiopática). Múltiples infartos cerebrales lacunares en la sustancia blanca central y estructuras subcorticales (estado lagunar), o cambios isquémicos difusos y extensos en la sustancia blanca profunda. Se debe a la oclusión de las arterias cerebrales pequeñas o estenosis crítica-hipoperfusión, respectivamenteIV. Encefalopatía hipóxico-isquémica. Incluye la necrosis laminar cortical secundaria a parada cardiorrespiratoria, micro-infartos múltiples corticales y subcorticales por hipotensión arterial, o esclerosis hipocampal por evento cerebral hipóxico-isquémicoV. Enfermedad cerebral hemorrágica. Lesión del parénquima cerebral (macrohemorragia o microhemorragias) secundaria a la ruptura vascular hipertensiva o por otros trastornos hemorrágicos (coagulopatías, vasculitis, aneurismas, malformaciones arteriovenosas, angiopatía amiloide hereditaria (demencia hemorrágica familiar), neoplasias, trombosis venosa cerebral)VI. Enfermedad cerebrovascular combinada. Combinación de las lesiones cerebrovasculares señaladas previamente (por ejemplo, infarto de sitio estratégico con estado lagunar)VII. Enfermedad cerebrovascular-enfermedad de Alzheimer. Cualquiera de las lesiones cerebrovasculares señaladas previamente y evidencia clínico-biológica de enfermedad de Alzheimer |
Una de las principales limitaciones para estandarizar los criterios diagnósticos de demencia vascular radica en los criterios ambiguos, heterogéneos y solapados utilizados para definir las lesiones vasculares cerebrales y los trastornos de los vasos sanguíneos. Un adecuado grupo de criterios diagnósticos requiere definiciones específicas y con elevado acuerdo interobservador6,8,37. Generalmente las definiciones de las lesiones cerebrales y vasculares causantes de demencia han sido descritas por diversos investigadores basándose en criterios meramente descriptivos (clínicos, radiológicos y/o patológicos), en lugar de en una perspectiva etiopatogénica que abarque el rol diagnóstico esencial que posee el estudio de imagen cerebral (estructural y funcional)3,18. Este enfoque en la descripción y no en el diagnóstico es probablemente producido por los siguientes hechos: 1) la patología vascular y degenerativa frecuentemente coexisten, y 2) no existen hallazgos radiológicos patognomónicos de DCV1.
Las categorías o tipos clásicamente propuestos de demencia vascular isquémica (demencia multi-infarto, demencia vascular subcortical y demencia por infarto estratégico) se entremezclan de forma variable ante la carencia de lineamientos definidos y como reflejo de la heterogeneidad en el diagnóstico de la demencia vascular. Ninguno de los criterios estándares para la demencia vascular incluye una descripción clínico-biológica detallada de sus categorías11,37. Las escalas isquémicas de Hachinski y de Rosen no abordan el tema de la relación causal, soslayan la localización específica de las lesiones vasculares requeridas para la demencia multi-infarto y solamente pueden usarse como un indicador grosero de la patología subyacente24,36. Tampoco los criterios DSM mencionan algún tipo de enfoque acorde a las lesiones cerebrovasculares necesarias o los diferentes mecanismos cerebrovasculares. El ICD-10 contiene 5 subtipos pobremente definidos (inicio agudo, multi-infarto, vascular subcortical, mixta cortical-subcortical, otra, no especificada) que no se articulan bien con la información brindada por los estudios de neuroimágenes (por ejemplo, un mismo paciente puede tener una demencia de inicio agudo y vascular subcortical)18,38. Los criterios ADDTC son muy liberales, se restringen a la demencia vascular isquémica e implican la especificación de los hallazgos diferenciales del infarto (por ejemplo, localización, tamaño, distribución, severidad y causa) solamente para propósitos de investigación6,16,36. Por último, los criterios NINDS-AIREN son los más específicos, pero no brindan una descripción detallada de los subtipos que incluyen y son muy restrictivos al precisar de una relación temporal entre la demencia y la enfermedad cerebrovascular3,12,24. Bajo dicha perspectiva, a un paciente hipertenso con deterioro cognitivo lentamente progresivo, parálisis seudobulbar, leucoaraiosis extensa e infartos lacunares múltiples se le puede entorpecer el diagnóstico de demencia vascular o esta puede ser considerada bajo diversos términos (por ejemplo, «enfermedad de Binswanger» o demencia vascular subcortical)18.
Demencia multi-infartoEs probablemente la forma más común de demencia vascular. Se atribuye a infartos cerebrales múltiples, grandes o pequeños, que afectan las áreas corticales y subcorticales. Clásicamente la oclusión arterial se ubica en las arterias cerebrales de gran calibre, y generalmente se atribuye a la trombosis aterosclerótica o a la embolia cardiogénica5,6.
Aunque la patología de la demencia multi-infarto está razonablemente bien definida, no existe consenso con respecto a la presentación clínica y el perfil cognitivo característico. En ocasiones la demencia multi-infarto ha sido intercambiada con el amplio concepto de demencia vascular o equiparada a la demencia post-ictus (cualquier demencia que ocurre después del ictus, independientemente de su causa)4–7,11 (fig. 3). El concepto de demencia multi-infarto puede equipararse con lagunas múltiples (estado lagunar), infartos multifocales trombóticos y/o embólicos, o como una combinación de ambos36,39. Solamente algunos estudios relacionan el deterioro cognitivo con el número de infartos cerebrales pequeños, pero la ecuación es compleja porque intervienen factores adicionales (edad, educación, volumen de tejido perdido, localización de las lesiones, comorbilidades cerebrales)37. Virtualmente existe cierto grado de deterioro cognitivo en cada paciente con infartos cerebrales múltiples, pero la mayoría de los casos no se califican como demencia cuando el diagnóstico se fundamenta en el examen del estado mini-mental. Algunos estudios reportan una variabilidad interindividual en el grado de déficit neuropsíquico, pero comúnmente no se distingue el estado multi-infarto con DCL y la demencia multi-infarto40.
En la demencia multi-infarto típica el paciente experimenta varios ictus isquémicos pequeños que pueden no resultar en un déficit neurológico focal41. Los síntomas cognitivos pueden presentarse de forma precoz o tardía en el curso del trastorno, acorde con la localización de los infartos. Clínicamente es característico un deterioro variable de las diversas áreas de la función intelectual. Se puede constatar una afectación irregular con indemnidad de ciertas funciones intelectuales y deterioro severo en otras (patrón parcheado). Con la recurrencia de los infartos, la mayoría de las funciones intelectuales se deterioran y se evidencia la demencia. El curso es progresivo y el efecto de los ictus es acumulativo. En la mayoría de los pacientes ocurren fluctuaciones clínicas en el desempeño cognitivo, la progresión es escalonada y la declinación cognitiva tiene una severidad similar a la EA6,24.
Los trastornos urinarios, con incremento en la frecuencia y urgencia o incontinencia, y los trastornos de la marcha ocurren precozmente, incluso antes del deterioro cognitivo. Frecuentemente existen cambios sensitivomotores lateralizados (hemiparesia, espasticidad, déficit hemisensitivo, déficit del campo visual, asimetría anormal de los reflejos miotáticos, respuesta extensora plantar) asociados al deterioro cognitivo y que sugieren un infarto por oclusión de una arteria grande. Los signos de disfunción neurológica focal pueden tener una recuperación completa o parcial, quedando solamente síntomas residuales menores. También pueden presentarse agnosia, apraxia y síndrome seudobulbar6,42.
En los estudios de perfusión se hallan reducciones regionales parcheadas del flujo sanguíneo cerebral (FSC), particularmente en la distribución de ambas arterias cerebrales medias. Estas zonas isquémicas con frecuencia involucran bilateralmente al tálamo y la corteza frontal y temporal circundante o adyacente a ambas cisuras silvianas. La isquemia involucra a determinadas áreas neuronales, pero persiste el potencial para que algunas neuronas se recuperen. La cognición puede mejorar espontáneamente al incrementarse el FSC regional mediante el desarrollo de la circulación colateral y/o la recanalización arterial.. No obstante, los períodos prolongados y severos de isquemia regional probablemente resultan en infartos focales que deterioran la cognición. Estos infartos pueden visualizarse como áreas hipodensas en la tomografía computarizada (TC) de cráneo y áreas hiperintensas en la resonancia magnética (RM) realzada en T231,43.
Demencia por infarto en sitio estratégicoLa lesión isquémica es focal e involucra a los sitios corticales o subcorticales con importancia crítica para la capacidad cognitiva y conductual. Los infartos únicos situados estratégicamente en la distribución de las arterias carótidas y cerebrales (anterior, media y posterior) producen demencia y una variedad de hallazgos neurológicos y neuroconductuales. Típicamente el inicio de la demencia es abrupto o se detecta una declinación escalonada en la función cognitiva6,36.
El diagnóstico de un infarto de sitio estratégico se facilita cuando se presentan los síntomas de déficit motor o sensitivo (hemiparesia, hemianopsia, hemianestesia). No obstante, en ciertos pacientes la demencia es la única manifestación del infarto de sitio estratégico, y puede inducir la sospecha de una enfermedad neuro-degenerativa. Estas manifestaciones neurológicas, y especialmente los cambios cognitivos, dependen de una ecuación compleja que involucra la localización de la lesión, el volumen de tejido cerebral dañado y la capacidad cerebral para compensar los cambios9. Debido a la reducida evidencia al respecto, Leys et al. señalan que el concepto de ictus estratégico debe revisarse con largos estudios prospectivos, el estudio adecuado de RM para excluir lesiones asociadas que interfieran en el déficit hallado y un seguimiento lo suficientemente prolongado para excluir una EA asociada4.
Actualmente las imágenes de RM multimodal brindan una localización excelente de la lesión de forma que se potencia el entendimiento del espectro de los trastornos cognitivos en el ictus y una elevada precisión en el diagnóstico de las áreas y redes estratégicas. Un análisis reciente de Hoffman et al. plantea que los síndromes cognitivos se presentan en la mayoría de los pacientes con ictus, y esencialmente resultan de las lesiones relacionadas con las siguientes redes anatómicas cognitivas mayores: 1) pre-frontal subcortical para la función ejecutiva (51%); 2) hemisférica izquierda con afasias, síndrome de Gertsmann (36%); 3) hemisférica derecha con anosognosias, heminegligencia y aprosodias (15,3%); 4) hipocampal-límbica con trastornos de la memoria y emocionales (22%); 5) occipitotemporal para el procesamiento visual complejo (6%); y 6) misceláneas (por ejemplo, discalculias, apraxias, síndromes de desconexión)44.
Infarto en la región del giro angular dominanteCausa el síndrome de Gerstmann cuya tétrada de síntomas característicos son: incapacidad para designar los diferentes dedos de las 2 manos (agnosia digital), confusión de los lados derecho e izquierdo del cuerpo, incapacidad para calcular (discalculia) y escribir (disgrafía). Puede asociarse alexia, hemianopsia visual, heminegligencia izquierda severa y afasia anómica5,31,37,45.
Infarto frontal orbital y cinguladoEl trastorno conductual es significativo en las lesiones del territorio de las arterias frontopolar y callosomarginal (ramas de la arteria cerebral anterior). La lesión orbitofrontal produce desinhibición, impulsividad («sociopatía adquirida»), conducta antisocial y sexualmente inapropiada (conducta indiscreta e indecencia). La lesión medial sobre el cingulado anterior causa pérdida de la iniciativa, de manera que predomina la desmotivación, la apatía, la pasividad o la inercia. La cognición puede estar intacta o tener un deterioro en la organización temporal y planeación conductual. La pérdida del control intelectual de la conducta y la dependencia del ambiente social y físico se manifiestan por una tendencia a imitar la conducta de otras personas, y por el uso automático de un objeto que se le presenta sin haber recibido la orden (conducta de imitación y utilización). Otras manifestaciones que pueden asociarse son el mutismo acinético (lesión bilateral mesiofrontal), afasia motora transcortical (con lesiones hemisféricas dominantes), desviación óculo-cefálica hacia la lesión, rigidez difusa, reflejo de succión y prensión, e incontinencia de esfínteres31,36,44,46.
Infarto temporo-occipital medial bilateralLa oclusión vertebrobasilar produce lesiones bilaterales del hipocampo con amnesia severa. El trastorno de la memoria se acompaña de otras manifestaciones por infarto en el territorio de las arterias cerebrales posteriores (por ejemplo, prosopagnosia, ceguera cortical, síndrome de Anton, simultanagnosia, dificultad en la coordinación de la mirada, metamorfopsia, agnosia visual). En ocasiones puede presentarse delirio con agitación psicomotriz31,36,44. En contraste, se ha reportado que el infarto extenso del territorio de la arteria cerebral posterior derecha puede cursar con una capacidad cognitiva y funcional preservada47.
Infarto talámico y de otros sitios estratégicos subcorticalesEl infarto unilateral o bilateral del territorio de las arterias paramedianas (principalmente el núcleo dorsomedial y núcleos intralaminares) produce amnesia asociada con trastornos conductuales («demencia talámica»). La disminución y fluctuación del nivel de conciencia es un hallazgo notable en la fase inicial. La amnesia también predomina en el infarto de los núcleos anteriores del tálamo por disrupción del tracto mamilotalámico, y en el infarto de la lámina medular interna por lesión de las proyecciones amigdalotalámicas. Estas dos últimas lesiones se atribuyen a la oclusión de la arteria tuberotalámica, y en algunos casos a la oclusión de la arteria paramediana31,48–51. En la amnesia vascular talámica predomina el déficit de la memoria anterógrada declarativa a largo plazo, un déficit menos consistente de la memoria retrograda declarativa a largo plazo y una preservación sustancial de la memoria a corto plazo e implícita. La desorientación, agitación, agresividad, apatía y el déficit disejecutivo son hallazgos asociados relevantes51,52. El infarto extenso del territorio tuberotalámico dominante cursa con anomia, afasia (fluencia y comprensión deteriorada, parafasias) y acalculia. El deterioro de la memoria visual se observa en la lesión no dominante53.
El infarto del globo pálido del hemisferio dominante puede manifestarse únicamente por cambios cognitivos y conductuales agudos (inatención, disminución de la fluencia verbal, embotamiento emocional, amnesia, disfunción ejecutiva)54. El infarto de la cabeza del núcleo caudado del hemisferio dominante se produce por la obstrucción de las arterias lenticuloestriadas laterales (ramas de la arteria cerebral media) y se manifiesta clínicamente por trastornos de la memoria o un deterioro mental amplio (apatía, agresividad, síntomas afectivos con rasgos psicóticos). Por último, se reporta que el infarto del brazo anterior y/o la rodilla de la cápsula interna puede comenzar con demencia y manifestaciones motoras ausentes o mínimas (por ejemplo, debilidad faciolingual)55–57.
Demencia por enfermedad de pequeñas arterias cerebralesEl término enfermedad de vaso pequeño hace referencia a un grupo de procesos patológicos de varias causas que afectan las arterias pequeñas, arteriolas, vénulas y capilares del cerebro. La enfermedad de vaso pequeño relacionada con la edad y con la hipertensión arterial, y la angiopatía amiloide cerebral son las formas más comunes. Las consecuencias de la enfermedad de vaso pequeño en el parénquima cerebral son heterogéneas, se localizan principalmente en las estructuras subcorticales e incluyen los infartos lacunares, lesiones isquémicas de sustancia blanca y las hemorragias. Frecuentemente el término enfermedad de vaso pequeño se aplica como sinónimo de las lesiones del parénquima cerebral al considerarse que existe una relación causal y porque actualmente resulta imposible la visualización en vivo de los vasos pequeños. Además, la enfermedad de vaso pequeño se generaliza a los trastornos en las arterias y se obvia el componente venoso (en dichos casos es más apropiado el término «enfermedad de vaso arterial pequeño»)58.
Recientemente L. Grinberg y H. Heinsen muestran cómo un tipo de demencia vascular subcortical determinada es etiquetada con diferentes nombres entre clínicos, radiólogos y patólogos, o incluso peor, una sola entidad radiológica o clínica corresponde a múltiples lesiones neuropatológicas. Por ejemplo, 3 cambios distintos como la arterioloesclerosis, el edema de la sustancia blanca y la rarefacción local de la mielina pueden ser llamadas leucoaraiosis por los radiólogos. Asimismo, el «estado lagunar» de Marie es similar a la «degeneración o atrofia cerebral ateroesclerótica» de Binswanger y Alzheimer. La interpretación de las lesiones ateroscleróticas en los vasos pequeños se dificulta también porque en ocasiones se subdivide la arterioloesclerosis acorde al cambio histológico más pronunciado (necrosis fibrinoide, lipohialinosis, microateromas), pero estos hallazgos pueden coexistir. Finalmente, algunos definen una «laguna» bajo dimensiones erróneas (por ejemplo, un volumen máximo de 15mm3) o independientemente de su fundamento (infarto, hemorragia, espacio perivascular agrandado)9,39,58,59.
Las características clínicas del DCV asociado con la enfermedad de pequeñas arterias comprenden los trastornos de la marcha, humor, conducta y del control de esfínteres. Inicialmente los signos son ligeros y se asocian vagamente. Al progresar el trastorno se cumplen los criterios de demencia, la marcha está muy deteriorada con incapacidad para caminar y caídas frecuentes, la depresión y apatía son prominentes, y se presenta incontinencia urinaria y signos motores extrapiramidales6,60–62. Los síntomas no cognitivos son con frecuencia obviados y los pacientes son principalmente valorados por el déficit cognitivo, resultando en una perspectiva limitada de la patología cerebrovascular. Sin embargo, en los pacientes con EA los problemas cognitivos son las manifestaciones más prevalentes58,63.
En contraste con la demencia que ocurre después de un ictus mayor, los procesos que conducen a la demencia por enfermedad de arteria pequeña pueden considerarse en varias etapas con un curso progresivo y relativamente insidioso58,63. Las lesiones implicadas en el deterioro cognitivo secundario a la enfermedad de las pequeñas arterias cerebrales se pueden apreciar de forma combinada y se desglosan típicamente en los siguientes 3 tipos: 1) lesiones isquémicas de la sustancia blanca, 2) infartos lacunares y 3) hemorragias64.
Lesiones isquémicas de la sustancia blancaSe observan en la RM como áreas más o menos confluentes que se sitúan de forma bilateral y simétrica en la sustancia blanca hemisférica periventricular o subcortical y brindan una apariencia hiperintensa en la RM con secuencia T2 y FLAIR (hiperintensidades de la sustancia blanca o HSB). Las lesiones alrededor de los cuernos frontal y occipital son homogéneas, pero aquellas ubicadas en la sustancia blanca periventricular frecuentemente consisten en un conglomerado de pequeñas lesiones. Las correlaciones en la TC son áreas hipodensas alrededor de los cuernos frontal y occipital de los ventrículos laterales, frecuentemente con extensión a la sustancia blanca frontal subinsular y la sustancia blanca del centro semioval65,66. Por definición, estas lesiones no se ubican adyacentes a las áreas de lesión cortical o agrandamiento ventricular para distinguirlas de los efectos de los infartos grandes en la sustancia blanca. El término leucoaraiosis (rarefacción de la sustancia blanca) fue introducido por Hachinski, Potter y Merskey en 1986 para describir dichos cambios, prevenir la confusión con un proceso clínico-patológico ambiguamente definido (la denominada «enfermedad de Binswanger»)39 y evitar la atribución inmediata de un significado especifico a un hallazgo radiológico. Al introducirse dicho neologismo, la mayoría de los estudios se basaban en la TC y, por lo tanto, algunos todavía piensan que se debe de usar solamente para describir las lesiones de la TC58,67.
El significado de la leucoaraiosis y los cambios vasculares relacionados ha sido precisado de forma incompleta. Su patogénesis probablemente es multifactorial64, pero generalmente se piensa que obedece a hipoxia e isquemia3,14,15,68. Probablemente algunos casos de leucoaraiosis ocurren por infartos pequeños, aislados o confluyentes68. La leucoaraiosis es un hallazgo de la enfermedad de pequeño vaso cerebral que conduce a ictus, incluyendo la arteriopatía hipertensiva, la angiopatía amiloide, el CADASIL (arteriopatía autosómica dominante con infartos subcorticales y leucoencefalopatía) y posiblemente las enfermedades venosas15,58,69.
Actualmente se afirma que un grado ligero de leucoaraiosis detectable por RM es casi un hallazgo normal en el cerebro de la mayoría de las personas ancianas5. Sin embargo, la evidencia acumulada muestra que los cambios de la sustancia blanca moderados a severos no son benignos. Dichos casos se relacionan con trastornos motores y de la marcha, síntomas depresivos, trastornos urinarios y ciertos deterioros cognitivos que empeoran por la influencia de lesiones asociadas (infartos lacunares, enfermedades degenerativas coexistentes)70,71. Los dominios cognitivos afectados en la leucoaraiosis no están claramente establecidos, pero la asociación con la declinación cognitiva y funcional es fuerte6,19,72. En general, en los pacientes con leucoaraiosis periventricular se deteriora más la función cognitiva en comparación con las lesiones profundas64. Las escalas de medición cuantitativas visuales y volumétricas son comparables, pero no tienen un rol práctico definido probablemente por sus efectos techos y su uso consecuente como medidas de resultado19,66,73.
Infartos lacunaresLos infartos lacunares (o lagunas tipo I) se asocian frecuentemente con las lesiones isquémicas crónicas de la sustancia blanca cerebral. Se ubican típicamente en la corona radiada, ganglios basales, cápsula interna, tálamo y base del puente. Se observan como áreas hipodensas en la TC, áreas hipointensas en la RM con secuencias T1, y áreas hiperintensas en la RM de densidad protónica o con secuencias T2. No existe un consenso total sobre el tamaño de los infartos lacunares, pero la definición usualmente aceptada del diámetro máximo es de 15mm. teniendo en cuenta las descripciones patológicas originales (este límite se considera que corresponde a 20mm en la TC/RM)58,64.
Ciertos infartos lacunares se localizan dentro de las áreas de las lesiones difusas de la sustancia blanca71. En estos casos resulta difícil determinar por RM cuándo dichas lesiones deben clasificarse como infartos lacunares puros o las consecuencias extremas de la leucoaraiosis. De hecho, las formas más severas de leucoaraiosis se visualizan en la prueba de neuroimagen como huecos y, por lo tanto, pueden ser interpretadas como infartos lacunares58. La distinción de los infartos cavitados y los espacios perivasculares dilatados (o lagunas tipo III) representa también una dificultad diagnóstica importante74.
Los infartos lacunares se aceptan ampliamente como un signo de la enfermedad de pequeña arteria cerebral64. En términos estrictos es más apropiado clasificar a los pacientes como portadores de una enfermedad de pequeña arteria cerebral cuando se excluye una fuente embolígena y los infartos lacunares son múltiples o asociados con leucoaraiosis moderada-severa58. Los infartos lacunares pueden presentarse bajo las siguientes formas: 1) un síndrome lacunar (hemiparesia motora pura, síndrome sensitivo puro, síndrome sensitivo-motor, hemiparesia atáxica, disartria-mano torpe o como un síndrome lacunar atípico); 2) ataque transitorio de isquemia; o 3) Un hallazgo asintomático en la neuroimagen. Sin embargo, en las 3 circunstancias, la progresión silente de la enfermedad cerebral de pequeño vaso está demostrada y los infartos lacunares constituyen un trastorno potencialmente deletéreo y funcionalmente invalidante75,76. La hipertensión arterial y la diabetes son factores de riesgo que predisponen claramente al infarto lacunar causado por la enfermedad isquémica de pequeño vaso58.
Los factores asociados con la declinación cognitiva en los infartos lacunares son la localización en sitios estratégicos (por ejemplo, tálamo, putamen, globo pálido) y la presencia de múltiples lagunas (estado lagunar)6,37,77,78. Una lesión lagunar estratégica puede asociarse con trastornos cognitivos como parte de la presentación clínica del ictus. El deterioro cognitivo también se asocia frecuentemente con los infartos lacunares silentes (infartos no relacionados clínicamente con un ictus y hallados incidentalmente en la neuroimagen)79,80.
Los trastornos neuropsicológicos leves se han evidenciado en más de la mitad de los pacientes con un primer infarto lacunar, especialmente en los que cursan con un síndrome lacunar atípico o con hemiparesia motora pura81. Además, la pérdida volumétrica de la sustancia gris cerebral estudiada mediante voxel-based morphometry por M. Grau-Olivares et al. ha sido señalada como un factor contribuyente al deterioro cognitivo en el infarto lacunar. Los pacientes con DCL vascular mostraron más atrofia bilateralmente en el giro temporal medial, regiones frontal derecha e izquierda y occipitoparietal posterior bilateral, incluyendo el cingulado posterior y el cerebelo82.
La suma de infartos en los ganglios basales y la cápsula interna por oclusión de las pequeñas arterias cerebrales (estado lagunar) se relaciona con la demencia y las manifestaciones sensitivo-motoras multifocales (rigidez, espasticidad, parálisis seudobulbar, hemiparesia, hiperreflexia muscular, respuesta plantar extensora, marcha a pequeños pasos, e incontinencia urinaria). Típicamente existe una historia de discapacidad neurológica leve y transitoria, y los primeros eventos pueden conformar los síndromes lacunares clásicos83. Las manifestaciones cognitivas comprenden lentitud del procesamiento de la información, deterioro de la memoria y pobreza de la atención sostenida. Las manifestaciones conductuales se atribuyen típicamente a las lesiones prefrontales, e incluyen la falta de volición y el mutismo-acinético. Las lesiones lacunares en el circuito prefrontal subcortical se asocian con deterioro de la fluencia verbal, función ejecutiva, incremento del riesgo de ictus y demencia, y un deterioro cognitivo más rápido, incluso cuando se controlan los otros factores de riesgo vascular5,15,84.
El CADASIL constituye el modelo más importante de demencia vascular relacionada con la microangiopatía subcortical. Se trata de una enfermedad autosómica dominante resultante de la mutación en el gen codificador del receptor transmembrana Notch 3, localizado en el cromosoma 19 (19p13.1). Probablemente es una de las enfermedades neurológicas hereditarias más comunes y la causa hereditaria más importante de ictus isquémico. Sus manifestaciones clínicas son diversas y la mayoría de los individuos presentan cefaleas recurrentes (migraña, usualmente con aura atípica o prolongada), déficit neurológico focal (secundario a uno o varios infartos cerebrales) y, en estadios avanzados, un deterioro psicomotor progresivo que incluye la demencia. La depresión ocurre en aproximadamente el 20% de los casos. Los hallazgos típicos en la RM son: 1) hiperintensidades multifocales y bilaterales en FLAIR/T2 ubicadas en la sustancia blanca periventricular y profunda (afectan principalmente el polo temporal anterior, lóbulos frontal y parietal, cápsula externa, puente y ganglios basales), 2) hipointensidades focales en T1 (infartos lacunares), y 3) lesiones sugestivas de microhemorragias. El diagnóstico clínico y mediante el estudio genético molecular o el examen de vasos sanguíneos en diversos órganos afectados (usualmente los vasos dérmicos de la piel) es valorado con detalle en la revisión de André y en la de del Río-Espínola et al.85,86.
HemorragiasDe forma engañosa la descripción de la enfermedad de pequeño vaso se restringe al proceso isquémico (infartos lacunares y lesiones isquémicas de la sustancia blanca), y así se obvia la posibilidad de que ocurran grandes hemorragias y microhemorragias (hemorragia lagunar o lagunas tipo II). Las lesiones hemorrágicas mayores en sitios cerebrales estratégicos son fácilmente reconocibles por la neuroimagen convencional, incluyendo la TC, pero las microhemorragias requieren del uso de secuencias de RM apropiadas como las de eco-gradiente o las secuencias T258,87,88.
Las microhemorragias se observan como áreas pequeñas (usualmente focos redondeados menores de 5mm) de señal hipointensa en las secuencias T2 de la RM cerebral64. Frecuentemente se asocian con lagunas y señales hiperintensas en la sustancia blanca. Representan patológicamente un depósito focal de hemosiderina asociado con eventos hemorrágicos previos. Constituyen un marcador de microangiopatía cerebral, más frecuentemente de lipohialinosis. En los pacientes con enfermedad cerebrovascular isquémica, el número y la localización de las microhemorragias puede asociarse con la disfunción ejecutiva15,37,88.
Demencia mixta enfermedad de Alzheimer-vascularLa forma en que la EA se relaciona con el DCV no está completamente comprendida, pero su coexistencia es bien aceptada3,4,8,18,36,37,83,89. Comúnmente la demencia vascular y la demencia tipo Alzheimer han sido conceptualmente distinguidas en función de los factores de riesgo vascular, hallazgos clínicos (como el inicio agudo, progresión escalonada y labilidad emocional) y hallazgos de neuroimágenes5,41 (tabla 3).
Criterios útiles para el diagnóstico del deterioro cognitivo vascular
| Criterio diagnóstico centralA. Presencia de deterioro cognitivo y alguna lesión cerebrovascular• Demencia o deterioro cognitivo leve (tabla 1)• Lesión cerebrovascular: puede sugerirse por la información clínica (historia de ictus, signos cerebrales focales con o sin historia sugestiva), pero siempre debe demostrarse por la RM/TC de cráneo y/o el estudio anatomopatológico (tabla 2)Criterios indicativos de una relación causalB. Inicio del deterioro cognitivo inmediatamente después del ictus y alguno de los siguientes• El deterioro cognitivo no empeora o mejora con el tiempoa• Progresión escalonada del deterioro cognitivoa• Paciente joven en el que resulta improbable la asociación de la EA (específicamente una EA familiar de inicio precoz)C. Presencia en el estudio de RM o en el estudio patológico de una lesión cerebrovascular que involucra un área o red estratégica para las funciones cognitivas• Zona circulatoria limítrofe (en el hemisferio dominante o de forma bilateral): frontal superior (entre la irrigación cortical de la ACA y ACM), parieto-occipital (entre la irrigación cortical de la ACM y ACP), interna (entre la ACA, ACM, ACP y el área irrigada por las arterias de Heubner, lenticuloestriada y coroidea anterior)• Giro angular (del hemisferio dominante o bilateral)• Frontal orbital-cingulada (ACA bilateral)• Tálamo anterior, dorsal-paramediano o dorsomedial (arteria tálamo-perforante unilateral o bilateral)• Temporal mesial del hipocampo (ACP bilateral)• Núcleo caudado (arteria lenticuloestriada de la ACM del hemisferio dominante)• Otras áreas de sustancia gris o blancab claves (en el hemisferio dominante o de forma bilateral): porción anterior del putamen, brazo anterior de la cápsula interna, rodilla de la cápsula internaD. Se demuestra un biomarcador genético de enfermedad cerebrovascular que causa demencia• Arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía: mutación en el gen Notch 3, localizado en el cromosoma 19• Hemorragia cerebral hereditaria con amiloidosis: mutación en el gen para las proteínas precursoras de amiloideCriterios de exclusión• Ausencia de lesión cerebrovascular en el estudio de RM multimodal, y• Evidencia de algún trastorno con la severidad suficiente para producir el deterioro cognitivo: depresión mayor, anormalidad tóxico-metabólica (precisa de investigaciones específicas), neoplasia intracraneal, hematoma subdural, hidrocefalia crónica, infección intracraneal |
ACA: arteria cerebral anterior; ACM: arteria cerebral media; ACP: arteria cerebral posterior; EA: enfermedad de Alzheimer; RM: resonancia magnética; TC: tomografía computarizada.
Implican un curso clínico lo suficientemente prolongado. La historia de un déficit cognitivo gradualmente progresivo antes o después del ictus sugiere la existencia de un trastorno neurodegenerativo.
La leucoencefalopatía isquémica debe ser difusa y extensa (periventricular y arbitrariamente al menos el 25% de la sustancia blanca total o un área de sustancia blanca superior a 10cm2). El diagnóstico práctico de la forma específica de deterioro cognitivo vascular se plantea en el paciente que cumple el criterio A y al menos un criterio indicativo de un rol causal prominente (por ejemplo, B, C o D).
Existe una limitación en el diagnóstico basado en esta dicotomía, y el concepto de «demencia mixta EA-vascular» resulta importante para comprender la fisiopatología subyacente en la EA y estimar adecuadamente la amplitud del DCV8,9,18,90. Al respecto, los criterios diagnósticos estándares brindan una perspectiva imprecisa. Cuando los trastornos sistémicos u otras enfermedades cerebrales (como la EA) tienen relación con los deterioros en la memoria y cognición, solamente el criterio ADDTC brinda el diagnóstico alternativo de «demencia mixta». El criterio NINDS-AIREN utiliza el término más específico de «EA con enfermedad cerebrovascular»11,12.
La forma más relevante de demencia mixta es en la que existe evidencia de EA y de enfermedad cerebrovascular91. La posibilidad de EA concomitante con frecuencia oscurece la relación entre la lesión cerebrovascular y el deterioro cognitivo. La enfermedad cerebrovascular tiene la capacidad de disminuir el umbral en el cual la patología Alzheimer se manifiesta clínicamente como demencia. Las lesiones degenerativas y vasculares pueden ser insuficientes para causar demencia, pero al interactuar de forma acumulativa llegan a deteriorar la cognición y la capacidad funcional9,91. Así, durante, la vida, puede ser difícil determinar qué hallazgo patológico es la causa primaria del deterioro cognitivo14,40.
En dicha presentación mixta existe evidencia de enfermedad cerebrovascular y típicamente se asocian los siguientes hallazgos de EA: 1) historia de declinación de la memoria lentamente progresiva, 2) amnesia episódica prominente (deterioro del aprendizaje y memoria reciente con preservación de la atención y pobre mejoría con pistas), y 3) atrofia del lóbulo temporal medial en la RM36,91. El rango de contribución de la enfermedad cerebrovascular y la EA se incrementa con la edad.
Recientemente Gorelick et al. publicaron un interesante artículo sobre la evidencia de la contribución de la patología vascular en el deterioro cognitivo y la demencia. En dicho artículo se propone una forma diferente a la clásica para ciertos términos usados para clasificar la seguridad en el diagnóstico del DCV (probable para las formas más «puras», y posible cuando la certeza en el diagnóstico es menor o existe un proceso «mixto»)92. Sin embargo, al respecto hemos notado que la descripción utilizada debe interpretarse con precaución, porque carece de una consistencia satisfactoria en cuanto a los patrones temporales, perfiles cognitivos, evidencia de imágenes y marcadores patológicos93. Para potenciar el rendimiento diagnóstico en las demencias vasculares «puras» y en las formas «mixtas» recomendamos la adopción en la práctica clínica de los criterios y los protocolos diagnósticos tabulados (tablas 3 y 4)1,5,6,18,94.
Recomendaciones para la evaluación práctica del paciente con DCV
| Historia y examen clínico• Datos demográficos: sexo, fecha de nacimiento, color de la piel, etnicidad, educación• Informante: datos demográficos, tiempo y calidad del contacto• Historia familiar: ictus, vasculopatía o demencia en familiares de primer grado• Historia personal: trastorno cardiovascular o cerebrovascular, hipertensión arterial, hiperlipidemia, diabetes mellitus, tabaquismo, alcoholismo, inactividad física, trastornos del sueño, sicklemia, estados hipercoagulables o trastornos relacionados (trombosis venosa profunda, embolismo pulmonar, aborto espontáneo), infecciones crónicas, nefropatías, cirugías, anticonceptivos, medicamentos y exposición ambiental a tóxicos• Historia de la enfermedad actual: inicio de los síntomas, síntomas cognitivos y conductuales, síntomas motores (trastorno de la marcha, debilidad muscular, dificultad para deglutir, incontinencia urinaria), cambios emocionales y del estado de ánimo (evaluar depresión), capacidad funcional (especialmente para las actividades instrumentales de la vida diaria)• Examen físico general y neurológico: peso, talla, presión arterial, estado nutricional, ritmo cardiaco, visión, audición, examen cardiovascular y examen neurológico (aspectos de la escala de Ictus NIH, marcha, reflejos musculares, signo de Babinski).• Examen mental: subcategorías de la Valoración Cognitiva de Montreal para 5 min (prueba de memoria inmediata y tardía con 5 palabras, tarea de orientación de 6 ítems, y prueba de fluencia fonémica con una letra (la letra F)*; otras tareas suplementarias se añaden para enfatizar en funciones particularesPruebas diagnósticas especiales• Análisis de sangre• Hemograma completo (incluyendo recuento de plaquetas), velocidad de eritrosedimentación, glucemia, pruebas de función renal, coagulograma, perfil de lípidos, hormonas tiroideas, niveles séricos de vitamina B12• Acorde al contexto clínico: serología de sífilis y VIH, pesquisa de trombofilia, anticoagulante lúpico, anticuerpos anticardiolipina, niveles de tóxicos, ceruloplasmina• Electrocardiograma de 12 derivaciones• Pruebas de imágenes cerebrales• IRM craneal multimodal: ponderada en T1 en 3D, ponderada en T2 y FLAIR (fluid-attenuated inversión recovery) para detectar infarto u otra lesión (atrofia, hiperintensidades de la sustancia blanca, malformaciones, colección extra-axial) y eco-gradiente para detectar hemorragias. Es preferible en la fase inicial del DCV, y especialmente ante la sospecha de CADASIL. Si está disponible se completa con imágenes ecoplanares de IRM de difusión y angio-IRM (intracraneal y cervicocefálica).• TC de cráneo: dilatación ventricular, atrofia temporal medial, hipodensidades severas de la sustancia blanca (número, volumen, localización), hemorragia aguda. Alternativa a la RM, sirve específicamente para mostrar las lesiones cerebrales en casos severos• PET o SPECT: patrón de hipometabolismo o hipoperfusión irregular o con predominio frontal (incluyendo el giro cingulado y frontal superior) y preservación de la corteza occipital. Útil para el diagnóstico diferencial con la EA• Ecografía vascular: ecografía duplex carotídea y doppler transcraneal (vasorreactividad, índice de pulsatilidad, velocidad del flujo sanguíneo, microembolias)• Estudio angiográfico cerebral: para evaluar la estenosis carotídea o ante la sospecha de vasculitis cerebral• Examen del LCR: ante la sospecha de causa infecciosa, inflamatoria o hidrocefalia crónica del adulto; para el diagnóstico diferencial mediante biomarcadores en casos selectos• Estudio genético: ante la sospecha de arteriopatía cerebral hereditaria. En el CADASIL se aplica el estudio ultraestructural de la biopsia cutánea si alta sospecha clínica y estudio genético negativo o no disponible |
Fuente: citas1,5,6,18,94.
Diversos biomarcadores han sido investigados para ayudar a la detección precoz, discriminar los hallazgos neuropatológicos, estimar el pronóstico y monitorizar la progresión de la enfermedad o la respuesta terapéutica en los pacientes con DCV5,95. En dicho ámbito son de especial interés los marcadores relacionados con los factores genéticos y los mediadores inflamatorios involucrados en la etiopatogenia del DCV.
Los factores genéticos tienen un rol reconocido en la demencia vascular. Actualmente se han identificado varias formas monogénicas de enfermedades cerebrovasculares que repercuten sobre la función cognitiva. De dichas formas han recibido especial atención el CADASIL y la hemorragia cerebral hereditaria con amiloidosis tipo holandés (HCHWA-D). En contraste, resultan escasas las investigaciones sobre los genes que podrían condicionar la susceptibilidad del cerebro a la lesión producida por la enfermedad cerebrovascular (por ejemplo, los genes de la EA)3,85,86.
El análisis de los biomarcadores del líquido cefalorraquídeo (LCR), en conjunción con la información clínica y de neuroimagen, también puede potenciar el diagnóstico de diferentes trastornos cerebrales causantes de deterioro cognitivo95. Generalmente la demencia vascular se relaciona con el conjunto de los siguientes biomarcadores en el LCR:
- -
Tau total. Es un marcador dinámico de la intensidad de la degeneración/daño axonal. Sus niveles se elevan en la enfermedad de Creutzfeld-Jakob, y también pueden hallarse en la demencia post-ictus, traumatismo cerebral y la EA96–99.
- -
Subunidad ligera de la proteína de neurofilamento. Es el mejor biomarcador en el LCR de daño/degeneración axonal subcortical. Se presenta en altas concentraciones en la demencia vascular, demencia frontotemporal y diversos trastornos inflamatorios (esclerosis múltiple, demencia-sida). La combinación con un biomarcador de la EA indica una demencia mixta5,100–103.
- -
Razón de concentración de albumina en LCR/sérica. Es el biomarcador más definido de integridad de la barrera hematoencefálica. Generalmente hay una elevación de esta razón en los pacientes con demencia vascular (en particular por enfermedad de vaso subcortical)95,98,99,103.
- -
Niveles de factor de necrosis tisular alfa. Esta citoquina proinflamatoria media el daño de la mielina. Sus niveles se elevan en los pacientes con demencia vascular subcortical y se correlacionan con los niveles de sulfátidos (un marcador de degradación de la sustancia blanca)99,104.
El hallazgo en el LCR de niveles bajos de la forma de 42 aminoácidos del amiloide beta, niveles altos de tau hiperfosforilada, o de signos bioquímicos de neuro-inflamación (aumento de leucocitos, producción de IgG o IgM) indican una demencia no-vascular y pueden ser útiles como biomarcadores negativos para el diagnóstico de la demencia vascular pura. No obstante, la implementación de los biomarcadores del LCR en el proceso diagnóstico de la demencia vascular requiere de métodos estándares en la obtención, almacenamiento y medición de la muestra5,95,96,105.
Diagnóstico del deterioro cognitivo leve vascularLos criterios para el diagnóstico de la demencia vascular no son sensibles para el fenotipo clínico de deterioro cognitivo secundario a una causa vascular sin la severidad suficiente para ser considerada una demencia (DCV-no demencia). La insuficiente precisión de los criterios diagnósticos para dicha entidad ha influido en el uso ambiguo y heterogéneo de los términos. Dentro de las categorías de DCV, la entidad paralela al deterioro cognitivo-no demencia es el DCL5,63,106–108.
A partir de diversos estudios y consensos se ha logrado concebir el DCL como un síndrome que incluye al déficit de la memoria y/o de otras funciones cognitivas superior al esperado para el envejecimiento normal, considerando la edad y el nivel cultural del individuo, que puede interferir o no con la vida diaria, y de severidad insuficiente para constituir una demencia (tabla 1)27,109. Al evolucionar la perspectiva del DCL se ha logrado un mayor refinamiento con la conformación de los 4 subtipos siguientes:
- -
DCL amnésico de dominio único. La única afectación cognitiva se relaciona con un déficit leve en las funciones mnésicas.
- -
DCL amnésico de dominio múltiple. Hay un déficit leve de la memoria y similar grado de afectación en otras áreas, como resolución de problemas o denominación de palabras.
- -
DCL no amnésico de dominio único. No existe déficit de memoria, pero sí hay evidencia de afectación leve y limitada a otra área cognitiva: funciones ejecutivas, capacidad visuoespacial o uso del lenguaje.
- -
DCL no amnésico de dominio múltiple. No existe déficit de memoria, pero están afectadas otras áreas cognitivas5,28,29.
En ocasiones el término DCL predemencia vascular se utiliza en lugar de DCV-no demencia5. Aunque la mayoría de los pacientes con diagnóstico de DCL evolucionan hacia la demencia, en algunos casos esto no ocurre28,110. El DCL puede ser transitorio y reversible (DCL inestable), o estacionario y con pocas variaciones en largos periodos de tiempo, o progresivo y convertirse en demencia sin un momento de transición claramente definido30,111,112. Los síntomas de DCL vascular pueden desaparecer debido a la influencia de otros procesos (por ejemplo, recuperación post-ictus).
Existen numerosos y discordantes informes sobre el riesgo que tienen los diferentes subtipos de DCL para convertirse en demencia, y sobre la utilidad de los subtipos de DCL en la predicción de las diferentes demencias113. En el estudio de Nordlund et al. se muestra que el rango de conversión para EA y demencia vascular (incluyendo la afectación multidominio) no difiere mucho. Solamente los pacientes con DCL y afectación de dominios múltiples evolucionaron a demencia, y los pacientes con afectación de un dominio parecieron tener un pronóstico más benigno112.
El rol de la enfermedad vascular en los pacientes con DCL ha sido examinado por un pequeño número de estudios longitudinales, y algunos resultados han sido contradictorios114. El estudio de Di Carlo et al. muestra que la hipertensión arterial y la insuficiencia cardiaca tienen una asociación consistente y significativa con los DCL multidominios. Por otro lado, el ictus previo fue un fuerte predictor de demencia, inclusive en individuos sin deterioro cognitivo acorde con la evaluación inicial de los investigadores106. La valoración de una muestra grande de pacientes con DCL reportó una asociación entre las HSB y la declinación cognitiva72. Además, el mismo grupo de investigadores informó de que las HSB están en relación con un riesgo aumentado de demencia vascular o mixta, pero no de EA115. Smith et al. encontraron que las HSB se asocian con el riesgo de progresión desde la función cognitiva normal hacia el DCL, pero no del DCL a la demencia116. Posiblemente en dichos resultados influye que el ictus y los factores de riesgo vasculares (especialmente la hipertensión arterial) pueden afectar la cognición en diferentes intervalos de tiempo desde el evento índice o primer diagnóstico de deterioro cognitivo. Además, se sugiere que la HSB que afecta la red fronto-parietal, pero no la frontal, contribuye de forma significativa al deterioro ejecutivo en el DCL117.
Recientemente se ha descrito que el grupo con DCL-vascular subcortical se maneja relativamente mejor en las tareas mediatas de reconocimiento y de memoria (verbal y visual) en comparación con los sujetos que tienen DCL-EA118. No obstante, se ha investigado escasamente la repercusión de ciertas formas específicas de enfermedad cerebrovascular (por ejemplo, microhemorragias) sobre la función cognitiva64. En el estudio de pacientes con DCL efectuado por Staekenborg et al. fue mayor la severidad de las HSB (periventriculares y profundas), y más frecuentes las «lagunas» en los ganglios basales y las microhemorragias en los pacientes que progresaron a demencia no-Alzheimer en comparación con los pacientes que no lo hicieron. También se encontró que las HSB profundas y periventriculares predicen la progresión hacia la demencia no-Alzheimer, pero las microhemorragias no mostraron un riesgo evidente114. Estos resultados indican que la combinación de biomarcadores con perfiles cognitivos más exactos y refinados puede servir como herramienta para el diagnóstico y pronóstico preciso del DCV.
ConclusionesLos principios para el diagnóstico del DCV han evolucionado, pero los criterios disponibles fueron diseñados básicamente para diferenciar la demencia vascular de la demencia tipo Alzheimer y para propósitos de investigación. No obstante, en la práctica clínica se requiere de la precisión de los siguientes elementos: 1) el diagnóstico clínico de la demencia y el DCL, 2) la identificación clínica y por neuroimagen de las diversas lesiones cerebrovasculares asociadas con la disfunción cognitiva, y 3) la formulación de una relación etiopatogénica entre el deterioro cognitivo y las lesiones cerebrovasculares. Para esto se sugiere estandarizar, por un grupo multidisciplinario de expertos, la nomenclatura y los criterios para el diagnóstico del espectro completo del DCV, y especialmente para la demencia vascular y sus categorías. Dicha clarificación conceptual tiene el potencial de facilitar la investigación epidemiológica y farmacológica de un problema de salud con una importancia creciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.