La cefalea con uso excesivo de medicación es una cefalea secundaria en la que el uso regular o frecuente de medicación analgésica produce un aumento de la frecuencia de una cefalea de base, pasando de episódica a crónica. La prevalencia de esta entidad está en torno al 1-2%, siendo más frecuente en mujeres entre 30 y 50 años con comorbilidades psiquiátricas como depresión o ansiedad y otros procesos de dolor crónico. Es importante conocer el manejo de esta entidad. Por este motivo, el Grupo de Estudios de Cefaleas de la Sociedad Española de Neurología ha pretendido realizar este documento de consenso sobre esta patología.
DesarrolloEsta guía ha sido redactada por un grupo de expertos a partir de la revisión de la evidencia científica publicada y estableciendo recomendaciones prácticas para su adecuado manejo y tratamiento. El tratamiento de la cefalea con uso excesivo de medicación tiene varios pilares fundamentales y suele ser complejo: información y educación sobre el desarrollo de la cefalea con uso excesivo de medicación, tratamiento preventivo, suspensión del fármaco de uso frecuente y tratamiento de deshabituación. Es importante el seguimiento de pacientes con riesgo de recurrencias.
ConclusionesEsperamos que este documento resulte de utilidad y permita su aplicación práctica en la consulta diaria y que sirva para actualizar y mejorar el conocimiento del manejo de esta patología.
Medication overuse headache is a secondary headache in which the regular or frequent use of analgesics can increase the frequency of the episodes, causing the transition from episodic to chronic headache. The prevalence of medication overuse headache is approximately 1-2%, with higher rates among women aged 30-50 years and with comorbid psychiatric disorders such as depression or anxiety, or other chronic pain disorders. It is important to be familiar with the management of this disease. To this end, the Spanish Society of Neurology's Headache Study Group has prepared a consensus document addressing this disorder.
DevelopmentThese guidelines were prepared by a group of neurologists specialising in headache after a systematic literature review and provides consensus recommendations on the proper management and treatment of medication overuse headache. The treatment of medication overuse headache is often complex, and is based on 4 fundamental pillars: education and information about the condition, preventive treatment, discontinuation of the drug being overused, and treatment for withdrawal symptoms. Follow-up of patients at risk of recurrence is important.
ConclusionsWe hope that this document will be useful in daily clinical practice and that it will update and improve understanding of medication overuse headache management.
Según la tercera edición de la Clasificación Internacional de Cefaleas (CIC-3)1, la cefalea por uso excesivo de medicación (CUEM) es un dolor de cabeza que acontece al menos 15 días al mes en pacientes que tienen una cefalea preexistente y que hacen un uso regular y excesivo de uno o varios fármacos sintomáticos durante al menos tres meses. La CIC-3 considera que la CUEM se desarrolla como consecuencia del uso excesivo de medicación y propone que, habitualmente, aunque no siempre, el cuadro se resuelve cuando el paciente interrumpe el abuso de dichos fármacos. La clasificación actual permite diagnosticar en un mismo paciente la CUEM y la cefalea preexistente, que en la mayor parte de los casos es una migraña o una cefalea tipo tensión. En el momento actual no existe un acuerdo unánime en la comunidad científica acerca de su abordaje y manejo terapéutico.
Desde el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología se ha elaborado este documento de consenso sobre la CUEM a partir de la revisión de la evidencia científica publicada y de nuestra experiencia clínica. Nuestro objetivo es realizar una actualización sobre esta entidad y establecer una serie de recomendaciones prácticas para su adecuado tratamiento.
Epidemiología y factores de riesgoEn una revisión sistemática que incluyó estudios de base poblacional realizados tras la publicación de la Clasificación Internacional de las Cefaleas del 20042, la prevalencia de la CUEM se situaba entre el 0,5% y el 7,2%3. Estas diferencias de estimación se podrían atribuir a cuestiones metodológicas o bien a las distintas situaciones geográficas en los que se llevaron a cabo. Entre los estudios incluidos, los que consideraron poblaciones más extensas fueron uno realizado en Suecia4, sobre una población de 50.000 sujetos, con una tasa estimada de prevalencia del 1,8% (2,5% en mujeres), y otro realizado en Noruega5, sobre 30.000 sujetos, con una prevalencia estimada del 1,7% (2,2% en mujeres). En nuestro país disponemos de un trabajo realizado sobre una población de casi 10.000 habitantes en Cantabria, que mostró una prevalencia del 1,4% (2,6% en mujeres)6. A partir de estos trabajos, podemos concluir que la CUEM afecta principalmente a sujetos entre los 30 y 50 años3 y que es más frecuente en las mujeres (ratio 4:1)7.
A pesar de que las tasas de prevalencia de la CUEM no son muy altas en la población general, este tipo de cefalea sí supone un problema importante en la atención especializada. De hecho, se ha calculado que la CUEM está presente en el 30-50% de los pacientes que acuden a unidades de cefaleas8.
En cuanto a los factores de riesgo de aparición de la CUEM, el más importante es el fármaco del que se hace un uso excesivo. Así, el número de días de consumo al mes necesario es de 15 en el caso de analgésicos no opiáceos o antinflamatorios y de 10 para los triptanes, ergóticos, analgésicos opiáceos o combinaciones de analgésicos1. En una revisión sistemática que analizó un total de 29 estudios, se apreció que el uso excesivo de opiáceos, barbitúricos o analgésicos combinados predisponen más al desarrollo de CUEM que el de triptanes o ergóticos8,9.
Otro de los factores que puede asociarse al riesgo de aparición de CUEM es el tipo de cefalea preexistente. Se ha comprobado que en la mayor parte de los casos se trata de una migraña6, siendo menos habitual la aparición de una CUEM en pacientes con cefalea tipo tensión o cefalea en racimos8.
Se ha analizado también con profundidad el aspecto psicológico. Así, la probabilidad de aparición de la CUEM en pacientes con cefalea primaria se ha relacionado con determinados perfiles de comportamiento que podrían predisponer al uso excesivo de medicación. Para detectarlos puede ser útil administrar una escala de dependencia en la que, brevemente, se indague si el paciente cree controlar el uso de analgésicos, y si este uso se asocia a ansiedad o preocupación10. También se ha evaluado si hay rasgos o trastornos de personalidad específicos que predispongan a la CUEM. En un estudio reciente se ha descrito que los pacientes con CUEM presentan comúnmente rasgos obsesivos o disfóricos de personalidad11.
Otros factores que se han asociado con la presencia de CUEM son el bajo nivel socioeconómico y cultural4, y la presencia de múltiples comorbilidades12.
En un estudio longitudinal se evaluó de forma prospectiva una población de más de 25.000 sujetos con cefalea episódica durante 11 años. Los autores identificaron como factores de riesgo para la incidencia de CUEM el uso de tranquilizantes, la combinación de síntomas musculoesqueléticos o de síntomas gastrointestinales, la presencia de ansiedad o depresión, el sedentarismo y el tabaquismo, además de la migraña frente a la cefalea sin características migrañosas. Como factores de riesgo no modificables, se señalaron la edad por debajo de 50 años, el género femenino, y un nivel educativo bajo13. En otro trabajo prospectivo, que incluyó 131 pacientes con migraña de un solo centro, se observó que la intensidad y frecuencia de la cefalea, así como la discapacidad asociada a la misma, eran factores predictores del desarrollo de CUEM. Sin embargo, ni los rasgos de personalidad ni los niveles de actividad física mostraron asociación con la incidencia de CUEM14.
Genética de la CUEMLa CUEM es una enfermedad compleja y, aunque varios datos epidemiológicos indicarían que se trata de una enfermedad con susceptibilidad genética, actualmente no tenemos evidencia científica ni estadística clara y definitiva de que esto sea así. Los estudios existentes son escasos, con muestras pequeñas y restringidos a pocos países (Italia y Japón fundamentalmente), y sus resultados, cuando han hallado asociación entre la CUEM y un polimorfismo, no han sido replicados. Los datos epidemiológicos que apoyan la participación de la genética en la génesis de la CUEM son:
- •
Los pacientes que no tienen predisposición a sufrir una cefalea primaria ni antecedentes familiares de migraña no tienen prácticamente riesgo de desarrollar una CUEM cuando hacen un uso excesivo de analgésicos por otras enfermedades15,16.
- •
El riesgo de desarrollar una CUEM es mayor en pacientes que presentan antecedentes familiares de CUEM o de uso excesivo de otras sustancias17. De hecho, la CUEM y la adicción a algunas drogas tiene similitudes fisiopatológicas. En ambas entidades se ha descrito una alteración en el circuito frontoestriatal que induce impulsividad, comportamientos compulsivos y adictivos, y alteración de los mecanismos de recompensa18.
- •
Aproximadamente, el 40% de los pacientes con CUEM que responden a la deshabituación recaen en un año de seguimiento19.
Hasta la fecha, se han publicado 17 estudios en humanos que han analizado 50 polimorfismos de 33 genes candidatos a una asociación con la CUEM. De ellos, 12 son estudios caso-control y cinco son series de casos, todos ellos realizados exclusivamente en población italiana o japonesa. No todos los estudios especifican qué cefalea primaria tenían los pacientes y en los criterios de selección está siempre presente el uso excesivo de triptanes, pero no el de analgésicos, AINE u opiáceos20.
Diez de los 17 estudios han encontrado asociación de alguno de los polimorfismos analizados con la CUEM. Concretamente, se han asociado 12 polimorfismos a la CUEM (tabla 1), que codifican, la mayoría de ellos, para sistemas dopaminérgicos o que se asocian a la dependencia de sustancias. En todos ellos el tamaño muestral es muy reducido. De los 17 estudios comentados, solo 7 incluyeron más de 100 pacientes. Por otra parte, es difícil saber cuántos pacientes se han sometido a los análisis, ya que los equipos de investigadores han utilizado las mismas muestras en diversos estudios. Estimamos que han sido analizados aproximadamente 1000 pacientes con CUEM, 300 con migraña episódica, 50 con migraña crónica y 600 controles sanos. Además, ninguno de los estudios ha sido replicado.
Polimorfismos de la cefalea con uso excesivo de medicación
| Sistema | Polimorfismo | Asociación |
|---|---|---|
| Vías de transmisión dopaminérgica | DRD2 (n=249), DRD4 (n=103), SLC6A3 (n=103), COMT (n=186) | Sí |
| DBH (n=227) | No | |
| Vías del péptido relacionado con el gen de la calcitonina (CGRP) | RAMP1 (n=130) | Sí |
| CALCA (n=130) | No | |
| Dependencia de sustancias | ACE (n=65), BDNF (n=356), WFS1 (n=82), HDAC3 (n=23) | Sí |
| OPRM1 (n=227), EEAT2 (n=227) | No | |
| Vías metabólicas: | CYP1A2 (n=75), MTHFR (n=22) | Sí |
| MAOA (n=200) | No | |
| Factor de necrosis tumoral-b (TNF-b): | TNF-b G252A (n=22) | Sí |
| Vías de estrés oxidativo | eNOS (n=118), GTPCH (n=22), GSTP1 (n=96), GSTM1 (n=96), GSTT1 (n=96), SOD2 (n=96), CAT (n=96), PONI (n=96), CYBA (n=96). | No |
| Vías de transmisión serotoninérgicas | 5HT1A (n=138), 5HT2A (n=365), 5HT1B (n=138), 5HT6 (n=138), SLC6A4 (n=694), GNB3 (n=75), TPH2 (n=22) | No |
ACE: angiotensin-converting enzyme: BDNF: brain-derived neurotrophic factor; CALCA: calcitonin related polypeptide alpha; CAT: catalase; COMT: catecol O-metiltransferasa; CYBA: Cytochrome B-245 Alpha Chain; CYP1A2: Cytochrome P450 1A2; DBH: dopamina β-hidroxilasa; DRD2: Dopamine Receptor D2; DRD4: Dopamine Receptor D4; EEAT2: excitatory amino acid transporter 2; eNOS: endotelial nitric oxide synthase; GNB3: G Protein Subunit Beta 3; GSTM1: glutathione S-transferase Mu 1; GSTP1: Glutathione S-transferase P 1; GSTT1: glutathione S-transferase theta 1; GTPCH: guanosine triphosphate ciclohidrolasa; HDAC3: histone deacetylase 3; 5HT1A: 5-hidroxitriptamina 1A; 5HT2A: 5-hidroxitriptamina 2A; 5HT1B: 5-hidroxitriptamina 1B; 5HT6: 5-hidroxitriptamina 6; MAOA: monoamine oxidase A; MTHFR: methylenetetrahydrofolate reductase; OPRM1: opioid receptor mu subunit 1; PONI: paraoxonase 1; RAMP1: Receptor activity modifying protein 1; SLC6A3: Solute Carrier Family 6 Member 3; SLC6A4: Solute Carrier Family 6 Member 4; SOD2: Superoxide dismutase 2; TPH2: Tryptophan hydroxylase 2; WFS1: Wolfram syndrome 1.
Finalmente, se ha realizado un único estudio fármaco-genómico con 33 pacientes con migraña crónica (19 con CUEM y 14 sin CUEM) para evaluar la respuesta al tratamiento de deshabituación21. El 57% de los pacientes presentaron un patrón único de expresión genómica asociado a la respuesta terapéutica, pero en diferentes tejidos y en múltiples vías metabólicas. Se encontraron asociaciones a genes SNARE (Soluble NSF Attachment Protein Receptor) o receptores de proteínas de fijación soluble de N-ethylmaleimide sensitive fusion proteins (NSF) de transporte vesicular, de apoptosis, de enfermedades neurodegenerativas, tejido adiposo, receptores linfocíticos, nicotinoides e insulinoides. Los autores argumentaron que esta variedad traduce la elevada complejidad de la CUEM.
No se han realizado estudios de ligamiento familiar ni se han utilizado las nuevas técnicas de GWAS (estudios de asociación de genoma completo) o de proteómica en el estudio genético de la CUEM.
Por todo lo dicho, podemos concluir que, actualmente, ninguno de los polimorfismos analizados ha mostrado una asociación clínicamente relevante con la CUEM. Se necesitan estudios cooperativos multicéntricos para conseguir grandes tamaños muestrales así como la aplicación de nuevas técnicas genéticas, epigenéticas y fármaco-genómicas.
Fisiopatología de la CUEMLa fisiopatología de la CUEM, como en tantas otras cefaleas, no es bien conocida. Por definición, el consumo de analgésicos juega un papel fundamental, si bien hay datos a favor de un componente genético que predispone a que determinados sujetos que padecían previamente una cefalea primaria desarrollen una conducta adictiva, consumiendo analgésicos de forma frecuente y continuada. El efecto final produce un aumento en la excitabilidad cortical y del sistema trigémino-vascular, favoreciendo los fenómenos de sensibilización periférica y central, similar a lo descrito en la migraña crónica22.
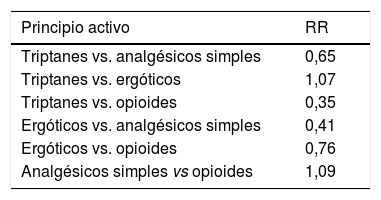
AnalgésicosLa experiencia clínica indica que cualquier analgésico puede llegar a producir una CUEM. La diferencia estriba en que, para ello, algunos precisan menos dosis y tiempo de exposición. En una revisión sistemática de la literatura que incluyó 29 estudios, se determinó el riesgo relativo basado en la prevalencia de desarrollo de CUEM según los subtipos de analgésicos consumidos9. En la tabla 2 se resumen las medias ponderadas del riesgo relativo ajustado de la CUEM con relación al consumo de diferentes analgésicos. Así, los resultados sugieren que el consumo de analgésicos combinados y opioides predispone con mayor facilidad a la CUEM que los triptanes y ergóticos, posiblemente por los diferentes mecanismos involucrados. Hay que tener en cuenta el fácil acceso a los analgésicos simples, frente al resto de fármacos que están sujetos a control, lo que permite su consumo ad libitum.
Estimación de las medias ponderadas del riesgo relativo ajustado de desarrollo de la cefalea con uso excesivo de medicación en relación al consumo de diferentes analgésicos4
| Principio activo | RR |
|---|---|
| Triptanes vs. analgésicos simples | 0,65 |
| Triptanes vs. ergóticos | 1,07 |
| Triptanes vs. opioides | 0,35 |
| Ergóticos vs. analgésicos simples | 0,41 |
| Ergóticos vs. opioides | 0,76 |
| Analgésicos simples vs opioides | 1,09 |
RR: riesgo relativo; vs: versus.
La CUEM presenta similitudes con el trastorno por consumo de sustancias. Muchos de estos pacientes desarrollan tolerancia a los analgésicos y presentan características propias de esta entidad, como son los síntomas por deshabituación, pérdida de control, uso de medicación en mayor cantidad o durante más tiempo del deseado, fracaso en el esfuerzo de reducir el consumo y una alta tasa de recidiva.
En un estudio noruego investigaron el grado de dependencia de analgésicos en la CUEM utilizando la Escala de Gravedad de Dependencia23. Para ello estudiaron 25 pacientes con CUEM, 15 con cefalea crónica sin abuso de medicación y 25 controles. Se siguieron los actuales criterios de la CIC1 y el Diagnostic and Statistical Manual of Mental Disorders IV (DSM-IV). El 62% de los pacientes con CUEM presentaban consumo excesivo de analgésicos simples y el 38% utilizaban analgésicos con acción central (codeína, opiáceos, triptanes). Un 50% de los pacientes con CUEM se pudieron diagnosticar según el DSM-IV de trastorno por consumo de sustancias. El consumo habitual de analgésicos con acción central y las puntuaciones más altas en la escala se asociaron con una mayor dependencia mientras que las puntuaciones más bajas lo hicieron con un mayor éxito en la deshabituación.
Sensibilización centralUno de los posibles mecanismos involucrados en la cronificación del dolor inducido por medicación es el fenómeno de sensibilización central. En estudios experimentales realizados en roedores se ha demostrado la capacidad de los analgésicos para producir un estado de hiperexcitabilidad del sistema de dolor. La exposición de ratones de laboratorio durante 7 días a analgésicos simples y triptanes produjo cambios persistentes en las fibras durales, incluyendo aumento en la expresión de péptido relacionado con el gen de la calcitonina (CGRP) y de la óxido nítrico-sintetasa24. Por otro lado, en los animales de laboratorio sensibilizados a triptanes, el estrés o la exposición a donantes de óxido nítrico facilitan la aparición de alodinia, el aumento de la expresión de c-FOS en el núcleo caudal del trigémino y de la concentración plasmática de CGRP y disminuyen el umbral para desencadenar la depresión cortical propagada25.
Por otra parte, en estudios electrofisiológicos realizados en pacientes con CUEM se ha demostrado hiperexcitabilidad neuronal con aumento en la respuesta a estímulos y déficit en la habituación utilizando diferentes modalidades (potenciales evocados corticales, somatosensoriales y potenciales evocados con láser de CO2). La hiperexcitabilidad del sistema de dolor es reversible una vez suspendido el consumo de analgésicos, aunque puede llevar hasta un año su normalización; de ahí la importancia de evitar la recidiva en estos pacientes26.
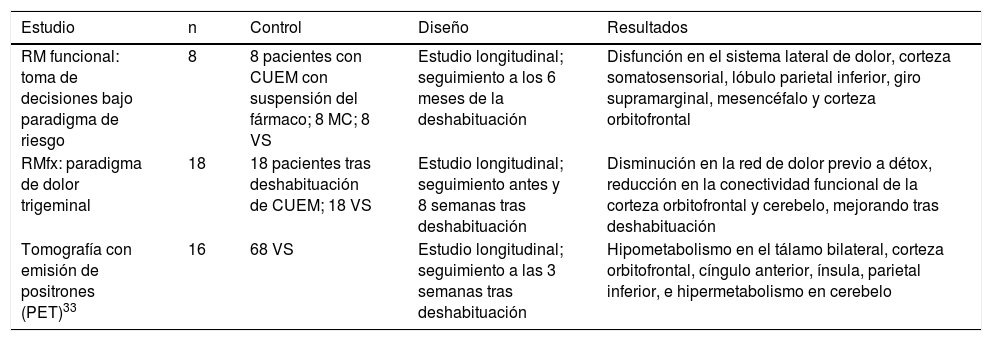
Neuroimagen en la CUEMLos estudios de neuroimagen han demostrado cambios tanto estructurales como funcionales en el cerebro de pacientes con CUEM22. Estos cambios afectan principalmente a las áreas de la red de dolor, sobre todo regiones involucradas en su discriminación, y en el procesamiento cognitivo, atencional y emocional (tabla 3). Si bien el diagnóstico de la CUEM es clínico, la neuroimagen puede ayudarnos a entender aspectos clave de la fisiopatología de la entidad. No obstante, los estudios son escasos, especialmente los que incluyen grupo control, y los resultados en ocasiones han sido contradictorios27.
Estudios con resonancia magnética funcional en la CUEM
| Estudio | n | Control | Diseño | Resultados |
|---|---|---|---|---|
| RM funcional: toma de decisiones bajo paradigma de riesgo | 8 | 8 pacientes con CUEM con suspensión del fármaco; 8 MC; 8 VS | Estudio longitudinal; seguimiento a los 6 meses de la deshabituación | Disfunción en el sistema lateral de dolor, corteza somatosensorial, lóbulo parietal inferior, giro supramarginal, mesencéfalo y corteza orbitofrontal |
| RMfx: paradigma de dolor trigeminal | 18 | 18 pacientes tras deshabituación de CUEM; 18 VS | Estudio longitudinal; seguimiento antes y 8 semanas tras deshabituación | Disminución en la red de dolor previo a détox, reducción en la conectividad funcional de la corteza orbitofrontal y cerebelo, mejorando tras deshabituación |
| Tomografía con emisión de positrones (PET)33 | 16 | 68 VS | Estudio longitudinal; seguimiento a las 3 semanas tras deshabituación | Hipometabolismo en el tálamo bilateral, corteza orbitofrontal, cíngulo anterior, ínsula, parietal inferior, e hipermetabolismo en cerebelo |
CUEM: cefalea por consumo de medicación; MC: migraña crónica; RMfx: resonancia magnética funcional; VS: voluntarios sanos.
En relación con los hallazgos a nivel anatómico28, se ha encontrado un menor volumen de sustancia gris (VSG) en estructuras que forman parte de la denominada matriz del dolor (córtex orbitofrontal, córtex cingulado anterior, ínsula y precuneus), y un mayor volumen a nivel de sustancia gris periacueductal, tálamo y núcleo estriado ventral. Los mismos autores29, un año después, relacionaron un menor VSG a nivel del córtex orbitofrontal en situación basal con una peor respuesta al tratamiento deshabituador. En estudios posteriores27, estos hallazgos no se han confirmado. No se han podido obtener datos concluyentes sobre posibles cambios del volumen de la sustancia blanca28.
Los datos procedentes de los estudios con resonancia magnética funcional en estado de reposo (resting-state) sugieren la existencia de alteraciones funcionales a nivel de las redes cerebrales implicadas en la modulación del dolor y la respuesta cognitivo-conductual al mismo (región orbitofrontal principalmente)30. A partir de la hipótesis de que la CUEM puede constituir un trastorno adictivo, y de que el sistema dopaminérgico mesocorticolímbico puede jugar un papel en su patogenia31, algunos trabajos se han centrado en el estudio de ambos núcleos accumbens (estriado ventral) y del putamen dorsal caudal y rostral (estriado dorsal). Sus resultados han permitido discriminar entre pacientes con y sin abuso de medicación. Parece, por tanto, que alteraciones de la conectividad de las estructuras que conforman el denominado sistema de recompensa y los diferentes patrones del núcleo estriado podrían tener un papel importante en el diagnóstico de esta entidad. En esa misma línea se sitúan los resultados de un estudio32 con RM funcional y tarea de toma de decisiones bajo un paradigma de riesgo.
Finalmente, en un estudio con tomografía de emisión de positrones realizado en pacientes con migraña crónica y uso excesivo de medicación emparejados con un grupo control, se detectó un hipometabolismo en tálamo, córtex orbitofrontal, córtex cingulado anterior, ínsula, estriado y lóbulo parietal inferior derecho, además de un hipermetabolismo en vermis cerebeloso. Transcurridas tres semanas desde la retirada de la medicación, persistía el hipometabolismo orbitofrontal33.
Como conclusión, en todos los estudios publicados hasta la fecha, los hallazgos en la neuroimagen de los pacientes con CUEM sugieren la existencia de alteraciones funcionales y estructurales en áreas implicadas en la modulación del dolor. Aunque no de forma consistente, estos cambios se han correlacionado con diversos parámetros clínicos como el tiempo de evolución de la situación de abuso, la frecuencia e intensidad de la cefalea y, en el caso del córtex orbitofrontal, con la respuesta al tratamiento deshabituador30. Estos hallazgos, sobre todo aquellos que afectan al VSG, son en su mayor parte reversibles, y deben considerarse más una consecuencia que un mecanismo etiológico de la enfermedad. Finalmente, el protagonismo de las áreas dopaminérgicas mesocorticolímbicas (estriado, área tegmental ventral, córtex orbitofrontal) es compatible con la hipótesis de la posible conducta adictiva que subyace en estos pacientes.
Clínica de la CUEMCriterios diagnósticos. Clasificación según tipo de fármacos de abuso.La CUEM se presenta en pacientes con antecedente de una cefalea primaria que, en el contexto de un consumo excesivo de medicación, desarrollan una nueva cefalea o un empeoramiento de la ya existente. Esta cefalea es una cefalea secundaria, concretamente del grupo 8 de la CIC (cefaleas relacionadas con exposición a sustancias o la supresión de las mismas). Sus criterios diagnósticos aparecen reflejados en la tabla 4.
Criterios diagnósticos de la cefalea con uso excesivo de medicación
| Cefalea con uso excesivo de medicación |
| Cefalea que ocurre 15 días/mes en un paciente con una cefalea preexistente |
| Uso excesivo y regular durante más de 3 meses de uno o más fármacos tomados como tratamiento sintomático de la cefalea |
| No atribuible a otro diagnóstico de la CIC-3 |
| Clasificación de la cefalea según el fármaco del que se hace un uso excesivo |
| Uso excesivo de ergóticos: cefalea que aparece 15 o más días al mes por consumo de ergóticos 10 o más días al mes durante más de 3 meses |
| Uso excesivo de triptanes: cefalea que aparece 15 o más días al mes por consumo de triptanes 10 o más días al mes durante más 3 meses |
| Uso excesivo de analgésicos no opioides: cefalea que aparece 15 o más días al mes por consumo de paracetamol, AINE, ácido acetilsalicílico u otros analgésicos no opioides 15 o más días al mes durante más de 3 meses |
| Uso excesivo de opioides: cefalea que aparece 15 o más días al mes por consumo de opioides 10 o más días al mes durante más 3 meses |
| Uso excesivo de analgésicos combinados: cefalea que aparece 15 o más días al mes por consumo de analgésicos en combinación 10 o más días al mes durante más 3 meses. Suelen ser analgésicos que combinan fármacos de grupos diferentes como paracetamol con codeína o la combinación de analgésico y adyuvantes como la cafeína |
| Uso excesivo de múltiples clases de analgésicos: cefalea que aparece 15 o más días al mes por consumo de ergóticos, triptanes, analgésicos no opioides u opioides 10 o más días al mes durante más 3 meses, sin abuso de ninguna categoría individual de fármacos |
| Uso excesivo de múltiples clases de analgésicos no especificados o no verificados: cefalea que aparece 15 o más días al mes por consumo de ergóticos, triptanes, analgésicos no opioides u opioides 10 o más días al mes durante más 3 meses (la dosis, tipo o patrón de uso no está establecido) |
| Uso excesivo de otra medicación: cefalea que aparece 15 días o más días al mes por consumo de analgésicos diferentes a los descritos, 10 o más días al mes durante más 3 meses |
AINE: antiinflamatorios no esteroideos; CIC: Clasificación Internacional de Cefaleas.
Dependiendo del fármaco del que se hace un uso excesivo, el cuadro clínico será diferente y la dosis y número de días necesarios para desarrollar una CUEM también. Así, para los triptanes es de 1,7 años, 2,7 años para los ergóticos y 4,8 para los analgésicos. La dosis necesaria por tratamiento para presentar una CUEM es menor en triptanes (18 dosis simples al mes), que con ergóticos (37 dosis simples al mes) o analgésicos (114 dosis simples al mes)7,34
Características clínicas de la CUEMEl diagnóstico de la CUEM se basa en la historia clínica y en la exploración física. La cefalea es diaria o casi diaria, resistente al tratamiento, y varía en intensidad, tipo y localización en el tiempo. Sus características dependen de la cefalea primaria. Cualquier esfuerzo físico o mental puede desencadenarla ya que el umbral al dolor suele ser bajo. Pueden observarse síntomas de abstinencia si se produce la retirada brusca de los analgésicos. La mejoría de la cefalea, una vez interrumpido el uso excesivo de medicación, tiene lugar varios días después. Cuando la migraña coexiste con la CUEM, su diagnóstico es más complejo34.
La CUEM puede asociar astenia, náuseas, síntomas gastrointestinales, irritabilidad, ansiedad, inquietud de extremidades, depresión, alteración de memoria y déficit de concentración. Además, se han descrito comorbilidades como depresión, hipertensión arterial y obesidad y, con menor frecuencia, alergias (16%), patología digestiva (6%) y enfermedades musculoesqueléticas12.
Los pacientes migrañosos que hacen un uso excesivo de triptanes suelen presentar una cefalea diaria de características migrañosas, unilateral, pulsátil, y manifestaciones autonómicas. Sin embargo, en ocasiones estos síntomas se pierden y el diagnóstico es más difícil34. El uso excesivo de ergóticos tiene unas características clínicas especiales. El paciente puede sufrir bradicardia o taquicardia, parestesias, síndrome de colon irritable, hipertensión arterial, mareo y debilidad de extremidades35.
Posibles complicaciones del uso excesivo de medicaciónEl uso excesivo de medicación puede conducir a diferentes tipos de complicaciones médicas. No es objetivo de esta revisión analizar todos los efectos adversos posibles que la medicación de rescate pudiera ocasionar; sin embargo, existen una serie de complicaciones específicas por el uso de algunos de estos fármacos que sí merecen una mención aparte, siendo los derivados de la ergotamina los que se asocian con más frecuencia a complicaciones de relevancia.
El uso continuado de ergóticos se ha relacionado con la aparición de neuropatías sensitivas, así como con un enlentecimiento del procesamiento cognitivo36 y con cambios estructurales y funcionales en los vasos cerebrales37. El empleo crónico de ergotamina también se ha relacionado con claudicación intermitente, acrocianosis, úlceras rectales, náuseas persistentes, cefalea de rebote, isquemia miocárdica y trastornos fibróticos (peritoneales, pleurales o miocárdicos), entre otras complicaciones.
En cuanto a la aparición de nefropatía, esta solo se ha relacionado claramente con el uso de analgésicos que contengan fenacetina, aunque el consumo agudo o en concomitancia con otros fármacos pueden potenciar el efecto nefrotóxico en ciertas circunstancias38. El uso crónico de AINE también se ha relacionado con gastritis crónica y malabsorción de algunos nutrientes, como vitamina B12, con las consiguientes complicaciones derivadas de su déficit. Mención aparte suponen las complicaciones producidas durante el síndrome de abstinencia, que serán tratadas en un epígrafe específico.
Por último, el uso continuado de triptanes se ha relacionado con el desarrollo de colitis isquémica39.
Consideraciones clínicas especiales en niños y adolescentesLa prevalencia de uso excesivo de medicación en niños y adolescentes se sitúa entre el 0,3 y 0,5%40, siendo los analgésicos combinados, muchas veces con cafeína, los más utilizados41. Parece existir un predominio femenino con una ratio aproximada de 4:1.
Los niños también se benefician de una terapia de deshabituación, aunque existen pocos datos sobre qué tratamiento podría ser más beneficioso en esta población. Algunos estudios muestran una reducción del 90% o más de la cefalea al mes de la deshabituación en al menos el 53% de los pacientes tratados en ese rango de edad, independientemente de que se inicie o no un preventivo42. El uso excesivo de medicación superior a dos años se ha identificado como un factor predictor de mal pronóstico en este grupo de edad.
Prevención y tratamiento de la CUEMComo hemos visto, la CUEM es común, no solo, pero especialmente, en pacientes con migraña. El tratamiento es complejo, y requiere un planteamiento integral del paciente. Sus hábitos y estilo de vida, la presencia de otras enfermedades, el tratamiento habitual y los aspectos psicoafectivos son piezas clave.
Prevención de la CUEMEn la prevención primaria juegan un papel importante las autoridades sanitarias, quienes, con campañas como la publicada por la Agencia Española de Medicamentos y Productos sanitarios (AEMPS) el 21/02/201743, llaman la atención sobre el incremento del uso de opioides. La Atención Primaria y las oficinas de farmacia son quienes mejor pueden identificar a los pacientes con cefaleas primarias que están en riesgo de desarrollar CUEM y realizar labores de prevención primaria, con control de los consumos de analgésicos, triptanes, ergóticos (estos últimos dispensados sin receta), tranquilizantes y opiáceos. En nuestro país, el tramadol se utiliza para cualquier tipo de dolor, también para la migraña y la cefalea tensional, y su consumo, en combinación con paracetamol, casi se ha triplicado en el periodo 2008-201529.
La educación sobre el empleo correcto de estos fármacos debe iniciarse ya en Atención Primaria con la concienciación del paciente sobre el uso excesivo de medicación, el registro de los días de cefalea en un diario que incluya el consumo de medicación aguda, la prescripción de aquellos fármacos recomendados en las guías de práctica clínica para el tratamiento de la migraña y otras cefaleas y la derivación temprana si aumenta la frecuencia de cefaleas a atención especializada.
Sería útil el desarrollo de campañas, como las establecidas para el tabaco, con mensajes de advertencia del riesgo de CUEM por el consumo excesivo de medicación analgésica. Una campaña danesa que alcanzó a más del 10% de la población mostró un significativo incremento del conocimiento de la CUEM (del 31 al 38%)44.
Tratamiento de la CUEMEl abordaje terapéutico de la CUEM se sustenta en los siguientes pilares:
- •
Información y educación del paciente sobre el mecanismo de desarrollo de la CUEM.
- •
Tratamiento preventivo farmacológico y no farmacológico.
- •
Deshabituación y suspensión de aquellos fármacos de los que se hace un uso excesivo.
- •
Seguimiento del paciente con riesgo de recurrencia.
Estas aproximaciones terapéuticas no son exclusivas y en general en la práctica clínica se combinan. La supresión del fármaco suele precisar además un tratamiento de los síntomas de deshabituación que se tratará en el siguiente apartado de este documento.
Información y educaciónEl paciente debe ser informado sobre el mecanismo de la CUEM y sobre los fármacos implicados en su caso en el desarrollo de la misma. Debemos aconsejar sobre la idoneidad de disminuir el consumo de medicación aguda para la cefalea (menos de 15 días al mes para analgésicos simples y AINE y menos de 10 días al mes para el resto), disuadir del uso anticipatorio de medicación, evitar la prescripción de fármacos de mayor riesgo como los ergóticos, opiáceos y combinaciones fijas de analgésicos y promover el uso de diarios para monitorizar su cefalea y el uso de medicación.
El tratamiento de la CUEM se basa en la suspensión del fármaco responsable. Se debe informar al paciente sobre el posible desarrollo de la denominada cefalea de rebote y sus síntomas y convencer de que el uso excesivo de fármacos puede ser clave en la perpetuación de su cefalea45.
En un estudio italiano se vio que el simple asesoramiento o consejo de supresión del fármaco inductor de CUEM en pacientes sin comorbilidad y bajos requerimientos médicos fue tan efectivo como los programas de deshabituación ambulatorios o con ingreso46 con una tasa de éxito de más del 70% a los 2 meses. En cambio, en un estudio posterior del mismo grupo47 realizado en pacientes con formas más complicadas de CUEM (recurrentes, abuso de opiáceos o barbitúricos, comorbilidades, problemas psicológicos o fracasos previos en el tratamiento) la deshabituación hospitalaria fue más efectiva (87% de éxito a los dos meses, frente al 60% obtenido en los otros dos grupos).
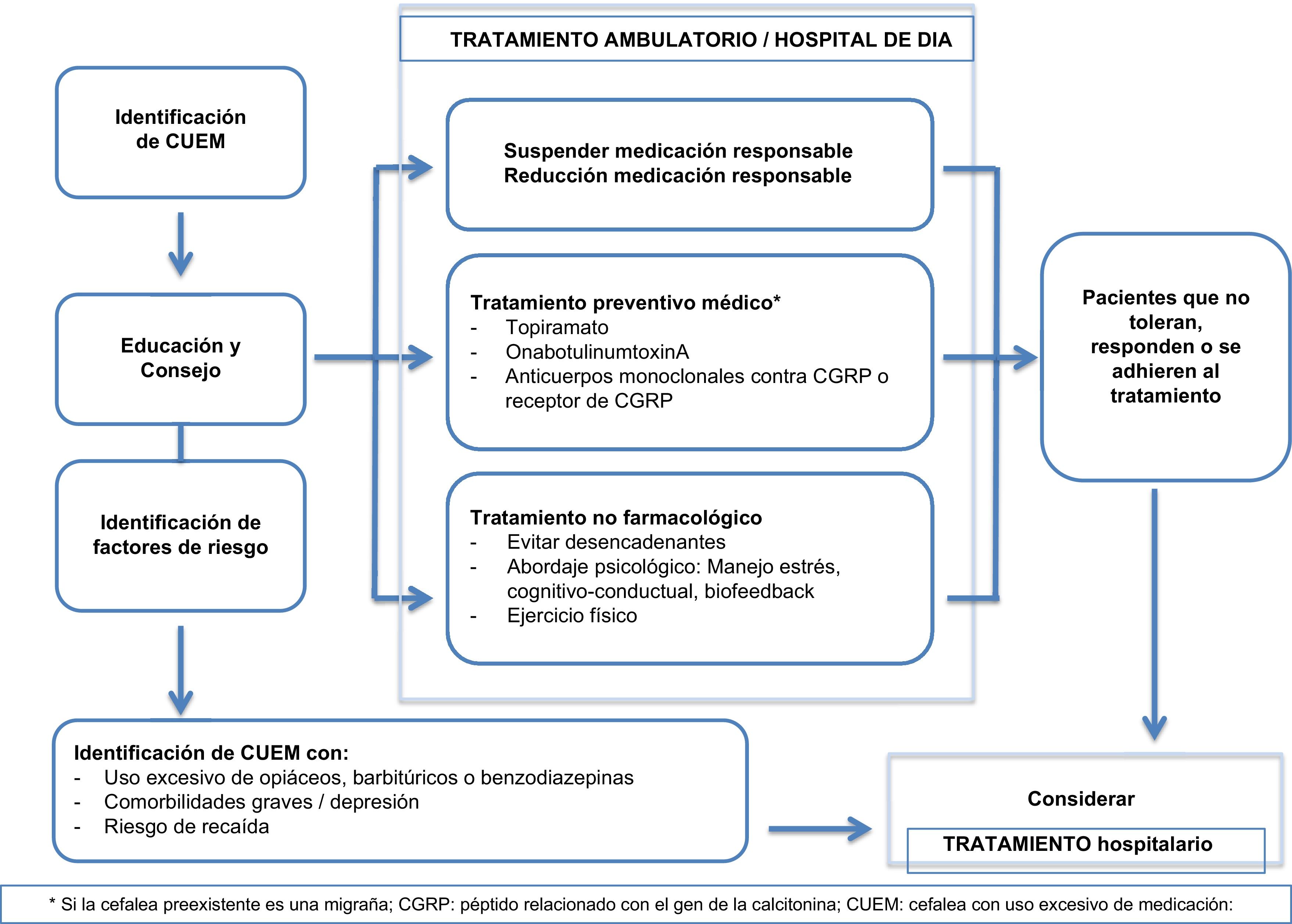
El éxito de la información y consejo sobre la CUEM se ha constatado en otros trabajos48, por lo que esta medida debe establecerse en la práctica clínica diaria ya desde Atención Primaria. Los pacientes más complejos, con uso excesivo de varios fármacos, recurrencia, o comorbilidad psiquiátrica grave, deben ser manejados en unidades o consultas monográficas de cefalea35. Cuando el paciente hace un uso excesivo de opioides o barbitúricos, existen comorbilidades médicas o psiquiátricas que requieren un abordaje más complejo, o han fracasado al menos dos intentos de deshabituación ambulatoria, se debe plantear el ingreso hospitalario (fig. 1).
Tratamiento preventivo no farmacológico y farmacológicoEl tratamiento no farmacológico se basa en terapias conductuales centradas en biofeedback, estrategias para una mejor gestión del estrés y ejercicio físico regular, entre otras22.
El topiramato49, la onabotulinumtoxinA (OnabotA)50–52 y los anticuerpos monoclonales contra el péptido relacionado con el gen de la calcitonina (CGRP) (erenumab, fremanezumab y galcanezumab)53–55 han demostrado ser eficaces en el tratamiento de la migraña crónica asociada al uso excesivo de medicación, en varios ensayos clínicos, sin una deshabituación previa. Sin embargo, la evidencia de su eficacia proviene de análisis post hoc. En estudios posteriores con los dos primeros no se ha confirmado este efecto56,57. Otros fármacos, como ácido valproico, cannabinoides y pregabalina, la estimulación del nervio occipital mayor, y la acupuntura se han evaluado en ensayos de escasa potencia y defectuosa metodología, por lo que no aportan información de calidad58.
En el único ensayo aleatorizado que ha comparado el tratamiento preventivo desde el inicio sin deshabituación previa, la deshabituación sin prevención inicial y un grupo control, el grupo de pacientes tratados con preventivo desde el principio tuvo menos días de cefalea y menos días de migraña al mes, alcanzándose una reducción significativa del 50% en el número de días de cefalea en el 53% de los pacientes59. Por otro lado, en la revisión sistemática de Chiang et al. se concluye que la combinación de tratamiento preventivo y discontinuación temprana del fármaco inductor de la CUEM obtuvo mejores resultados que esta última de forma aislada58.
Deshabituación y suspensión de aquellos fármacos de los que se hace un uso excesivoLa retirada del fármaco puede acompañarse de sintomatología por deshabituación, cuya duración es variable dependiendo del tipo de fármaco (más breve con triptanes en comparación con los derivados de la ergotamina, AINE u opioides)60. Habitualmente no se prolonga más de dos semanas. El síntoma por deshabituación más común es el empeoramiento de la cefalea, pero con frecuencia los pacientes pueden presentan también náuseas, vómitos, trastornos del sueño, y ansiedad61,62.
Tratamiento de la cefalea por deshabituaciónExisten diferentes estrategias para el tratamiento de la cefalea asociada a la deshabituación de analgésicos que se centran en evitar el fármaco del que se hace un uso excesivo61,62.
Tradicionalmente se consideró que algunos fármacos como los esteroides, neurolépticos, valproato sódico y antidepresivos tricíclicos podrían reducir los síntomas por deshabituación, aunque esta afirmación no está claramente sustentada por ensayos controlados frente a placebo61,62.
EsteroidesEn estudios abiertos se ha observado que la utilización de prednisona parece facilitar la suspensión de los analgésicos al mejorar los síntomas por deshabituación sin apenas efectos secundarios63,64. También un pequeño estudio controlado frente a placebo mostró un efecto beneficioso de la prednisona por vía oral65, que, sin embargo, no se ha podido confirmar en un estudio posterior66,67.
NeurolépticosLa utilización de neurolépticos como la proclorperazina intravenosa se consideró un tratamiento potencialmente eficaz a partir de un estudio retrospectivo no controlado que incluyó 135 pacientes con cefalea crónica diaria que, en un porcentaje elevado, asociaban CUEM68. Sin embargo, las dosis de proclorperazina fueron muy variables y muchos de los pacientes fueron tratados simultáneamente con fármacos preventivos, por lo que no es posible establecer la eficacia de esta terapia.
Valproato sódicoEl valproato intravenoso se ha utilizado en series cortas de pacientes con CUEM, con una dosis de carga de 15mg/kg durante 30 min y dosis de mantenimiento posterior a razón de 5mg/kg en 15 min, cada 8 h, durante 12 a 48 h. Su eficacia ha sido discreta en el tratamiento de la cefalea por deshabituación69. Aporta la ventaja de que, en casos seleccionados se puede continuar administrado por vía oral como tratamiento preventivo de la migraña.
Otros fármacosAlgunos autores sugieren que podría utilizarse naproxeno 550mg70 o sumatriptán71,72, administrados durante varios días, para reducir la cefalea por deshabituación, aunque el uso de estas terapias tampoco está sustentado por series de casos, no por estudios controlados frente a placebo.
Tratamiento de otros síntomas por deshabituaciónLos AINE podrían mejorar tanto la cefalea como los otros síntomas asociados a la deshabituación. En una serie de 22 pacientes se estudió el efecto del naproxeno como tratamiento de la deshabituación tras la suspensión hospitalaria de ergotamina70. Diez pacientes recibieron medicación sintomática (antieméticos, analgésicos e hidratación), mientras que 12 pacientes fueron tratados con naproxeno (500mg dos veces al día). Al octavo día de suspender el uso de ergotamina, los que tomaron naproxeno tuvieron menos dolor, náuseas, vómitos e inquietud.A partir de los resultados de estudios abiertos se ha propuesto que la utilización de hidratación intravenosa, y el uso combinado de dexametasona, metoclopramida y benzodiazepinas durante un periodo de 7 a 15 días podría ser beneficioso para el control de estos síntomas73. También se ha sugerido que la utilización de amitriptilina74 o el uso de clomipramina intravenosa75 podrían ser útiles teniendo en cuenta su efecto sedante y modulador del dolor.
Seguimiento del paciente con riesgo de recurrenciaLa CUEM tiene un índice de recurrencia elevado, que oscila entre el 25-35% (especialmente en pacientes con rasgos depresivos), ya que la suspensión o la disminución de la medicación pueden reducir la frecuencia de la cefalea primaria, pero no la curan. Por ello, los pacientes deben ser evaluados de forma periódica. El seguimiento regular tras el tratamiento reduce el riesgo de recaída22.
ConclusionesTras la revisión de la evidencia publicada, y basándonos en nuestra práctica clínica habitual, nuestras recomendaciones para el tratamiento de la CUEM y de los síntomas por deshabituación son:
- -
Vigilar el uso de fármacos sintomáticos no recomendados para el tratamiento de pacientes con cefalea, sobre todo ergóticos, opiáceos y combinaciones de fármacos. Los AINE rara vez condicionan una CUEM y el manejo del uso excesivo de triptanes es generalmente más sencillo.
- -
La suspensión del fármaco del que se hace un uso excesivo es clave, pero aún parece más importante, a la luz de los estudios recientes comentados, el inicio de un adecuado tratamiento preventivo, especialmente si la cefalea primaria es una migraña: topiramato, OnabotA o anticuerpos monoclonales contra el CGRP (receptor o ligando).
- -
Las terapias no farmacológicas como la conductual, una mejor gestión del estrés y el ejercicio físico regular pueden ayudar en el manejo de esta entidad.
- -
Es recomendable que el tratamiento de la CUEM se lleve a cabo en unidades o consultas monográficas de cefaleas.
- -
Si bien es preferible la deshabituación ambulatoria, en determinados casos (abuso de opiáceos, barbitúricos, recurrencias o comorbilidad que así lo requiera) es necesario el ingreso hospitalario.
Los autores declaran no tener ningún conflicto de intereses.