La enfermedad de Alzheimer (EA) es una patología neurodegenerativa caracterizada por demencia de carácter progresivo asociada a una perdida global de funciones cognitivas.
MétodosSe realizó una síntesis de evidencia a través de una revisión sistemática con metaanálisis de ensayos clínicos que hayan evaluado la suplementación de omega-3 en pacientes con EA.
ObjetivoDeterminar si existe evidencia científica que avale la efectividad de la suplementación omega-3 en la mejoría de la función cognitiva de pacientes con EA.
Estrategia de búsquedaLa estrategia de búsqueda incluyó solo ensayos clínicos aleatorizados (ECA). Las bases de datos usadas fueron: Medline, Cochrane Central, Cinahl y Lilacs. Además, se realizó una búsqueda electrónica en Google Scholar.
Selección de estudiosSe obtuvieron 6 artículos que cumplían con nuestros criterios de elegibilidad. Se evaluó el riesgo de sesgo según el método Cochrane.
ConclusiónNo hay evidencia consistente que avale la suplementación de omega-3 versus placebo en la mejoría de la función cognitiva de pacientes con EA a corto y mediano plazo.
Alzheimer disease (AD) is a neurodegenerative disease characterised by progressive dementia associated with global cognitive dysfunction.
MethodsWe conducted a systematic review and meta-analysis of clinical trials evaluating omega-3 supplementation in patients with AD.
ObjectiveTo determine if there is scientific evidence of the effectiveness of omega-3 supplementation in improving cognitive function in patients with AD.
Search strategyWe included only randomised controlled trials (RCTs) from the following databases: Medline, Cochrane Central, Cinahl, and LILACS. An electronic search was also conducted using Google Scholar.
Study selectionSix articles met the eligibility criteria. The risk of bias was assessed following the Cochrane method.
ConclusionThere is no consistent evidence to support the effectiveness of omega-3 supplementation in improving cognitive function in AD patients in the short and medium term.
La enfermedad de Alzheimer (EA) es una patología neurodegenerativa de origen multifactorial, que se caracteriza por desarrollar una demencia progresiva asociada a una pérdida global de las funciones cognitivas1. Es una condición clínica que ha aumentado considerablemente, sobre todo en aquellos países donde se ha incrementado la expectativa de vida. La población menor de 60 años presenta una prevalencia menor de un 1%, que incrementa sobre un 40% en los mayores de 85 años2. La probabilidad de que se manifieste esta enfermedad en la vida de un individuo está condicionada por factores genéticos y/o ambientales que interaccionan durante el envejecimiento3; siendo la edad, el sexo y el polimorfismo de la apolipoproteína E los factores de riesgo no modificables más relevantes2,4,5. Factores socioeconómicos como el nivel educacional, factores conductuales como el consumo de alcohol, tabaco y el nivel de actividad física; y factores nutricionales como el consumo de cafeína, antioxidantes y de ácidos grasos constituyen los principales factores de riesgo y/o protección modificables para el desarrollo de la EA2,6,7.
Varios estudios han establecido la relación entre dieta y deterioro cognitivo asociado a la EA8-11. Entre los factores nutricionales que más influyen en su incidencia destaca el bajo consumo de pescados grasos. Con base en esto, ha sido posible establecer la hipótesis de que un bajo consumo de pescado graso se asocia a un mayor riesgo de desarrollar este déficit cognitivo12,13.
Los ácidos grasos omega-3 son una familia de los ácidos grasos polinsaturados. Este es considerado un ácido graso esencial, puesto que lo necesitamos para el desarrollo básico del cuerpo, pero nuestro organismo no cuenta con las enzimas necesarias para poder sintetizarlo14. Los derivados del omega-3 tipo ácido docohexaenoico (DHA) se encuentran principalmente en los alimentos de origen marino, como algas, moluscos, crustáceos y peces grasos de aguas profundas15. Una vez proporcionado por la dieta, el omega-3 precursor es metabolizado a DHA o ácido eicosapentaenoico (EPA) principalmente en el hígado y, en menor medida, en el endotelio cerebral o en los astrocitos, desde donde se exporta hacia las neuronas16. El DHA se incorpora a los fosfolípidos de las membranas neuronales otorgándole propiedades estructurales y físico-químicas esenciales para su funcionamiento sináptico17. Por lo tanto, una alta concentración de DHA les otorga mayor fluidez a las membranas plasmáticas, facilitando el transporte de neurotransmisores18. Es por esto que en la actualidad el DHA es considerado como factor relevante en la prevención y/o el tratamiento de enfermedades neurodegenerativas19. Experimentalmente se ha observado que el aporte de DHA protege a las neuronas del estrés oxidativo, especialmente en la conservación de la organización de los microtúbulos del citoesqueleto20. Varios estudios han demostrado que un aumento en la suplementación de DHA favorece la maduración y el desarrollo neuronal, específicamente en las células del hipocampo, incrementando de esta forma la función sináptica21-23.
A pesar de los resultados de los estudios experimentales, las revisiones sistemáticas (RS) solamente han reportado resultados en relación con el efecto del omega-3 y el riesgo de desarrollar la EA12,24-26. Mazereeuw et al.24 concluyeron que la suplementación con omega-3 produce una mejoría de la función cognitiva en pacientes con deterioro cognitivo sin demencia, pero estos efectos no se observaron en pacientes con EA. Wu et al.25 concluyeron que una mayor ingesta de pescado se asoció a un menor riesgo de desarrollo de EA, sin embargo, no hubo evidencia de una asociación similar entre la ingesta de ácidos grasos omega-3 como suplemento y el riesgo de desarrollar demencia o EA. Zhang et al.12 concluyeron que la ingesta de DHA se asoció a un menor riesgo de demencia y EA, pero sin una relación lineal dosis-respuesta. Burckhardt et al.26 no encontraron evidencia convincente en relación con la eficacia de la suplementación de omega-3 en el tratamiento de pacientes con EA medio y moderado. Por el contrario, un metaanálisis realizado en modelos animales mostró que la suplementación con omega-3 en el largo plazo sí produce una mejora de la función cognitiva1.
De acuerdo con lo anteriormente expuesto, surge nuestra pregunta clínica: ¿es efectiva la suplementación con omega-3 en comparación con placebo para la mejoría de la función cognitiva en pacientes con EA?
ObjetivoDeterminar si existe evidencia científica que avale la efectividad de la suplementación omega-3 en la función cognitiva en pacientes con EA.
Materiales y métodosLa RS fue realizada bajo la normativa internacional PRISMA para RS y metaanálisis27. Cabe consignar que no se registró el protocolo metodológico previo a la realización de la presente revisión.
Criterios de elegibilidadPara la realización de la presente RS se desarrolló una estrategia de búsqueda en la cual se incluyeron los siguientes criterios de elegibilidad: 1) estudios clínicos aleatorizados (ECA); 2) en pacientes con diagnóstico de EA, sin distinción de género y raza; 3) la intervención estudiada debe ser suplementación oral de omega-3 y sus derivados comparados con placebo, y 4) artículos publicados en inglés o español hasta el 31 de marzo del 2017.
Fuentes de informaciónSe realizó una búsqueda electrónica en las siguientes bases de datos: MEDLINE (http://www.ncbi.nlm.nih.qov/pubmed [consultado el 31 de marzo del 2017]), CENTRAL (http://www.cochrane.org/ [consultado el 31 de marzo del 2017]), LILACS (www.bases.bireme [consultado el 31 de marzo del 2017]) y CINAHL (http://search.ebscohost.com [consultado el 31 de marzo del 2017]); también se revisaron otras fuentes de búsqueda, como Google Scholar (https://scholar.google.cl/).
Estrategias de búsquedaPara llevar a cabo la búsqueda en la base de datos Medline, se utilizó la estrategia de búsqueda sensible propuesta por la colaboración Cochrane28. Los términos de búsqueda de nuestra revisión, fueron obtenidos de los MeSH, a través de PubMed siendo algunos de ellos, Alzheimer, omega-3, entre otros. A continuación, se describe el proceso:
- 1.
Alzheimer Disease.
- 2.
Omega3 Fatty.
- 3.
Fatty Acids.
- 4.
Fatty Acids omega3.
- 5.
(#2) OR (#3) OR (#4).
- 6.
(#1) AND (#5).
- 7.
Randomized Clinical trial.
- 8.
Clinical trial.
- 9.
(#7) OR (#8).
- 10.
Humans.
- 11.
Animals
- 12.
(#10) NOT (#11).
- 13.
(#6) AND (#9) AND (#12).
Para las restantes bases de datos, Central, Cinahl, Lilacs y Google Scholar, se realizó la estrategia de búsqueda combinando los términos mencionados previamente en la opción de búsqueda avanzada.
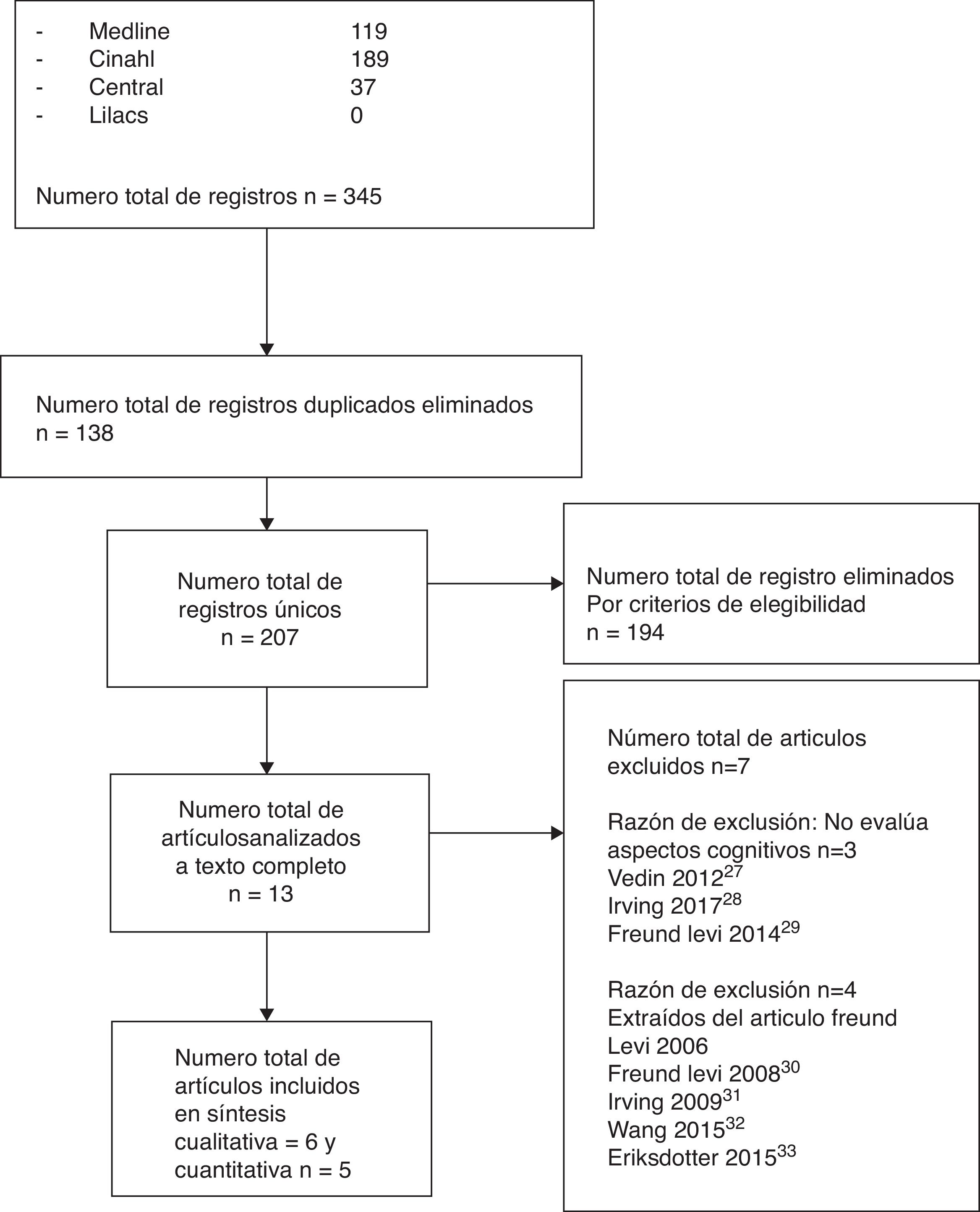
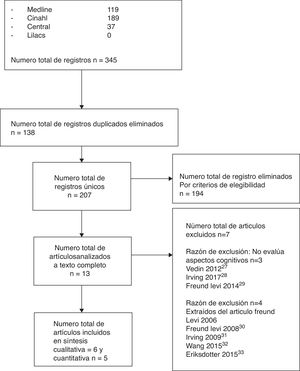
Selección de los estudiosTres de los autores (FA, HG, AB) realizaron la cadena de búsqueda en forma independiente; al eliminar los artículos duplicados, la búsqueda preliminar arrojó un total de 207 estudios; al aplicar el primer filtro se eliminaron 194 artículos que no cumplían nuestros criterios de elegibilidad.
Criterios de selecciónA los 13 artículos seleccionados se les aplicó un segundo filtro, realizando una lectura crítica al texto completo, donde fueron evaluados según los siguientes criterios:
Criterios de inclusión- –
ECA que evalúen la efectividad de la suplementación oral de ácidos grasos omega-3 y sus derivados, como DHA y EPA, que se comparen con placebo.
- –
ECA que evalúen las diferentes dimensiones de la función cognitiva tales como: memoria, deterioro cognitivo, praxia, habilidades del lenguaje, etc.
- –
ECA que incluyan pacientes con deterioros cognitivos secundarios a otras patologías, que no sean EA.
El proceso de extracción de datos fue realizado por 3 evaluadores de forma independiente (FA, MP, LF), quienes ocuparon un formulario estandarizado para recopilar la información de los ECA; en caso de desacuerdo y/o discrepancia los autores acordaron previamente incorporar el artículo y someterlo al análisis de un asesor independiente (CO) para decidir mediante discusión y consenso su inclusión final.
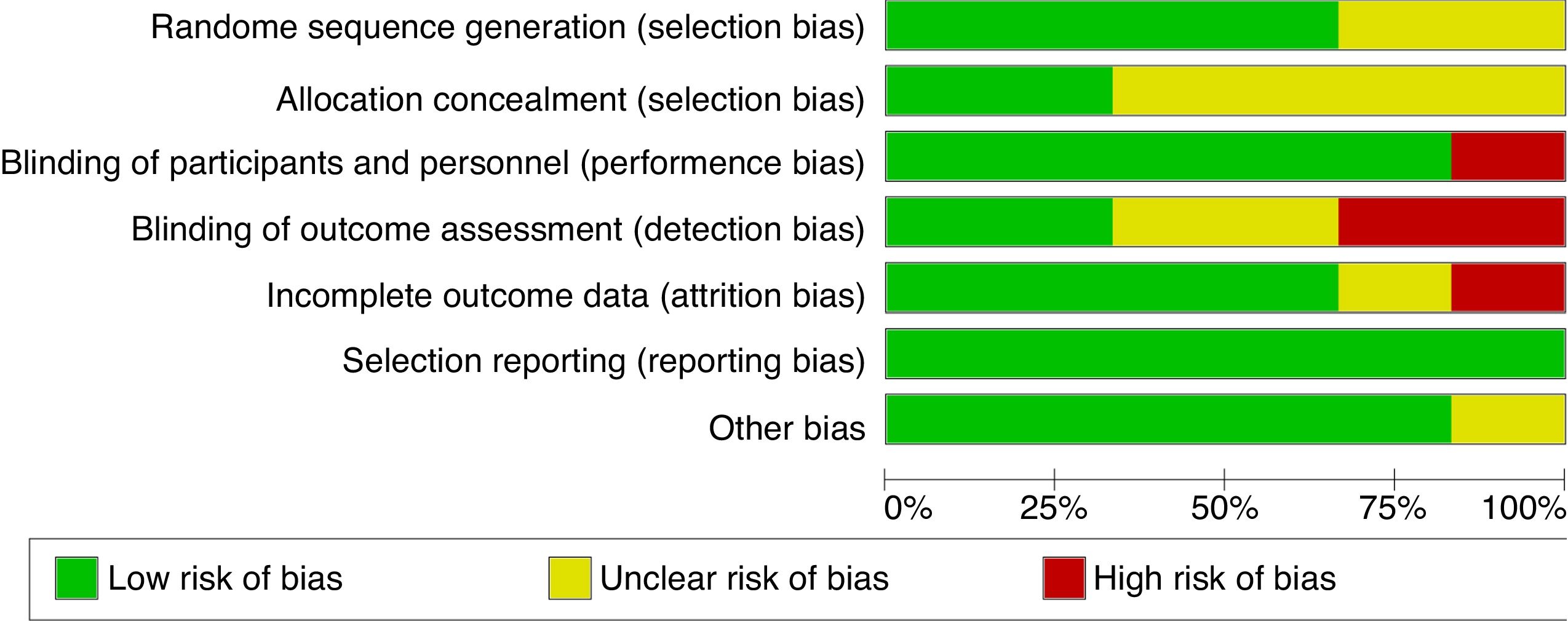
Riesgo de sesgo de los estudios individualesLa evaluación del riesgo de sesgo de los estudios individuales se realizó como recomienda el Manual de la Colaboración Cochrane28. Los estudios incluidos en nuestra revisión fueron evaluados cualitativamente y los resultados se expresaron en una figura especificando si cumple el criterio (color verde: bajo riesgo de sesgo), no lo cumple (rojo: alto riesgo de sesgo) o es poco claro (amarillo: riesgo incierto/poco claro/falta información para dar una sentencia). Los 7 criterios a evaluar son: generación de la secuencia aleatoria; ocultamiento de la secuencia de aleatorización; cegamiento de los participantes y del personal; cegamiento de la evaluación de los resultados; datos de resultados incompletos; notificación selectiva de los resultados y otros sesgos.
Síntesis de resultadosPara el análisis y síntesis de datos se utilizó el programa Rev-Man 5. Las medidas de resultados fueron analizadas como variables continuas; usando el modelo de efecto aleatorio, los estimadores puntuales ocupados para variables continuas fue la diferencia de medias (DM) estandarizadas (DME) y DM, con sus respectivos intervalos de confianza del 95% (IC). Los resultados de los artículos solo se pueden combinar para llegar a un estimador puntual cuando son homogéneos, para esto se evaluó la heterogeneidad estadística con la prueba estadística de chi al cuadrado y el test de heterogeneidad I2. Consideramos admisible realizar el metaanálisis cuando los análisis de los datos mostraban baja heterogeneidad, con un valor de chi al cuadrado con un p>0,1 y el test I2 con un valor menor o igual a un 40%.
ResultadosSelección de los estudiosCobre la base de los criterios de elegibilidad de nuestra RS, se seleccionaron 13 artículos y al aplicar los criterios de selección finalmente quedaron 6 estudios incluidos19,29-33. La figura 1 muestra el diagrama de flujo de las fases de la RS y la causa de exclusión de los otros 7 estudios34-40.
Características de los estudiosDe acuerdo con los criterios de nuestra revisión, la búsqueda preliminar identificó 345 artículos potencialmente elegibles, al aplicar los criterios de elegibilidad y de selección, quedaron finalmente 6 artículos19,29-33. Considerando los 6 estudios seleccionados, el número total de pacientes fue 758, el promedio de pacientes por estudio es de 142, el rango de edad de los pacientes estaba entre los 67 y 76,7 años, con un promedio de 71,8 años. El resumen de las características clínicas, metodológicas y los resultados de los artículos incluidos individuales se encuentran en la tabla 1.
Características de los artículos incluidos
| Autor/año | Características pacientes | Intervención | Seguimiento/medidas de resultado | Resultados |
|---|---|---|---|---|
| Kotani et al., 200633 | Pacientes con disfunción cognitiva leve (subgrupo con EA sin demencia)MDA: no menciona método de aleatorizaciónn=21 pacientes totalGE: n=8Edad: 67 años (DE 6,3)GC: n=9Edad: 69,7 años (DE 5,2) | GE: 6 cápsulas diarias, con una dosis total de 240mg de ARA y DHA, durante 90 díasGC: 6 cápsulas diarias, con una dosis total de 240mg aceite de oliva, durante 90 días | Seguimiento a los 90 díasMedidas de resultado:5 dominios de la función cognitiva según el RBANS− Memoria inmediata− Visuo-espacial y construccional− Lenguaje− Atención– Memoria tardía | Para ninguno de los dominios de la función cognitiva evaluados a los 90 días hubo diferencias significativas entre el GE comparado con el GC (p>0,05) |
| Freund-Levi et al., 200632 | Pacientes con EA leve a moderada en tto. con inhibidores de la AChE por lo menos 3 mesesMDA: aleatorización en bloque generado por ordenador, se ocultó usando sobres selladosn=174 pacientesGE: n=89Edad: 72,6 años (DE 9)GC: n=85Edad: 72,9 años(DE 8,6) | GE: 4 cápsulas diarias, con una dosis total de 1,7 g de DHA y 0,6 g de EPA, durante un año, además se agregó vitamina E por 4mgGC: 4 cápsulas diarias de aceite de maíz como placebo (incluye 0,6 g de ácido linoleico), durante 6 meses y después del 6.° mes se le dio el mismo tto. que el GE. Además, se agregó vitamina E en 4mg | Seguimiento a los 6 y 12 mesesMedidas de resultado:Función cognitiva− MMSE− ADAS-COGFunción global− CDR− Presión arterial– Tolerancia | Para la función cognitiva al 6.° y al 12.° mes, en el análisis total no hubo diferencias significativas entre el GE comparado con el GC (p>0,05)Al realizar un análisis por subgrupos, solo los pacientes con EA muy leve (MMSE > 27 ptos.) presentan diferencias significativas en el MMSE (p<0,05) comparado con el GC |
| Chiu et al., 200831 | Pacientes con EA leve a moderadaMDA: no menciona método de aleatorizaciónn=46 pacientesGE: n=24Edad: 74 años (70,1-77,8)GC: n=22Edad: 76,5 años (71,8-81,1) | GE: 3 cápsulas 2 veces al día, con una dosis total de un g de EPA y 0,7 de DHA, durante 24 semanasGC: 3 cápsulas 2 veces al día con ésteres de aceite de oliva, durante 24 semanas | Seguimiento a 24 semanasMedidas de resultado:− CIBIC-plus− ADAS-COG− MMSE− HDRS− Adherencia– Efectos adversos | Para la función cognitiva, a la 6.ª, 12.ª, 18.ª y 24.ª semana, no hubo diferencias significativas entre el GE comparado con el GC (p>0,05)Al realizar un análisis por subgrupos, solo los pacientes con EA leve presentan diferencias significativas en el ADAS-COG (p=0,03) comparado con el GC |
| Quinn et al., 201030 | Pacientes con EA leve a moderada en tto. con inhibidores de la AChE por lo menos 3 mesesMDA: aleatorización en bloque generado por ordenador centraln=402 pacientesGE: n=238Edad: 76 años (DE 9,3)GC: n=164Edad: 76 años (DE 7,8) | GE: 2 cápsulas diarias, con una dosis total de 2 gr de DHA, durante 18 mesesGC: 2 cápsulas diarias de aceite de maíz y de soya como placebo, durante 18 meses | Seguimiento a los 6, 12 y 18 mesesMedidas de resultado:Función cognitiva:− ADAS-COG− CDR− MMSEActividades de la vida diaria:− ADAS-ADL− NPICalidad de vida:− QLADSEfectos adversos | Para la función cognitiva, a los 6, 12 y 18 meses, no hubo diferencias significativas entre el GE comparado con el GCAl finalizar el tto. las diferencias para:− ADAS-COG (p=0,41)− CDR (p=0,68)− MMSE (p=0,88)− ADAS-ADL (p=0,38)– NPI (p=0,11) |
| Shinto et al., 201419 | Pacientes con EA leve a moderadaMDA: aleatorización en bloque generado por ordenador centraln=39 pacientesGE1: n=13Edad: 75,9 años (DE 8,1)GE2: n=13Edad: 76,7 años (DE 10,6)GC: n=13Edad: 75,2 años(DE 10,8) | GE1: 3 cápsulas diarias con una dosis total de 675mg de DHA y 975mg de EPA durante un añoGE2: una tableta de 600mg/día de LA más 3 cápsulas diarias con una dosis total de 675mg de DHA y 975mg de EPA durante un añoGC: 3 cápsulas diarias de excipientes como placebo, durante un año | Seguimiento a los 6 y 12 mesesMedidas de resultado:Función cognitiva:− ADAS-COG− MMSEActividades de la vida diaria:− ADAS-ADLBiomarcadores de estrés oxidativoEfectos adversos | Para la función cognitiva a los 12 meses, las diferencias fueron:− En el ADAS-COG entre GC y GE1 (p=0,86); entre GC y GE2 (p=0,98)– En el MMSE entre GC y GE1 (p=0,80), pero entre el GC y GE2 (p<0,01) |
| Phillips et al., 201529 | Pacientes con EA y deterioro cognitivo sin demencia, todos los pacientes fueron tratados con inhibidores de la AChEMDA: no menciona método de aleatorizaciónN = 76 pacientesGE: n=37Edad: 71,1 años(DE 8,6)GC: n=39Edad: 71,1 años(DE 9,5) | GE: una dosis total de 600mg de EPA y 625mg de DHA diarios, durante 4 mesesGC: aceite de oliva como placebo, durante 4 meses | Seguimiento al 1.er y 4.° mesMedidas de resultado:− MMSE− Memoria verbal inmediata− Memoria verbal tardía− Memoria verbal de reconocimiento− Estado anímico | Para la función cognitiva al 1.er y 4.° mes, no hubo diferencias significativas entre el GE comparado con el GCAl finalizar el tto., las diferencias para:− MMSE (0,576)− Memoria verbal inmediata (p=0,499)− Memoria verbal tardía (p=0,463)− Memoria verbal de reconocimiento (p=0,463)− Estado anímico (p=0,548) |
AChE: acetilcolinesterasa; ADAS-COG: ítem cognitivo de la escala de evaluación de la enfermedad de Alzheimer; ARA: ácido araquidónico; CDR: escala clínica de demencia; CIBIC-plus: impresión del cambio a través de una entrevista clínica; DE: desviación estándar; DHA: ácido docohexaenoico; EA: enfermedad de Alzheimer; EPA: ácido eicosapentaenoico; GC: grupo control; GE: grupo experimental; HDRS: escala de depresión de Hamilton; LA: ácido alfalipoico; MDA: método de aleatorización; MMSE: Minimental State Examination; NPI: inventario neuropsiquiátrico; QLADS: escala de calidad de vida de la enfermedad de Alzheimer; RBANS: batería para evaluar el estado neurofisiológico.
La evaluación del riesgo de sesgo realizado por los autores fue de manera independiente para cada uno de los artículos incluidos (figs. 2 y 3). Cabe consignar que la mayoría de los estudios incluidos reportaba cómo se habían realizado la aleatorización y el ocultamiento de esta, salvo los estudios de Kotani et al.33 y Phillips et al.29, quienes no dejaban en claro este aspecto metodológico, limitando su validez interna. Con respecto a la aplicación de ciego para de pacientes y tratantes, la mayoría de los estudios fueron calificados como bajo riesgo de sesgo, excepto Kotani et al.33, que no proporcionaban esta información. Con respecto al cegamiento de evaluadores, los artículos de Kotani et al33 y Phillips et al.29 no contemplaban el ciego de los analistas de datos, y los estudios de Quinn et al.30 y Freund-Levi et al.32 no proporcionaban información para tomar una decisión con respecto a este punto, aspecto que es primordial para no sobreestimar o subestimar los resultados de las variables de estudio. Si bien es cierto que la mayoría de los estudios presentan pérdidas de pacientes durante el tiempo de tratamiento y/o seguimiento, ellos contemplaron la estrategia metodológica de análisis por intención de tratar para prevenir el sesgo de desgaste. Solo en el ECA de Chiu et al.31 no se llevó a cabo este análisis. Ninguno de los estudios tiene inscrito el protocolo de investigación en algún sistema de registro existente en la actualidad. Según esto, se hace muy difícil poder establecer si hubo un reporte selectivo de medidas de resultados. Sin embargo, en los informes publicados se incluyen todos los resultados previstos y todos los estudios se encontraban libres de otras fuentes de sesgo.
Medidas de resultados de los estudiosLas medidas de resultados para evaluar la función cognitiva más comúnmente ocupadas en los ECA fueron; el deterioro cognitivo con Mini-mental State Examination (MMSE), la disfunción cognitiva con ADAS-COG, el nivel de demencia con Clinical Dementia Rating (CDR) y evaluación neurosiquiatrica con el cuestionario NPI.
Síntesis de los resultadosDe acuerdo con el análisis de los datos, 6 estudios cumplieron con los criterios de elegibilidad de nuestra RS19,29-33. Al analizar la efectividad, en la mejoría de algún aspecto de la función cognitiva en pacientes con EA, cuando se realizó una suplementación oral de DHA más EPA comparado con placebo, solo 5 de ellos estaban en condiciones de agruparse sobre la base de un estimador puntual19,29-32.
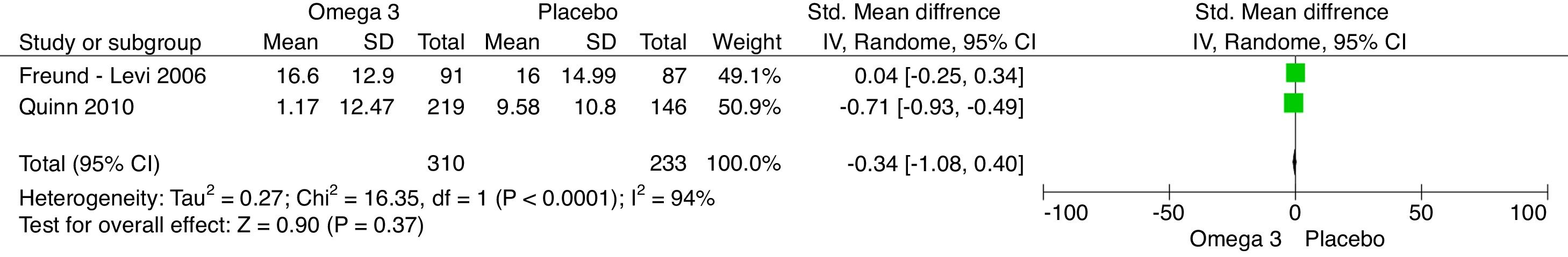
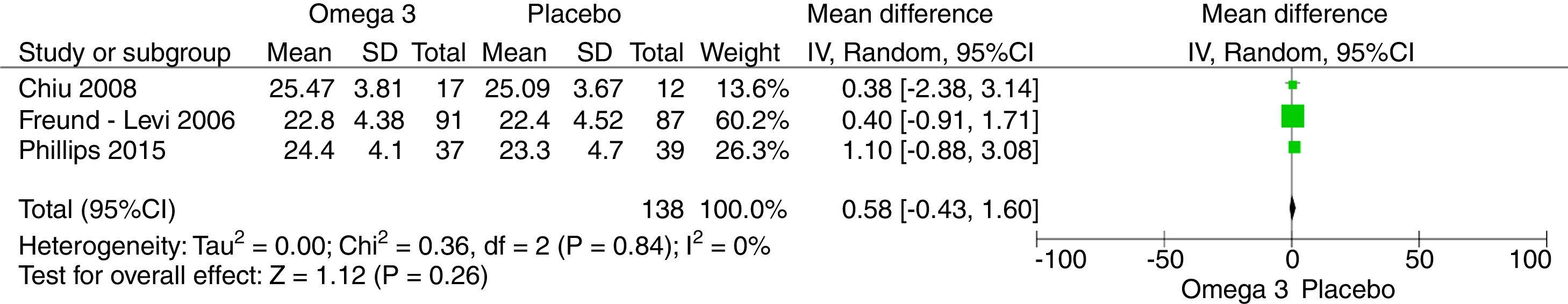
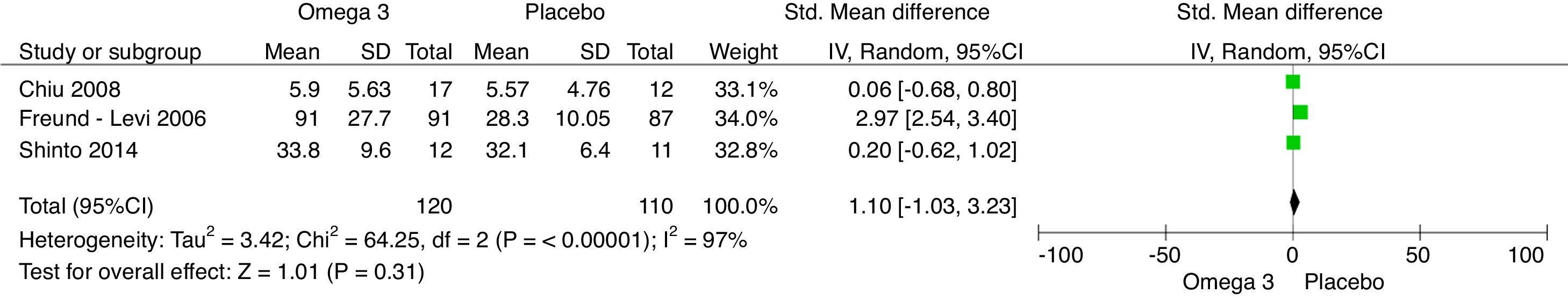
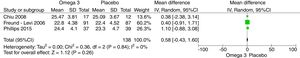
Los resultados del metaanálisis son: para la comparación de suplementación de omega-3 vs. placebo con el cuestionario NPI al 6.° mes es –0,34 (IC –1,08, 0,40; p=0,37) (fig. 4). Para la comparación de suplementación de omega-3 vs. placebo al 6.° mes con el MMSE fue 0,58 (IC –0,43, 1,60; p=0,26) (fig. 5). Para la comparación de suplementación de omega-3 vs. placebo al 6.° mes con la escala de evaluación cognitiva ADAS-COG fue 1,10 (IC –1,03, 3,23; p=0,31) (fig. 6).
Se intentó determinar la efectividad en la mejoría de la función cognitiva, comparando la suplementación oral de omega-3 con placebo, en pacientes con EA. Para esto, se realizó una síntesis de la evidencia disponible a través de una RS de ECA, donde se seleccionaron 6 artículos que cumplían con nuestros criterios de elegibilidad y se consideró factible realizar un metaanálisis con 5 de los estudios seleccionados. A pesar de que algunos estudios epidemiológicos mencionan que el consumo de pescados ricos en ácidos grasos omega-3 reduce el riesgo de deterioro cognitivo12,25, las RS que han estudiado el efecto de la suplementación con omega-3 en pacientes con EA concluyen que solo logra mejorar algunos aspectos de la función cognitiva en pacientes con deterioro cognitivo sin demencia, los cuales no pueden extrapolarse a pacientes con EA24-26. Estos hallazgos son concordantes con los resultados de nuestra RS.
Existen diversos factores que podrían explicar los resultados obtenidos. Uno de ellos es la variabilidad respecto a la dosis de DHA o DHA/EPA indicadas, las cuales variaron entre 240mg/día a los 2,3g/día, sumado a la variabilidad en tiempos de administración del suplemento que variaron desde los 90 días a un año y medio en los estudios clínicos. Un segundo factor es la razón DHA/EPA indicada. Estos aspectos dificultan que los resultados puedan compararse entre sí y extrapolarse a la población general. Otro factor que no fue considerado en ninguno de los estudios seleccionados fue la polifarmacia asociada a las patologías de base que presentan la mayoría de los adultos mayores, lo que puede tornarse en un impedimento para que la absorción de la suplementación sea exitosa, debido a la interacción del suplemento con algún fármaco41,42.
Un cuarto factor a considerar debe ser el tipo de dieta que lleva cada paciente. Se ha demostrado, por ejemplo en modelos animales, que una dieta alta en azúcares simples podría interferir con los beneficios reportados de los omega-343. Una dieta alta en fibra y quelantes alimentarios puede interferir con la correcta absorción de lípidos desde la luz intestinal, mientras que la ingesta del suplemento junto con alimentos de origen animal podría ser un factor favorecedor.
En cuanto al mecanismo de acción, el consumo de ácidos grasos omega-3, especialmente DHA, tiene efectos beneficiosos en el control del proceso inflamatorio39. Modula la respuesta inflamatoria modificando la fluidez y la composición de la membrana celular, debido a que tiene un efecto directo sobre la función de los receptores y conductabilidad de los canales iónicos implicados en la activación inmunitaria44. Estudios recientes han demostrado que una deficiencia en la producción de mediadores antiinflamatorios tienen un papel importante en la disminución cognitiva de los pacientes con EA39,45-47. La evidencia epidemiológica indica que existe un período crítico de 2 o más años antes de la aparición de la demencia, en donde hay un incremento de los mediadores proinflamatorios en el cerebro que podría afectar a la progresión de la EA32,48. Debido a lo señalado anteriormente, autores como Freund-Levi et al.32 indican que la suplementación de omega-3 tendría efectos beneficiosos en la prevención o la atenuación de la progresión de la enfermedad y no en el tratamiento de la misma cuando se ha manifestado la demencia.
Con respecto a los efectos adversos y considerando las características de la intervención estudiada, solo los estudios de Chiu et al.31 y Quinn et al.30 reportaron estos eventos en relación con la terapia, dividiéndolos en severos y no severos. Dentro de los eventos severos se encontraban la hospitalización, la trombosis venosa profunda y la muerte; y dentro de los no severos y con mayor frecuencia, reportaron: diarrea, estreñimiento, síntomas gastrointestinales e infección del tracto urinario. Ningunos de los 2 estudios reportó diferencias estadísticamente significativas con respecto a los eventos adversos, por lo que ellos consideran que la suplementación con omega-3 es una intervención segura.
Con respecto a las limitaciones de la RS, se puede considerar el no uso de literatura gris; esta consiste en la información biomédica no indizada en las bases de datos; sin embargo, es necesaria para la búsqueda de los estudios incluidos. Esto se considera un sesgo de publicación y se debe tomar en cuenta, ya que existe la probabilidad de que haya estudios que pueden haber quedado fuera de la revisión por problemas de indización. Por último, se agradece a los autores de la revisión por prestar información al desarrollo de esta investigación.
ConclusiónSegún los resultados arrojados por los estudios incluidos en nuestra RS, no hay evidencia consistente que avale la suplementación de omega-3 en la mejoría de la función cognitiva en pacientes con EA a corto y mediano plazo.
Conflicto de interesesNo declarados.