Las alteraciones de la marcha están presentes en un alto porcentaje en los pacientes con esclerosis múltiple (EM); aparece desde estadios iniciales pudiendo limitar la realización de las actividades básicas de la vida diaria y afectando a su calidad de vida. El entrenamiento en bicicleta con retroalimentación visual se presenta como una herramienta útil en el tratamiento de estas alteraciones. El objetivo del presente estudio es valorar el efecto a corto plazo del entrenamiento en bicicleta con retroalimentación visual sobre las alteraciones de la marcha en pacientes con EM.
Material y métodosSesenta y un pacientes con EM con afectación leve-moderada, distribuidos aleatoriamente en un grupo control y un grupo experimental participaron en el estudio. El grupo experimental fue sometido a entrenamiento con bicicleta con biofeedback visual (sistema MOTOmed Viva2) un día en semana durante 3 meses y un programa domiciliario de ejercicios. El grupo control tuvo solo el programa domiciliario de ejercicios. Valoración mediante el sistema de análisis de marcha GAITRite® Walkway de ambos grupos, pre, al mes y postintervención.
ResultadosResultados estadísticamente significativos en el parámetro FAP del grupo experimental entre el pre y al mes (p=0,014) y el pre y postintervención (p=0,002). Mejoró significativamente la diferencia de la longitud de paso del grupo experimental entre el pre y post (p=0,001) y entre el mes y el postintervención (p=0,004).
ConclusionesEl tratamiento con la bicicleta mejoró a corto plazo determinados parámetros de la marcha, pudiéndose mostrar como opción terapéutica en la reeducación de la marcha en pacientes con EM.
Gait alterations are present in a high percentage of patients with multiple sclerosis (MS). They appear from early stages of the disease and can limit patients’ capacity to perform basic activities of daily living, affecting their quality of life. Visual biofeedback cycling training appears to be a useful tool in treating these impairments. This study aims to evaluate the short-term effect of visual biofeedback cycling training on gait in patients with MS.
Material and methodsA total of 61 patients with mild to moderate MS were randomly assigned to a control group and an intervention group. The intervention group received visual biofeedback cycling training (MOTOmed viva2 system) once per week for 3 months, and a home exercise program. The control group only received the home exercise program. Both groups were evaluated using the GAITRite® Walkway gait assessment system before the intervention, during the first month of the programme, and after the intervention.
ResultsIn the intervention group, the analysis revealed statistically significant differences between Functional Ambulation Profile (FAP) scores before and during the intervention (P=.014), and before and after the intervention (P=.002). A statistically significant improvement was observed in step length in the intervention group between pre- and post-intervention scores (P=.001) and between first-month and post-intervention scores (P=.004).
ConclusionsVisual biofeedback cycling training improved specific gait parameters in the short term and appears to be a therapeutic option for gait retraining in patients with MS.
La esclerosis múltiple (EM) es una enfermedad degenerativa, inflamatoria y autoinmune que afecta al sistema nervioso central (SNC). Las alteraciones motoras son las más frecuentes, con un 90-95% de prevalencia, seguidas de sensitivas, con un 77%, y las cerebelosas en un 75%. También puede aparecer afectación del tronco cerebral, del control y alteraciones cognitivas y visuales. Sin embargo, no se puede predecir su evolución1.
Es la causa no traumática más común de discapacidad neurológica entre las personas jóvenes y de mediana edad2, afectando a 2,5 millones de la población europea1.
Un alto porcentaje (75%) de pacientes con EM refieren alteraciones en la marcha3, las cuales pueden limitar la realización de las actividades básicas de la vida diaria (ABVD) y afectar a la calidad de vida de los sujetos4.
Una de las pruebas funcionales más comunes en neurología para la evaluación de los pacientes con EM, es el Timed 25-Foot Walk (T25FW) y la escala EDSS expanded disability status scale (EDSS), siendo la herramienta que se utiliza con mayor frecuencia para evaluar la gravedad de la EM5. Mide la discapacidad mediante un examen neurológico cuantitativo, con puntuación de 0 (ninguna discapacidad) a 10 (muerte debido a la EM)6. Esta puntuación se obtiene a partir de 8 escalas funcionales que incluye los siguientes sistemas: piramidal (motor), sensorial, cerebeloso, tronco cerebral, visuales, mentales, esfínteres y otras.
En sujetos con EDSS ≥ 4 la de ambulación se encuentra seriamente comprometida: utilizan más ayudas técnicas, aparecen más desajustes posturales y mayor gasto energético7.
Estudios recientes han descrito con precisión los parámetros espacio-temporales de la marcha, según el déficit neurológico en personas con EM mostrando una reducción de la velocidad, cadencia, longitud del paso y un incremento en el tiempo del paso8.
El pedaleo comparte un patrón cinemático similar a la marcha, ya que ambas tareas son cíclicas, requieren de flexo-extensión recíproco de cadera, rodilla y tobillo, y tienen una activación alternante de agonistas y antagonistas de manera sincronizada y coordinada9.
El entrenamiento en bicicleta con biofeedback visual ha demostrado efectos positivos en patologías neurológicas en las que la deambulación es asimétrica y se hace un uso excesivo del hemicuerpo menos afectado10. En pacientes con ictus se ha comprobado mejoría en la simetría del paso y la mejor distribución de las cargas, ya que el paciente, gracias al feedback visual, es capaz de ajustar el movimiento bilateral de ambos MMII por ellos mismos y la distribución de la carga durante la marcha. Eso llevó también a un aumento de la velocidad de la marcha, pero aún no hay estudios que propongan su utilización en pacientes con EM10.
En otro estudio se ha demostrado también que el entrenamiento en bicicleta con biofeedback mejora el control muscular y la activación muscular, no encontrando en los pacientes ningún efecto adverso11.
Otros autores indican que hay un efecto a nivel del generador central de patrones (GCP), que es el que produce los movimientos de flexión y extensión del MMII durante la marcha. Este puede ser regulado por estímulos sensoriales externos y este respondería al feedback visual proporcionado en el panel de la bicicleta durante el entrenamiento12.
El tratamiento mediante bicicleta con feedback visual parece ser beneficioso en personas con una mayor asimetría del MMII y marcha ineficiente. También en los casos que hagan sobreúso de la pierna sana aumentando la asimetría13.
La hipótesis fue que el tratamiento mediante bicicleta con feedback visual durante 3 meses induciría mejoría no solo en el pedaleo, sino en diferentes aspectos de la marcha del paciente de EM.
El propósito principal de este estudio es investigar la eficacia de un programa de neurofisioterapia que incluye un programa de retroalimentación en bicicleta, en la mejora de la marcha en pacientes de EM. Se va a valorar la influencia de este programa en la asimetría del paso, el perfil funcional de ambulación (FAP), la velocidad y la cadencia en la marcha de pacientes de EM, mediante el sistema GAITRite® (The GAITRite Electronic Walkway CIR Systems, Inc. United States).
Pacientes y métodosSujetosLos sujetos del estudio fueron reclutados de la Unidad de Esclerosis Múltiple del Hospital Universitario Virgen Macarena. Los pacientes fueron seleccionados sobre la base de su orden de ingreso en la Unidad, si bien se emplearon los siguientes criterios.
Los criterios de inclusión fueron: 1) paciente derivado por un neurólogo de la Unidad de Esclerosis Múltiple del Hospital Universitario Virgen Macarena; 2) diagnóstico confirmado de EM con 2 años de antigüedad basado en los criterios de McDonals; 3) EDSS establecida por un neurólogo ≤ 7; 4) edad comprendida entre 20 y 70 años; 5) estabilidad médica durante los 3 meses antes del reclutamiento para el estudio; 6) ausencia de daños cognitivos de acuerdo con el test de Minimental; 7) firma del consentimiento informado, y 8) paciente con una EDSS: 2 ≤ 6,5. Los criterios de exclusión fueron: 1) pacientes con comorbilidad grave diferente de la EM que puede representar algún riesgo vital su movilización o atención en el servicio de neurofisioterapia biofuncional; 2) pacientes con algún trastorno médico o psicológico que pudiera limitar su capacidad para entender y/o contestar las preguntas y cumplimentar los cuestionarios; 3) presentar un brote de la enfermedad el tercer mes antes de comenzar el tratamiento o durante el proceso de intervención, y 4) presentar defectos visuales.
De un total de 70 sujetos inicialmente seleccionados, fueron incluidos 61 en el estudio, de los que 25 son varones y 36 mujeres. Se distribuyeron aleatoriamente, de manera que 30 quedaron asignados al grupo experimental y 31 al control.
El protocolo de investigación fue revisado y aprobado por el Comité de Ética de la investigación del centro Hospital Universitario Virgen Macarena (C.P.-C.I. 1896). Todos los participantes firmaron el consentimiento informado antes de realizar su participación en el estudio.
DiseñoSe trata de un ensayo clínico aleatorizado (ECA) con un evaluador ciego. Los pacientes fueron aleatoriamente distribuidos (el método usado para generar la secuencia es MAS Version 2.1 @Glazo Wellcome) a un grupo experimental (n=30) o a un grupo control (n=31). Durante el tiempo de intervención ninguno de los sujetos recibió otros tratamientos de fisioterapia. Todas las valoraciones fueron realizadas por un investigador ciego con respecto a los grupos de estudio establecidos.
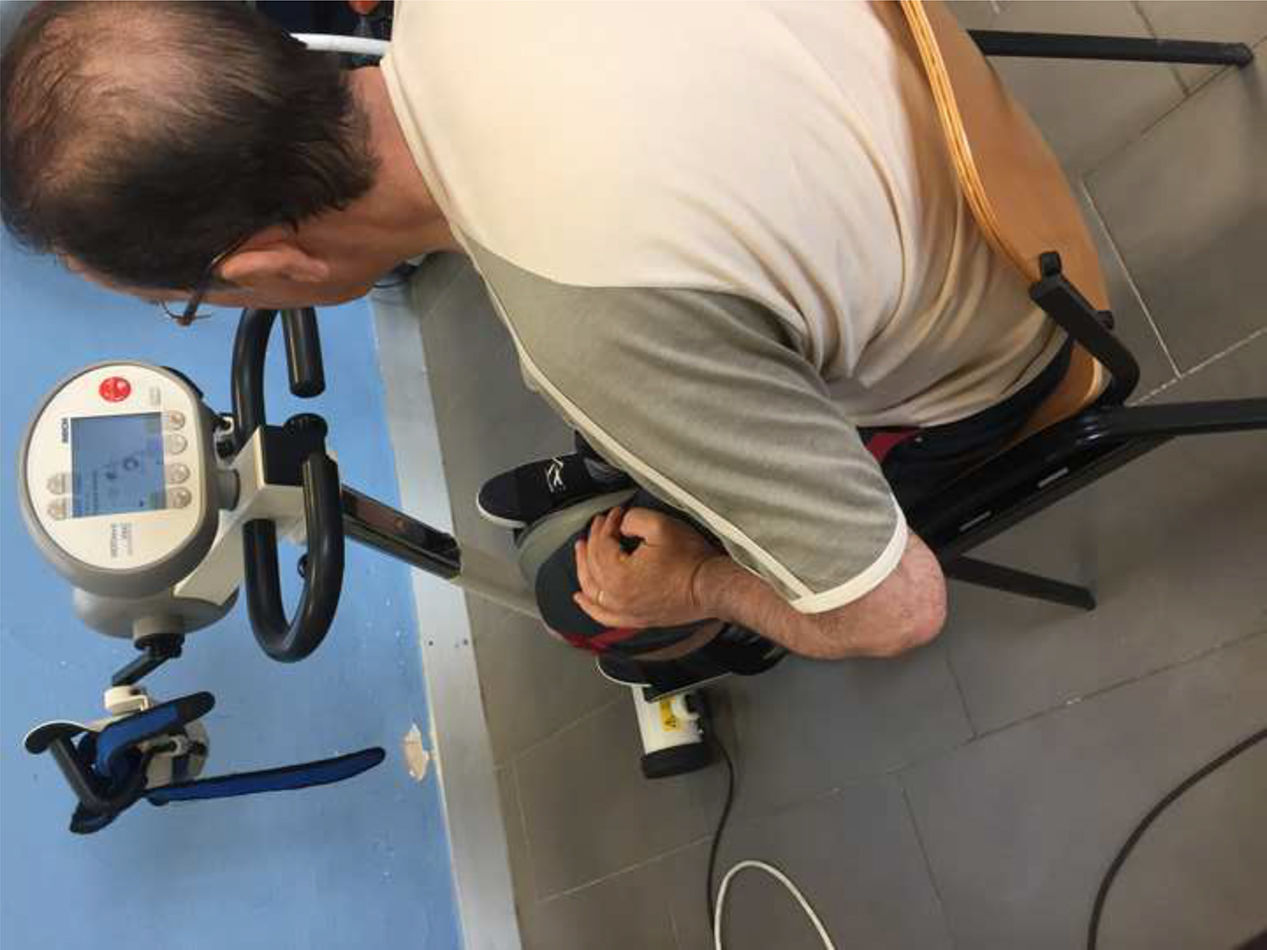
IntervenciónEn la sala de neurofisioterapia biofuncional de la Unidad de Esclerosis Múltiple del Hospital Universitario Virgen Macarena, el grupo experimental fue sometido al uso de la bicicleta estática con programa de retroalimentación con programa de coordinación para trabajar la asimetría de presiones de los miembros inferiores durante 30min de duración de pedaleo con una resistencia al 75% de la capacidad máxima. La intervención se realizó una vez por semana durante 3 meses. Se empleó el sistema MOTOmed Viva2 Movement Trainer® (Reck-Technik GmbH Et Co. KG, GERMANY) (fig. 1). El grupo control tuvo un programa domiciliario de ejercicios personalizados. El grupo experimental también tuvo este programa domiciliario además de la intervención.
VariablesSe realizó una evaluación de las variables previo al inicio del tratamiento, la siguiente evaluación fue al mes del inicio del estudio y a los 3 meses del inicio del tratamiento, fue llevado a cabo por un evaluador ciego respecto a la asignación de los pacientes y la evaluación de las variables. Las variables fueron evaluadas antes del inicio del estudio, volvieron a ser evaluadas al mes del comienzo del estudio y a los 3 meses del comienzo estudio. Esta evaluación se realizó por un investigador independiente y ciego.
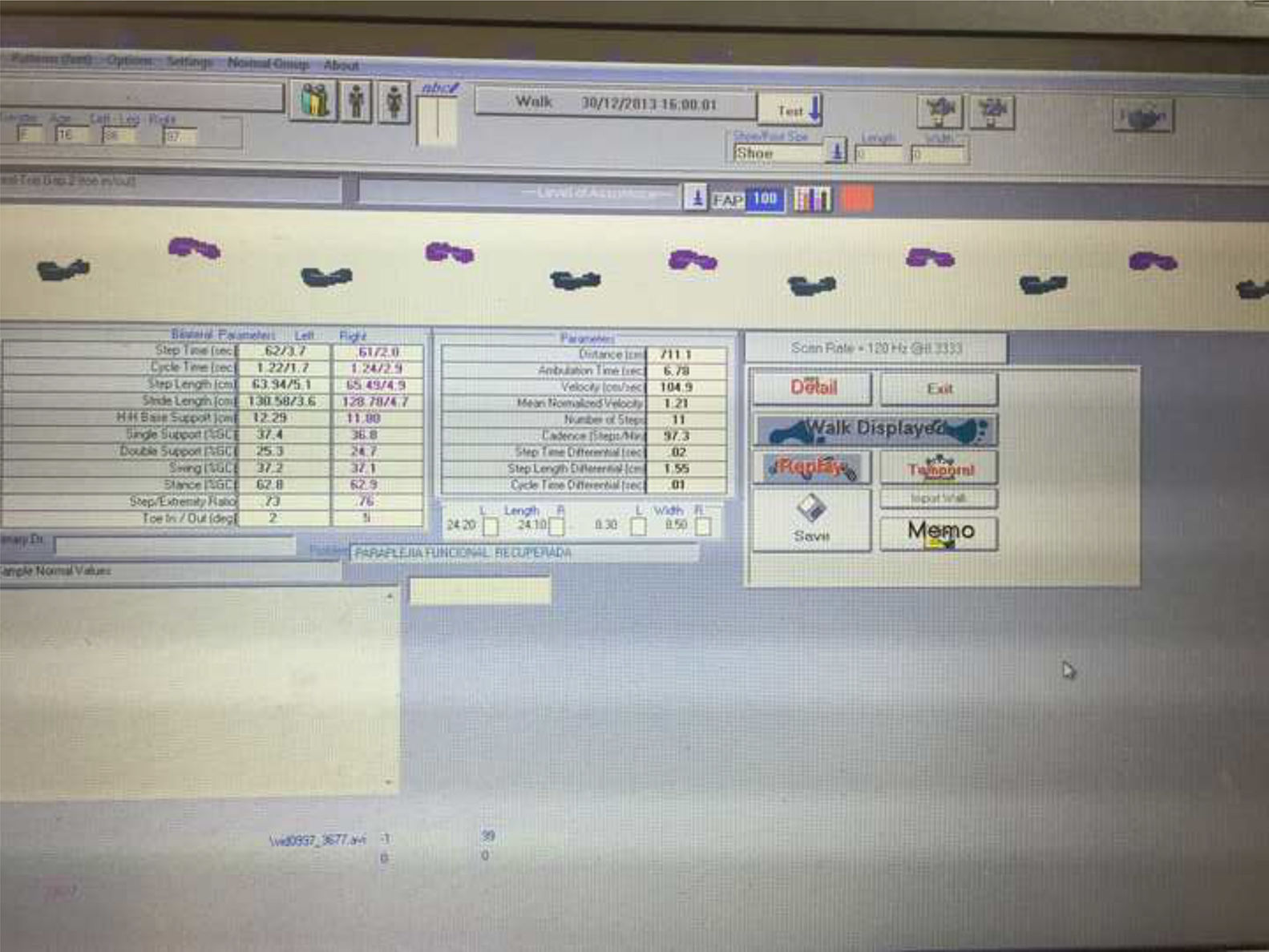
Las mediciones fueron realizadas con el sistema GAITRite® Walkway (fig. 2); es un sistema de análisis de marcha (tapiz con sensores de presión) usado para la valoración de las alteraciones de la marcha14,16. Es equivalente al T25FW, pero proporciona información más precisa y detallada15.
Las variables medidas con el sistema GAITRite® (fig. 3)
- –
Diferencia de la longitud de paso, expresado en centímetros: se mide sobre la línea de progresión, desde el centro del talón de la pisada actual hasta el centro del talón de la pisada previa del pie contrario14.
- –
Velocidad, expresado en cm/s: se obtiene del cociente entre la distancia recorrida y el tiempo de ambulación14.
- –
Cadencia: es el número de pasos que se dan en un minuto14.
- –
FAP: es un parámetro funcional de la marcha que a través de un porcentaje; utilizando los parámetros temporo-espaciales, calcula en porcentaje la funcionalidad de la marcha en comparación con los parámetros de un grupo de personas sanas14.
La velocidad de marcha disminuye en los pacientes de EM con el aumento de la EDSS, al igual que la longitud del paso7.
Análisis estadísticoLa normalidad de la distribución de los valores de cada una de las variables se comprobó utilizando la prueba de Shapiro-Wilk.
Se valoró la similitud entre los grupos antes de comenzar el estudio por medio de la prueba de la t de Student para las muestras independientes de las variables cuantitativas con distribución normal, y el test de la U de Mann-Whitney en el caso de variables cuantitativas, cuando la distribución de las variables no se ajustaba a la normalidad.
Para las variables cuantitativas con distribución normal se llevó a cabo un análisis t de Student para datos emparejados realizando comparaciones intragrupo (3 mediciones) y un análisis t de Student para muestras independientes realizando análisis entre grupos (diferencia de medias).
La prueba de Wilcoxon se aplicó en las variables cuantitativas sin distribución normal para datos emparejados para las comparaciones intragrupo (3 mediciones) y el test de la U de Mann-Whitney para muestras independientes en el análisis comparativo entre grupos (diferencia de medias).
Para el análisis de los datos se empleó el programa estadístico SPSS versión 23. El nivel de significación se consideró en p<0,05.
ResultadosDe un total de 70 sujetos inicialmente seleccionados, fueron incluidos 61 en el estudio, los 9 pacientes restantes no fueron incluidos debido a que presentaron brotes. La muestra del grupo experimental es (N=30) y la muestra del grupo control es (N=31).
Se ha analizado la homogeneidad de las muestras sobre la base de la edad de los sujetos que la componen. El valor Shapiro-Wilk obtenido (0,395 y 0,91 para las muestras experimental 1 y control 2, respectivamente) permite asumir la normalidad de ambos grupos según su edad.
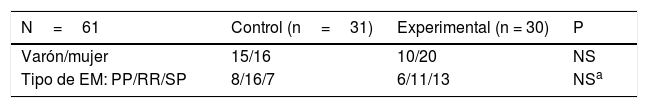
En la distribución por sexos de ambos grupos, el valor χ2 obtenido (0,30ns) permite afirmar que no existen diferencias estadísticamente significativas en la distribución por sexos de ambos grupos, si bien en el grupo experimental existe una mayor proporción de mujeres que en el control. La muestra está constituida por 25 varones y 36 mujeres (tabla 1).
Características basales de la muestra
| N=61 | Control (n=31) | Experimental (n = 30) | P |
|---|---|---|---|
| Varón/mujer | 15/16 | 10/20 | NS |
| Tipo de EM: PP/RR/SP | 8/16/7 | 6/11/13 | NSa |
El valor χ2 obtenido (0,22ns) permite afirmar que no existen diferencias estadísticamente significativa en la distribución por tipo de EM.
El estadístico Shapiro-Wilk aplicado a las puntuaciones en EDDS de los grupos experimental y control (0,84, p<0,001 y 0,90, p<0,05, respectivamente) permiten indicar las distribuciones ajustada la normalidad de esta variable solo en el primer grupo citado. La aplicación de la U de Mann-Whitney a esta variable (377,0, ns) indica la inexistencia de diferencias estadísticamente significativas entre ambos grupos. La puntuación media en la EDSS es de 4,3. En consecuencia, podemos afirmar que en los grupos analizados en ambos grupos son comparables al no presentarse diferencias estadísticamente significativas según edad y sexo.
La línea de base o fase 0 es previo a la intervención, fase 1 al mes y fase 2 es el seguimiento que corresponde a los 3 meses.
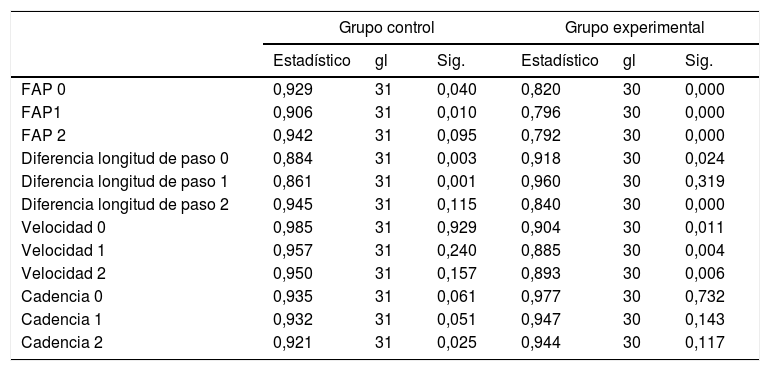
La prueba de Shapiro-Wilk es más apropiada para probar los conjuntos de datos, consideramos que los datos se distribuyen normalmente si en la columna de «Sig» es>0,05. Como se aprecia, en líneas generales, FAP y diferencia de longitud no siguen una distribución normal, mientras velocidad y cadencia siguen una distribución normal. Por ello, se ha ajustado los estadísticos a analizar sobre la base de la distribución de los datos (tabla 2).
Pruebas de normalidada
| Grupo control | Grupo experimental | |||||
|---|---|---|---|---|---|---|
| Estadístico | gl | Sig. | Estadístico | gl | Sig. | |
| FAP 0 | 0,929 | 31 | 0,040 | 0,820 | 30 | 0,000 |
| FAP1 | 0,906 | 31 | 0,010 | 0,796 | 30 | 0,000 |
| FAP 2 | 0,942 | 31 | 0,095 | 0,792 | 30 | 0,000 |
| Diferencia longitud de paso 0 | 0,884 | 31 | 0,003 | 0,918 | 30 | 0,024 |
| Diferencia longitud de paso 1 | 0,861 | 31 | 0,001 | 0,960 | 30 | 0,319 |
| Diferencia longitud de paso 2 | 0,945 | 31 | 0,115 | 0,840 | 30 | 0,000 |
| Velocidad 0 | 0,985 | 31 | 0,929 | 0,904 | 30 | 0,011 |
| Velocidad 1 | 0,957 | 31 | 0,240 | 0,885 | 30 | 0,004 |
| Velocidad 2 | 0,950 | 31 | 0,157 | 0,893 | 30 | 0,006 |
| Cadencia 0 | 0,935 | 31 | 0,061 | 0,977 | 30 | 0,732 |
| Cadencia 1 | 0,932 | 31 | 0,051 | 0,947 | 30 | 0,143 |
| Cadencia 2 | 0,921 | 31 | 0,025 | 0,944 | 30 | 0,117 |
En primer lugar, se ha contrastado la variable FAP que no sigue una distribución normal. En el grupo experimental se hallan cambios estadísticamente significativos entre las fases 0 y 1 (p<0,014) y entre 0 y 2 (p<0,002), cambios que no son observados en el grupo control. Lo que implica una mejora significativa del rendimiento entre la ejecución inicial y las posteriores (tabla 3).
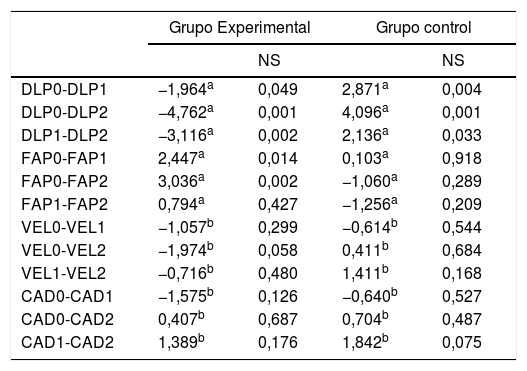
Resultados de las comparaciones de las variables estudiadas entre el grupo experimental y grupo control
| Grupo Experimental | Grupo control | |||
|---|---|---|---|---|
| NS | NS | |||
| DLP0-DLP1 | −1,964a | 0,049 | 2,871a | 0,004 |
| DLP0-DLP2 | −4,762a | 0,001 | 4,096a | 0,001 |
| DLP1-DLP2 | −3,116a | 0,002 | 2,136a | 0,033 |
| FAP0-FAP1 | 2,447a | 0,014 | 0,103a | 0,918 |
| FAP0-FAP2 | 3,036a | 0,002 | −1,060a | 0,289 |
| FAP1-FAP2 | 0,794a | 0,427 | −1,256a | 0,209 |
| VEL0-VEL1 | −1,057b | 0,299 | −0,614b | 0,544 |
| VEL0-VEL2 | −1,974b | 0,058 | 0,411b | 0,684 |
| VEL1-VEL2 | −0,716b | 0,480 | 1,411b | 0,168 |
| CAD0-CAD1 | −1,575b | 0,126 | −0,640b | 0,527 |
| CAD0-CAD2 | 0,407b | 0,687 | 0,704b | 0,487 |
| CAD1-CAD2 | 1,389b | 0,176 | 1,842b | 0,075 |
CAD: cadencia; DLP: diferencia de la longitud de Paso; FAP: perfil funcional de ambulación; NS: nivel de significación; VEL: velocidad.
En cuanto a la diferencia de la longitud del paso (DLP) en el grupo experimental se hallan cambios estadísticamente significativos entre las fases 0 y 2 (p<0,001) y entre 1 y 2 (p<0,002), cambios que son observados en el grupo control pero solo en la fase 0 y 2 (p<0,004) (tabla 3).
Dada la distribución normal de la variable velocidad, se ha empleado la prueba de la t de Student para datos apareados. No se han encontrado cambios ni en el grupo experimental ni en el control entre ninguna de las fases de evaluación (tabla 3).
En la variable cadencia no se han obtenido diferencias estadísticamente significativas en ninguna de las fases ni en el grupo experimental ni en el control (tabla 3).
DiscusiónNo existen estudios publicados hasta la fecha en los que se valore el efecto del sistema MOTOmed Via2 en la marcha de los pacientes de EM. La literatura científica solo tiene estudios sobre el efecto del entrenamiento en bicicleta con biofeedback visual en la marcha en ictus10,11. Los estudios anteriores han demostrado que el entrenamiento del movimiento con retroalimentación visual puede proporcionar información sensorial intrínseca y extrínseca para mejorar el aprendizaje y el control motor.
El presente estudio es el primer trabajo realizado en España en el que se plantea como objetivo evaluar los efectos del sistema MOTOmed Via2 sobre la asimetría del paso, el perfil funcional de ambulación, la velocidad y la cadencia en pacientes con EM17,18.
Con objetivo de solucionar las limitaciones metodológicas de los estudios ya publicados, se han utilizado valoraciones objetivas consideradas como «gold standard» con buena fiabilidad intra e interobservador en la EM. Concretamente, para la valoración objetiva de los parámetros de marcha se utilizó, como ya se ha indicado anteriormente, el sistema validado GAITRite®, el cual nos proporcionó los resultados del estudio. Analizar si el nivel de variabilidad de los parámetros temporo-espaciales de la marcha que presentan los pacientes de EM, de manera tan exhaustiva, rápida y sencilla gracias al sistema electrónico de tapiz de la marcha GaitRite®, demostró ser eficaz y útil para evaluar la calidad de la marcha en los pacientes con EM15.
Las cuestiones que nos planteamos en el tratamiento propuesto es sobre todo si los efectos obtenidos en la simetría del ciclismo pueden transferirse a la marcha funcional.
Solo hubo mejoras significativas del grupo experimental en la variable del FAP y de la longitud del paso. El FAP mejoró en el grupo experimental al mes del inicio de la intervención y en la postintervención a los 3 meses. La longitud del paso del grupo experimental no mostró diferencias significativas al mes del tener el tratamiento pero sí se obtuvieron mejorías a los 3 meses, entre el pre y el postratamiento, y también hubo diferencias significativas entre el primer mes de tratamiento y la postintervención. Por lo que la mejoría más significativa se obtuvo en los 3 meses de comienzo del tratamiento. Así que los pacientes tuvieron una mejora significativa en la simetría de la marcha. En los parámetros de marcha de velocidad y cadencia no se obtuvieron diferencias ni en el grupo experimental, ni en el grupo control. Esto parece indicar que el tiempo de intervención puede que no fuera suficiente para inducir cambios en estos parámetros específicos de la marcha. Además, los resultados parece que indican que el pequeño número de sesiones administradas (n=12) no es suficiente para tener una idea clara de la potencialidad que se puede obtener en la marcha a través del pedaleo. Un tratamiento prolongado en el tiempo sería más eficaz en conseguir progresos desde el rendimiento físico del paciente hasta su capacidad locomotora. Esta duración debe optimizarse siempre dependiendo de la condición específica de cada paciente. Este estudio trata también de demostrar qué tipo de pacientes pueden beneficiarse más este tratamiento; parece ser efectivo para las personas con mayor asimetría y que hacen un uso excesivo de la pierna menos afectada.
Los patrones de activación de los músculos durante el ciclismo y la marcha son similares, ya que ambos requieren de una flexión y extensión recíproca del miembro inferior y una coordinación adecuada de los músculos agonistas y antagonistas19,20. Las investigaciones anteriores indican que el movimiento de flexión y extensión de los miembros inferiores producidos por el GCP puede ser regulado por entradas sensoriales periféricas21. Así que una posible explicación de los efectos positivos observados del tratamiento es que la retroalimentación visual proporcionada en el panel de la bicicleta durante el entrenamiento podría ser beneficiosa para el control muscular y las activaciones a nivel muscular del miembro inferior afectado.
Hay estudios en los pacientes con accidente cerebrovascular que se ha utilizado un método de espectroscopia de infrarrojo cercano para detectar los cambios hemodinámicos resultantes de la actividad neuronal durante el ejercicio de pedaleo. Se ha observado que se encuentran mejora de la activación en el corte premotor durante el ciclo activo con retroalimentación visual, comparado con el observado sin retroalimentación22,23; sin embargo, hay limitación de la información sobre el entrenamiento de bicicleta con retroalimentación extrínseca en la inducción de activación del cerebro, especialmente a largo plazo. Esto podría ser explorado por la resonancia magnética en futuros estudios con pacientes de esclerosis múltiple.
Las limitaciones de este estudio, entre ellas la falta de seguimiento tras la intervención y el número reducido de pacientes, pueden afectar a la generalización y la aplicación de los resultados obtenidos; sin embargo, podemos afirmar que el entrenamiento en bicicleta con retroalimentación visual podría optimizar la funcionalidad del miembro inferior y mejorar los parámetros de la marcha en pacientes con EM. Se puede recomendar que este tipo de entrenamiento se pudiera utilizar como protocolo clínico en rehabilitación o como ejercicio en domicilio para pacientes con EM.
Los resultados demostraron que el tratamiento es factible y puede ser efectivo en este tipo de pacientes, por lo que si estos resultados se confirman en una escala mayor y controlada se puede llegar a afirmar que intervención, gracias a su seguridad y bajo precio, podría tener un impacto significativo como tratamiento de rehabilitación domiciliaria.
Conflicto de interesesLos autores manifiestan no tener ningún tipo de conflicto de interés.
Al hogar Virgen de los Reyes, por la cesión de la sala donde se llevó a cabo el estudio y donde está ubicada la Unidad de Neurofisioterapia Biofuncional.
Presentado en la Sociedad Nacional de Neurología (SEN), en formato póster de estudio piloto, en el año 2014.