Diversas enfermedades neuropatologías asociadas a la degeneración del tracto corticoespinal muestran deterioro de las funciones motoras. Tales alteraciones neurológicas se asocian a diversos fenómenos plásticos subsecuentes, a nivel tanto presináptico como postsináptico. Sin embargo, no existe evidencia que indique la existencia de modificaciones en la transmisión de información del tracto corticoespinal a las motoneuronas espinales.
MétodosSe indujo una lesión por vía estereotáxica en la corteza motora primaria de ratas hembra adultas con ácido kaínico y, 15 días después, se evaluó el desempeño motor mediante la escala BBB y en un dispositivo Rota-Rod. Paralelamente, se cuantificó la densidad numérica y proporcional de las espinas delgadas, en hongo y gordas, en motoneuronas de un segmento torácico-lumbar de la médula espinal. Así mismo, se registró la expresión de las proteínas espinofilina, sinaptofisina β iii-tubulina.
ResultadosLa lesión farmacológica provocó un desempeño motor deficiente. Así mismo, tanto la densidad de espinas como la proporción de espinas delgadas y gordas fue mayor, al igual que la expresión de las 3proteínas estudiadas.
ConclusiónLa aparición de los síntomas clínicos de daño neurológico provocado por la degeneración walleriana del tracto corticoespinal se acompaña de respuestas plásticas espontáneas de tipo compensador, a nivel sináptico. Lo anterior indica que durante la rehabilitación temprana de este tipo de pacientes, la plasticidad espontánea constituye un factor que se debe considerar para el diseño de estrategias de intervención más eficientes.
Motor function is impaired in multiple neurological diseases associated with corticospinal tract degeneration. Motor impairment has been linked to plastic changes at both the presynaptic and postsynaptic levels. However, there is no evidence of changes in information transmission from the cortex to spinal motor neurons.
MethodsWe used kainic acid to induce stereotactic lesions to the primary motor cortex of female adult rats. Fifteen days later, we evaluated motor function with the BBB scale and the rotarod and determined the density of thin, stubby, and mushroom spines of motor neurons from a thoracolumbar segment of the spinal cord. Spinophilin, synaptophysin, and β iii-tubulin expression was also measured.
ResultsPharmacological lesions resulted in poor motor performance. Spine density and the proportion of thin and stubby spines were greater. We also observed increased expression of the 3 proteins analysed.
ConclusionThe clinical symptoms of neurological damage secondary to Wallerian degeneration of the corticospinal tract are associated with spontaneous, compensatory plastic changes at the synaptic level. Based on these findings, spontaneous plasticity is a factor to consider when designing more efficient strategies in the early phase of rehabilitation.
La organización del movimiento voluntario depende de la función coordinada de diferentes áreas cerebrales1,2. Las neuronas piramidales de la capa v de la corteza motora primaria (M1) integran información relacionada con el movimiento voluntario3, cuya ejecución se asocia a las conexiones directas que dichas neuronas corticales poseen con la médula espinal a través de la vía piramidal corticoespinal1.
Existen diversas alteraciones del movimiento relacionadas con la lesión de M1, entre las que se encuentran las parálisis, las parestesias4,5 y la hiperreflexia6. Las neuropatologías subyacentes a estas constituyen la causa principal de discapacidad y la evidencia clínica muestra que la recuperación solamente tiende a una recuperación funcional parcial, tanto sensitiva como motora7.
El principal daño histopatológico asociado a parálisis o parestesias es la degeneración walleriana, que ocurre tras una lesión a nivel cortical. La degeneración walleriana se caracteriza por la degeneración axonal tras una lesión distal al soma neuronal. En las lesiones corticales, este tipo de degeneración provoca la pérdida de comunicación de las neuronas corticales con las motoneuronas de la médula espinal8,9.
Existe evidencia clínica10,11 y experimental7,12 de recuperación funcional parcial posterior a la lesión de la corteza motora. Se ha reportado que la eventual recuperación incipiente subyace parcialmente en procesos plásticos como la reorganización cortical, el rebrote axonal de las vías aferentes viables a motoneuronas medulares o bien, la elongación dendrítica o el surgimiento de nuevas dendritas en las motoneuronas de la médula espinal13-15.
Estudios recientes muestran espinogénesis en motoneuronas espinales derivada de la lesión medular experimental16. Sin embargo, no existe evidencia experimental acerca de cambios plásticos asociados a la actividad sináptica mediada por espinas dendríticas en motoneuronas de la médula espinal eventualmente resultantes de una lesión degenerativa de la vía piramidal corticoespinal.
Material y métodosAnimalesSe utilizaron 26 ratas hembra adultas (200-250g de peso) de la cepa Sprague-Dawley, las cuales fueron mantenidas bajo condiciones estándar de bioterio (25°C, ciclos de 12×12h de luz-oscuridad) y con libre acceso a agua y alimento especial para roedores pequeños.
CirugíaLos animales fueron asignados a uno de 2grupos de estudio. Al grupo experimental (experimental; n = 13) se le administró una dosis única de 5nM de ácido kaínico diluido en 0,3μl de solución salina fisiológica, por vía estereotáxica en 2puntos diferentes de M1 bilateral en las coordenadas: 1) antero-posterior a Bregma = 2,7, dorso-ventral = 2,4, lateral = ± 3,0, y 2) antero-posterior a Bregma = –1,8, dorso-ventral = 1,6, lateral = ± 1,417. Un grupo de ratas se utilizó como control (control; n = 13). A estas se les administró 0,3μl de solución salina fisiológica por vía estereotáxica, en las mismas coordenadas que el grupo experimental. Previo a la cirugía estereotáxica, los animales fueron anestesiados con 13mg/kg de xilazina y posteriormente con 80mg/kg de quetamina por vía intramuscular. A los 15 días posteriores a la lesión se llevó a cabo la evaluación conductual de todos los animales.
Estudio conductualTodos los animales de ambos grupos fueron evaluados conductualmente. Para la evaluación de los cambios en el desempeño motor provocados por la lesión, se realizó una evaluación neurológica mediante la prueba de desempeño locomotriz de Basso-Beattie-Bresnahan
18 (BBB) y la prueba de equilibrio y coordinación motora en un dispositivo Rota-Rod.
La escala BBB asigna puntuaciones de 0 a 21, donde 0 representa ausencia completa de movimiento espontáneo y 21 una marcha normal. La prueba se realizó en un área circular delimitada y para el registro se consideró el movimiento en las articulaciones de la cadera, la rodilla y el tobillo, así como la capacidad de estar en ambas piernas, la posición plantar en el piso, tomar pasos, la postura de la cola y la coordinación. Las ratas fueron evaluadas en una sola sesión durante 4min. Treinta minutos después de concluida la evaluación BBB, los animales fueron evaluados en el Rota-Rod. Para ello, se indujeron 2procedimientos de habituación: primero permanecieron durante 15 min previos al experimento en su jaula de mantenimiento en el recinto en que se harían las pruebas y, acto seguido, cada rata se colocó sobre el tambor giratorio sin rotar durante 2 a 3 min. La evaluación consistió en una sola sesión de 3 ensayos con intervalos de 15 min entre cada ensayo. Al inicio del primer ensayo se colocó a la rata en un carril individual sobre el tambor giratorio; se hizo girar el tambor a velocidad constante de 4rpm y se corroboró que fue capaz de caminar sobre el tambor durante aproximadamente 5 s continuos. Una vez comprobado lo anterior, la prueba dio inicio haciendo rotar el tambor a una aceleración constante, yendo de 4 a 40rpm durante 5 min. Se registraron tanto la latencia de caída como las rpm a las cuales el animal cayó del rodillo. Una vez terminado cada ensayo, las superficies del aparato fueron limpiadas con alcohol etílico al 70%.
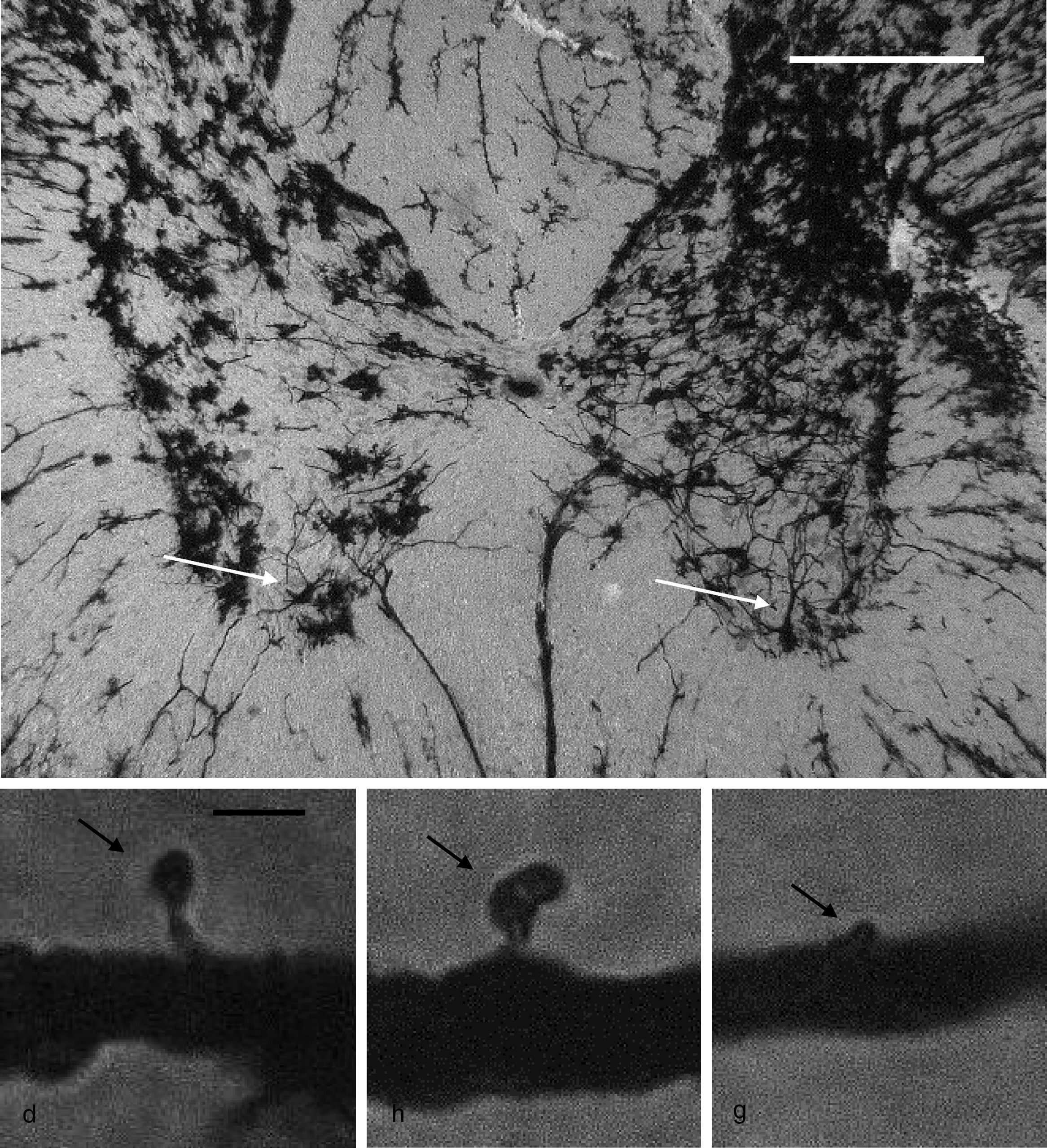
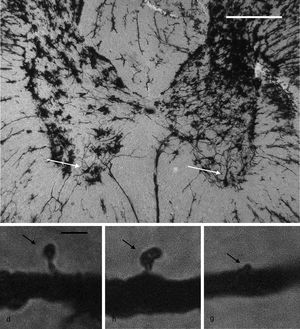
Citoarquitectura neuronalSe utilizaron 6 animales de cada grupo al azar para los estudios de citoarquitectura neuronal. Estos fueron anestesiados con 13mg/kg de xilazina y posteriormente con 80mg/kg de quetamina por vía intramuscular. Enseguida fueron perfundidos por vía intracardíaca con 200ml de una solución amortiguadora de fosfatos (pH 7,4; 0,1M), a la cual se adicionó heparina sódica (1.000 UI/l) como anticoagulante y clorhidrato de procaína (1g/l) como vasodilatador19. Inmediatamente después, se les perfundió 200ml de una solución de formaldehído al 4% en amortiguador de fosfatos (pH 7,4; 0,1M), por la misma vía. Se obtuvo una sección de 3cm de médula espinal entre la porción torácica y la porción lumbar de la médula espinal y se conservaron en una solución fresca de formaldehído al 4% en amortiguador de fosfatos por un mínimo de 24h. Se diseccionaron bloques de 4mm de espesor, los cuales se procesaron mediante una modificación al método rápido de Golgi20 para el estudio de la citoarquitectura neuronal. A partir de cortes horizontales de 100μm de espesor, se cuantificaron 6neuronas por animal y, en ellas, la posible presencia de espinas dendríticas, su densidad y la densidad proporcional de espinas delgadas, en hongo y gordas21 (fig. 1).
Panel superior: fotomicrografía panorámica de las astas dorsales y ventrales de un segmento torácico de la médula espinal de rata, impregnada mediante una modificación al método de Golgi. Las fleches señalan motoneuronas en el asta ventral, en cuyas dendritas primarias se realizaron los conteos de espinas. Escala: 100μm. Panel inferior: fotomicrografías representativas de una espina delgada (d), una en hongo (h) y una gorda (g) (flechas), como aquellas que se contaron en este estudio. Escala: 2μm.
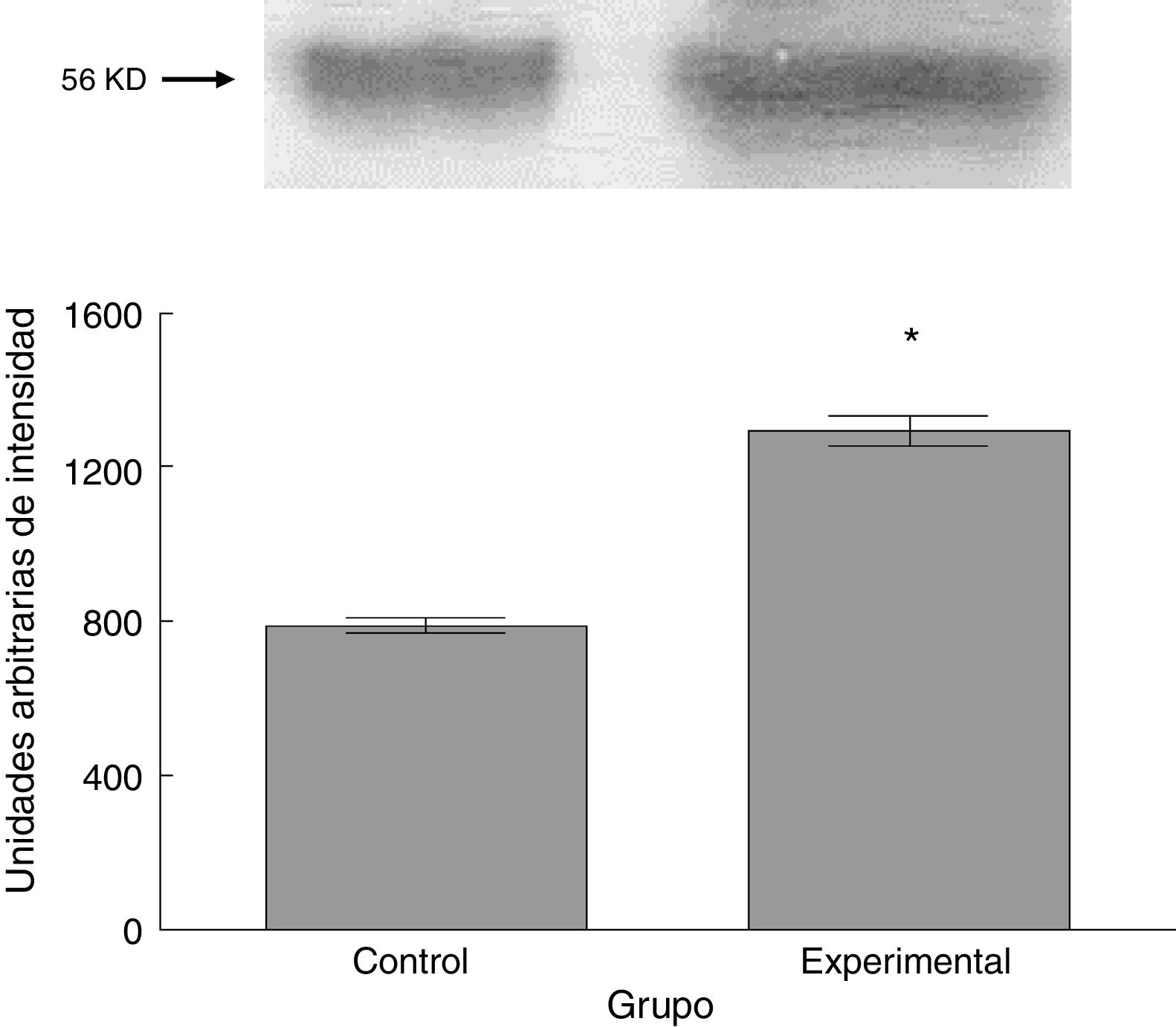
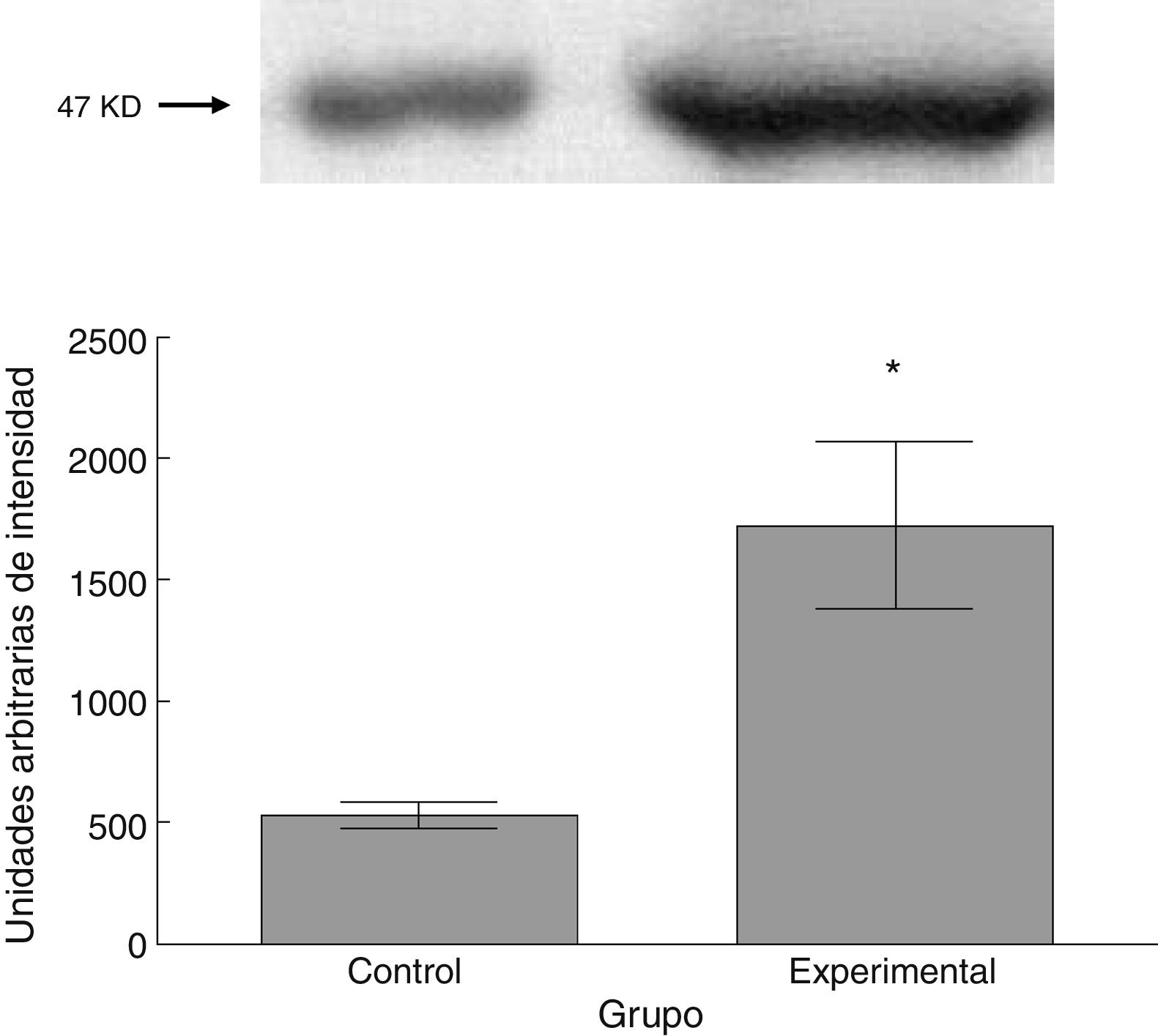
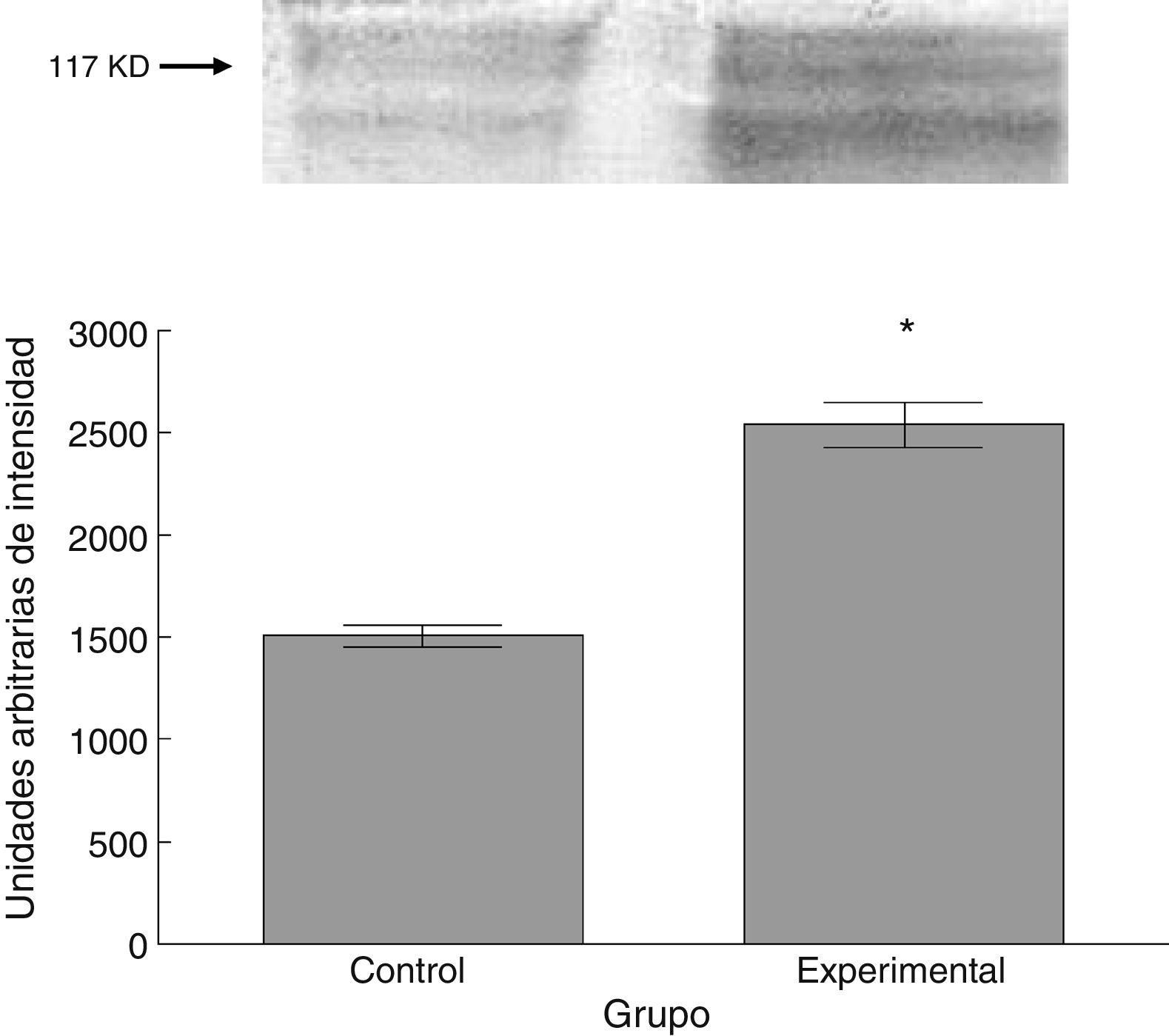
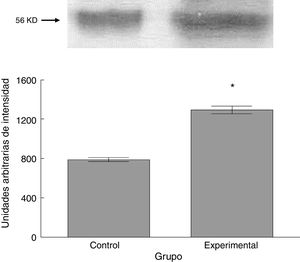
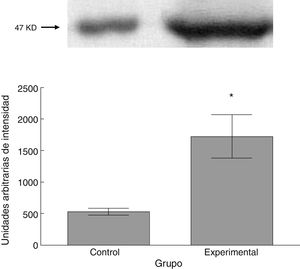
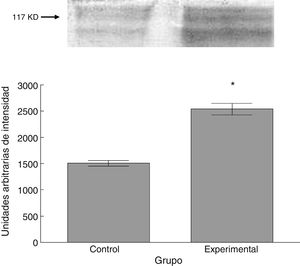
Para los estudios moleculares correspondientes a la cuantificación de proteínas, fueron sacrificados 6 animales por grupo mediante decapitación. Se obtuvieron secciones de 3cm de médula espinal torácica y lumbar para ser procesados para la cuantificación de la presencia de las proteínas β iii-tubulina (56 KD), sinaptofisina (47 KD) y espinofilina (117 KD), mediante la técnica de Western blot. El análisis se llevó a cabo por medio de la toma de fotografía digital de la membrana resultante, de un sistema de fotodocumentación y los datos obtenidos se reportan en unidades arbitrarias de intensidad.
Análisis estadísticoPara el análisis de los resultados conductuales, morfológicos y moleculares se utilizó la prueba de la t de Student para muestras independientes.
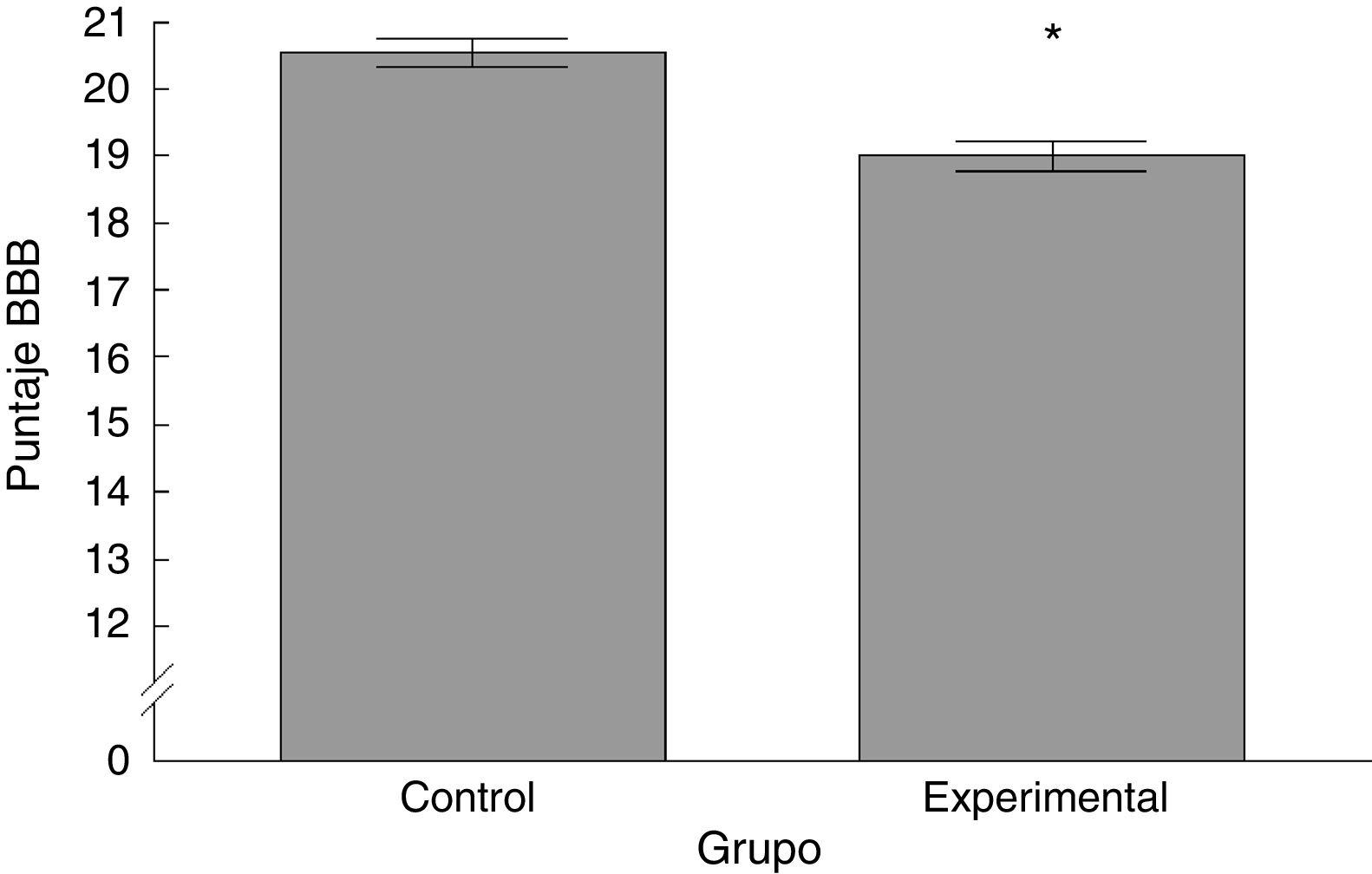
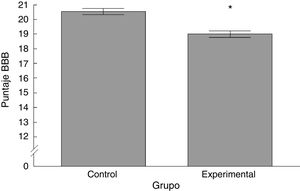
ResultadosAnálisis Basso-Beattie-BresnahanExistieron diferencias significativas entre los 2grupos estudiados. El puntaje registrado para el grupo experimental fue menor con respecto al grupo control (t = 4,924, p < 0,0001) (fig. 2).
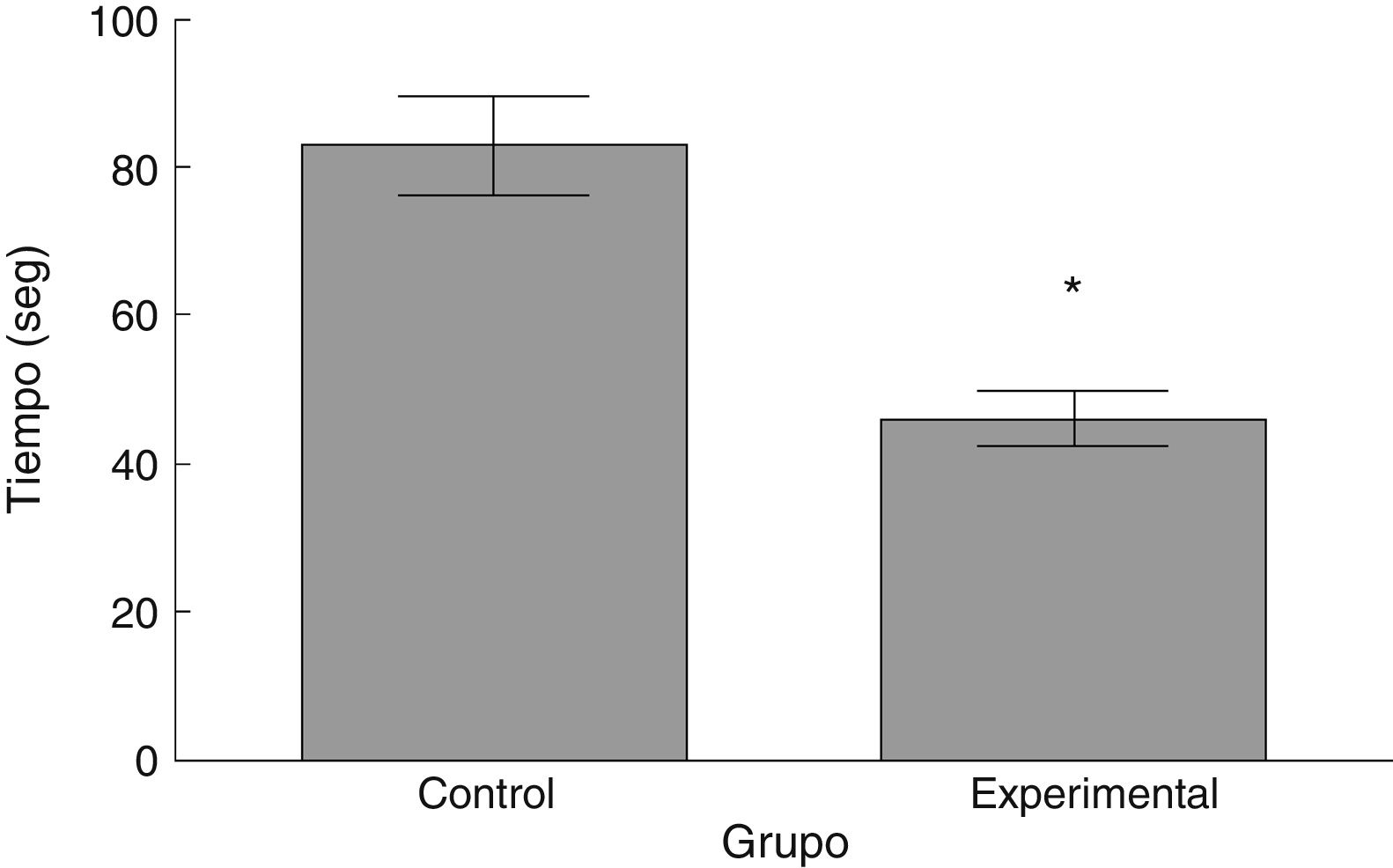
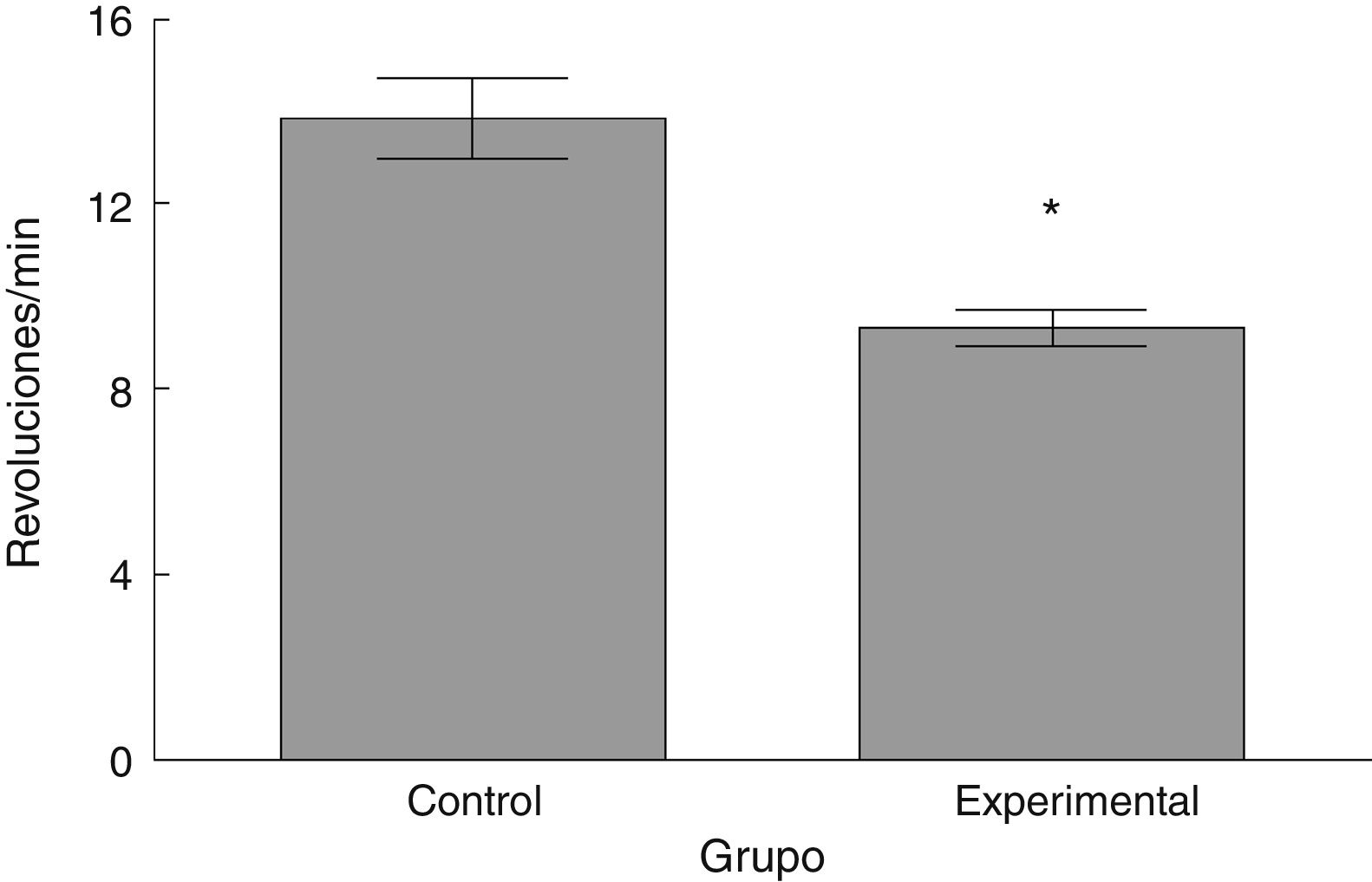
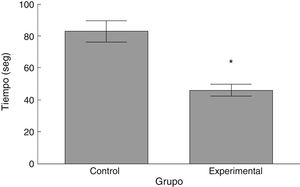
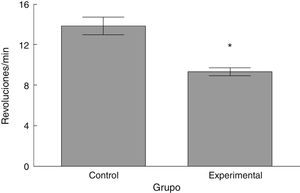
Rota-RodLa latencia de caída por parte de los animales experimentales fue menor que aquella en los correspondientes al grupo control (t = 4,883, p < 0,0001) (fig. 3). Así mismo, la aceleración soportada por los animales experimentales fue menor respecto a los controles (t = 747, p < 0,0001) (fig. 4).
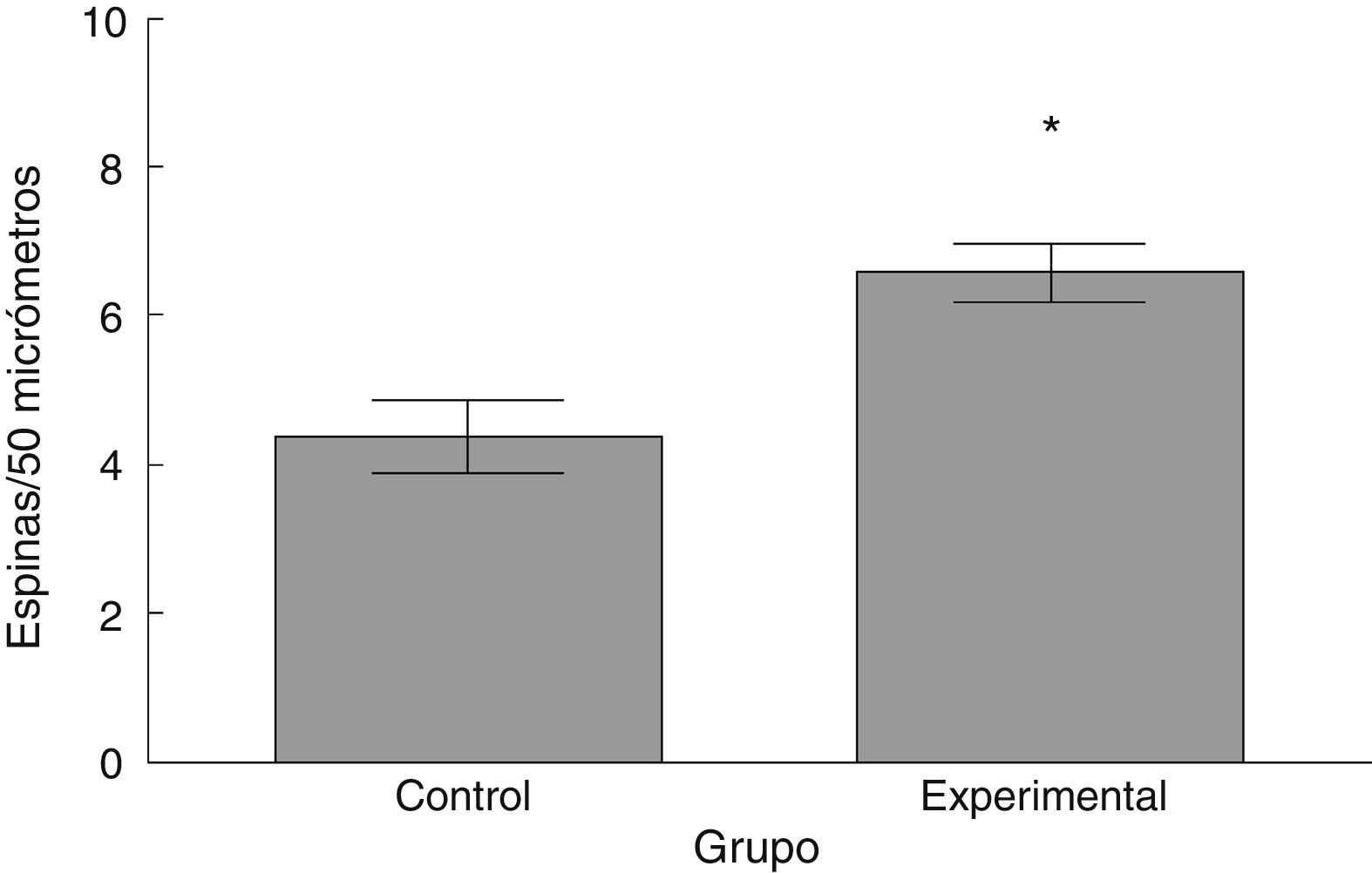
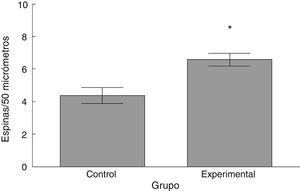
La densidad de espinas dendríticas fue mayor en el grupo experimental que en el grupo control (t = –3,508, p < 0,006) (fig. 5). Particularmente, las espinas delgadas (t = –2,624, p < 0,02) y las espinas gordas (t < –4,447; p < 0,001) se observaron en una mayor proporción en el grupo experimental con respecto al grupo control. No se observaron diferencias significativas en la proporción de espinas en hongo entre los grupos (tabla 1).
El grupo experimental mostró una mayor marca tanto de β iii-tubulina (t = –11,9, p < 0,0001) (fig. 6) como de sinaptofisina (t = –3,451, p < 0,006) (fig. 7) y espinofilina (t = –8,370, p < 0,0001) (fig. 8).
Diversas enfermedades desmielinizantes del tracto corticoespinal cursan con daño neurológico y deterioro de la motricidad4,5. En el presente estudio se evaluaron la funcionalidad motora y la plasticidad subyacente de las motoneuronas espinales torácico-lumbares tras la lesión experimental de M1.
El análisis neurológico funcional, tanto en la prueba BBB como en el dispositivo Rota-Rod, evidenció deficiencias en el desempeño motor. Lo anterior ocurrió de forma concomitante con un aumento en la densidad numérica de espinas dendríticas y, particularmente, de las espinas delgadas y gordas.
El incremento numérico de espinas dendríticas observado en las motoneuronas espinales tras la lesión de M1 podría interpretarse como una respuesta plástica compensadora que, de ser espinas funcionales22-24, representaría un aumento de la capacidad asociativa de los estímulos sinápticos aferentes25 y, eventualmente, posibilitaría la recuperación de las funciones perdidas26.
Estudios realizados en diversos modelos experimentales que involucran daño motor27-30, incluido el daño medular16, han mostrado que no solamente la densidad numérica de espinas dendríticas es importante como respuesta plástica ante la alteración del microambiente sináptico, sino que variaciones en la densidad proporcional de los diferentes tipos de espinas también constituyen eventos plásticos críticos.
Las espinas delgadas han sido clásicamente relacionadas con la adquisición de información novedosa31,32 en virtud de su característica de procesar de manera rápida la información sináptica aferente a ellas33,34. Si bien la información sináptica que procesa la médula espinal no está relacionada con el aprendizaje, los fenómenos electrofisiológicos subyacentes son comunes en sus fundamentos28. Para este estudio, tales fenómenos bioeléctricos constituyen una respuesta plástica emergente para captar la disminuida información química disponible procedente de aquellas fibras nerviosas que: a) hubiesen quedado viables tras la lesión; b) que fueren resultantes a un eventual rebrote axonal, o c) ambos eventos. De hecho, estudios previos aportaron evidencia de aumento de β iii tubulina —como la observada en el presente estudio— tras una lesión, lo que estaría relacionado con el rebrote de nuevas terminales axónicas35. En cualquier caso, el incremento de espinas delgadas podría ser interpretado como una respuesta plástica espontánea ante la degeneración walleriana inducida experimentalmente, tendiente a compensar la reducida transmisión de la información aferente a las motoneuronas espinales.
Al igual que las espinas delgadas, las espinas gordas también aumentaron en número tras la lesión experimental. Las espinas gordas carecen de cuello; esto les confiere la característica funcional de ofrecer poca resistencia al paso de corriente mediada por calcio36, de manera que, de acuerdo con evidencia circunstancial21,32,37,38, la actividad funcional de este tipo de espinas se traduciría en la regulación de la excitabilidad de las neuronas postsinápticas. Así, el incremento proporcional de espinas gordas observado indica, por un lado, que la actividad excitadora aferente a las motoneuronas espinales pudiere haberse visto incrementada tras la lesión de la vía corticoespinal y, por otra parte, que existe una respuesta plástica tendiente a regular la homeostasis bioeléctrica de las motoneuronas. Esta propuesta estaría sustentada en el hecho de que la proteína sinaptofisina, la cual constituye un marcador de la eventual liberación de neurotransmisor al espacio intersináptico39, mostró una expresión mayor en el tejido procedente de los animales lesionados. Más aún, el incremento de sinaptofisina sería correspondiente con el incremento observado en la expresión de espinofilina, que indicaría la existencia de una mayor cantidad de espinas dendríticas40, como de hecho ocurrió.
El estudio no reveló cambios en la densidad proporcional de las espinas en hongo. La transmisión sináptica mediada por este tipo de espinas es más lenta que en cualquier otro tipo de espinas31 en virtud de que la estimulación aferente a ellas las potencia41. Con base en lo anterior, la actividad funcional de este tipo de espinas ha sido relacionada con el almacenamiento de la información en el largo plazo31.
El hecho de que las espinas en hongo no hayan sufrido cambios indica que los procesos plásticos acaecidos en las espinas dendríticas de las motoneuronas espinales no tienden a la consolidación de la información sináptica aferente, lo que mantendría latente la posibilidad de ajustes dinámicos de la información sináptica, representados por la preponderancia de espinas delgadas. De ser así, y sobre la base de un microambiente bioeléctrico regulado por la elevada densidad de espinas gordas, lo anterior podría coadyuvar subyacentemente al establecimiento de patrones de actividad motora más efectivos durante la eventual intervención terapéutica temprana tendiente a la rehabilitación de pacientes con este tipo de alteraciones neuromotoras.
FinanciaciónEste trabajo fue financiado por el Fondo de Investigación en Salud del Instituto Mexicano del seguro Social, con Número de Registro FIS/IMSS/PROT/G11-2/1028.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.