La estereoelectroencefalografía (E-EEG) es una técnica de evaluación prequirúrgica en pacientes con epilepsia focal refractaria de difícil localización (EFRDL) que permite explorar con electrodos profundos regiones cerebrales de difícil acceso y la profundidad de la corteza. Esta técnica, en auge en centros internacionales, apenas se ha desarrollado en España. Describimos nuestra experiencia con la E-EEG en la evaluación de pacientes con EFRDL.
Material y métodosEn los últimos 8 años, 71 pacientes con EFRDL fueron evaluados con E-EEG en nuestro centro. Analizamos prospectivamente los resultados obtenidos en la localización, los resultados quirúrgicos y las complicaciones asociadas a la técnica.
ResultadosLa mediana de edad fue de 30 años (rango 4-59 años), 27 pacientes eran mujeres (38%). La RM cerebral fue negativa en 45 pacientes (63,4%). Se implantaron 627 electrodos (mediana de 9 electrodos por paciente, rango 1-17), con un 50% de implantaciones multilobares. En 64 (90,1%) pacientes se localizó la zona epileptógena (ZE), siendo extratemporal o temporal plus en el 66% de los casos. En 55 pacientes de los 61 intervenidos el seguimiento fue superior al año: en el último año de seguimiento 32/55 pacientes (58,2%) estaban libres de crisis (Engel I) siendo los resultados favorables (Engel I-II) en el 76,4% de las intervenciones. Tres pacientes (4,2%) presentaron una hemorragia cerebral.
ConclusiónLa E-EEG permite localizar la ZE en pacientes en quienes anteriormente no era posible, ofreciendo unos resultados quirúrgicos superiores a otras técnicas invasivas y una tasa de complicaciones relativamente baja.
Stereoelectroencephalography (SEEG) is a technique for preoperative evaluation of patients with difficult-to-localise refractory focal epilepsy (DLRFE), enabling the study of deep cortical structures. The procedure, which is increasingly used in international epilepsy centres, has not been fully developed in Spain. We describe our experience with SEEG in the preoperative evaluation of DLRFE.
Material and methodsIn the last 8 years, 71 patients with DLRFE were evaluated with SEEG in our epilepsy centre. We prospectively analysed our results in terms of localisation of the epileptogenic zone (EZ), surgical outcomes, and complications associated with the procedure.
ResultsThe median age of the sample was 30 years (range, 4-59 years); 27 patients (38%) were women. Forty-five patients (63.4%) showed no abnormalities on brain MR images. A total of 627 electrodes were implanted (median, 9 electrodes per patient; range, 1-17), and 50% of implantations were multilobar. The EZ was identified in 64 patients (90.1%), and was extratemporal or temporal plus in 66% of the cases. Follow-up was over one year in 55 of the 61 patients undergoing surgery: in the last year of follow-up, 58.2% were seizure-free (Engel Epilepsy Surgery Outcome Scale class I) and 76.4% had good outcomes (Engel I-II). Three patients (4.2%) presented brain haemorrhages.
ConclusionSEEG enables localisation of the EZ in patients in whom this was previously impossible, offering better surgical outcomes than other invasive techniques while having a relatively low rate of complications.
Las crisis epilépticas no se controlan con fármacos antiepilépticos en aproximadamente el 30% de los pacientes1,2, y en ellos la cirugía es eficaz cuando es posible localizar la zona epileptógena (ZE) y esta puede ser resecada quirúrgicamente. Hasta ahora se ha considerado que la cirugía de epilepsia es más resolutiva cuando la resonancia magnética (RM) cerebral muestra una lesión epileptógena evidente y circunscrita, cuya localización concuerda con la semiología de las crisis, la electroencefalografía (EEG) y otras pruebas complementarias. En esta situación la intervención permite el control de las crisis en más del 70% de los pacientes3,4. Sin embargo, en los últimos años se han publicado series en las que pacientes cuya RM cerebral no reveló una lesión bien definida también se beneficiaron de la cirugía tras ser examinados con estereoelectroencefalografía (E-EEG) utilizando electrodos profundos5-8. A esta situación clínica se le ha denominado «epilepsia focal refractaria difícil de localizar» (EFRDL). Avanzar en la localización de la ZE en pacientes con EFRDL tiene relevancia clínica, pues representan entre el 25% y 43% de los pacientes con epilepsia focal refractaria (EFR)9–12. La epilepsia no controlada en esta población tiene un gran impacto negativo en la calidad de vida, además de asociarse con tasas elevadas de depresión y muerte súbita13.
El objetivo de este trabajo consiste en describir nuestra experiencia con la E-EEG en la evaluación prequirúrgica de adultos, niños y adolescentes con EFRDL atendidos en el Programa de Epilepsia del Hospital Ruber Internacional y compararla con los resultados publicados por otros centros. En particular, describimos la capacidad para localizar la ZE, los resultados quirúrgicos obtenidos y la seguridad del procedimiento.
Material y métodosDesde septiembre de 2010 hasta junio de 2018, evaluamos mediante E-EEG a 71 pacientes con EFRDL. Las características de la implantación, las complicaciones de la E-EEG y los resultados quirúrgicos se recogieron de forma prospectiva.
La evaluación prequirúrgica no invasiva, incluyó los siguientes procedimientos: 1) estudio vídeo-EEG prolongado con registro de sus crisis, 2) estudio neuropsicológico y 3) RM cerebral de 3 teslas. En 59 pacientes se realizó PET/RM cerebral y en 16 pacientes magnetoelectroencefalografía fusionada con RM cerebral. La RM cerebral se consideró negativa cuando el neurorradiólogo (JAL) y el resto del equipo en sesión multidisciplinar no identificaron una lesión epileptógena.
Criterios de selección para la realización de estereoelectroencefalografíaLa E-EEG se indicó en todos aquellos pacientes con EFRDL en los que tras la fase inicial no invasiva de la evaluación prequirúrgica se pudo establecer una hipótesis sobre la localización de la ZE, si bien esta no era lo suficientemente sólida como para proceder directamente a la intervención quirúrgica14–16. Los criterios que se siguieron para la indicación de la E-EEG fueron: a) incongruencia entre los hallazgos de la RM cerebral y el cuadro electroclínico, b) lesiones extensas en la RM cerebral que no podían ser extirpadas por incluir corteza elocuente, c) sospecha de solapamiento y/o participación de zonas elocuentes en la ZE, d) necesidad de estudiar corteza cerebral profunda no abordable con otras técnicas y e) RM negativa.
Método de implantaciónLa implantación de los electrodos fue realizada por el mismo neurocirujano (RMA), siendo dirigida a la lesión visible en la RM cuando la había, las estructuras en las que se sospechaba el inicio ictal, las vías de propagación y, en algunos casos la zona sintomatogénica.
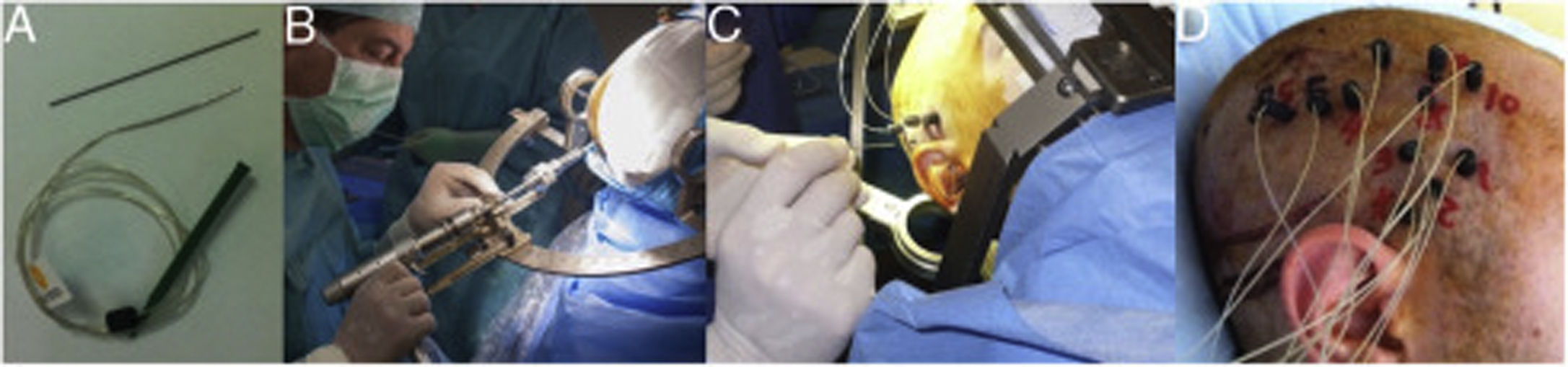
En la implantación se emplearon electrodos Microdeep® (Dixi Medical, Chaudefontaine, Francia) de diferentes contactos (fig. 1). La planificación de la trayectoria de cada electrodo fue realizada con un programa específico (Steronauta®) desarrollado por nuestro equipo (GR y WC) y que se aplica sobre la RM cerebral previa del paciente. El día de la implantación, se realizó una nueva RM cerebral en condiciones esterotácticas (Leksell Frame, Elekta®, Estocolmo, Suecia), adquiriéndose una secuencia 3D T1 con doble dosis de gadolinio. En un paso posterior, las trayectorias planificadas previamente fueron transferidas a esta nueva secuencia y revisadas una por una para evitar la colisión con vasos. Desde septiembre de 2013, se incluyó una secuencia 3D TOFT; con esta nueva secuencia, desde enero de 2015 añadimos una angiotomografía selectiva (desarrollada por GR y WC), que permite visualizar alrededor de cada electrodo la vascularización en el volumen cerebral que atraviesa, excluyendo los vasos que quedan más allá de su trayectoria. De esta forma se maximiza el número de trayectorias posibles y aumenta la seguridad del procedimiento. Tras la implantación se realizó un TAC multicorte que fue fusionado con la RM del paciente para conocer la trayectoria de cada electrodo y descartar complicaciones. Los pacientes ingresaron el mismo día de la implantación en la Unidad de vídeo-EEG. Antes de la retirada de los electrodos se realizó una RM cerebral de control y una TAC tras la retirada de los mismos.
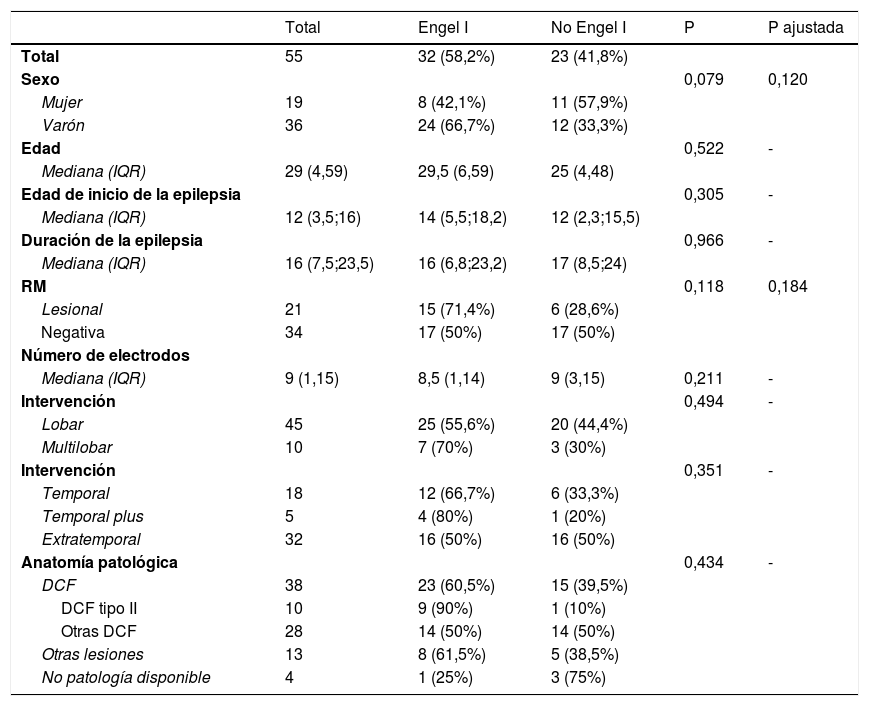
Ejemplo de la implantación de electrodos profundos en la E-EEG. A) Se emplean electrodos de 0,8mm, en el dibujo se compara con la mina de un portaminas de diámetro similar. B) Los electrodos son implantados individualmente guiados por las coordenadas de la planificación que son trasladadas a un marco estereotáxico de Leksell. C) Tras realizar la trayectoria intracraneal con una guía, se introduce el electrodo con una precisión milimétrica. D) En esta última imagen se muestra la implantación final en un paciente con sospecha de una epilepsia periinsular derecha.
En la planificación de la resección se tuvieron en cuenta los hallazgos de la evaluación no invasiva y los resultados de la E-EEG, considerándose las estructuras donde comenzaban las crisis (zona ictal), las estructuras con mayor actividad epileptifome y lentificación patológica (zona irritativa) y la proximidad de posibles zonas elocuentes con riesgo de déficit neurológico. Para definir la zona ictal se consideraron los patrones ictales descritos recientemente17,18. Los pacientes candidatos a cirugía fueron operados al menos un mes después de la implantación por los mismos cirujanos (JGA y JP).
Resultados quirúrgicosEl tejido resecado fue fijado en formaldehido y estudiado mediante microscopía óptica en tinciones de hematoxilina eosina y otras técnicas de inmunohistoquímica (NeuN, Map2). La evaluación de la histopatología fue realizada por un único patólogo (IB) y en cada paciente se estableció un diagnóstico de acuerdo con las clasificaciones
actuales19–21. Los resultados posquirúrgicos fueron recogidos prospectivamente a través de la entrevista con los pacientes en consultas seriadas. Para el análisis de los resultados quirúrgicos solo se analizaron los pacientes con un seguimiento mínimo de un año. Los resultados quirúrgicos se clasificaron de acuerdo a la clasificación de Engel22, donde Engel I-II se consideraron buenos resultados quirúrgicos y Engel III-IV como resultados no satisfactorios. Para la clasificación de Engel se consideró el último año de seguimiento en comparación con la situación basal antes de la cirugía. Todas las complicaciones que ocurrieron en los 30 días siguientes a la E-EEG se consideraron relacionadas con el procedimiento.
Análisis estadísticoLos análisis estadísticos se realizaron con el programa R (versión 3.1.2) e incluyeron análisis descriptivos y estudios de asociación univariables y multivariables. Los análisis de asociación univariables consistieron en el test de suma de rangos de Wilcoxon, el test t de Student, el test chi-cuadrado de Pearson o el test exacto de Fisher. Los ajustes por edad, sexo y duración de la enfermedad se realizaron por regresión logística y solo se aplicaron a las variables con valores p <0,2 en los test univariables. Se consideraron significativos los valores p <0,05.
ResultadosCaracterísticas demográficasDurante el periodo de estudio (8 años), se realizó E-EEG en 71 pacientes con EFRDL (27 mujeres, 38%) (tabla 1) con una mediana de edad de 30 años (rango 4-59 años). Entre ellos había 16 pacientes ≤18 años (mediana 8,5 años; rango 4-18 años). La mediana de edad en la que comenzó la epilepsia fue de 12 años (rango 0,1-53 años) y la mediana de edad cuando se hizo el estudio E-EEG de 16 años (2-38 años). En el momento de la evaluación, 62 pacientes (87%) presentaban crisis parciales complejas y 31 pacientes (42%) crisis secundariamente generalizadas tónico-clónicas. Nueve pacientes presentaban otros tipos de crisis focales motoras (hipermotoras, tónicas asimétricas y acinéticas).
Características clínicas y demográficas (n=71)
| Edad (años) | |
| Media (DE) | 29,3 (14,1) |
| Mediana (rango) | 30 (4-59) |
| Sexo | |
| Mujer | 27 (38%) |
| Varón | 44 (62%) |
| Edad de inicio de la epilepsia (años) | |
| Media (DE) | 12,5 (9,9) |
| Mediana (rango) | 12 (0,1-53) |
| Duración de la epilepsia (años) | |
| Media (DE) | 16,9 (10,8) |
| Mediana (rango) | 16 (2-38) |
| RM cerebral | |
| Negativa | 45 (63,4%) |
| Lesional | 26 (36,6%) |
| Lesional temporal circunscrito | 7 (9,8%) |
| Lesional extratemporal circunscrito | 5 (7%) |
| Lesional extenso multilobar | 11 (15,5%) |
| Lesional extenso frontal | 3 (4,2%) |
| PET cerebral | |
| Realizado | 59 (83,1%) |
| Norealizado | 12 (16,9%) |
La RM cerebral de 3 teslas fue negativa en 45 casos (63,4%), y mostró una lesión en 26 casos (36,6%): en 12 pacientes la lesión era circunscrita y en 14 pacientes la lesión era extensa (tabla 1). Se hizo PET cerebral en 59 pacientes (83,1%), incluyendo todos los pacientes con RM negativa y 14 pacientes con algún tipo de lesión. No hubo diferencias significativas entre los resultados de la RM cerebral (lesional vs. negativa) y las diferentes variables demográficas. En los pacientes con RM negativa fue más frecuente realizar un PET cerebral (test de razón de verosimilitudes, p <0,001).
Características de la implantación y localización de la zona epileptógenaLa duración media del ingreso fue de 5 días. Se implantaron un total de 627 electrodos (mediana de 9 electrodos por paciente, rango 1-17) (tabla 2). En los pacientes≤18 años la mediana de electrodos implantados fue inferior (7 electrodos, rango 5-14). En dos pacientes se combinaron electrodos profundos con mantas subdurales. Se implantaron más electrodos en pacientes con RM negativa que en pacientes con lesión en la RM (t de Student (69)=3,06, p=0,03). Las implantaciones fueron tanto lobares como multilobares (50,7% y 49,3% respectivamente), siendo la implantación frontal la localización lobar más frecuente (64%). La lateralidad de la implantación fue similar. En tan solo 4 pacientes la implantación fue bilateral. En un paciente se realizaron dos exploraciones en diferentes ingresos. El número de electrodos por paciente disminuyó en los últimos años, desde una mediana de 9,9 en los cuatro primeros años del desarrollo de la técnica hasta 6,8 electrodos en los últimos tres años. En 70 pacientes se realizó estimulación eléctrica cortical. Antes de la retirada de los electrodos, en 27 pacientes se realizó termocoagulación guiada por los hallazgos de la evaluación previa (técnica disponible en nuestro centro desde 2012).
Características del estudio E-EEG (n=71)
| Número de electrodos implantados (todos) | |
| Media (DE) | 8,8 (3,3) |
| Mediana (rango) | 9 (1-17) |
| Número de electrodos con RM lesional | |
| Media (DE) | 7,3 (3,4) |
| Mediana (rango) | 7 (1-14) |
| Número de electrodos con RM negativa | |
| Media (DE) | 9,7 (2,9) |
| Mediana (rango) | 9 (5-17) |
| Localización de los electrodos | |
| Lobar | 36 (50,7%) |
| Frontal | 23 (32,4%) |
| Temporal | 7 (9,8%) |
| Otros | 6 (8,5%) |
| Multilobar | 35 (49,3%) |
| Lateralidad de los electrodos | |
| Derecho | 35 (49,3%) |
| Izquierdo | 32 (45,1%) |
| Bilateral | 4 (5,6%) |
En 64 pacientes explorados (90,1%) la E-EEG permitió localizar la ZE (tabla 3). La ZE fue lobar en el 62% de los pacientes y multilobar en el 28,2%. La localización fue exclusivamente temporal en el 23,9% de los pacientes, temporal plus (temporal+otro lóbulo contiguo) en el 11,3% y extratemporal en el 54,9%, sin que se encontraran diferencias estadísticamente significativas entre los pacientes con RM lesional vs. negativa. En 7 pacientes no se localizó la ZE.
Características de la zona epileptógena (ZE) (n=71)
| Extensión de la ZE | |
| Lobar | 44 (62%) |
| Multilobar | 20 (28,2%) |
| No localizado* | 7 (9,9%) |
| Lateralidad de la ZE | |
| Derecho | 32 (45,1%) |
| Izquierdo | 32 (45,1%) |
| No localizado | 7 (9,9%) |
| Localización de la ZE: temporal vs. extratemporal | |
| Temporal | 17 (23,9%) |
| Temporal plus** | 8 (11,3%) |
| Extratemporal | 39 (54,9%) |
| No localizado | 7 (9,9%) |
| Localización de la ZE por lóbulos | |
| Frontal | 19 (26,8%) |
| Temporal | 17 (24%) |
| Occipital | 5 (7%) |
| Parietal | 3 (4,2%) |
| Temporal plus | 8 (11,3%) |
| Extratemporal multilobar | 12 (16,8%) |
| No localizado | 7 (9,9%) |
El tipo de intervención vino determinado por la localización de la ZE en relación con posibles zonas elocuentes, la extensión de la misma, la accesibilidad quirúrgica y/o la respuesta a la termocoagulación previa si se hubiera realizado. Bajo estas premisas, en 61 pacientes (85,8%) se realizó algún tipo de intervención: en 53 pacientes de los intervenidos (74,6%) se realizó cirugía convencional y en 5 pacientes (7%) radiocirugía con gamma knife (tabla 4). Hubo 3 pacientes (4,2%) que respondieron a la termocoagulación, no siendo necesario realizar otro procedimiento. La resección más frecuente fue la sublobar, con 48 pacientes intervenidos (67,6%), y la localización más frecuente fue la extratemporal, con 38 casos (53,5%). La resección frontal fue la intervención sublobar más frecuente (31%). La demora desde el debut de su epilepsia hasta la intervención fue de 16 años (2-38 años). En 10 pacientes (14,1%) no se realizó ningún tipo de intervención.
Características de la intervención (n=71) y de la patología (n=55)
| Tipo de intervención | |
| Cirugía | 53 (74,6%) |
| Radiocirugía | 5 (7%) |
| Termocoagulación | 3 (4,2%) |
| No operado | 10 (14,1%) |
| Pendiente de cirugía | 3 |
| ZE coincide con zona funcional | 2 |
| No localizado | 4 |
| Complicación hemorrágica | 1 |
| Localización de la intervención: extensión | |
| Sublobar | 48 (67,6%) |
| Multilobar | 14 (19,7%) |
| No operado | 10 (14,1%) |
| Localización de la intervención | |
| Temporal | 18 (25,4%) |
| Temporal plus | 5 (7%) |
| Extratemporal | 38 (53,5%) |
| Frontal | 22 (31%) |
| Otra localización | 16 (22,5%) |
| No operado | 10 (14,1%) |
| Patología | |
| Displasia cortical focal (DCF) | 41 (57,7%) |
| Otros | 14 (19,7%) |
| No patología disponible | 16 (22,6%) |
| Patología por subgrupos | |
| DCF tipo I | 12 |
| DCF tipo II | 11 |
| DCF tipo III | 5 |
| mMCD | 8 |
| MOGHE | 5 |
| Polimicrigiria | 3 |
| Esclerosis del hipocampo | 4 |
| DNET | 2 |
| Gliosis | 3 |
| Negativa | 2 |
| No patología disponible | 16 |
DNET: dysembryoplastic neuroepithelial tumor; mMCD: mild malformation of cortical development; MOGHE: mild malformation of cortical development with oligodendroglial hyperplasia.
La histopatología estuvo disponible en 55 pacientes, siendo la displasia cortical focal (DCF) la patología más frecuente en sus distintos subtipos (tabla 4). En los pacientes con DCF, la RM cerebral fue con frecuencia negativa (70,7% de los casos) en comparación con otras patologías (chi-cuadrado (2)=9,19, p=0,01).
Resultados quirúrgicosEn 55 pacientes de los 61 en los que se realizó algún tipo de intervención, el seguimiento fue superior a un año (tabla 5). En este grupo de pacientes la mediana de edad en la intervención fue de 29 años (rango 4-59 años) y el seguimiento medio de 4,8 años (rango 1-7,8 años). La RM cerebral fue negativa en 34 pacientes (62%) y se realizó una resección extratemporal en 32 pacientes (58%). En los dos primeros años de seguimiento (donde el número de pacientes era mayor), 35/55 pacientes (63,6%) estaban libres de crisis al año (Engel I), de los cuales 30 pacientes seguían en Engel I a los dos años (63,8%, 30/47 pacientes). En el último año de seguimiento 32 pacientes estaban libres de crisis (Engel I, 58,2%), siendo los resultados favorables (Engel I-II) en el 76,4% de las intervenciones.
Resultados quirúrgicos en pacientes con seguimiento superior al año (n=55)
| Total | Engel I | No Engel I | P | P ajustada | |
|---|---|---|---|---|---|
| Total | 55 | 32 (58,2%) | 23 (41,8%) | ||
| Sexo | 0,079 | 0,120 | |||
| Mujer | 19 | 8 (42,1%) | 11 (57,9%) | ||
| Varón | 36 | 24 (66,7%) | 12 (33,3%) | ||
| Edad | 0,522 | - | |||
| Mediana (IQR) | 29 (4,59) | 29,5 (6,59) | 25 (4,48) | ||
| Edad de inicio de la epilepsia | 0,305 | - | |||
| Mediana (IQR) | 12 (3,5;16) | 14 (5,5;18,2) | 12 (2,3;15,5) | ||
| Duración de la epilepsia | 0,966 | - | |||
| Mediana (IQR) | 16 (7,5;23,5) | 16 (6,8;23,2) | 17 (8,5;24) | ||
| RM | 0,118 | 0,184 | |||
| Lesional | 21 | 15 (71,4%) | 6 (28,6%) | ||
| Negativa | 34 | 17 (50%) | 17 (50%) | ||
| Número de electrodos | |||||
| Mediana (IQR) | 9 (1,15) | 8,5 (1,14) | 9 (3,15) | 0,211 | - |
| Intervención | 0,494 | - | |||
| Lobar | 45 | 25 (55,6%) | 20 (44,4%) | ||
| Multilobar | 10 | 7 (70%) | 3 (30%) | ||
| Intervención | 0,351 | - | |||
| Temporal | 18 | 12 (66,7%) | 6 (33,3%) | ||
| Temporal plus | 5 | 4 (80%) | 1 (20%) | ||
| Extratemporal | 32 | 16 (50%) | 16 (50%) | ||
| Anatomía patológica | 0,434 | - | |||
| DCF | 38 | 23 (60,5%) | 15 (39,5%) | ||
| DCF tipo II | 10 | 9 (90%) | 1 (10%) | ||
| Otras DCF | 28 | 14 (50%) | 14 (50%) | ||
| Otras lesiones | 13 | 8 (61,5%) | 5 (38,5%) | ||
| No patología disponible | 4 | 1 (25%) | 3 (75%) |
IQR: rango intercuartil; P: análisis univariables (ver texto); P ajustada: regresión logística ajustada por edad, sexo y duración de la epilepsia.
Aunque no se encontraron diferencias estadísticamente significativas entre las variables estudiadas y los resultados quirúrgicos (tabla 5), sí se observaron algunas tendencias. En particular, los mejores resultados quirúrgicos se observaron en los pacientes con RM lesional (71,4% Engel I) y resecciones temporales (66,7% Engel I). No obstante, en pacientes con resecciones extratemporales, un 50% estaban libres de crisis en el último año de seguimiento y en un 72% el resultado fue favorable (Engel I o II). Estos resultados fueron ligeramente inferiores si además la RM fue negativa (45% Engel I, 70% Engel I o II). Trece de los 16 pacientes≤18 años intervenidos tenían un seguimiento superior al año; siete de ellos (53,8%) estaban libres de crisis y otro paciente había mejorado más de un 90% (Engel II).
En la mayoría de los casos con DCF tipo II se obtuvieron buenos resultados quirúrgicos (90% Engel I), pero las diferencias entre grupos no llegaron a ser estadísticamente significativas (test exacto de Fisher, p=0,434), incluso cuando se compararon los pacientes con DCF II, otros tipos DCF y otras patologías (test exacto de Fisher, p=0,087) (tabla 5).
Complicaciones relacionadas con la estereoelectroencefalografíaTres pacientes (4,2%) presentaron una hemorragia cerebral que llevó a la retirada inmediata de los electrodos y a su intervención. Todas las hemorragias ocurrieron en los años previos a la implantación de la angiotomografía selectiva, sin que se hayan producido nuevas hemorragias desde el año 2015. Dos de las hemorragias fueron frontales izquierdos y otra temporal derecha. Un paciente desarrolló una hemiparesia derecha con mejoría parcial durante el seguimiento y otro paciente una hemianopsia homónima izquierda. Aunque en ninguno de los casos se volvió a realizar E-EEG, dos de los tres pacientes acabarían operándose meses después guiados por la información de la evaluación prequirúrgica (resultados quirúrgicos incluidos en el análisis), realizándose resecciones más amplias que las que hubieran resultado de la evaluación E-EEG. Una paciente desarrolló una monoparesia transitoria tras la termocoagulación.
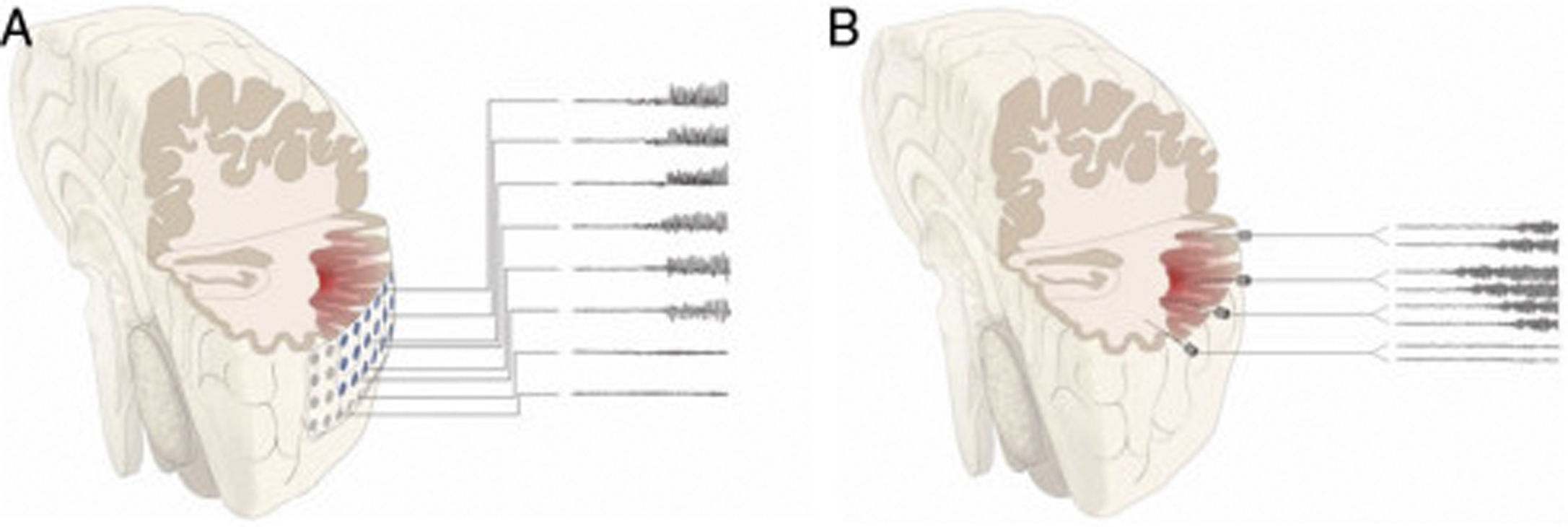
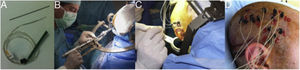
DiscusiónAunque clásicamente se ha considerado que la cirugía no es una opción en pacientes con RM normal o con lesiones extensas que no pueden ser resecadas completamente, el conocimiento acumulado sobre la semiología de las crisis y los patrones del EEG, así como las técnicas de imagen funcional, han permitido el tratamiento quirúrgico eficaz en muchos pacientes con RM de estas características23–27. La mejoría en los resultados quirúrgicos se debe además a la implantación de la E-EEG. Esta técnica, desarrollada principalmente por las escuelas francesa y norte-italiana5,7,15, aporta mayor precisión en la localización de la ZE que los electrodos subdurales, que fueron extensamente utilizados entre 1990 y 2010 en la mayoría de los centros de cirugía de epilepsia estadounidenses y en muchos europeos12,28–30 (fig. 2).
Esquema que representa el inicio y la propagación de una crisis con electrodos intracraneales. En la figura A) la crisis se registra con electrodos subdurales que exploran la corona del giro, sin poder registrar lo que sucede en la profundidad del mismo. De esta forma podemos tener un patrón falsamente localizador, con un inicio de la descarga que es registrado de forma simultánea por múltiples contactos de la manta de electrodos subdurales, sin conseguir identificar el inicio de la crisis. En la figura B) la crisis se registra con electrodos profundos (E-EEG). Si la hipótesis de implantación ha sido la correcta, podemos identificar el inicio ictal en una zona muy concreta de la corteza (en este ejemplo en la profundidad del giro), desde donde la crisis propaga hacia otros electrodos en forma de un patrón ictal claramente evolutivo.
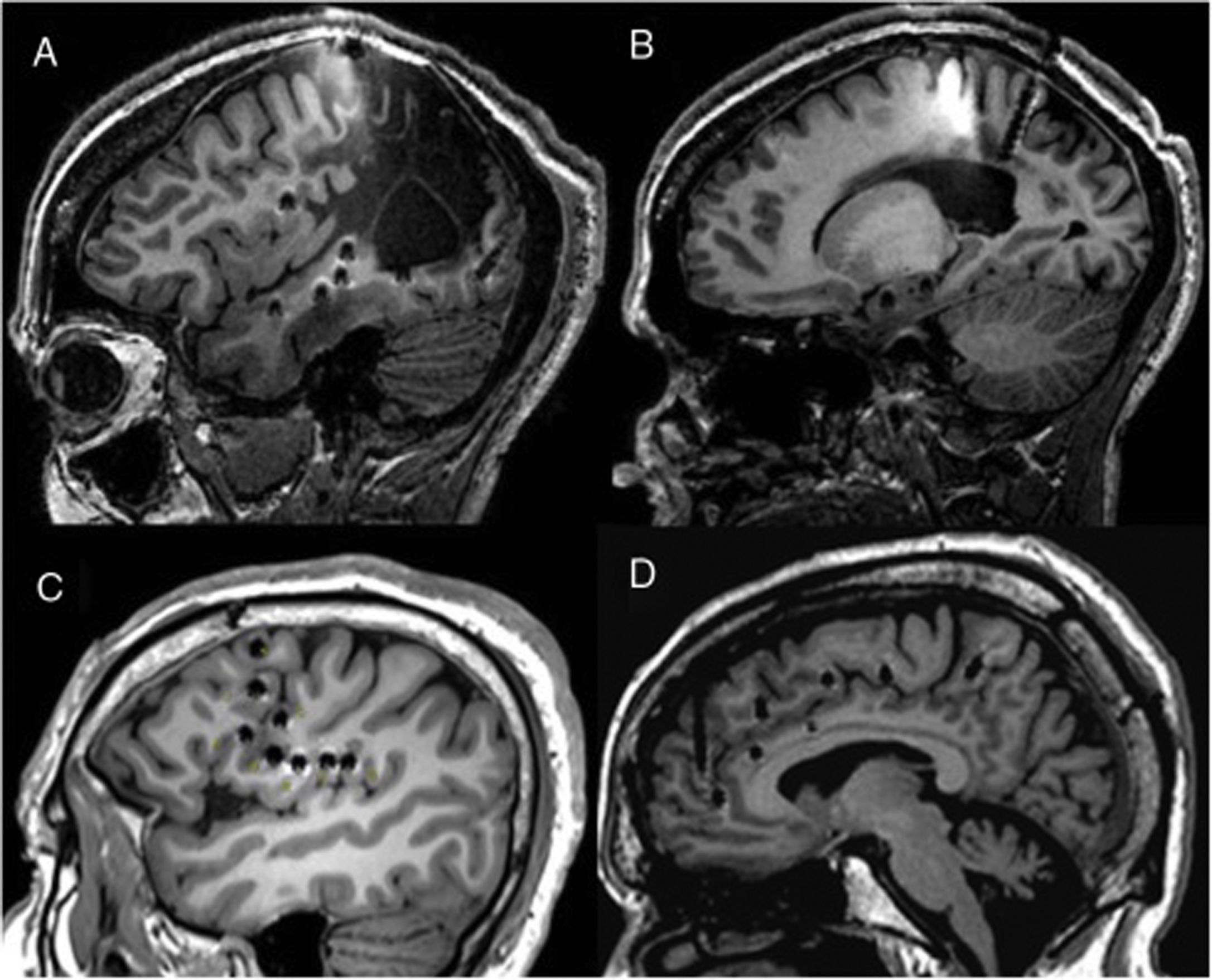
En este trabajo mostramos la experiencia adquirida en nuestro centro con la E-EEG como técnica diagnóstica en pacientes con EFRDL. Aunque se trata de una muestra heterogénea de pacientes evaluados de forma consecutiva en los últimos ocho años, todos ellos comparten una gran dificultad en la localización de la ZE y representan la práctica habitual en nuestro centro. La complejidad en la evaluación prequirúrgica en esta serie viene apoyada porque hasta en un 63% de los pacientes la RM cerebral de 3 teslas fue negativa y en un 66% la localización de la ZE fue extratemporal o temporal plus, factores que muchas veces se han asociado con pobres resultados quirúrgicos9,31 (fig. 3). Nuestros datos son comparables a la de otros centros europeos y norteamericanos publicados en los últimos años5–8, donde la E-EEG es la técnica de referencia en pacientes con EFRDL. A diferencia de otras series en las que se han incluido pacientes evaluados con RM cerebral de diferentes características (por ejemplo 1,5 tesla)5,16, en todos nuestros pacientes empleamos una RM cerebral de 3 teslas con un protocolo específico. Esto, comparando con RM de 1,5 teslas, disminuye la posibilidad de que ciertas lesiones epileptógenas sutiles pasaran desapercibidas.
Ejemplos de diferentes abordajes que muestran cómo la E-EEG permite explorar regiones extratemporales de difícil acceso a otras técnicas como los electrodos subdurales. A y B) Exploración en un paciente con una lesión porencefálica extensa donde se explora estructuras neocorticales y mediales. C) Exploración perirolándica e insular en un paciente con RM negativa. D) Exploración frontal medial empleando un abordaje ortogonal y oblicuo.
En un 90% de los pacientes explorados pudimos localizar la ZE, siendo estos resultados similares a las series más recientes con E-EEG5,8 y considerablemente superiores a las series más antiguas con electrodos subdurales, donde hasta en un 30-40% de los pacientes explorados se retiraban los electrodos sin poder ofrecer cirugía29,30. El número medio de electrodos implantados fue de alrededor de 9, siendo algo superior en pacientes con RM negativa. En comparación con otros centros, donde el número medio de electrodos oscila entre 11-13 electrodos5,16, fuimos más conservadores y apenas tuvimos que realizar abordajes bilaterales. Las diferencias con otros centros pueden obedecer al desarrollo en los últimos años de técnicas de neuroimagen más avanzadas, empleadas también en nuestro centro, donde la evaluación prequirúrgica no invasiva permite reducir el área que debe ser explorada con electrodos profundos24–27. Además, con nuestra técnica de implantación pudimos realizar abordajes oblicuos y ortogonales, permitiendo explorar con un mismo electrodo regiones cerebrales que precisarían de varios electrodos ortogonales. De esta forma, en los últimos años se ha reducido el número de electrodos implantados.
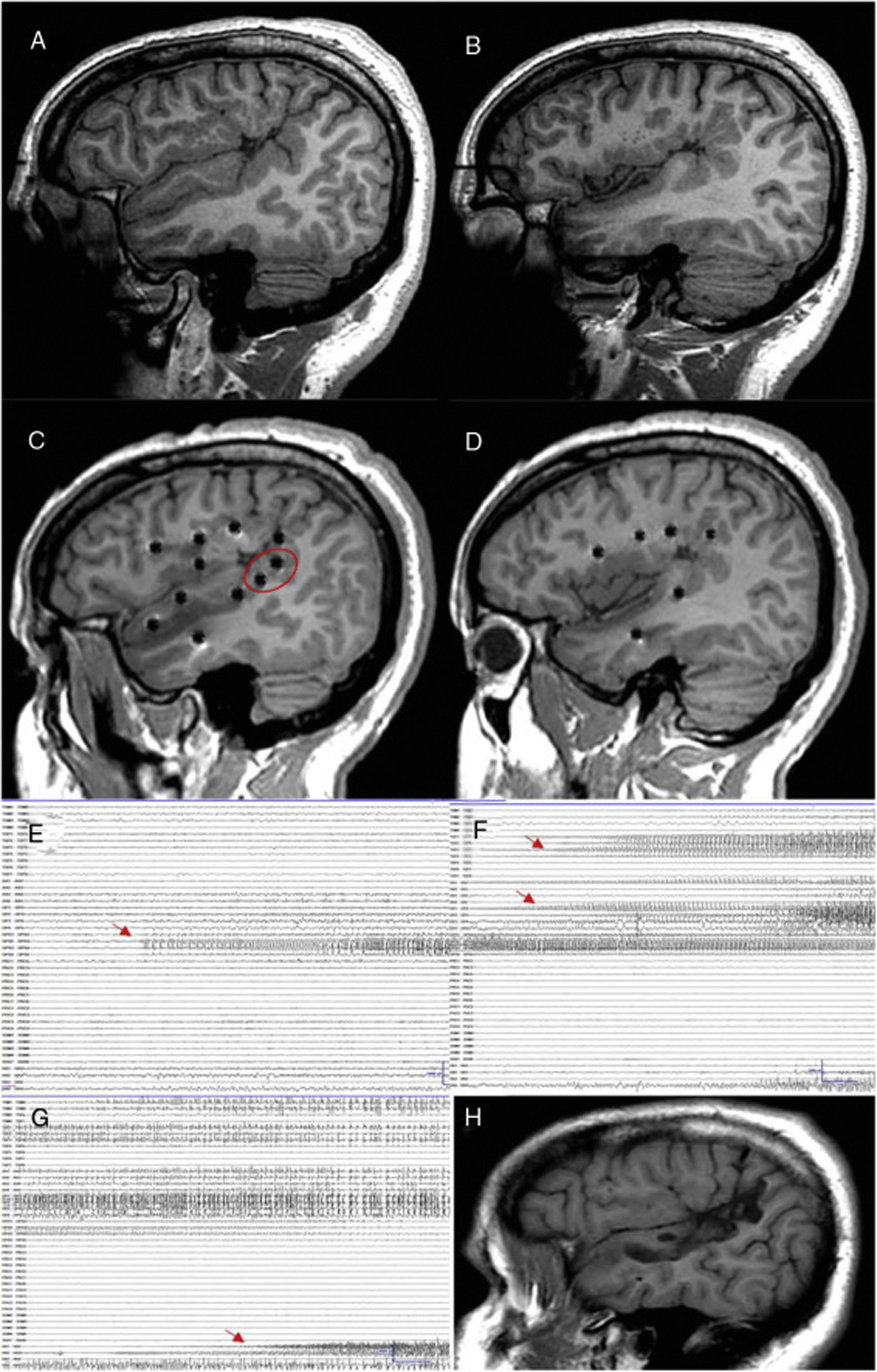
Tipo de intervenciónPese a que la implantación fue multilobar en cerca del 50% de los pacientes explorados, la E-EEG mostró que la ZE era sublobar en prácticamente el 62% de los pacientes, siendo en su mayoría extratemporal y/o temporal plus (66%). La E-EEG junto con otros datos de la evaluación prequirúrgica permitió realizar resecciones de volumen relativamente reducido en la mayoría de los pacientes (fig. 4). Estos datos reflejan la complejidad en la evaluación de este tipo de pacientes y la práctica habitual en muchos centros quirúrgicos5,23. Así, un trabajo europeo reciente32 muestra cómo en los últimos años el aumento en el número de cirugías ha sido a expensas de cirugías extratemporales y de pacientes no lesionales.
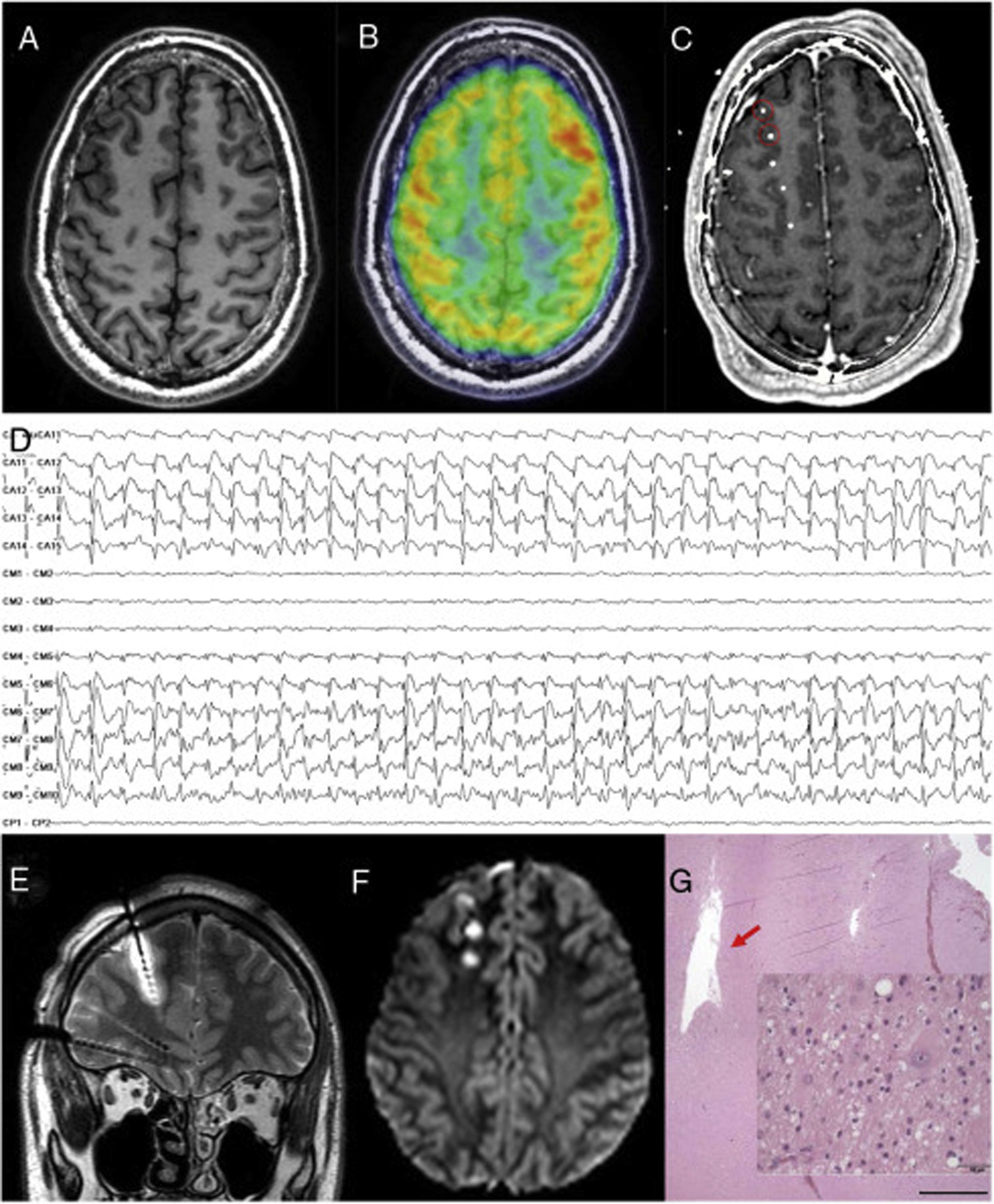
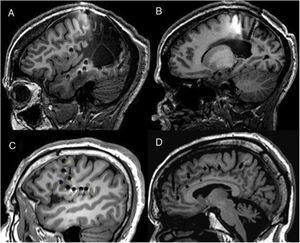
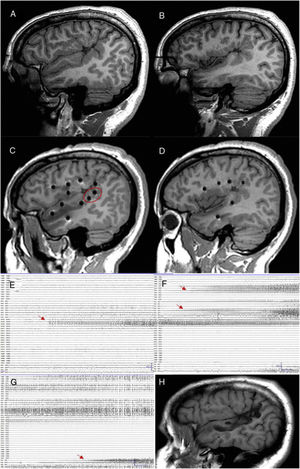
Paciente con epilepsia focal en relación con una polimicrogiria perisilviana derecha extensa. A y B) Secuencia T1 sagital que muestra la extensión de la malformación, con afectación profunda a nivel de la ínsula y de los opérculos. C y D) Abordaje extenso con electrodos profundos que permiten explorar la corteza en diferentes planos, incluyendo la ínsula. E) La crisis comienza en la parte posterior del giro temporal superior (círculo en blanco en C). F) Evolución sobre corteza temporal e ínsula posterior. G) Evolución al hipocampo. H) Secuencia T1 sagital que muestra cómo una resección limitada en el giro temporal superior puede conseguir el control de la epilepsia en este paciente, pese a presentar una lesión más extensa.
En 27 pacientes se realizó termocoagulación, una técnica que, aunque generalmente tiene un carácter paliativo33,34 en tres de nuestros pacientes consiguió una mejoría permanente que evitó una cirugía posterior. Es posible, aunque aún no disponemos de un número suficiente de pacientes con seguimiento a largo plazo, que una mejoría transitoria tras esta técnica, anticipe una respuesta favorable si finalmente el paciente es operado. Además, cinco de nuestros pacientes fueron tratados con gamma knife. Se decidió emplear esta técnica debido al riesgo quirúrgico asociado a una posible corticectomía sobre la región cerebral donde se localizó la ZE.
Resultados quirúrgicosEn el último año de seguimiento, aproximadamente un 76% de los pacientes intervenidos habían mejorado significativamente, con cerca de un 60% de pacientes libres de crisis. Aunque nuestra muestra y el seguimiento realizado no son totalmente comparables a los de otros estudios, los resultados obtenidos son similares a las series más recientes que muestran una libertad de crisis entorno al 56-62% en pacientes con EFRDL evaluados con E-EEG5,7,8. Los resultados en los primeros dos años poscirugía, donde se dispone de mayor número de pacientes, son similares a los resultados más optimistas5, con un 80% de pacientes con mejoría marcada; de ellos un 63% estaban libres de crisis al primer y segundo año poscirugía. Aunque con un menor número de pacientes, los resultados también fueron favorables en alrededor de un 54% de niños y adolescentes intervenidos.
En nuestra serie, variables como la histopatología, la localización de la resección o las características de la RM cerebral no se asociaron estadísticamente a un mejor resultado posquirúrgico. Estos hallazgos se podrían explicar porque implantamos a pacientes con una distribución homogénea en cuanto a la complejidad de la localización de la ZE, incluyendo pacientes con lesiones extensas, donde la localización de la ZE puede ser tan compleja como en los pacientes con RM negativa. No obstante, en base al número limitado de pacientes en cada subgrupo, no se puede descartar que se trate de un efecto del tamaño muestral. Pese a lo anterior, sí encontramos una tendencia entre los mejores resultados quirúrgicos y el tipo de intervención. La mejor respuesta se obtuvo en pacientes con epilepsia temporal, especialmente con lesiones, siendo este grupo de pacientes los menos frecuentes en nuestra serie, al ser pacientes donde generalmente no se precisa E-EEG. Históricamente es un dato conocido que la cirugía de epilepsia ofrece resultados inferiores en pacientes con epilepsias extratemporales, especialmente con una RM cerebral negativa9,10,29–32,35; en nuestra serie, en el último año de seguimiento, la mitad de los pacientes con epilepsia extratemporal estaba sin crisis, siendo la cifra ligeramente inferior en pacientes en los que además la RM cerebral fue normal. Estas cifras son más optimistas que las obtenidas en un metanálisis y una serie de estudios previos que muestran una libertad de crisis inferior al 40%29,35,36, y se asemejan a los resultados de pacientes estudiados con E-EEG en otros centros5,8.
La histopatología más frecuente fue la DCF, representando la mayoría de las patologías en pacientes con RM negativa (fig. 5). En este grupo, las DCF pobremente circunscritas fueron las más frecuentes, lesiones frecuentemente asociadas con RM normal y afectación cortical más extensa, que son factores asociados a un peor pronóstico quirúrgico9,12,29,35. Por lo tanto, la recurrencia de crisis en algunos pacientes durante los últimos años de seguimiento, se puede explicar por la dificultad para delimitar completamente la ZE por E-EEG y otras técnicas.
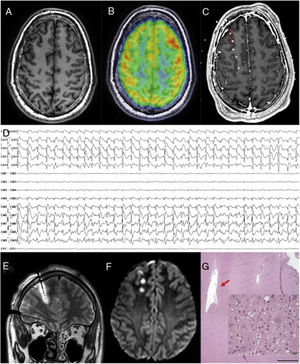
Paciente con epilepsia frontal con RM negativa donde se localiza la zona epileptógena y se realiza termocoagulación. A) Secuencia T1 axial con un patrón giral normal. B) PET fusionado con RM cerebral que muestra una dudosa área de hipometabolismo frontopolar derecho. C) RM cerebral fusionada con TAC craneal con electrodos implantados explorando esa región (no se muestran todos los electrodos de la implantación). D) Patrón interictal que muestra una punta periódica sobre los dos primeros electrodos, patrón sugerente de una displasia cortical tipo IIb. E) Secuencia T2 coronal que muestra el edema que produce la termocoagulación sobre el electrodo anteriormente descrito. F) Secuencia DWI axial que muestra las lesiones generadas por la termocoagulación una vez retirados los electrodos. G) El paciente sería finalmente intervenido. En esta imagen que muestra la patología en la tinción de hematoxilina-eosina, se puede apreciar la cavidad producida por la termocoagulación. A un mayor aumento, en la misma tinción se observan células dismórficas y globoides que confirman el diagnóstico de displasia cortical focal tipo IIb.
La tasa de complicaciones en nuestra serie (4% de hemorragias), donde empleamos la E-EEG con una serie de modificaciones con respecto a la metodología original14,15, son similares a las de otros estudios8,14–16 e inferiores a las descritas con electrodos subdurales37,38. A diferencia de otros centros europeos y norteamericanos, en la implantación de los electrodos no empleamos angiografía por substracción digital para la visualización de la anatomía vascular. En su lugar, al igual que en otros centros39, diseñamos un programa específico que muestra la trayectoria individual de cada electrodo en relación con los vasos visualizados sobre una RM cerebral con doble dosis de gadolinio y sobre una secuencia vascular (3D TOFT). Desde el año 2015 hemos desarrollado una técnica específica, la angiotomografía selectiva, que sustituye a la angiografía por substracción digital y nos permite hacer una angiografía selectiva del volumen cerebral por donde va a pasar cada electrodo de forma individual, sin que hayamos tenido ninguna complicación desde entonces.
ConclusionesLa E-EEG es una técnica diagnóstica que permite evaluar a pacientes complejos que sufren una EFRDL, ofreciendo unos resultados quirúrgicos superiores a técnicas invasivas previas a expensas de una tasa de complicaciones relativamente baja. Esta técnica, cuando es correctamente diseñada sobre una evaluación prequirúrgica sólida, permite rescatar a pacientes que históricamente no eran considerados candidatos quirúrgicos y mejorar la localización de la ZE. Las series publicadas, incluida la nuestra, muestran unos resultados similares en los centros que han adquirido experiencia en la aplicación de esta técnica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores de este trabajo están inmensamente agradecidos al trabajo realizado por el equipo de enfermería de la Unidad de Video-EEG.