Analizar un grupo de pacientes con síndrome parkinsoniano mediante estudios seriados con FP-CIT, valorando fundamentalmente los resultados falsamente negativos iniciales.
MétodosEstudio retrospectivo en el que se incluye a 92 pacientes (55 varones y 37 mujeres), a los que se les realizó un doble estudio con FP-CIT pues existían discrepancias entre este y la evolución clínica del paciente. El tiempo medio ± desviación estándar transcurrido entre ambos estudios fue de 26 ± 6 meses. Se realizó una valoración semicuantitativa analizando mediante la historia clínica y la bibliografía disponible los casos discrepantes con estudio inicial normal y posterior patológico.
ResultadosDel total de 184 estudios realizados a 92 pacientes, 11/92 mostraron resultados discrepantes entre estudio inicial y tardío. De estos, en 7/11 el estudio inicial fue normal y el posterior patológico. Los rasgos clínicos predominantes que pudieran explicar este comportamiento mostraron que en 4/7 sujetos destacó la presentación de un cuadro parkinsoniano con predominio de la clínica tremórica; 1/7 presentó un síndrome parkinsoniano en estadio inicial en tratamiento con fármaco antidopaminérgico, 1/7 fue catalogado de probable atrofia multisistema tipo C y 1/7 presentaba un cuadro de parkinsonismo atípico, sin que encontráramos justificación para dicho comportamiento.
ConclusionesLa realización de estudios seriados con FP-CIT carece de fundamento en gran proporción de casos, aunque existen ciertas situaciones clínicas que pueden justificarlo.
To assess a group of patients with parkinsonism using serial studies with FP-CIT, basically the initial false negative results.
MethodsRestrospective study of 92 patients (55 men and 37 women) who had undergone 2 different FP-CIT studies because of discrepancies between study results and clinical progression. The mean elapsed time between the studies was 26 months (SD: 6). We performed a semi-quantitative study using the patient's clinical history and the available literature to analyse discrepant cases with a normal initial study and subsequent pathological findings.
ResultsA total of 184 studies were completed for 92 patients; 11 of those 92 showed discrepancies between initial and subsequent studies. Among the 11 discrepant cases, 7 showed a normal initial study and pathological findings at a later date. Analysis of the predominant clinical features that might explain this behaviour revealed that 4 of these 7 subjects presented tremor-dominant parkinsonism. Regarding the rest, 1 presented early stage parkinsonism and was treated with antidopaminergic agents; 1 was classified as probable multisystem atrophy type C, and the third showed clinical signs of atypical parkinsonism without any causes of those signs being identified.
ConclusionsSerial FP-CIT studies are unnecessary in the large majority of cases, but they may be justifiable in certain clinical situations.
La medida de la densidad de transportadores de dopamina (DAT), proteínas situadas en el terminal presináptico de neuronas dopaminérgicas que se encargan de la recaptación de dopamina, mediante técnicas tomográficas, bien SPECT o PET, usando ligandos específicos nos aporta una medida directa «in vivo» de la integridad de la vía estriato-nígrica. Diversos trazadores derivados del tropano y análogos de la cocaína se han utilizado para este propósito, entre ellos el ioflupano o FP-CIT-I-123 (N-ω-fluoropropil-2ß-carbometoxi-3ß-[4-iodofenil] nortropano). Esta técnica diagnóstica permite la detección de una enfermedad de Parkinson (EP) aun cuando esta se encuentra en fase de afectació premotora, como casos de déficit olfatorio1 o trastorno del sueño asociado a fase REM2. En este sentido, se ha comprobado que ante la pérdida de neuronas dopaminérgicas se produce una regulación al alza de la dopa decarboxilasa3 y un mecanismo de regulación a la baja de receptores DAT4, hecho que contribuye a un teórico elevado nivel de sensibilidad. Sin embargo, aún teniendo en cuenta los Scan Without Evidence of Dopaminergic Deficit, que suponen aproximadamente el 10% de los pacientes (según datos extraídos de los distintos ensayos clínicos realizados sobre medicación neuroprotectora), que van a originar una merma de la validez diagnóstica de la técnica, el valor predictivo negativo de la misma no alcanza niveles óptimos5.
Por otra parte, dado que se ha descrito una pérdida de neuronas dopaminérgicas de la vía nigroestriada en pacientes con parkinsonismo (PK) degenerativo de un 6-13% anual6 frente a un 0-2,5% por década que presentan los controles normales de la misma edad y que la tasa de progresión no es lineal, con una pérdida más rápida en fases iniciales respecto a estadios más avanzados, es plausible la realización de un nuevo estudio tras un periodo prudencial con objeto de valorar el desarrollo de un PK degenerativo.
Pretendemos analizar a un grupo de pacientes con un síndrome parkinsoniano (SP) a los que se les ha realizado estudios seriados con FP-CIT, centrándonos fundamentalmente en los que presentaron un estudio inicial valorado como normal (N) y control posterior como patológico (P) (secuencia N-P) y determinar mediante análisis de la historia clínica, y en función de la bibliografía disponible, las causas más probables de este comportamiento como causa de posibles falsos resultados negativos. De forma análoga y como objetivo secundario, valoramos la secuencia inversa (P-N).
Material y métodosPacientesSe estudió de forma retrospectiva a 92 pacientes (55 varones y 37 mujeres) procedentes de la unidad de trastornos del movimiento de nuestro centro, a los que se les realizó de forma secuencial un doble estudio con FP-CIT, uno inicial y un control evolutivo posterior, pues existían discrepancias entre el resultado del mencionado estudio y la clínica del paciente. Asimismo se incluyeron 20 pacientes con diagnóstico clínico de temblor esencial, que se utilizaron como controles y que fueron analizados previamente.
En los pacientes que constituyen el objetivo central de este trabajo (casos discordantes), el diagnóstico clínico final se realizó mediante seguimiento con un periodo mínimo de 18 meses. Todos los pacientes se encontraban en un estadio similar de su enfermedad, puesto que en todos los casos se solicitó el estudio con FP-CIT tras la valoración clínica inicial. En la tabla 1 se muestra a los pacientes según esta orientación inicial.
El tiempo medio±desviación estándar transcurrido entre ambos estudios fue de 26±5 meses. La edad media de los pacientes en el momento del primer estudio fue de 69,3 años (36-84), con una desviación estándar de 9,2 años.
MétodoLas imágenes se obtuvieron tras un periodo comprendido entre 3 y 4 h de la inyección por vía intravenosa de 185 MBq (5 mCi) de FP-CIT-I-123, previo bloqueo tiroideo con solución de lugol. El estudio tomográfico (SPECT) con ioflupano/FP-CIT se llevó a cabo con una gammacámara Siemens, modelo Symbia, dotada con doble cabezal y colimador de baja energía y alta resolución. Se realizó órbita circular de 360° alrededor del cráneo, a intervalos de 3°, 60 imágenes con una duración de 35 s por intervalo, matriz 128×128. Se realizó reconstrucción de las imágenes mediante algoritmos de retroproyección filtrada sin corrección de atenuación, aplicación de un filtro de Hanning (frecuencia de 0,7) y se obtuvieron imágenes según cortes transaxiales y orientación orbito-meatal.
Los estudios se valoraron según análisis semicuantitativo, estableciendo un índice de captación entre área de actividad específica (unión a transportadores dopaminérgicos a nivel estriatal) y área de actividad inespecífica (corteza occipital) obteniendo el índice estriado/occipital (E/O). Para ello se obtuvieron regiones de interés (ROI) sobre ambos estriados (cuentas media, ROI rectangular de 250 píxeles) y captación media sobre lóbulo occipital (ROI de 350 píxeles con morfología rectangular) en la resultante de la suma de las 6 imágenes más representativas de la actividad estriatal (grosor de corte: 3,39mm; total grosor examinado: 20,34mm). Con objeto de obtener una valoración global del estado de la vía nigroestriada, se realizó la media aritmética del índice de ambos hemisferios.
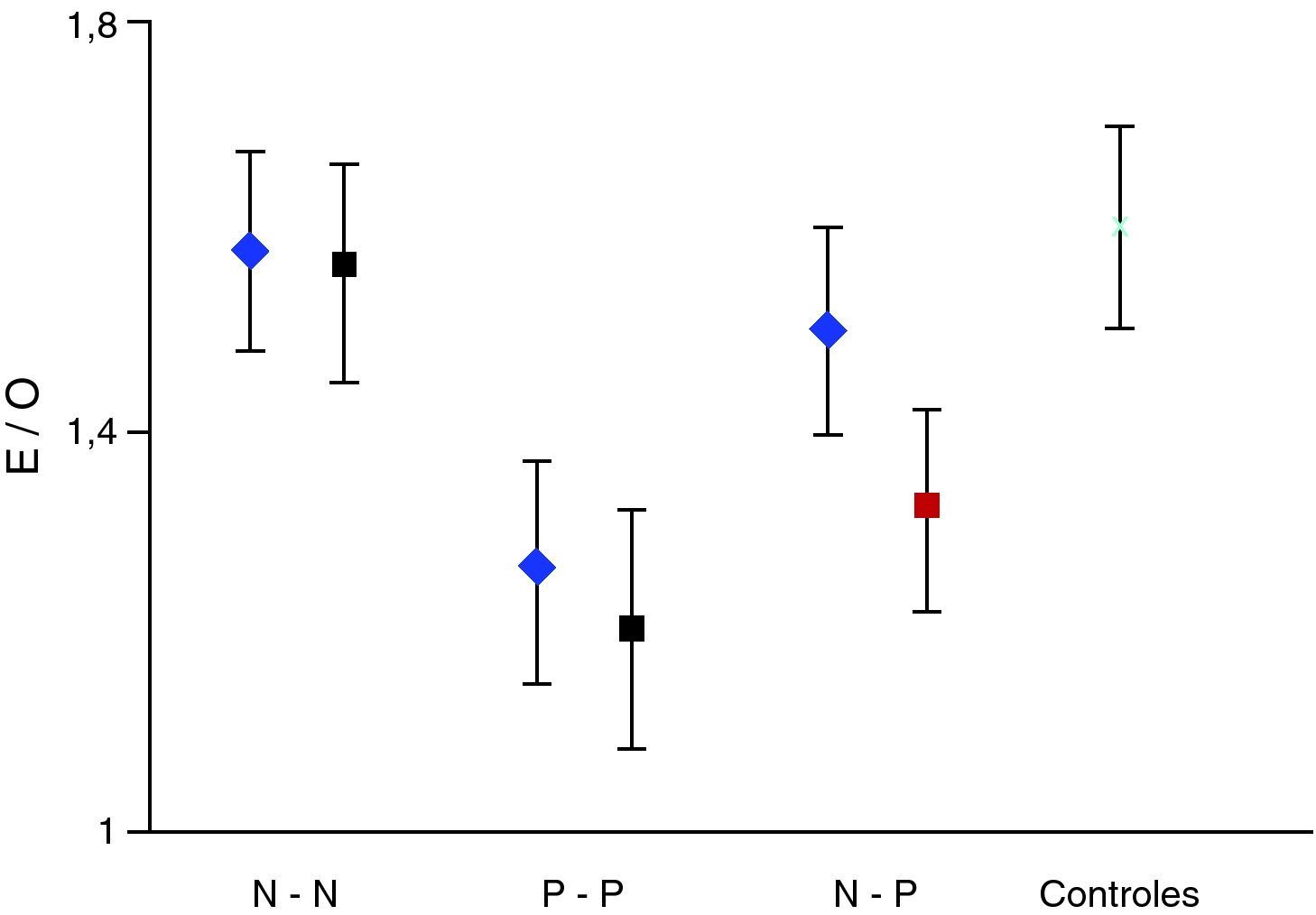
Partiendo de que la curva de distribución del mencionado índice sigue un patrón normal, el estudio se consideró como normal cuando el índice obtenido quedaba incluido en el rango de la media±2 DE del grupo control y patológico cuando descendía por debajo de la media –2 DE. Del grupo control se obtuvo una media del índice E/O de 1,60 con una DE de 0,10. Por tanto, se consideró patológico a todo paciente con un índice E/O por debajo de 1,4. Se establecieron así 4 grupos de estudio según el resultado del FP-CIT en el estudio inicial y final. Grupo o secuencia N-N, P-P, N-P y P-P. Estas 2 últimas secuencias o grupos discordantes constituyen el objetivo prioritario del presente trabajo.
La discrepancia clínico-gammagráfica vino dada cuando el neurólogo responsable evidenció en función de la presentación clínica y la evolución posterior un contexto sugerente de PK degenerativo con un estudio con FP-CIT inicial en rango de normalidad o bien un estudio inicial considerado patológico con evolución posterior no sugerente de cuadro degenerativo, atendiendo a aspectos como valoración según escalas evolutivas, presentación de rasgo atípico, respuesta a L-dopa o agonistas dopaminérgicos, posible interferencia farmacológica, entre otros. En este último supuesto, en los casos en los que se constató una posible interferencia, se repitió el estudio suspendiendo el fármaco el equivalente a 4 veces la vida media de eliminación7.
Análisis estadísticoLos datos se analizaron en programa estadístico SPSS (versión 13.0). Se utilizan medidas centrales de dispersión para describir las variables cuantitativas. Se utilizó un test paramétrico (t de Student) para la comparación de medias. En general, se consideró un nivel de significación para p<0,05. Se estableció un intervalo de confianza del 95%. La normalidad en la distribución de la curva se estableció mediante el test de Kolgomorov-Smirnov.
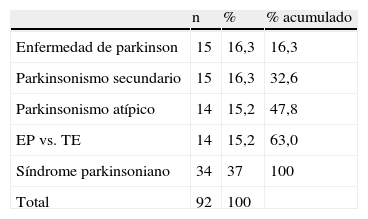
ResultadosSe han realizado un total de 184 estudios correspondientes a 92 pacientes; 81/92 (88%) sujetos mostraron resultados concordantes entre estudio inicial y control, y 51/81 (62,9%), tanto el estudio inicial como el control, se consideraron normales (N-N). En 30/81 (37,1%) ambos estudios fueron considerados patológicos (P-P). Por otra parte, 11/92 (11,9%) fueron discrepantes. De estos 7/11, el inicial resultó normal y el posterior patológico (N-P), por 4/11 el supuesto contrario (P-N).
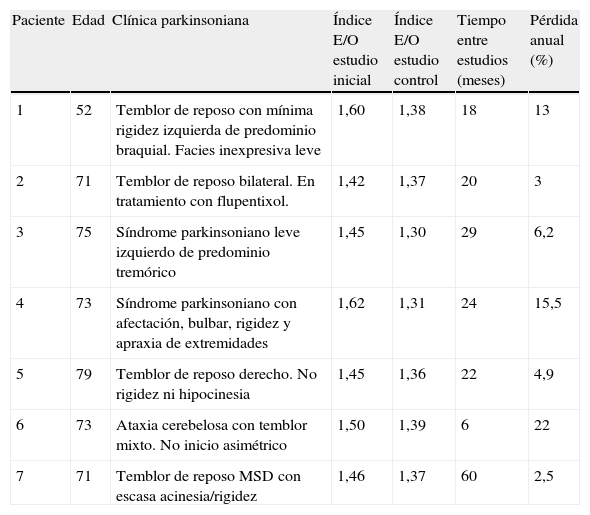
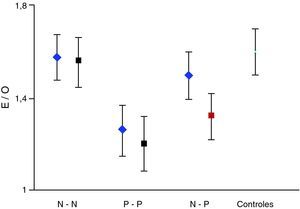
La valoración semicuantitativa aportó los siguientes datos: el valor medio del índice E/O correspondiente a pacientes con resultados concordantes entre ambos estudios, secuencia N-N mostró: 1,58±0,10 (inicial); 1,56±0,11 (final); p>0,05. Secuencia P-P: 1,26±0,11 (inicial); 1,20±0,12 (final); p>0,05. Secuencia P-N: 1,32±0,10; 1,48 ± 0,12; p>0,05. Secuencia N-P: 1,50±0,12; 1,35±0,10; p>0,05. La pérdida media anual estimada de este último grupo fue de 8,15 ± 7,5%. El índice E/O mostró en el grupo control un valor medio de 1,60±0,11. Estos datos se expresan en la figura 1. La clínica predominante del grupo N-P junto con datos relevantes de la valoración semicuantitativa se exponen en la tabla 2.
Valoración semicuantitativa de pacientes con secuencia normal/patológica de estudios seriados con FP-CIT y clínica predominante
| Paciente | Edad | Clínica parkinsoniana | Índice E/O estudio inicial | Índice E/O estudio control | Tiempo entre estudios (meses) | Pérdida anual (%) |
| 1 | 52 | Temblor de reposo con mínima rigidez izquierda de predominio braquial. Facies inexpresiva leve | 1,60 | 1,38 | 18 | 13 |
| 2 | 71 | Temblor de reposo bilateral. En tratamiento con flupentixol. | 1,42 | 1,37 | 20 | 3 |
| 3 | 75 | Síndrome parkinsoniano leve izquierdo de predominio tremórico | 1,45 | 1,30 | 29 | 6,2 |
| 4 | 73 | Síndrome parkinsoniano con afectación, bulbar, rigidez y apraxia de extremidades | 1,62 | 1,31 | 24 | 15,5 |
| 5 | 79 | Temblor de reposo derecho. No rigidez ni hipocinesia | 1,45 | 1,36 | 22 | 4,9 |
| 6 | 73 | Ataxia cerebelosa con temblor mixto. No inicio asimétrico | 1,50 | 1,39 | 6 | 22 |
| 7 | 71 | Temblor de reposo MSD con escasa acinesia/rigidez | 1,46 | 1,37 | 60 | 2,5 |
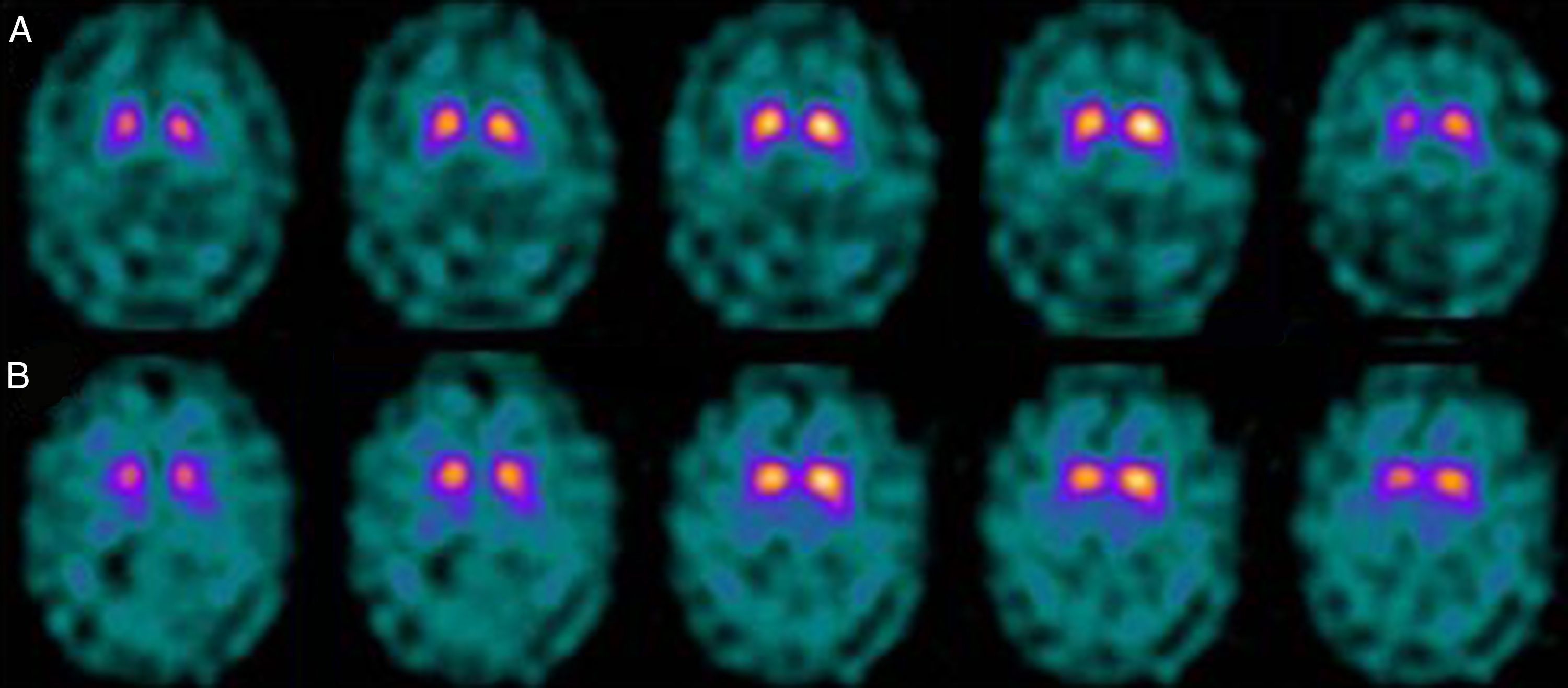
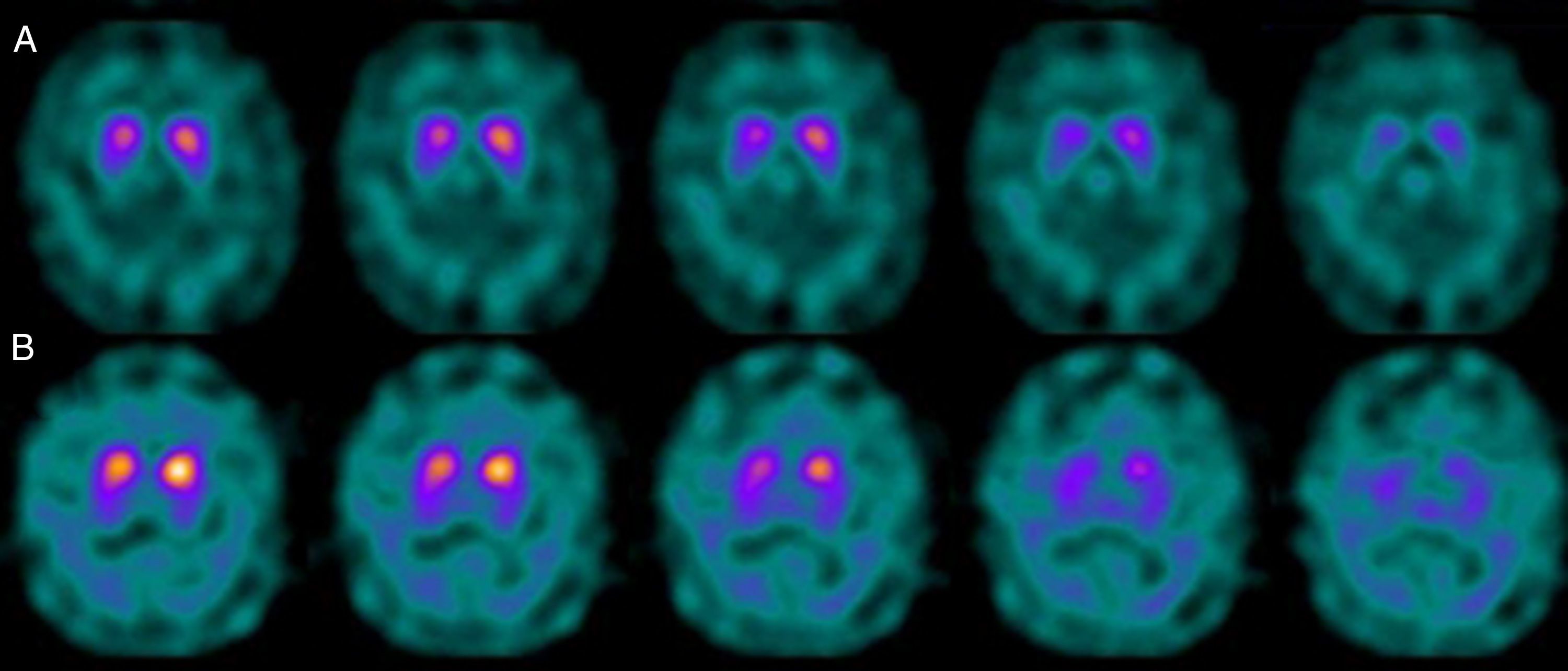
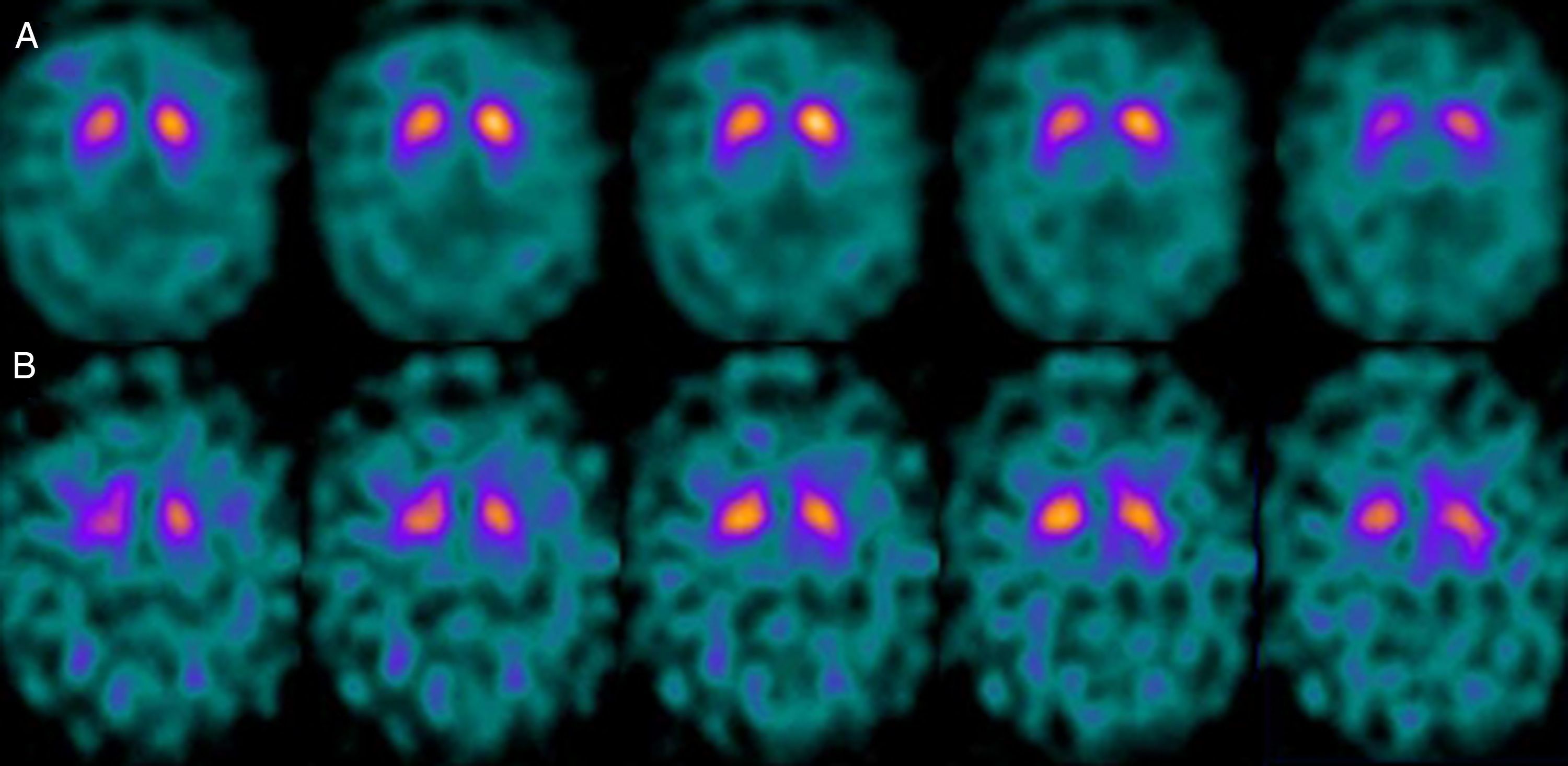
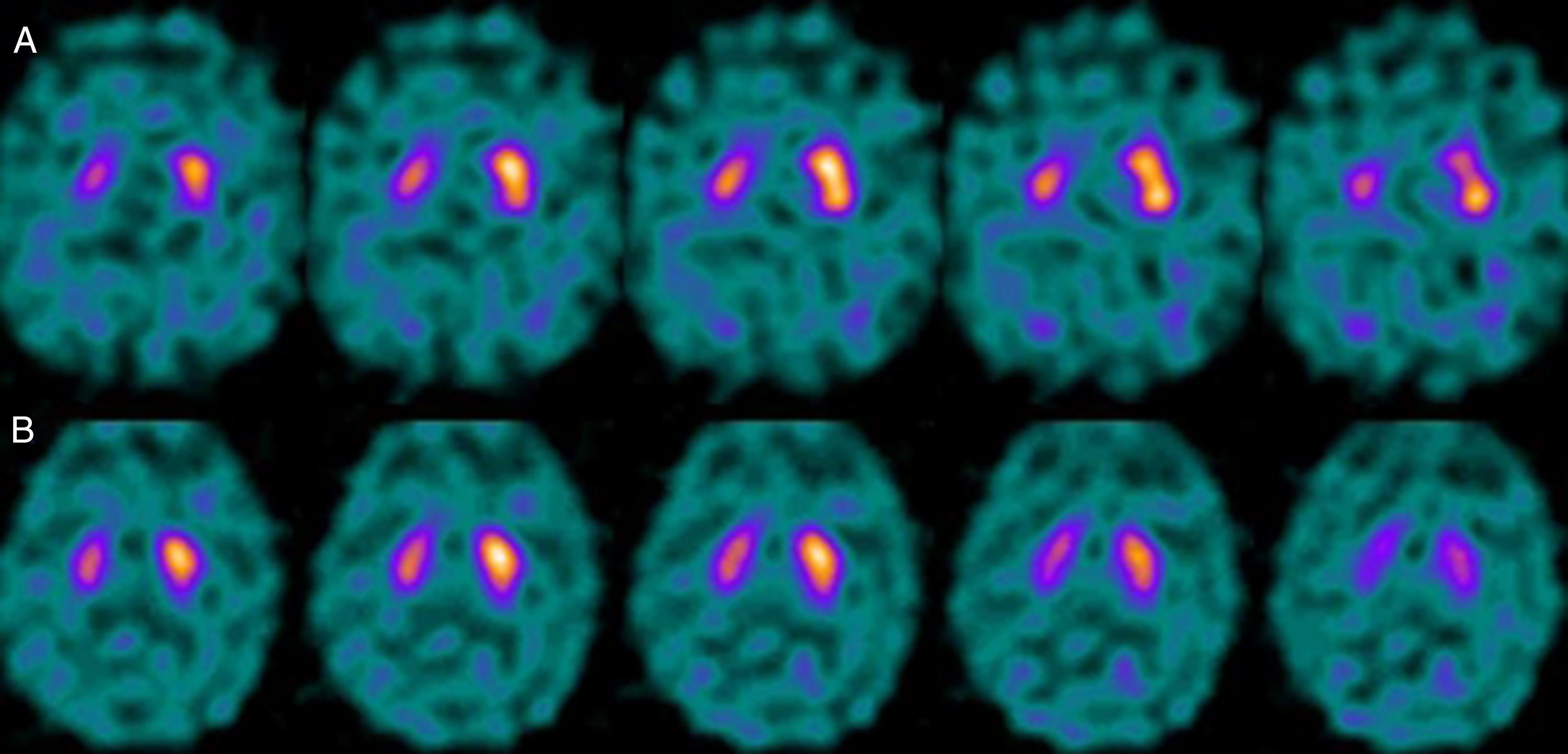
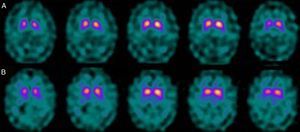
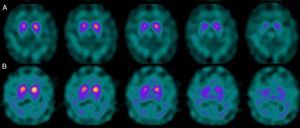
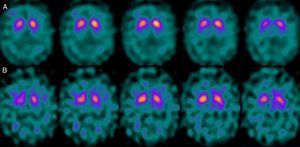
Si analizamos los rasgos clínicos predominantes de los pacientes con estudio inicial negativo y control posterior considerado patológico (N-P), y sobre la base de las publicaciones previas, las posibles causas de estos hallazgos podrían estar en relación con: en 4 de 7 sujetos destacaba el hecho que presentaran un cuadro de predominio tremórico con escasa o nula rigidez/hipocinesia (fig. 2). Uno de 7 presentaba un SP, en estadio I en la escala de Hoehn y Yahr (H&Y), en tratamiento concomitante con un fármaco antidopaminérgico (flupentixol) (fig. 3). Uno de 7 fue catalogado como probable atrofia multisistema tipo C (AMS-C) (fig. 4) y otro paciente presentaba clínica indicativa de PK atípico, sin que encontráramos causa que justificara este comportamiento discrepante.
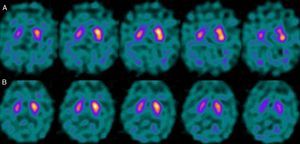
En cuanto a los pacientes con secuencia P-N, en 3 de 4 se constató que en el momento de realizarse el estudio con FP-CIT tomaban algún fármaco perteneciente al grupo de los inhibidores selectivos de la recaptación de serotonina (ISRS). En un paciente, tras suspender el fármaco, se obtuvo un incremento significativo del índice E/O (por disminución de actividad de fondo), aunque persistía hipocaptación global en el estriado derecho, sin alteraciones en izquierdo. Tras el seguimiento clínico, fue catalogado de PK vascular (fig. 5). Uno de 4 seguía tratamiento con bupropión como terapia de deshabituación tabáquica.
DiscusiónLos resultados obtenidos muestran que en el 88,04% de los pacientes, la valoración del estudio inicial y el control evolutivo posterior coincidió. En cambio, se obtuvo discrepancia en 11 pacientes, en 7 de los cuales la secuencia obtenida fue N-P. Centrándonos en estos últimos, si bien el índice E/O obtenido en el estudio inicial se encuentra en rango de normalidad, presenta un valor medio por debajo del obtenido en el grupo control y claramente superior a la media obtenida en el grupo de patológicos, lo que viene a apoyar nuestra suposición inicial acerca de que existen situaciones clínicas que originan inicialmente un menor grado de afectación funcional de la vía nigroestriada del esperado.
Analizando la historia clínica de los mismos, apreciamos los siguientes datos de interés. Cuatro de ellos, aunque con sus peculiaridades, presentaban un SP que mostraba como rasgos comunes iniciales una predominancia tremórica con nula o escasa rigidez/hipocinesia. En este sentido, diversos estudios han demostrado escasa correlación entre la severidad del temblor y la captación estriatal de FP-CIT8,9, hecho también puesto de manifiesto cuando se utiliza F-dopa con técnica PET10. Ciertos autores han indicado patrones morfológicos de afectación diferentes en formas de PK rígido-acinéticas con respecto a aquellas predominantemente tremóricas. Mientras el tipo rígido-acinético se caracteriza por pérdida neuronal, sobre todo en porción ventrolateral de sustancia negra (que se proyecta preferentemente a putámenes), el tipo con predominio tremórico muestra una menor pérdida neuronal en la totalidad de la sustancia negra11. En este contexto, y utilizando como marcador presináptico el FP-CIT, 2 recientes estudios corroboran estos modelos neuropatológicos. Rossi et al.12 valoran el patrón de afectación en distintos fenotipos clínicos de la EP inicial. Así la variante tremórica muestra mayor preservación del putamen respecto de las formas rígido-acinéticas, indicando que otros sistemas de neurotransmisión distintos del dopaminérgico están implicados en la génesis del temblor. Por otra parte, Eggers et al.13 describen una mayor afectación a nivel del putamen dorsal en las formas rígido-acinéticas y del putamen lateral en la variante tremórica. Desde el punto de vista clínico, algunas observaciones también apoyan que el origen del temblor puede diferir con respecto a la bradicinesia sobre la base de la lenta progresión de las formas tremóricas de EP14, la mejor respuesta a L-dopa de la bradicinesia/rigidez y la mejora del temblor y no de otros síntomas cuando se practica una talamotomía. Otros han considerado la posibilidad de que el temblor no esté directamente relacionado con la degeneración neuronal dopaminérgica15.
Por otra parte, 1/7 pacientes: se trataba de un sujeto varón con un cuadro cuyas características más destacadas eran temblor de características mixtas, ataxia cerebelosa y disfunción eréctil, por lo que fue catalogado de probable AMS-C. La AMS implica la afectación de diversos sistemas (piramidal, cerebelo, autonómico y estriato-nígrico) de forma variable. En el caso de la AMS-C, el único hallazgo constante es una degeneración cortical del cerebelo. La degeneración nígrica en este caso no suele ser tan evidente como la apreciada en el caso de la AMS-P (en la que predomina la semiología parkinsoniana). Así, en un estudio reciente de nuestro grupo16 se pone de manifiesto que el estudio con FP-CIT no permite descartar por completo la existencia de una AMS-C, al menos en estadios iniciales.
Siguiendo con los pacientes con secuencia N-P, otro presentaba un cuadro parkinsoniano en estadio inicial (H & Y grado i), que previamente seguía tratamiento con un fármaco antidopaminérgico. La ocupación de los receptores D2 en relación con el tratamiento descrito podría dar lugar a la aparición de clínica parkinsoniana de forma prematura, en una situación de déficit subclínico de dopamina a nivel sináptico, aun cuando la pérdida de neuronas dopaminérgicas de la vía nigroestriada no ha alcanzado el umbral mínimo para ser detectada por el estudio con FP-CIT. En este sentido, Kägi et al.17, en su revisión acerca del papel del FP-CIT en los trastornos del movimiento, indican que existe evidencia de que en pacientes con EP presintomática los fármacos antidopaminérgicos pueden desenmascararla. Por otro lado, Kim et al.18 realizan durante 2 años un seguimiento a 20 pacientes con diagnóstico de PK farmacológico y los estudian mediante un marcador DAT utilizando técnica PET y con MIBG. Advierten que en 2/20 pacientes el estudio inicial con DAT fue normal; sin embargo, mostraban alteración de la inervación simpática miocárdica. Tras 2 meses de la interrupción del tratamiento antipsicótico, los 2 pacientes mejoraron de sus síntomas parkinsonianos, aunque desarrollan un nuevo cuadro de PK tras 2 años con DAT patológico.
Por último, un paciente con SP atípico con afectación bulbar progresiva, rigidez y apraxia de extremidades, que igualmente presentaba un estudio inicial negativo y control patológico y que no encontramos posible justificación para este comportamiento.
Por otro lado, en el grupo de pacientes con secuencia P-N, cabe mencionar que el tratamiento con ISRS origina un incremento de la actividad inespecífica, por lo que el índice de captación entre actividad específica e inespecífica (E/O) disminuye19. El FP-CIT no posee afinidad selectiva por el receptor DAT, pues también se une a receptores serotoninérgicos. Si bien el bloqueo de estos no tiene un efecto sobre la captación estriatal, conlleva un aumento del sustrato disponible que va a originar aumento de la actividad inespecífica por incremento del «pool» vascular. Por su parte, el bupropión se une al receptor DAT, por lo que origina una competencia directa con el FP-CIT en la unión con dicho receptor, dando lugar a afectación de la captación a nivel estriatal20.
En un estudio similar a este, en tanto y en cuanto, como parte de dicho estudio también se valora la pérdida dopaminérgica neuronal mediante estudios secuenciales con FP-CIT, a mayor escala al tratarse de un multicéntrico europeo, aunque con similar número de pacientes21, solo obtuvieron 2/99 resultados discrepantes entre el estudio inicial y el control a los 36 meses. Uno de ellos con secuencia N-P catalogado, tras seguimiento clínico de 36 meses, como posible EP y el otro con secuencia P-N con diagnóstico final de EP probable, aunque en dicho estudio no se aportan posibles justificaciones para estas discrepancias entre en el resultado inicial y final.
Otro aspecto que nos parece interesante destacar es la elevada variabilidad interindividual en los índices de progresión de enfermedad, aspecto poco entendido hasta el momento y, al igual que en nuestro caso, también apreciado en otros estudios longitudinales22. Posibles explicaciones habría que buscarlas en el hecho de que en estudios patológicos la incidencia de cuerpos de Lewy es de 14 a 16 veces la incidencia de EP23. Esta disfunción subclínica nigroestriatal puede explicar casos de susceptibilidad/variabilidad individual.
Entre las limitaciones propias del estudio, somos conscientes de las inexactitudes que se puedan derivar de la utilización de ROI que, como en el caso de la utilizada para las estructuras estriatales, no se circunscribe exclusivamente al borde de actividad específica, albergando pequeñas áreas de actividad inespecífica. Este hecho puede conllevar, sobre todo cuando existe elevada pérdida de receptores dopaminérgicos, un cálculo más o menos inexacto de los parámetros semicuantitativos. Por otra parte, se debe tener en cuenta el sesgo que origina el conocer previamente al diagnóstico clínico final el resultado del estudio con FP-CIT, hecho difícil de controlar en estudios retrospectivos sobre técnicas de imagen.
En conclusión, aunque la realización de estudios seriados con FP-CIT en el contexto de un PK carece de sentido en la gran mayoría de las ocasiones, existen ciertas situaciones clínicas que pueden justificarlo. La revisión de la historia clínica a la hora de la interpretación de estos estudios puede aportar información de relevancia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.