El status epilepticus (SE) es un tipo de actividad epiléptica que causa atrofia cerebelar y pérdida de células de Purkinje en humanos y en animales de experimentación. El cerebelo es una región con alto contenido de ácido γ-aminobutírico (GABA) y glutamato, y algunos estudios refieren cambios en su concentración después de las convulsiones. Sin embargo, hasta la fecha no existen estudios que hayan analizado su efecto en diferentes regiones cerebelares en ratas en desarrollo. El objetivo del presente estudio fue realizar un curso temporal del efecto del SE inducido en ratas Wistar de 14 días de edad (P14) sobre el contenido tisular de GABA y glutamato en el vermis y los hemisferios cerebelares.
MétodosEl SE se indujo con el modelo de litio-pilocarpina; las ratas control se inyectaron con salina. Seis h, 24 h o 30 días después del inicio del SE o de la aplicación de solución salina, las ratas se anestesiaron y decapitaron, se extrajo su cerebelo y se separaron el vermis y los hemisferios. Las ratas de ambos grupos se anestesiaron y decapitaron, se extrajo su cerebelo y se separaron el vermis y los hemisferios. Ambas regiones se homogeneizaron (ácido perclórico 0,1M conteniendo metabisulfito de sodio 4mM) y centrifugaron, y el sobrenadante se empleó para cuantificar la concentración tisular de GABA y glutamato por cromatografía de líquidos de alta resolución acoplada a un detector fluorométrico.
ResultadosEl SE no modificó la concentración de GABA y glutamato a los diferentes tiempos de análisis ni en el vermis ni en los hemisferios cerebelares.
ConclusionesEl cerebelo en desarrollo es resistente a los cambios neuroquímicos a corto y largo plazo producidos por el SE.
Status epilepticus (SE) is an epileptic condition that can cause cerebellar atrophy and loss of Purkinje cells in both humans and research animals. Cerebellum is a region rich in γ-aminobutyric acid (GABA) and glutamate, and some studies have shown that their concentrations may be altered after convulsions. However, there are no studies showing the effect of seizures on different cerebellar regions in developing rats. Time course of the effect of status epilepticus induced in the developing rat on γ-amino butyric acid and glutamate cerebellar concentration.
MethodsSE was induced using the lithium-pilocarpine model; control rats were injected with saline solution. At 6h, 24h, and 1 month after SE o saline injection, rats were anaesthetised with pentobarbital and decapitated, and cerebella were extracted. The vermis and hemispheres were dissected and homogenised in 0.1M perchloric acid containing 4mM sodium bisulfite. Homogenates were centrifuged and supernatant was used to quantify GABA, and glutamate tissue concentrations by HPLC coupled with fluorometric detection.
ResultsSE did not alter GABA and glutamate tissue concentration in the cerebellar vermis and hemispheres.
ConclusionThe developing rat cerebellum is resistant to both short- and long-term neurochemical changes induced by SE.
Recientemente la Liga Internacional contra la Epilepsia propuso una nueva definición para el status epilepticus (SE), definiéndolo conceptualmente como un trastorno que resulta ya sea de una falla en los mecanismos responsables de la terminación de las crisis o de la iniciación de mecanismos que conducen a crisis anormalmente prolongadas. Este trastorno tiene consecuencias a largo plazo, incluyendo muerte neuronal, daño neuronal y alteración de las redes neuronales, dependiendo del tipo y de la duración de las crisis1. El SE es considerado la forma más extrema de una crisis2 y su incidencia en la población varía considerando diferentes factores, incluyendo la edad, la etnicidad, la genética y el estatus socioeconómico3. Lo cierto es que al considerar los resultados obtenidos en 5 estudios epidemiológicos realizados en poblaciones específicas en Europa y los Estados Unidos, se observó una mayor incidencia de SE convulsivo en niños menores de uno o 5 años de edad3. Lo anterior hace a esta población pediátrica importantemente vulnerable a este tipo de actividad epiléptica y a sus consecuencias.
El cerebelo es una estructura cuyo desarrollo se inicia durante el período embrionario temprano y finaliza posnatalmente4,5. Participa en funciones como el equilibrio, el control del movimiento y postural, y el aprendizaje motor5,6, aunque recientemente también se ha destacado su participación en las conductas sexual7-9 y adictiva10. A diferencia de otras enfermedades del sistema nervioso central, tales como las ataxias y el autismo11,12, el cerebelo no es una región clásicamente relacionada con la epilepsia. Sin embargo, varios estudios muestran que la modulación de la función cerebelar puede tener efectos antiepilépticos o anticonvulsivantes13-16. Además, se ha demostrado que pacientes con epilepsia o que presentaron SE muestran atrofia cerebelar17-20 y pérdida de células de Purkinje21-23, y este efecto ha sido también observado utilizando modelos experimentales de epilepsia24-26. El cerebelo es una región rica en aminoácidos, principalmente el ácido γ-aminobutírico (GABA) y glutamato, pues las células de Purkinje y las granulares (las más abundantes en el cerebro) los emplean como neurotransmisores inhibitorio y excitatorio, respectivamente, para integrar la información que entra y sale de este27.
Las consecuencias de la actividad epiléptica en la neuroquímica cerebelar han sido poco exploradas, sobre todo en el cerebro en desarrollo. Se sabe que las crisis hipertérmicas inducidas en ratas de 10 días de edad promueven una disminución en la concentración de GABA, taurina y alanina, así como un aumento del ácido aspártico en el cerebelo completo, 24h después de las convulsiones28. El SE producido en ratas de 14 días de edad no modificó la concentración tisular de GABA ni de glutamato cerebelar cuando se analizaron 24h después de las convulsiones29. Considerando la evidencia anterior, resulta importante evaluar si inmediatamente después del SE, o bien a largo plazo, pueden observarse cambios en la concentración de estos neurotransmisores. El objetivo del presente estudio fue realizar un curso temporal del efecto del SE inducido con el modelo de litio-pilocarpina en ratas en desarrollo sobre la concentración tisular de GABA y glutamato en el vermis y los hemisferios cerebelares.
MétodosSujetos experimentalesSe emplearon 36 ratas de la cepa Wistar de ambos sexos y de 14 días de edad posnatal (P14) al momento de inducir las convulsiones (peso corporal de 25-30g), las cuales fueron criadas en el bioterio del Centro de Investigaciones Cerebrales de la Universidad Veracruzana. El día de nacimiento fue considerado como el día posnatal cero (P0). Las crías se mantuvieron con sus madres (hasta el final del experimento o hasta el día del destete durante el día posnatal 21, según el caso) en cajas de acrílico transparente (15×24×37cm). En el caso de las ratas adultas, se emplearon solo machos, los cuales se alojaron en cajas colectivas de acrílico (20×30×50cm). En todos los casos, las ratas se mantuvieron en condiciones de temperatura y humedad ambientales, con ciclos luz-oscuridad normales de 12h (8:00 a 20:00h) y con libre acceso a agua y alimento. Todos los experimentos se realizaron bajo los lineamientos éticos nacionales e internacionales indicados en la Norma Oficial Mexicana para el uso y cuidado de animales de investigación (NOM-062-ZOO-1999), así como en la guía de cuidado y uso de animales de laboratorio del National Research Council versión 2011.
Grupos experimentalesLas ratas se dividieron en 6 grupos experimentales. Una vez inducido el SE, las ratas se eutanizaron 6h, 24h o 30 días posteriores al evento epiléptico; los grupos control (sin convulsiones) se manipularon y eutanizaron a los mismos tiempos indicados que los grupos con SE (n=6 por grupo).
Inducción del status epilepticus con litio-pilocarpinaLas ratas se inyectaron con cloruro de litio (3mEq/Kg, i.p.) durante el día posnatal 13, y 20h después, durante el día posnatal 14, se indujo el SE mediante la administración de clorhidrato de pilocarpina (100mg/kg, s.c.). La manifestación conductual del SE fue monitorizada según la escala de Haas et al.30 y solo aquellos animales que lo desarrollaron se incluyeron en el estudio. Los grupos controles fueron inyectados con cloruro de litio y solución salina. Todas las ratas se rehidrataron con solución salina glucosada (5%) 7h después del inicio del experimento (1ml, s.c.) e inmediatamente regresaron con su madre. Este tiempo se eligió porque las convulsiones ya habían cesado en las ratas con SE. El tiempo de separación de las crías y su madre fue similar en los grupos control y SE.
Procesamiento del tejidoLas ratas se anestesiaron con pentobarbital sódico (60mg/kg, i.p.), se decapitaron e inmediatamente después se extrajo el cerebelo en frío (aproximadamente 4°C utilizando hielo frappé), y se separaron el vermis y los hemisferios (ambos hemisferios se procesaron conjuntamente). Posteriormente, el tejido cerebelar se homogeneizó mecánicamente adicionando 30μl de ácido perclórico 0,2N (HClO4, Baker) y metabisulfito de sodio (Baker, S-1516) por cada 10mg de tejido. Los homogeneizados se centrifugaron a 10.000rpm durante 20min a 4°C y los sobrenadantes se recolectaron y se filtraron (filtros HV de 0,45μm tamaño de poro, Milipore). Los filtrados y el sedimento se almacenaron a –70°C hasta que se realizó la cuantificación de aminoácidos y de proteínas.
Determinación del contenido tisular de aminoácidos por cromatografía líquida de alta resoluciónLa separación y cuantificación de GABA y glutamato en los hemisferios y el vermis cerebelares se llevaron a cabo considerando el procedimiento descrito por Luna-Munguía et al.31. Se empleó un sistema de cromatografía de líquidos de alta resolución acoplado a un detector de fluorescencia (Waters modelo 474), así como una precolumna Nova-Pack C18 (4μm-60A [3,9×20]) y una columna de fase reversa Nova-Pack C18 (4μm-60A [3,9-150]). El detector de fluorescencia operó a una longitud de onda de excitación de 360nm y una longitud de onda de emisión de 450nm. La determinación de aminoácidos se realizó preparando una dilución del sobrenadante (1:250-1:450), para posteriormente mezclar 20μl de la muestra con 6μl del agente derivatizante, e inyectar esta mezcla manualmente (25μl) al cromatógrafo 2min después de iniciada la reacción. El agente derivatizante se preparó mezclando 4,7mg de o-ftaldialdehido (OPA), 94μl de metanol, 0,874ml de tetraborato de potasio 0,4M y 8,8μl de 2-β-mercapto etanol 0,116M. La separación cromatográfica se realizó utilizando un sistema binario de gradiente. La fase móvil A consistió en una solución amortiguadora de acetato de sodio 40mM en metanol al 10 (pH a 6,7). La fase móvil B consistió en una solución amortiguadora de acetato de sodio 8mM y metanol al 80% (pH 5,7). El perfil de elusión se realizó como se describe a continuación: a 0min 77% A, 23% B; 1min 55% A, 45% B; 6,5min 30% A, 70% B; 11-13min 3% A, 97% B; 16min 77% A, 23% B. El flujo se mantuvo a 0,5ml/min. La concentración tisular de GABA y glutamato se determinó por medio de un análisis de regresión lineal utilizando el sistema Milenium (Waters®), a partir de una curva de calibración (100, 300 y 500ng/ml) de un estándar externo de GABA y glutamato. La concentración de aminoácidos se expresó en pg/mg de proteína.
Cuantificación de proteínas por el método de BradfordLa cuantificación de las proteínas se realizó con la técnica de Bradford (Quick Start Bradford 1x Dye Reagent, Biorad) utilizando el sedimento remanente en los homogeneizados cerebelares. Para este fin, se preparó una curva estándar con albúmina sérica bovina (Sigma). La absorbancia se determinó a una longitud de onda de 595nm utilizando un lector de microplacas (Molecular- Devices, Spectra Max 190).
Análisis estadísticoLos resultados se analizaron con una ANOVA de 2 vías para grupos independientes teniendo como factores el tratamiento (control y SE) y el tiempo de evaluación (6h, 24h y un mes) y siendo las variables respuestas la concentración de los aminoácidos. Se empleó la prueba de Tukey de comparación múltiple para identificar diferencias entre los factores. El análisis estadístico y las gráficas se realizaron con el programa GraphPad Prism versión 5.0. Los resultados se representan como la media±el error estándar de la media (EEM) y se consideró un nivel de significación menor a 0,05.
ResultadosTodas las ratas del estudio presentaron SE con una duración de 5 a 6h. La severidad máxima de las convulsiones correspondió al nivel 5, pues las ratas presentaron crisis generalizadas caracterizadas por mioclonus bilateral de las extremidades anteriores y postura de canguro, ya sea con pérdida o no de la postura.
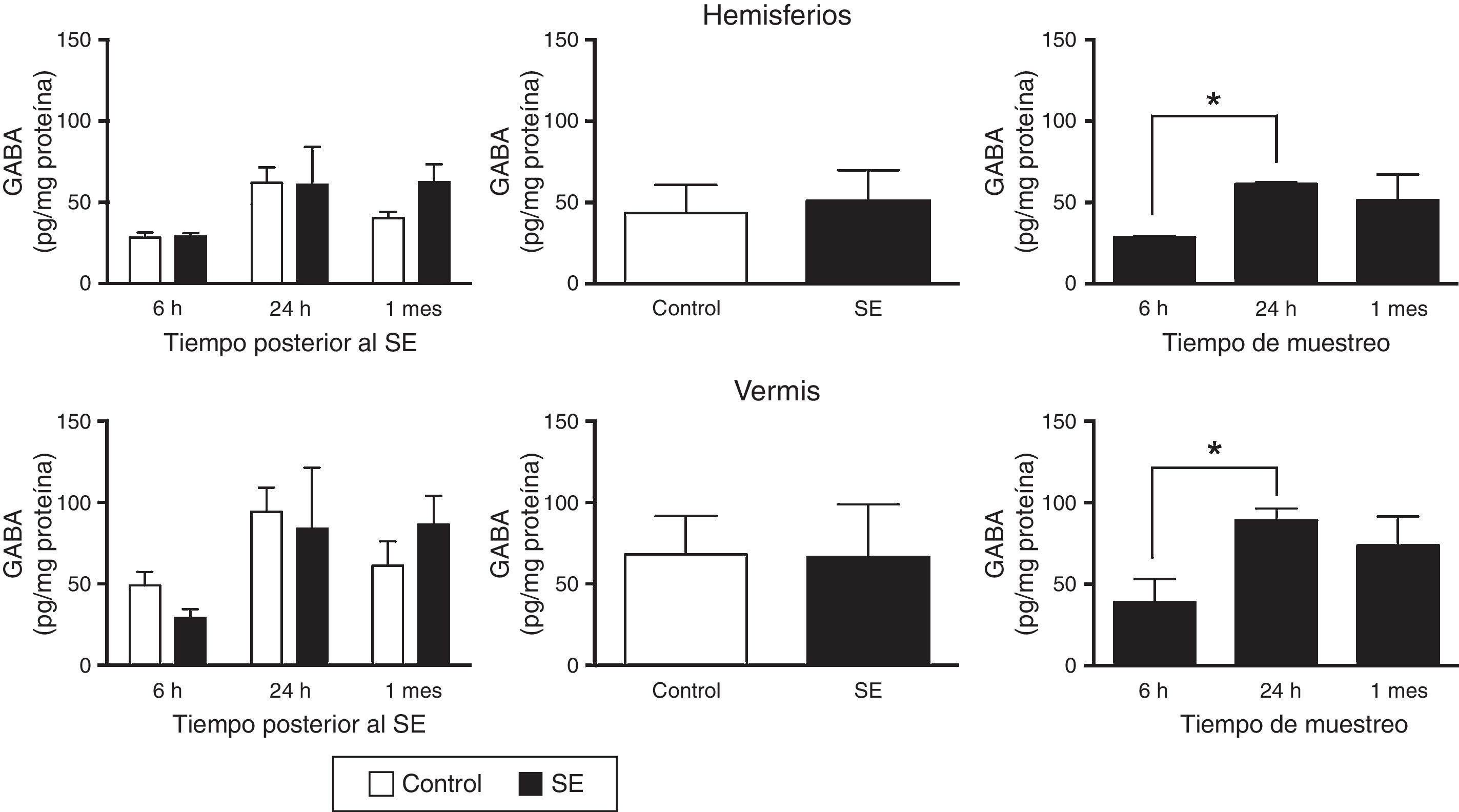
El análisis de varianza de 2 vías mostró que existen diferencias en el contenido tisular de GABA en los hemisferios considerando el tiempo de análisis (F(2,30)=4,47; p=0,0199), pero no debido a la inducción del SE (F(1,30)=0,645; p=0,4282) o a la interacción entre el SE y el tiempo de evaluación (F(2,30)=0,651; p=0,5299). Un efecto similar se observó en el vermis, pues el análisis estadístico identificó diferencias en la concentración tisular de GABA debido al tiempo de análisis (F(2,30)=3,5; p=0,0430), pero no debido al SE (F(1,30)=0,010; p=0,9190) ni a la interacción entre la inducción del SE y el tiempo transcurrido hasta el análisis (F(2,30)=0,749; p=0,4813). La prueba post hoc mostró que existe una mayor concentración tisular de GABA en los hemisferios (p<0,05) y el vermis (p<0,05) evaluados a las 24h con respecto al período de 6h (fig. 1).
Concentración tisular del ácido γ-aminobutírico (GABA) en los hemisferios y el vermis cerebelares después del status epilepticus (SE). En el panel de la izquierda se muestra el curso temporal de la concentración de GABA después del SE. En el panel medio se presenta el efecto del tratamiento, ya sea control o SE, en la concentración tisular de GABA, independientemente del tiempo de análisis. En el panel de la derecha se indica la concentración de GABA a los diferentes tiempos de análisis considerando ambos grupos experimentales. Las barras representan la media±EEM de la concentración de glutamato (n=6 por grupo experimental). *p<0,05.
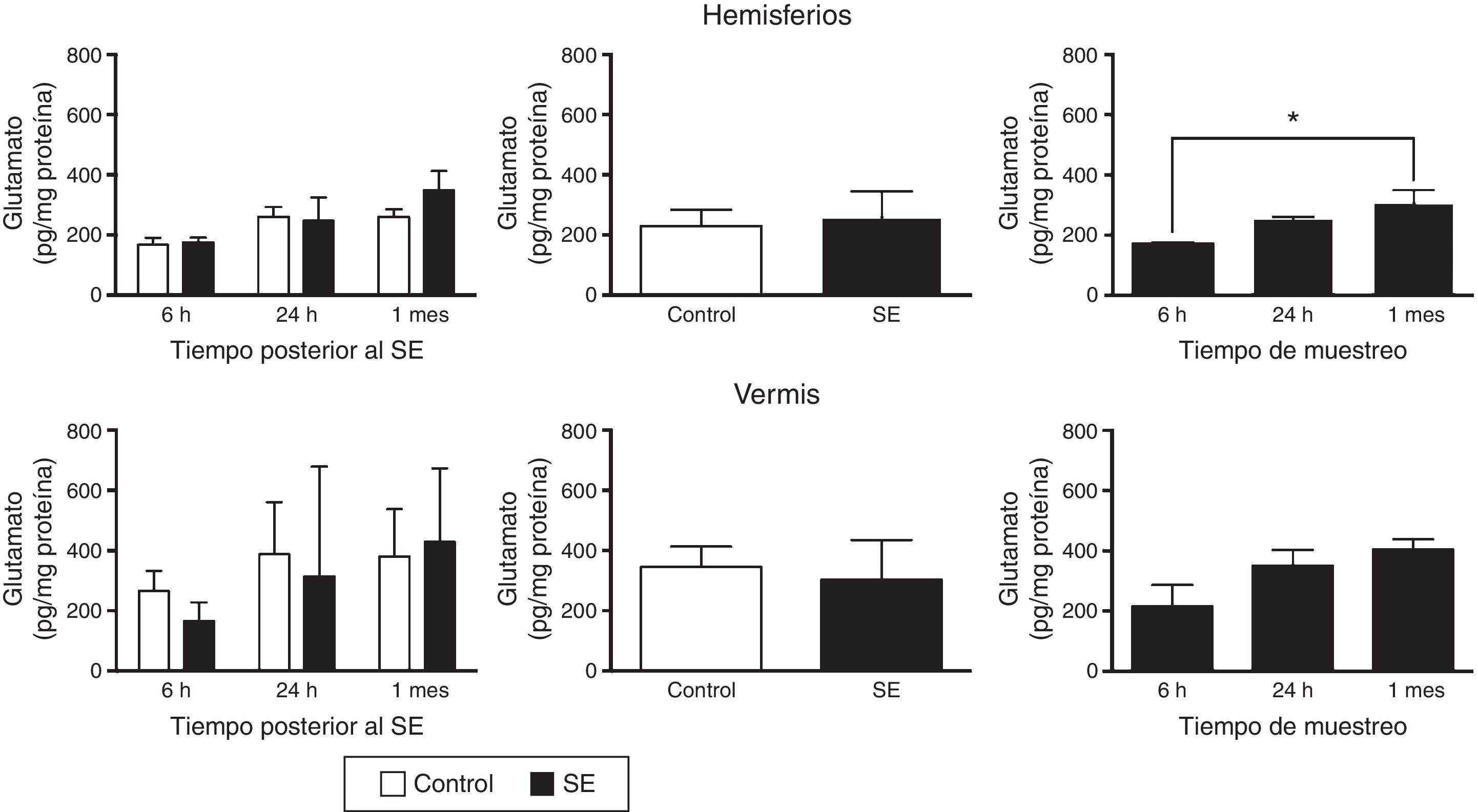
Con respecto al glutamato, el análisis de varianza de 2 vías mostró diferencias en el contenido tisular de este aminoácido en los hemisferios cerebelares considerando el tiempo de análisis (F(1,30)=4,37, p=0,0216), pero no debido a la inducción del SE (F(1,30)=0,556; p=0,4615) o a la interacción entre el SE y el tiempo de evaluación (F(2,30)=0,710; p=0,4995). La prueba post hoc mostró que existe una menor concentración tisular de glutamato en los hemisferios evaluados a las 6h con respecto al análisis realizado un mes después (p<0,05). La concentración tisular de glutamato en el vermis cerebelar no se modificó debido al tiempo de análisis (F(2,30)=2,67; p=0,0855), ni al SE (F(1,30)=371; p=0,5473) y no se detectó ninguna interacción entre estos 2 factores (F(2,30)=0,44; p=0,6481) (fig. 2).
Concentración tisular de glutamato en los hemisferios y el vermis cerebelares después del status epilepticus (SE). En el panel de la izquierda se muestra el curso temporal de la concentración de glutamato después del SE. En el panel medio se presenta el efecto del tratamiento, ya sea control o SE, en la concentración tisular de glutamato, independientemente del tiempo de análisis. En el panel de la derecha se indica la concentración de glutamato a los diferentes tiempos de análisis considerando ambos grupos experimentales. Las barras representan la media±EEM de la concentración de glutamato (n=6 por grupo experimental). *p<0,05.
Los resultados de este estudio muestran que el SE inducido en ratas de 14 días de edad no modifica, de forma aguda ni a largo plazo, la concentración tisular de GABA y glutamato en el cerebelo, ya sea a nivel del vermis o de los hemisferios.
Las causas y consecuencias del SE han sido estudiadas en gran medida empleando modelos experimentales que mimetizan este tipo de actividad epiléptica. El modelo de litio-pilocarpina utilizado en este estudio, se ha empleado para estudiar el SE durante el desarrollo ya que reproduce las manifestaciones motoras y causa daño neuronal en diversas regiones cerebrales32-35. Los hallazgos aquí presentados evidencian que la neuroquímica GABAérgica y glutamatérgica cerebelar en la rata en desarrollo no es dramáticamente afectada por un trastorno tan agresivo como lo es el SE, ya sea inmediatamente luego de las convulsiones, un día después durante la etapa postictal o a largo plazo. Pocos estudios han evaluado las consecuencias del SE en la concentración extracelular de aminoácidos cerebelares. Previamente se reportó que el SE inducido en ratas de 14 días de edad no modificó la concentración tisular de GABA ni de glutamato en el vermis y los hemisferios cerebelares, pero sí aumentó los niveles tisulares de alanina, taurina y glutamina en los hemisferios al ser evaluados 24h después de las convulsiones. Este efecto fue acompañado de una ausencia de cambios en la unión de radiologando a los receptores GABAA en el vermis cerebelar29. Se sabe que las crisis hipertérmicas producidas en ratas de 10 días de edad promueven un aumento de aspartato en el cerebelo completo, mientras que la concentración de otros aminoácidos, como el GABA y el glutamato, disminuye un día después de las convulsiones28. El hecho de que el SE no promueva cambios en la concentración tisular de GABA y glutamato sugiere que el cerebelo en desarrollo presenta resistencia a los cambios producidos por las convulsiones, aun si estas se presentan durante varias horas. Lo anterior puede ir de la mano con los cambios propios del desarrollo del cerebro de la rata y su neuroplasticidad36. De hecho, se sabe que el SE produce en la rata daño neural con un patrón anatómico y de una intensidad diferente dependiendo de la edad a la cual se induzca; así mismo, una menor proporción de ratas presentan crisis epilépticas espontáneas debido al SE cuando este se induce en ratas de 2 semanas de edad en comparación con aquellas de 3 o 4 semanas de vida32.
Los resultados mostraron que la concentración tisular de GABA, tanto en los hemisferios como en el vermis cerebelar, resultó mayor cuando se evaluó 24h después de las convulsiones, o de la manipulación con solución salina en el caso de las ratas control, es decir, cuando las ratas tenían 14 días de edad, que 6h después de la recolección de las muestras, es decir, cuando las ratas tenían 13 días de edad. Mientras tanto, la concentración tisular de glutamato fue mayor un mes después del SE o de la manipulación en comparación con las muestras obtenidas a las 6h. Estos hallazgos sugieren que los cambios pueden deberse al proceso propio de maduración del cerebelo de la rata, pues se sabe que posnatalmente y hasta alrededor de los 25 días de edad existe una prominente tasa de proliferación celular y neurogénesis37. Además, se sabe que las sinapsis GABAérgicas se forman durante la segunda y tercera semanas de vida38.
En conclusión, el presente estudio mostró que el SE producido en ratas de 14 días de edad no modifica la concentración tisular de GABA ni de glutamato, ni a corto ni a largo plazo, en el vermis o los hemisferios cerebelares, efecto que puede deberse a la neuroplasticidad propia de esta región del encéfalo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses relacionado con el artículo.
A la Secretaría de Educación Pública (SEP) de México por el apoyo otorgado a MLLM a través del Programa de Mejoramiento al Profesorado (PROMEP) como nuevo profesor de tiempo completo (PROMEP/103.5/10/5006). Al Programa Integral de Fortalecimiento Institucional (PIFI) de la SEP por el apoyo al Cuerpo Académico de Neurofisiología (UV-CA-333).