La mayor parte de los seres vivos son capaces de realizar acciones que pueden ser consideradas inteligentes o al menos el resultado de un proceso de reacción adecuado ante las circunstancias cambiantes de su medio ambiente. Sin embargo, la inteligencia o los procesos intelectuales que desarrollan los seres humanos son enormemente superiores a los que logran los organismos de cualquier otra especie. El cerebro humano adulto es un órgano sumamente complejo: pesa aproximadamente 1.500g, lo que representa solo el 2% del peso corporal pero consume igual cantidad de energía que todo el músculo esquelético en reposo. Aunque el cerebro humano presenta una estructura típicamente primate, revela algunas características que lo distinguen y lo individualizan plenamente.
El proceso de evolución y humanización del cerebro del Homo sapiens (H. sapiens) lo convirtió en un órgano único y diferente, alcanzando el mayor tamaño relativo entre todas las especies, pero además le permitió una reorganización estructural de tejidos y circuitos en segmentos y regiones específicas. Esto explica las notables capacidades cognitivas del hombre moderno, en comparación no solo con otros miembros de su género, sino con otros miembros más antiguos de su propia especie.
La evolución del cerebro requirió la coexistencia de 2 mecanismos de adaptación. El primero involucra cambios genéticos que ocurren a nivel de especies y el segundo ocurre a nivel individual e involucra cambios en la organización de la cromatina o cambios epigenéticos. Entre los mecanismos genéticos se encuentran: a) cambios en regiones genéticas codificantes que conducen a cambios en la secuencia y actividad de proteínas existentes; b) los procesos de duplicación y deleción de genes previamente existentes; c) cambios en la expresión génica a través de modificaciones en las secuencias reguladoras de diferentes genes, y d) síntesis de ARNs no codificantes.
Finalmente, en esta revisión se describen algunas de las más importantes diferencias cromosómicas reportadas entre humanos y grandes simios, que también han contribuido al proceso de evolución y humanización del cerebro del H. sapiens.
Most living beings are able to perform actions that can be considered intelligent or, at the very least, the result of an appropriate reaction to changing circumstances in their environment. However, the intelligence or intellectual processes of humans are vastly superior to those achieved by all other species. The adult human brain is a highly complex organ weighing approximately 1500g, which accounts for only 2% of the total body weight but consumes an amount of energy equal to that required by all skeletal muscle at rest. Although the human brain displays a typical primate structure, it can be identified by its specific distinguishing features.
The process of evolution and humanisation of the Homo sapiens brain resulted in a unique and distinct organ with the largest relative volume of any animal species. It also permitted structural reorganization of tissues and circuits in specific segments and regions. These steps explain the remarkable cognitive abilities of modern humans compared not only with other species in our genus, but also with older members of our own species.
Brain evolution required the coexistence of two adaptation mechanisms. The first involves genetic changes that occur at the species level, and the second occurs at the individual level and involves changes in chromatin organisation or epigenetic changes. The genetic mechanisms include: a) genetic changes in coding regions that lead to changes in the sequence and activity of existing proteins; b) duplication and deletion of previously existing genes; c) changes in gene expression through changes in the regulatory sequences of different genes; and d) synthesis of non-coding RNAs.
Lastly, this review describes some of the main documented chromosomal differences between humans and great apes. These differences have also contributed to the evolution and humanisation process of the H. sapiens brain.
Aunque la definición de inteligencia aún es tema de discusión, se acepta que la mayor parte de los seres vivos, en especial aquellos ubicados en los niveles más altos de la escala evolutiva, llevan a cabo una serie de acciones que pueden ser consideradas inteligentes o al menos el producto de un proceso de reacción adecuado ante las circunstancias de su medio ambiente. De cualquier forma, la inteligencia o los procesos intelectuales que desarrollan los seres humanos son enormemente diferentes a los que logran los organismos de cualquier otra especie en este planeta.
Actualmente, es conocido que el órgano corporal que permite tal capacidad al ser humano es el cerebro, pero no siempre fue así; los egipcios en sus procesos de momificación extraían el cerebro de los cadáveres y los antiguos griegos creían que el cerebro era solamente el lugar en el que se enfriaba la sangre procedente del corazón. Darwin en su obra clásica On the origin of species by means of natural selection (1859)1, raramente menciona al cerebro en sus observaciones y discusiones. De igual forma, Huxley2, contemporáneo de Darwin, en alguna de sus obras argumenta que el cerebro de los humanos recuerda al cerebro de los grandes monos en sus características fundamentales3.
El cerebro humano adulto es un órgano intrincado y complejo; con un peso aproximado de 1.500g representa el 2% del total de la masa corporal, pero consume igual cantidad de energía que todo el músculo esquelético en reposo4. En general, el cerebro humano está construido de acuerdo con un plan estructural típicamente primate, aunque con algunas características que lo distinguen y lo individualizan.
A pesar del enorme bagaje de conocimientos biológico-médicos que actualmente tenemos de nuestro cerebro, todavía nos planteamos preguntas que no han sido completamente contestadas. ¿Qué es lo que individualiza y hace un órgano tan particular al cerebro humano, aun comparándolo con el cerebro de primates superiores y homínidos ancestrales? ¿Cuándo nuestro cerebro llegó a ser realmente humano? ¿Cómo evolucionó el cerebro humano?
En la búsqueda de estas respuestas se ha propuesto inicialmente comparar el cerebro humano con el de otras especies vivas, genética o evolutivamente similares, tanto en sus aspectos macroscópicos como microscópicos, para discernir sus semejanzas y diferencias. También se ha buscado compararlo con el de otras especies del género Homo, aunque ello resulta una aproximación superficial, pues de estos parientes ancestrales solo han quedado las huellas del cerebro en su contacto con el endocráneo5. Todo ello ha permitido entender cómo ocurrió y qué caminos siguió el proceso de encefalización que llevó al desarrollo del complejo cerebro del Homo sapiens (H. sapiens).
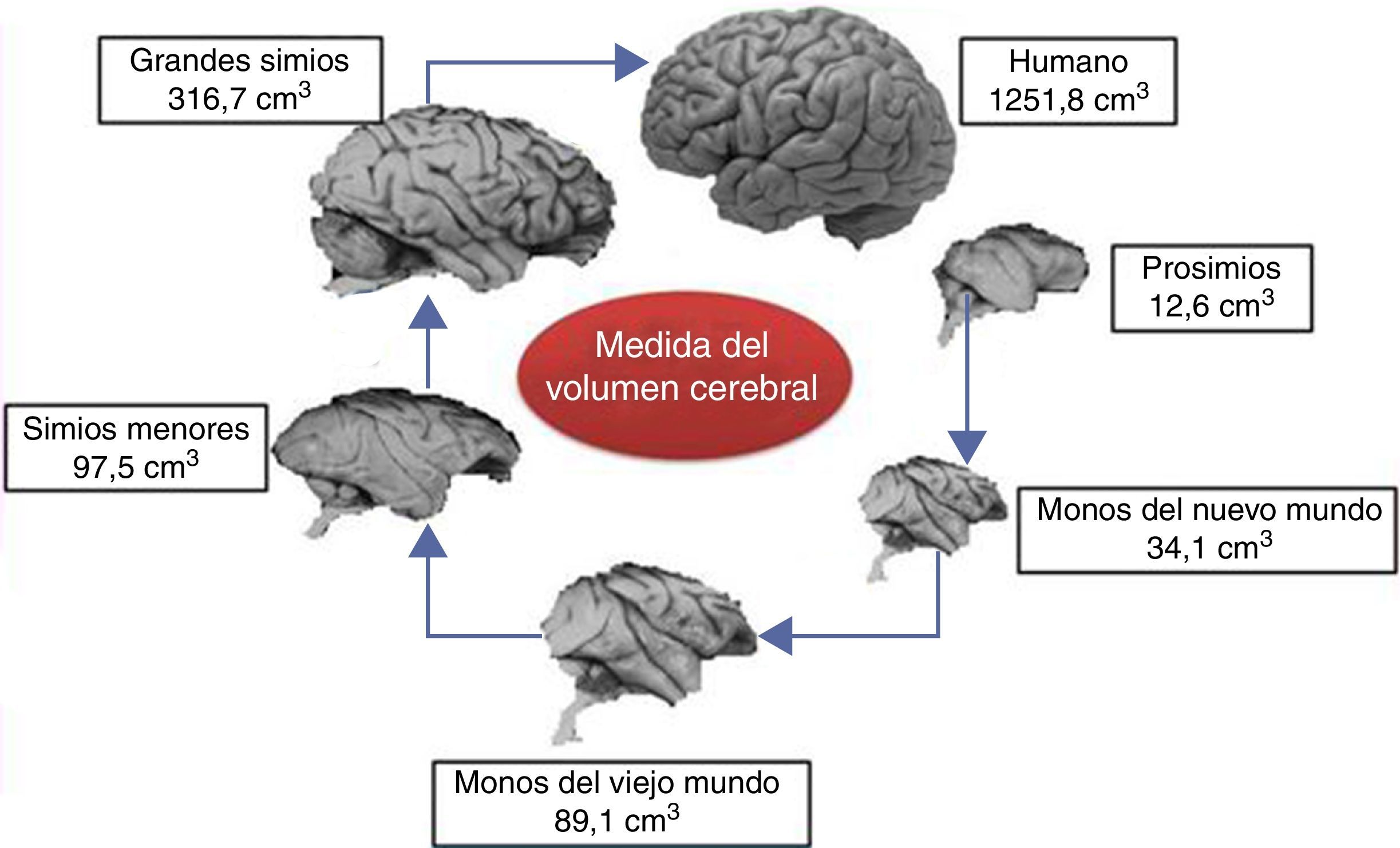
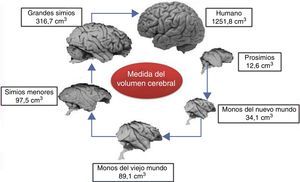
Proceso de encefalización y tamaño del cerebroLos seres humanos tenemos grandes cerebros, con un volumen en el adulto de aproximadamente 1.350cm3, un peso de 1.500g y conteniendo cerca de 20 billones de neuronas6. Este tamaño es mucho mayor que el de cualquier primate extinto y su peso es 3 veces mayor que el del chimpancé, el primate más cercano evolutivamente7 (fig. 1).
El tamaño absoluto del cerebro muestra una franca relación con los atributos de una especie en particular y predice en general la capacidad mental de los primates no humanos. Las pruebas de habilidad mental miden el poder cognitivo de una especie de acuerdo con las decisiones que toman sus individuos cuando se cambian las condiciones o circunstancias en un medio ambiente controlado8. Para propósitos prácticos, se puede considerar la flexibilidad mental como un tipo de inteligencia. En la medida que se incrementa el tamaño del cerebro de los prosimios a los grandes simios, así aumenta la flexibilidad cognitiva de estos animales. En la misma forma ha evolucionado el pequeño cerebro australopiteco a cerebros más grandes como el del Homo habilis (H. habilis), el Homo erectus (H. erectus) y eventualmente el gran cerebro del H. sapiens.
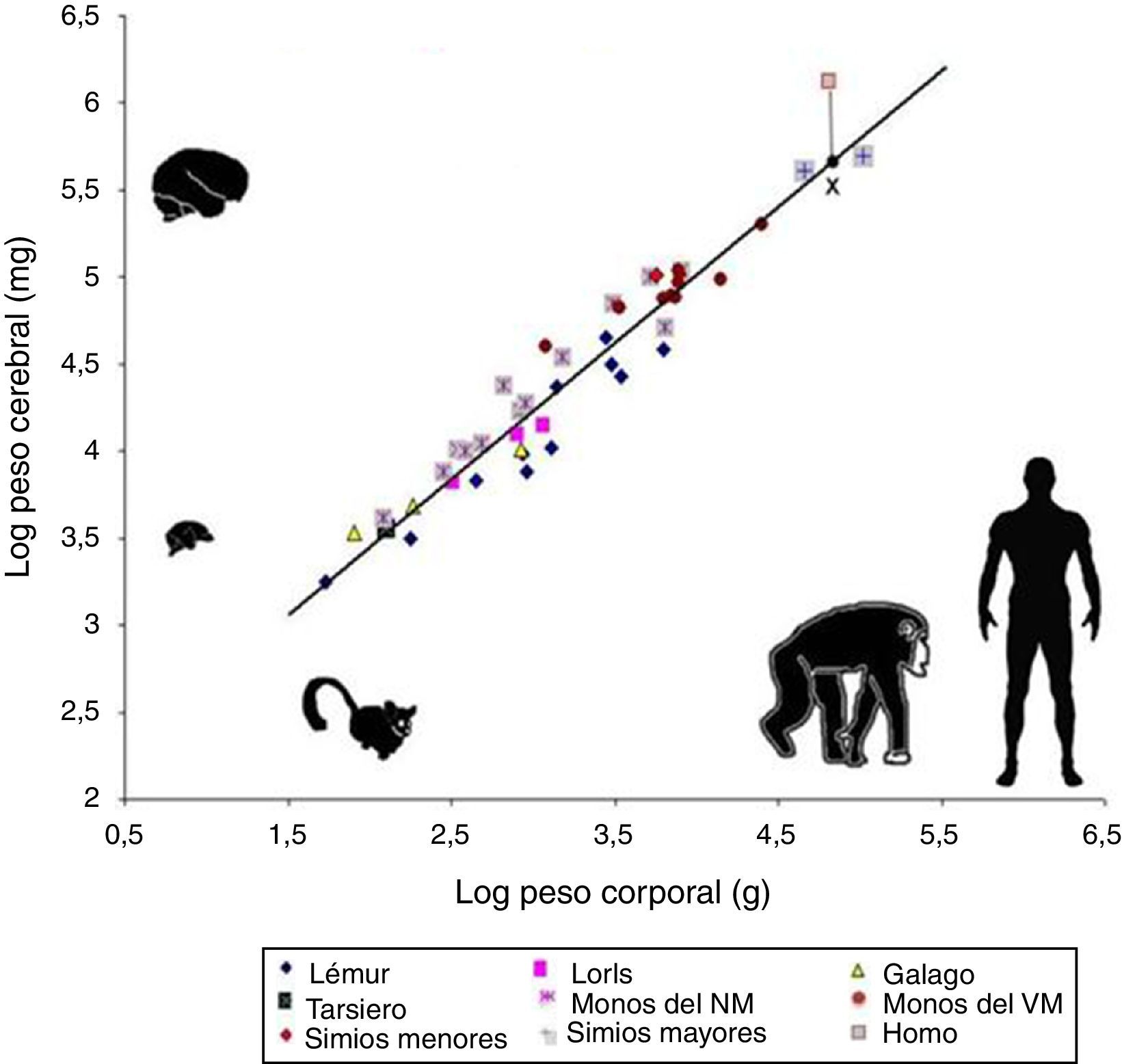
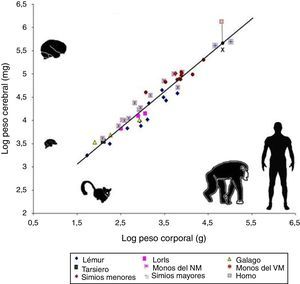
Sin embargo, el tamaño absoluto del cerebro no explica todas sus habilidades cognitivas. De ser así, el elefante, con 5kg de cerebro, o la ballena, con 7,8kg de cerebro, estarían mucho más encefalizados que los humanos que poseemos un cerebro de apenas 1,5kg. De ahí que, si se quiere encontrar en la encefalización la respuesta a la singularidad de nuestro cerebro, esta debería medirse en términos relativos, es decir, relacionando el peso del cerebro con el peso total del organismo (fig. 2). En todo caso, esta relación tampoco logra ser exacta, pues como ejemplo una pequeña musaraña con 0,25g de cerebro estaría mucho más encefalizada.
Comparación mediante escalas logarítmicas entre el peso corporal en gramos y el peso del cerebro en miligramos en 45 especies de primates. La línea (regresión) muestra el tamaño cerebral esperado para cada tamaño corporal. La X sobre la línea de regresión marca el tamaño esperado para el cerebro humano, lo que resulta mucho menor que el verdadero tamaño del cerebro humano actual, señalado con un cuadrado de líneas rojas. En general, los prosimios se ubican bajo la línea de regresión, en tanto que los antropoides se ubican sobre esta línea. Esta característica indica que hubo una presión selectiva para el desarrollo del tejido cerebral durante la evolución humana. Tomado y modificado de Stephan et al.7.
En 1973, Jerison9 propuso que la relación entre el tamaño del cerebro y del cuerpo debe hacerse considerando que los organismos más pequeños, en general, tienen cerebros más grandes, mientras que los organismos más grandes suelen tener cerebros proporcionalmente más pequeños, por una simple cuestión de alometría.
Por otro lado, existen ciertos requisitos mínimos que regulan el desarrollo del cerebro de cualquier mamífero. En principio, debe haber suficiente cantidad de cerebro para mantener el cuerpo en homeostasis, es decir, para mantener el equilibrio interno cuando el entorno cambia. También debe haber suficiente cerebro y tejido nervioso para percibir el mundo exterior y responder apropiadamente a los estímulos internos y externos. Estas funciones básicas permiten a un animal alimentarse, huir de los peligros y lograr su reproducción. Los animales que poseen más tejido cerebral que solo el necesario para la supervivencia tienen ventajas sobre los animales que sobreviven con los requisitos mínimos. Así, animales pequeños como los ratones tienen cerebros relativamente grandes para su tamaño corporal, mientras que animales de gran tamaño como los elefantes o las ballenas tienen cerebros relativamente pequeños. Durante el desarrollo ontológico de los organismos ocurre un fenómeno similar; un bebé muestra una cabeza relativamente mayor que lo que le corresponde al tamaño de su cuerpo si lo comparamos con las proporciones de un adulto mayor. Esta misma relación es válida para los primates, a medida que aumenta el tamaño del cuerpo del primate, disminuye la relación entre el tamaño del cerebro y el cuerpo. Este es un ejemplo de escala alométrica. De cualquier manera, ya sea considerando la forma absoluta o relativa, es claro que el cerebro del H. sapiens es mucho mayor que el del chimpancé, que es la especie más cercana a nosotros evolutivamente hablando.
Llegar a un cerebro tan grande como el nuestro ha tomado varios millones de años; sin embargo, considerando el conjunto de primates, se debe aceptar que ocurrió como un proceso muy rápido. Algunos autores, como Rakic y Kornack10 o Finlay y Darlington11, proponen que el principal mecanismo que da lugar a un cerebro más grande ocurre durante el desarrollo embrionario, produciendo un mayor número de células precursoras, a partir de las cuales formará el cerebro (tubo neural).
Aunque las razones que aceleraron la evolución del cerebro humano aún no son claras, es evidente que dicha aceleración abarca al menos todo el género Homo y siguió hasta la aparición del neandertal y de nuestra especie. Según Holloway et al.12, el cerebro empezó a aumentar notablemente de tamaño ya en los australopitecos (posibles predecesores inmediatos de nuestro género), de tamaño corporal similar al del chimpancé y cuyo cerebro creció entre 450 y probablemente 515cm3. Los primeros miembros del género Homo (H. habilis, Homo rudolfensis) ya tenían cerca de 700cm3 de volumen cerebral, de manera que el cambio hacia Homo ergaster y H. erectus, con aproximadamente 1.000cm3, ya no resultó tan drástico5.
La reorganización estructural como parte de la evolución cerebralEs evidente que el aumento del tamaño cerebral, absoluto o relativo, no es el único cambio en la evolución que llevó a la humanización de nuestro cerebro. Holloway et al.12 señalan que una reorganización de los tejidos y circuitos cerebrales es esencial en la evolución del cerebro humano. Los cerebros más grandes requieren mayor cantidad de neuronas y uniones neuronales, lo que eventualmente puede volverlos ineficientes. Para mantener su eficiencia el cerebro necesita reorganizarse13.
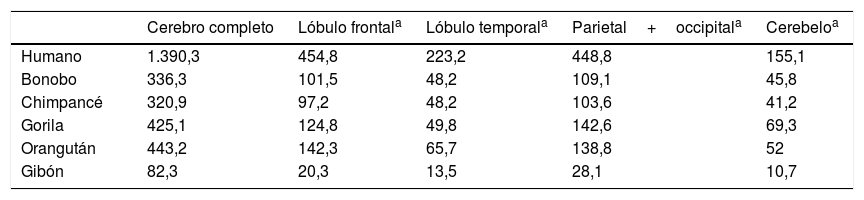
Semendeferi y Damasio14, estudiando por resonancia magnética el volumen de los lóbulos cerebrales de distintos simios y del hombre actual, reportaron una serie de sorprendentes resultados. En primer lugar encontraron que no existía la gran expansión de los lóbulos frontales, que se pensaba era el principal causante de la encefalización humana. Considerando las leyes alométricas, nuestros lóbulos frontales son más grandes, pero no mucho más de lo esperado para un cerebro como el nuestro. Sin embargo, aunque el tamaño total de los lóbulos frontales no es mayor que los de un simio con el cerebro grande, algunas de sus partes sí parecen haber aumentado notablemente en nuestra especie (tabla 1).
Volumen en cm3 del cerebro y los lóbulos cerebrales en diferentes primates, obtenido por resonancia magnética tridimensional
| Cerebro completo | Lóbulo frontala | Lóbulo temporala | Parietal+occipitala | Cerebeloa | |
|---|---|---|---|---|---|
| Humano | 1.390,3 | 454,8 | 223,2 | 448,8 | 155,1 |
| Bonobo | 336,3 | 101,5 | 48,2 | 109,1 | 45,8 |
| Chimpancé | 320,9 | 97,2 | 48,2 | 103,6 | 41,2 |
| Gorila | 425,1 | 124,8 | 49,8 | 142,6 | 69,3 |
| Orangután | 443,2 | 142,3 | 65,7 | 138,8 | 52 |
| Gibón | 82,3 | 20,3 | 13,5 | 28,1 | 10,7 |
Tomado de Semendeferi y Damasio14.
Por otro lado, Semendeferi y Damasio14 descubrieron que los lóbulos temporales, reconocidos por su importancia para la audición, visión y muchos otros procesos cognitivos superiores como la memoria y el lenguaje, sí aparecían anormalmente grandes en nuestra especie, lo que hace pensar que existe una presión selectiva en el género Homo para el desarrollo de esta parte del cerebro.
Otra novedad de tan relevantes trabajos mostró que el cerebelo es relativamente más pequeño en nuestra especie, datos que no coinciden exactamente con los obtenidos por Weaver15 en un estudio que incluyó al H. habilis, H. erectus, neandertales y H. sapiens antiguos y modernos. De acuerdo con estos resultados, si bien existe una tendencia a disminuir el tamaño relativo del cerebelo, este patrón cambia súbitamente al llegar al H. sapiens moderno y el cerebelo se hace más grande. Esto explicaría las notables capacidades cognitivas del H. sapiens moderno, en comparación no solo con otros miembros de nuestro género, sino con otros miembros más antiguos de nuestra propia especie15.
Comparando los endocráneos de distintas especies del género Homo, Bruner et al.16 encontraron que la principal diferencia entre nuestro cerebro y el de los demás integrantes de este género es la expansión del lóbulo parietal, particularmente de sus porciones superiores. Aquí se encuentra una de las zonas del cerebro implicadas en el procesamiento de la sintaxis y la gramática, que es una de las características más importantes del lenguaje humano, y que ha experimentado el mayor aumento en nuestra especie.
En resumen, aunque el proceso de encefalización humana tiene mucho que ver con un incremento en el tamaño absoluto y relativo del cerebro, es innegable que los cambios estructurales en segmentos y regiones específicas del cerebro han sido cruciales en este proceso. Si bien el crecimiento del lóbulo frontal no ha sido de la magnitud que se estimaba previamente, se ha dado un crecimiento desproporcionado de otros lóbulos del cerebro, en particular del temporal y el parietal.
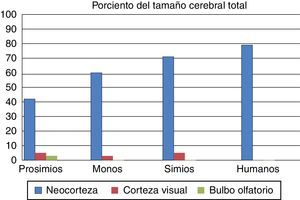
Cambios adaptativos fundamentales en la evolución del cerebroSe reconocen 3 principales cambios adaptativos en la morfología del cerebro que ocurrieron durante la evolución de los primates: una reducción en la importancia relativa del olfato, un incremento en la importancia relativa de la visión y un enorme incremento en la importancia relativa de la neocorteza17.
Algunos cambios en las condiciones que predominaban en el medio ambiente de los diferentes periodos evolutivos probablemente desencadenaron estos cambios en la morfología cerebral. Los prosimios son generalmente pequeños y codiciados por depredadores como gatos y aves grandes; por esta razón han mantenido en su primitiva adaptación sus actividades nocturnas. Para comunicarse unos con otros, especialmente cuando están en busca de parejas sexuales, usan señales olfatorias como la orina y otras secreciones olorosas. Este uso y dependencia de la olfacción se muestra en sus grandes bulbos olfatorios.
En el otro caso, con excepción de los monos búho de Sudamérica, todos los antropoides son de actividad diurna. Debido a su agudeza visual y visión de color, los primates pueden detectar fácilmente la coloración de una fruta madura, o la hinchazón de color rojo de un potencial compañero, así que dependen de la información visual para tener éxito en su entorno. La capacidad de ver en 3 dimensiones es un rasgo de la gran capacidad de adaptación, pues los primates pasaron gran parte de su historia evolutiva en los árboles. El aumento relativo en el tamaño y la complejidad de la corteza visual en los primates, y particularmente en los antropoides, es consecuencia de este cambio adaptativo.
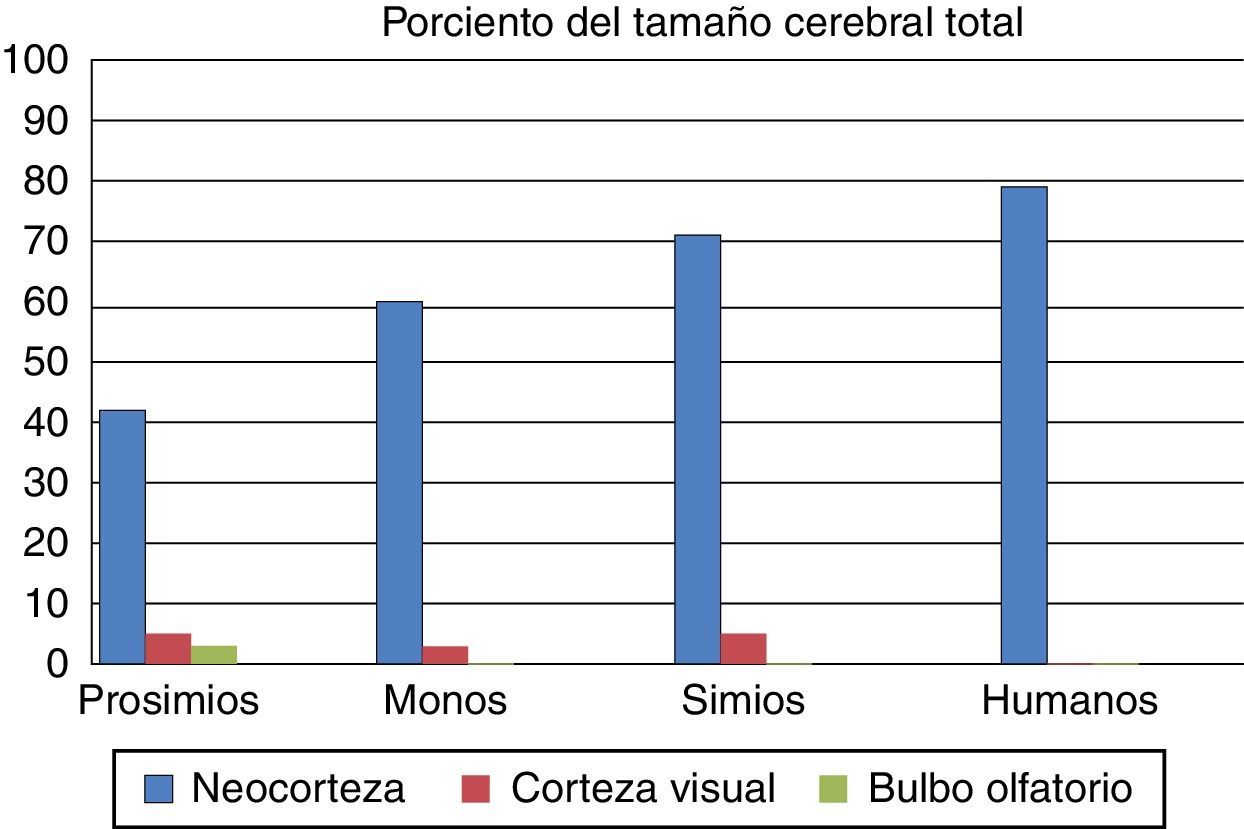
El tercer cambio adaptativo se refiere al aumento absoluto y relativo del tamaño de la neocorteza, la cual está involucrada en el procesamiento de la información de diferentes sentidos. Durante la evolución del cerebro antropoide, los primates con más áreas de asociación para procesar la información tenían más probabilidades de transmitir sus genes a la siguiente generación. Eran más listos, tenían mayor flexibilidad de comportamiento y más capacidad de adaptarse a los cambios del entorno. La figura 3 muestra las diferencias porcentuales del tamaño de estos órganos en diferentes primates.
Porcentaje del volumen cerebral dedicado al bulbo olfatorio, la corteza visual y la neocorteza en prosimios, monos, simios y humanos actuales. Tomado y modificado de Stephan et al.7.
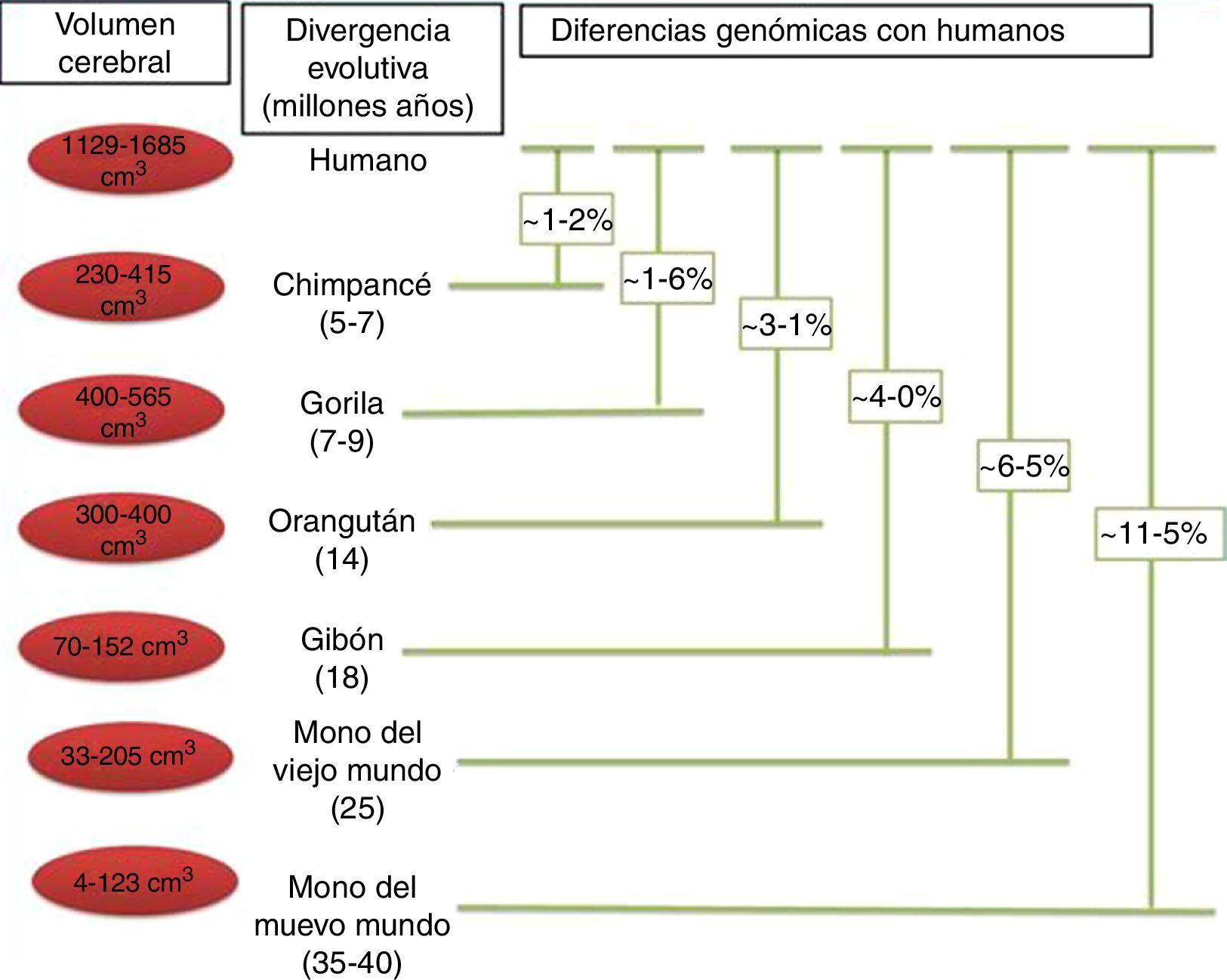
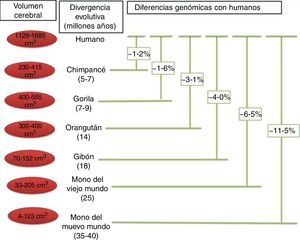
En el contexto del proceso general de nuestra evolución, es importante tratar de entender el enorme salto que hemos dado como especie para lograr la «humanización». Tal designación representa un conjunto de grandes y pequeñas diferencias que existen entre el H. sapiens y nuestros primos más cercanos, Pan paniscus y Pan troglodytes (P. troglodytes), de los cuales nos separamos hace más de 7 millones de años18. Estas diferencias son obvias desde el punto de vista morfológico, cognitivo y cultural, y algunas de las más importantes diferencias que ha determinado la evolución cerebral ya han sido analizadas. Sin embargo, es importante recordar que solo existe un 1,23% de diferencias genéticas entre el genoma del hombre y del chimpancé, que se traduce en una enorme diferencia fenotípica19,20.
Los seres vivos evolucionan y esta evolución les permite adaptarse a un entorno en constante cambio. Para ello es fundamental la coexistencia de 2 mecanismos de adaptación. El primero involucra los cambios genéticos que ocurren a nivel de especies y el segundo ocurre a nivel individual principalmente involucrando cambios en la organización de la cromatina. Estos mecanismos de adaptación ocurren de manera independiente y pueden observarse diferencias en ellos, dependiendo de la especie. También los cambios durante el desarrollo de la especie necesitan de mecanismos de adaptación que requieren de constantes modificaciones epigenéticas.
Como se describió anteriormente, la evolución humana se ha caracterizado por un rápido aumento en el tamaño del cerebro y por la complejidad que lo caracteriza. Décadas de investigación han aportado importantes avances en la identificación de las características anatómicas y fisiológicas del cerebro humano, y esto se ha logrado mediante herramientas moleculares como la genómica comparativa que ha permitido proponer un sinnúmero de hipótesis en cuanto a su evolución.
Las modificaciones genéticas que han conducido a la evolución del cerebro humano incluyen desde cambios epigenéticos, sustituciones de un solo nucleótido, hasta alteraciones estructurales a gran escala en nuestro genoma. Del mismo modo, las consecuencias funcionales de estos cambios genéticos varían mucho y van desde alteraciones en la secuencia de aminoácidos a cambios en las regiones cis-reguladoras, la aparición de nuevos genes o la extinción de los ya existentes.
Modificaciones epigenéticasLos mecanismos de adaptación implican, en gran parte, la participación de los llamados mecanismos epigenéticos. En ese sentido, cada individuo que se está adaptando logra su «individualización» a través de sus interacciones con el entorno10,20. Se cree que en los seres humanos estos mecanismos epigenéticos son los responsables de esos 900g de materia gris que tenemos en exceso en nuestro cerebro y de la forma en que las áreas cerebrales se distribuyen21. Sin entrar en mayor detalle respecto al genoma humano, debemos recordar que contiene entre 20 y 25 mil genes, los cuales codifican para el conjunto de proteínas que forman nuestra estructura bioquímica. Las secuencias codificadoras de proteínas representan menos del 2% de nuestro genoma; el otro 98% del genoma humano está constituido principalmente por secuencias que regulan la expresión génica, incluyendo secuencias de ARN no codificantes con funciones regulatorias (p. ej., micro-ARN)20,21.
Como se mencionó previamente, los seres humanos (H. sapiens) y los chimpancés (P. troglodytes) nos diferenciamos en tan solo un 1,23% de la secuencia genómica22. Además de los cambios de estructura y función de las proteínas, las diferencias en los patrones de expresión génica son considerados fundamentales para la diversificación fenotípica23,24. Estudios comparativos han identificado numerosas diferencias transcripcionales entre humanos y chimpancés25, las cuales no son únicamente cambios genéticos de elementos reguladores (duplicaciones, translocaciones, transversiones y transiciones), sino también modificaciones epigenéticas en regiones reguladoras26.
Aunque las diferencias genéticas entre el humano y el chimpancé han sido extensamente estudiadas, las diferencias epigenéticas no han sido bien identificadas ni caracterizadas27. Se conoce que la metilación de citosinas en sitios CpG es la principal modificación epigenética en el ADN genómico, y es capaz de regular la expresión génica de numerosas secuencias codificadoras28. En mamíferos, los sitios CpG que contienen citosinas metiladas se caracterizan por una elevada tasa de mutabilidad. Las islas CpG son regiones de 0,5-2 kilobases que albergan muchos sitios CpG, generalmente localizados en regiones promotoras no metiladas de los genes. La metilación de estas regiones es un proceso heredable a través de las divisiones celulares, lo que es importante para el mantenimiento de los patrones de expresión27. Se observan niveles de metilación variables en regiones adyacentes a las islas CpG durante el desarrollo embrionario, la carcinogénesis y la reprogramación celular29. En humanos y chimpancés, el 12-18% de los genes que muestran diferencias de expresión tienen también diferencias de metilación27.
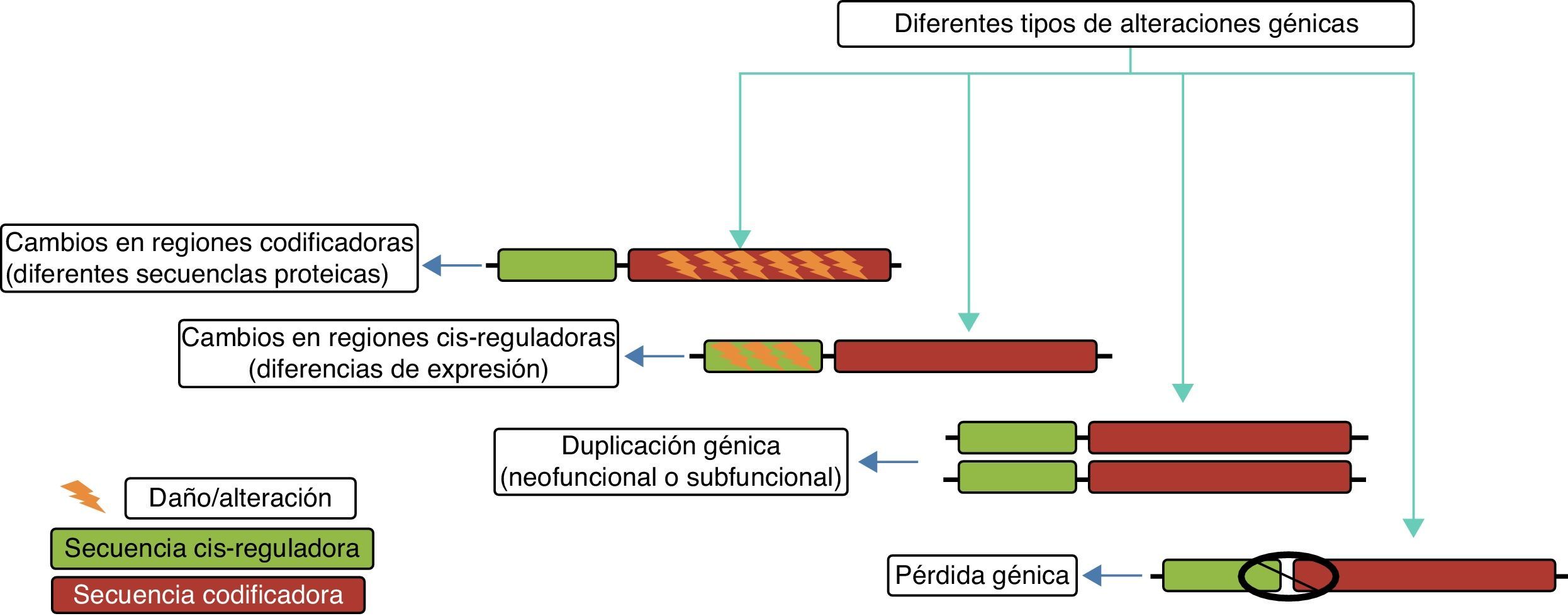
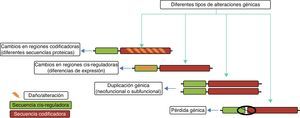
Mecanismos genéticos en la evolución del cerebro humanoEntre los principales mecanismos genéticos que se han relacionado con la evolución del cerebro humano se encuentran: a) la selección positiva en regiones codificantes de proteínas del genoma que conducen a cambios en la secuencias de proteínas existentes; b) la duplicación y la deleción de genes, y c) los cambios a través de la evolución en regiones no codificantes del genoma, especialmente en las secuencias reguladoras en cis que dan lugar a la expresión de genes alterados (fig. 4).
Esquema que muestra los diferentes cambios evolutivos observados en un gen y que potencialmente pudieron contribuir a la evolución del cerebro humano. Tomado y modificado Vallender et al.30.
Cambios en la secuencia proteica. Existen numerosas diferencias entre las secuencias de proteínas de humanos y otros mamíferos. Cuando se comparan los humanos y los chimpancés la mayoría de las proteínas presentan al menos una diferencia en sus aminoácidos. Algunas de estas diferencias encontradas en la secuencia proteica probablemente tienen pocas consecuencias funcionales, siendo estas no trascendentes para la evolución fenotípica de los seres humanos. Sin embargo, algunos cambios en las secuencias, sin duda han tenido efectos funcionales importantes que han contribuido a ciertas características cerebrales humanas específicas. Cuando la selección positiva actúa sobre las mutaciones en regiones codificadoras que alteran la secuencia de la proteína, frecuentemente deja huella en los genes afectados. El principal enfoque en el estudio de la genética y sobre todo en la evolución del cerebro humano ha sido la identificación de genes que han mostrado selección positiva en comparación con el resto de primates30 (fig. 5).
Relaciones filogenéticas de los humanos y otros primates. En esta figura se indica la separación entre los humanos y otras especies, así como las diferencias genéticas observadas a través de la evolución. Los valores descritos en las diferencias genéticas son basados en las sustituciones de nucleótidos, sin considerar otros tipos de cambios (inserciones, deleciones y cambios estructurales). Los valores para los simios del Viejo Mundo y los del Nuevo Mundo se basan en grupos de especies dentro de cada clado. Tomado y modificado de Vallender et al.30.
Un área de investigación que ha mostrado un amplio panorama en el entendimiento de la evolución del cerebro humano ha sido la identificación de genes relacionados con la microcefalia, un defecto congénito caracterizado por una severa reducción en el tamaño del cerebro. Entre sus muchas formas de presentación, la microcefalia primaria se manifiesta como una reducción en el tamaño del cerebro sin otras anormalidades en la arquitectura del cerebro o en la formación del giro30-32. Típicamente, la reducción en el tamaño de la corteza cerebral es mucho más severa que la de otras regiones del cerebro. Por lo tanto, la microcefalia primaria puede ser considerada como una condición atávica que recapitula algunos aspectos de las etapas evolutivas anteriores del cerebro homínido (menor tamaño con reducción especialmente de la corteza cerebral). La microcefalia primaria es genéticamente heterogénea y se han relacionado 6 regiones del genoma humano llamadas microcefalia autosómica recesiva primaria del 1 a 6 (MCPH1 a MCPH6); además se han asociado mutaciones nulas en 4 loci: microcefalina (MCPH1); proteína 2 reguladora asociada a la subunidad regulatoria CDK5 (CDK5RAP2); microcefalia asociada al uso mitótico anormal (ASPM) y proteína centromérica (CENPJ)30,33,34. El gen ASPM ha sufrido selección positiva durante todo el linaje de los primates a los seres humanos e incluye tanto el linaje de la separación de los grandes simios del Viejo Mundo hasta el linaje dentro de los grandes simios, el cual nos incluye como seres humanos30,35,36. Por otra parte, el gen de la microcefalina se ha caracterizado por una marcada selección positiva principalmente en el linaje de los primates ancestrales hasta los grandes simios35,37. Así mismo los genes CDK5RAP2 y CENPJ han mostrado mayores tasas de sustituciones no sinónimas en primates comparadas con los roedores y CDK5RAP2 mostró específicamente altas tasas de cambios en los linajes del chimpancé y los humanos38.
Otro ejemplo relacionado con la proliferación de precursores neuronales es el gen polipéptido 1 de activación de adenilato ciclasa (ADCYAP1), que también ha sufrido una acelerada evolución en su secuencia proteica en los seres humanos. ADCYAP1 regula la transición de la proliferación de estados diferenciados durante la neurogénesis39,40.
Un segundo aspecto del desarrollo neuronal que podría haber sido sustrato para la selección positiva en los seres humanos es el direccionamiento del axón. El gen auxiliar 1 del sitio de integración Abelson (AHI1) es uno de los genes asociados a una rara malformación cerebral denominada síndrome de Joubert; el gen AHI1 participa direccionando los axones desde el cerebro hasta la médula espinal. En ese sentido, tanto los genes ASPM, ADCYAP1 y AHI1 muestran una tasa acelerada de cambios no sinónimos en la secuencia a lo largo del linaje humano a partir de la divergencia de los chimpancés41. Otro ejemplo es el gen Sonic Hedgehog (SHH), el cual es altamente conservado durante el desarrollo. Este gen codifica para una molécula de señalización que tiene un papel central durante el desarrollo de muchos tejidos, especialmente en el sistema nervioso y esquelético. La proteína SHH está constituida por 2 dominios funcionales: el péptido señal y una región autocatalítica; ambos dominios se encargan de cortar el péptido señal. El dominio autocatalítico ha mostrado una marcada tasa de evolución en su secuencia proteica en primates comparada con otros mamíferos, y más aún en la secuencia proteica de los humanos. Interesantemente, los principales cambios encontrados en su secuencia proteica involucran ganancia de ciertos aminoácidos como serinas y treoninas, los cuales son sustratos potenciales para modificaciones postraduccionales, por lo que este gen SHH se ha propuesto como el principal autor de la evolución del sistema nervioso y/o sistema esquelético desde los primates hasta el humano42. Finalmente, otro gen relacionado en estos procesos es monoamino oxidasa A (MAOA), el cual codifica para una enzima mitocondrial que cataboliza varios neurotransmisores, entre los que se incluyen la dopamina, la serotonina y la norepinefrina. Alteraciones funcionales en este gen pueden tener potencialmente numerosas consecuencias fisiológicas y conductuales. Se sugiere que mutaciones no sinónimas en este gen provocaron un cambio funcional en la enzima, dando lugar a la divergencia humano-chimpancé43.
El caso del gen FOXP2. Procesos de selección positiva también han ocurrido en genes relacionados con el lenguaje. El ejemplo más notable es el caso del gen forkhead box P2 (FOXP2), en el que la pérdida de su función conlleva a un déficit lingüístico hereditario caracterizado por dispraxia verbal. Interesantemente, FOXP2ha sido implicado en la comunicación verbal en otras especies, como los ratones y aves30,44,45. A pesar de que la secuencia de este gen está altamente conservada entre las especies, los genes FOXP2 del chimpancé y el humano difieren solo en 2 sustituciones no sinónimas que probablemente aparecieron hace menos de 200.000 años, por lo que se propuso que estas mutaciones pueden haber participado en la aparición del lenguaje humano. También se conoce que este gen participa en el desarrollo y el funcionamiento de varias regiones del cerebro asociadas con el aprendizaje y la producción del lenguaje45,46. Además, y lo más importante, es que este gen tiene la función de controlar las tareas motoras delicadas que acompañan a la articulación del lenguaje, por lo que se cree que las mutaciones puntuales encontradas en ese gen pudieron haber contribuido a la fluidez lingüística que caracteriza a nuestra especie20.
Creación de nuevos genes. La generación de nuevos genes en el genoma es desencadenada por eventos de duplicación, a menudo dentro de grandes familias de genes que quizás tienen predisposición a tales eventos. La relajación de la restricción evolutiva en los genes duplicados proporciona una oportunidad única para neofuncionalización o subfuncionalización30. La «neofuncionalización» involucra la adquisición de nuevas características por uno o ambos genes duplicados, mientras que la «subfuncionalización» implica la repartición de la función ancestral entre los genes duplicados30.
Los recientes avances en la secuenciación completa de genomas de múltiples especies de primates, acopladas con nuevas tecnologías como la hibridación genómica comparativa, ha facilitado la identificación de genes duplicados durante la evolución humana47-49. La primera familia de genes para los cuales existe evidencia sustentable de duplicación génica, seguida por neofuncionalización, es la familia «Morfeo». Esta familia de genes es tan amplia en los linajes de humanos y los grandes simios que ha sido acompañada por una intensa selección positiva en las secuencias de proteínas codificadas. La función de los genes Morfeo es aún desconocida y no está claro si la adaptación drástica de esta familia de genes a través de la evolución tiene que ver con el proceso de encefalización humana47.
Otra familia de genes denominados MRG, los cuales codifican para un grupo de receptores acoplados de proteínas G, se expresan significativamente en neuronas nociceptivas de la médula espinal y son implicadas en la modulación de la nocipercepción50. La presencia de múltiples copias de los genes MRG en humanos, probablemente es el resultado de la amplificación del gen después de la divergencia humano-ratón, ya que las secuencias de las copias en humanos revelan fuerte evidencia de selección positiva en las regiones de los genes que codifican para los dominios de unión al ligando extracelular51,52.
Otro ejemplo en el que la consecuencia funcional de un evento de duplicación es evidente, es el nacimiento del gen glutamato deshidrogenasa 2 (GLUD2). Este gen surgió de la retrotransposición o de la reintegración del ARNm de solo un precursor ancestral: GLUD153. En la mayoría de las especies de mamíferos, GLUD1 es el único gen que codifica para la proteína glutamato deshidrogenasa, la cual en el cerebro cataliza el reciclaje del neurotransmisor excitatorio glutamato54,55. El evento de retrotranscripción ocurrió en el linaje de los simios, después de su divergencia de los monos del Viejo Mundo, dando lugar al gen GLUD2, el cual codifica para otro gen glutamato deshidrogenasa específico en los simios y los humanos. Aunque el gen GLUD1 es ampliamente expresado en muchos tejidos, la expresión de GLUD2 es específica del tejido nervioso y testicular54,55.
Pérdida de genes. Aunque la creación de nuevos genes puede producir efectos fenotípicos importantes, la pérdida de genes en un organismo puede tener consecuencias drásticas o deletéreas, por lo que este es un evento mucho más raro durante la evolución. En algunos casos, sin embargo, la pérdida de genes puede ocurrir debido a cambios selectivos con el tiempo. El mejor ejemplo conocido de pérdida de genes durante la evolución humana es la familia de genes de los receptores olfatorios (RO)30,56,57. Se ha estimado que el ratón tiene aproximadamente 1.200 genes con funciones de RO, en tanto que en el humano solo existen cerca de 350 de estos genes56. Esta cantidad reducida de genes es debida principalmente a los seudogenes (reliquias no funcionales de los genes ancestrales). Esta degeneración en los genes RO no es única en humanos y parece afectar también varias especies de primates. Recientemente se ha demostrado una selección positiva en algunos genes RO en el linaje humano57. Otro ejemplo interesante de pérdida de genes que podría haber desempeñado un papel importante en la evolución del cerebro humano es el gen cadena pesada 16 de la miosina (MYH16); este gen codifica para la cadena pesada de la miosina, proteína presente en el músculo esquelético58. En primates no humanos, MYH16 se expresa exclusivamente en músculos de la cabeza, incluidos los músculos encargados de la masticación; en humanos, una mutación en este gen produce desplazamiento del marco de lectura, lo que resulta en la pérdida de su función. En ese sentido, al realizarse comparaciones con otros primates, los humanos tienen un sistema para la masticación poco desarrollado, sugiriendo que la pérdida del gen MYH16 fue parcialmente responsable de ello59,60.
Cambios en la expresión génica. Se ha postulado que cambios en la expresión génica hayan desempeñado un papel importante en la aparición del fenotipo humano. En particular, ha sido argumentado que pequeños cambios en elementos regulatorios no codificantes pudieran fuertemente impactar en los patrones de expresión espacial y temporal de genes del desarrollo, lo que podría tener profundos efectos fenotípicos61-63.
Una estrategia utilizada para establecer cómo los cambios en la expresión génica han contribuido a la evolución humana es comparar regiones regulatorias cis de genes relacionados con el cerebro, para identificar aquellos genes que han sufrido selección positiva. El gen prodinorfina (PDYN) codifica para un precursor de un neuropéptido opioide involucrado en muchos procesos neurales. Un elemento cis regulatorio ubicado corriente arriba de este gen exhibe una tasa rápida de cambios en su secuencia en el linaje humano después de la divergencia de los chimpancés, lo que demuestra los efectos de la selección positiva64. Además de secuencias reguladoras cis, los cambios en las secuencias proteicas de factores de transcripción pueden tener profundos efectos en la expresión de los genes que regulan. Varios estudios han encontrado un aumento significativo de factores de transcripción entre los genes que han experimentado selección positiva en sus regiones codificantes para las proteínas, aunque no es claro si los patrones de expresión de sus genes diana se ven afectados65,66.
ARNs no codificantes. Un área de investigación interesante y de rápida evolución es la identificación de los ARNs no codificantes. Metodológicamente, son similares a los estudios que tratan de identificar patrones evolutivos en los elementos cis-regulatorios. En consecuencia, muchas de las técnicas desarrolladas para estudiar la evolución en regiones promotoras o de potenciadores pueden ser usadas para estudiar la evolución de los ARNs no codificantes67-70. De hecho, fue durante una exploración a gran escala de elementos cis-reguladores que se encontró el primer ARN no codificante humano seleccionado positivamente (Pollard et al., 2006). El gen para este ARN no codificante fue el llamado región humana acelerada 1 (HAR1), el cual es expresado en las neuronas del desarrollo del neocórtex humano. El análisis evolutivo realizado reveló que, a pesar de que este gen mide solo 118 pb, contiene 18 cambios en el linaje humano desde la divergencia de los chimpancés. El análisis estructural del gen HAR1 reveló que estos cambios alteran la estructura secundaria del ARN humano en comparación con otros amniotas, lo que sugiere que los cambios específicos en el gen HAR1 humano podrían haber participado en la evolución de la corteza cerebral humana67.
Diferencias cromosómicas entre humanos y grandes simiosLas diferencias reportadas entre el genoma del humano y el de los grandes simios incluyen cambios cromosómicos, cambios en el ADN genómico repetitivo, presencia de polimorfismos de un solo nucleótido, inactivación específica de genes, duplicaciones y pérdidas de genes71, etc. Las diferencias cromosómicas fueron los primeros cambios genéticos observables72, de manera que los cromosomas son una importante herramienta para el estudio de cambios genómicos en procesos evolutivos, estableciéndose sintenias cromosómicas ancestrales para determinar el origen evolutivo por medio de líneas filogenéticas73. Es de importancia resaltar que el cromosoma X es considerado el cromosoma más conservado evolutivamente entre los mamíferos74.
Anteriormente, con las técnicas clásicas de tinción cromosómica no era posible establecer con precisión la homología y la localización de rearreglos y puntos de ruptura ocurridos a través de la evolución del humano y grandes simios, pero este problema se solucionó en buena parte en la década de 1980 con la innovación de sondas moleculares como la hibridación in situ fluorescente (FISH)73.HAR1
Algunos rearreglos cromosómicos entre humanos y chimpancés pueden revelar la historia de los eventos de especiación que eventualmente pudieron diversificar a los humanos y chimpancés modernos75. De esta manera, se analizó y caracterizó el material cromosómico de grandes simios como el chimpancé, el gorila y la subespecie del orangután Sumatran (Pongo pygmaeus abelii), encontrándose que el cromosoma 2 humano era el resultado de la fusión de 2 cromosomas acrocéntricos y homólogos; así, el brazo corto del cromosoma 2 (2p) proviene del chimpancé y el brazo largo (2q) proviene de los grandes simios, reduciendo en consecuencia a 23 pares el complemento cromosómico en el humano moderno76-78. Adicionalmente, una inversión pericéntrica común localizada en 2p reafirma que los humanos y los chimpancés están unidos filogenéticamente (condición ancestral independiente) y que esta inversión ocurrió en un ancestro en común para ambas especies, posterior a la divergencia del gorila. Consecuentemente, el gorila y el orangután conservan las formas más ancestrales73,76,79.
Los cromosomas del chimpancé y el gorila difieren de los cromosomas humanos principalmente en 11 rearreglos (9 inversiones paracéntricas y pericéntricas, una translocación y una fusión), diferencias en los centros de organización nucleolar, además de la presencia adicional de bandas G en regiones terminales subteloméricas. Estas modificaciones subteloméricas están compuestas de heterocromatina, las cuales se encuentran ausentes en el humano y el orangután80-82. Mientras que la mayoría de los cromosomas del gorila muestran estas cubiertas subterminales, solo la mitad de los cromosomas del chimpancé contienen estas características83. Estas regiones subteloméricas son reconocidas como regiones extremadamente dinámicas de los cromosomas84. Se ha propuesto que cuando todas las cromátides están interconectadas (profase meiótica) ocurre el dinamismo genómico, permitiendo el intercambio de los extremos cromosómicos entre cromosomas no homológos85, posiblemente explicando por qué las regiones subteloméricas son preferentemente asociadas y comparten un alto grado de secuencias idénticas localizadas en cromosomas no homólogos86. De esta manera, las terminales cromosómicas son consideradas como puntos calientes en la evolución del genoma87.
ConclusionesLas preguntas relacionadas a qué hace del cerebro humano un órgano tan particular, por qué es cognitivamente tan especial, aun en comparación con el cerebro de primates superiores y homínidos ancestrales o cuándo nuestro cerebro llegó a ser realmente humano no han sido del todo contestadas; sin embargo, los esfuerzos de la neurobiología, la bioquímica, la anatomía comparada, la fisiología, la histología y últimamente el poder de las pruebas de genética molecular y genómica han permitido una mejor comprensión del complejo e intrigante cerebro humano. Aunque el entendimiento completo de las funciones cerebrales cognitivas conductuales y de memoria aún no están a nuestro alcance, el conjunto enorme de esfuerzos de un sin número de investigadores de todos los ámbitos nos acerca paulatinamente a descubrir la estructura biológica más compleja de este planeta.
Conflicto de interesesLos autores declaran no tener conflictos de interés relacionados con este trabajo.
Este trabajo no tiene conflicto de intereses por parte de sus autores.