La enfermedad de Parkinson (EP) cuenta con un tratamiento sintomático amplio. No existe información fidedigna sobre los factores que influyen en la elección del tratamiento.
ObjetivoIdentificar los factores que determinan el inicio del tratamiento con levodopa/carbidopa/entacapona (LCE) en pacientes con EP.
Pacientes y métodosEstudio observacional, transversal retrospectivo y multicéntrico en pacientes con EP idiopática en tratamiento con LCE. Se recogieron datos sobre factores potencialmente implicados, como determinantes del inicio del tratamiento con LCE en la práctica clínica habitual.
ResultadosSe estudió a 1.050 pacientes (edad media 71,3±8,7 años; 58,2%, hombres), con 13,8±12,9 meses de evolución hasta el diagnóstico y 74,5±53,6 meses hasta el momento del inicio del tratamiento con LCE. Los síntomas iniciales incluyeron: temblor (70,6%), reducción de destreza (43,2%) y lentitud de movimientos (41,5%). El estadio de Hoehn y Yahr mayoritario al inicio de LCE fue 2 (57,5%), mientras que la escala de Schwab y England presentó una puntuación media de 73,4%. Ochocientos veintidós pacientes (78,3%) recibieron otros fármacos antes de LCE (tiempo medio entre inicio de tratamiento e inicio con LCE: 40,5±47,2 meses). Los factores clínicos determinantes para iniciar el tratamiento con LCE fueron la presencia de bradicinesia (84,7%), rigidez diurna (72,2%), empeoramiento general (72,2%), dificultad marcha (66,4%), temblor (62,7%), rigidez nocturna (56,1%) e inestabilidad postural (53%). El único factor psicosocial determinante identificado fue la dificultad para realizar las actividades habituales de la vida diaria (84,3%).
ConclusionesEn la EP, el inicio del tratamiento con LCE viene determinado fundamentalmente por los déficits motores y la discapacidad asociada.
Several therapeutic options are available for the symptomatic treatment of Parkinson's disease (PD).There is no reliable information about which factors are involved in the choice of treatment.
ObjectiveTo identify factors contributing to the decision to start treatment with levodopa/carbidopa/entacapone (LCE) in patients with PD.
Patients and methodsWe completed a descriptive cross-sectional retrospective multicentre study of patients with idiopathic PD receiving LCE. Clinical data were collected with special attention to factors that could potentially determine when to initiate treatment with LCE in normal clinical practice.
ResultsWe studied 1050 patients with a mean age of 71.3±8.7 years (58.2% men). Average time from onset of symptoms to diagnosis was 13.8±12.9 months, with a latency time of 74.5±53.6 months before starting LCE treatment. The most common initial symptoms were tremor (70.6%), reduced dexterity (43.2%) and slowness of movement (41.5%). At the start of LCE treatment, most patients were in Hoehn and Yahr stage 2 (57.5%), with an average rating of 73.4% on the Schwab & England scale. Eight hundred twenty two patients (78.3%) received treatment with other drugs before starting LCE (mean time between starting any PD treatment and starting LCE was 40.5±47.2 months). Clinical factors with a moderate, marked, or crucial effect on the decision to start LCE treatment were bradykinesia (84.7%), daytime rigidity (72.2%), general decline (72.2%), difficulty walking (66.4%), tremor (62.7%), nocturnal rigidity (56.1%), and postural instability (53%). Difficulty performing activities of daily living was the only psychosocial factor identified as having an influence on the decision (84.3%).
ConclusionsThe decision to start patients with idiopathic PD on LCE treatment is mainly determined by motor deficits and disabilities associated with disease progression.
La enfermedad de Parkinson (EP) se manifiesta por síntomas motores (temblor de reposo, bradicinesia y rigidez) y no motores. La prevalencia de EP en España se estima en 1,7% entre mayores de 65 años1, aunque con considerables diferencias según la región geográfica2.
La EP idiopática representa alrededor del 85% de todos los «parkinsonismos», diagnosticados anualmente3. Su etiología es compleja e implica factores ambientales y genéticos, lo cual probablemente explica la heterogeneidad en la progresión de la enfermedad4. En este contexto, es posible que existan subgrupos de pacientes con diferentes mecanismos patogénicos y que tal vez precisen un abordaje terapéutico individualizado5. En la actualidad, no existe ningún tratamiento neuroprotector comprobado pero sí se dispone de tratamientos sintomáticos potentes y eficaces6, aunque no existe consenso sobre en qué momento y cómo debe iniciarse el tratamiento farmacológico6,7. Algunos estudios sugieren beneficios en la calidad de vida del paciente ligados al inicio temprano del tratamiento8,9, mientras que la mayoría de las guías de práctica clínica recomiendan iniciar la terapia cuando aparezcan los primeros síntomas comprometedores de la actividad diaria10. Además, la elección del tratamiento depende de numerosos factores, relacionados con el propio fármaco (eficacia, complicaciones, seguridad, etc.), el perfil del paciente (síntomas, edad, profesión, comorbilidad, etc.) y otras circunstancias (socioeconómicas, por ejemplo)11-13. Esta situación favorece la incertidumbre en los pacientes y la variabilidad en la práctica clínica ligada a la falta de evidencia.
No se dispone de información suficiente acerca de los factores que influyen en algunas decisiones terapéuticas durante el curso de la EP14 y, por tanto, parece justificada la realización de estudios para su identificación. Hasta el momento, no se conocen los factores que influyen en la decisión de iniciar el tratamiento con la combinación de levodopa/carbidopa/entacapona (LCE) a dosis fijas, uno de los tratamientos para EP más frecuentemente utilizados. El presente estudio pretende identificar, de modo retrospectivo, cuáles son los factores que en la práctica clínica habitual influyen en los neurólogos españoles para indicar el inicio de este tratamiento. En nuestro conocimiento, no existe un estudio con un objetivo similar en nuestro medio y sus resultados pueden ser interesantes para incrementar el conocimiento en esta área.
Pacientes y métodosEl estudio se desarrolló según un diseño observacional, transversal retrospectivo y multicéntrico a nivel nacional según condiciones de práctica clínica habitual. Cada neurólogo participante incluyó datos de al menos 10 pacientes en tratamiento con LCE, hasta alcanzar un total de 1.050 pacientes válidos, cifra que se estimó sobre la base de la precisión considerada como aceptable para el peor escenario (desde una precisión de±3 puntos porcentuales para una proporción del 50% a una precisión 1,8 para una proporción del 10% en una categoría de respuesta). Se incluyó a pacientes mayores de 18 años, con EP idiopática en tratamiento con LCE durante un mínimo de 3 meses previos a la inclusión en el estudio. Se excluyó a los pacientes que estuvieran participando en un ensayo clínico durante el tratamiento con LCE y aquellos cuyo estado de salud, a juicio del investigador, desaconsejase su inclusión en el estudio.
Mediante revisión de la historia clínica se recogieron datos clínicos de los pacientes, con atención especial a los factores que determinaron el inicio del tratamiento LCE en práctica clínica habitual. El protocolo del estudio fue aprobado por el Comité Ético del Hospital Clínic de Barcelona.
Además de la sintomatología clínica específica de la EP, se recogieron el tiempo desde el diagnóstico, los síntomas iniciales, la puntuación Hoehn y Yahr15, las secciones 2 (actividades de la vida diaria) y 3 (examen motor) de la Escala Unificada de Valoración de la EP (Unified Parkinson Disease Rating Scale [UPDRS])16, la escala de actividades de la vida diaria Schwab y England17, los tratamientos previos recibidos y el momento de inicio de los diferentes tratamientos. Además, se analizó la relación existente entre las variables demográficas y clínicas recopiladas, y los factores patológicos relacionados con el progreso de la enfermedad y con el inicio del tratamiento con LCE. Se consideró que un factor clínico o psicosocial fue «determinante» para la decisión de iniciar el tratamiento con LCE, cuando la suma de los porcentajes de pacientes en las categorías «influyó moderadamente» a «fue crucial y decisivo», representaba más del 50% del total de pacientes que presentaban dicho factor.
Se utilizaron estadísticos descriptivos habituales según las características de las variables (categóricas o continuas). Para las comparaciones se utilizaron pruebas paramétricas (t de Student o ANOVA) o no paramétricas (Mann-Whitney o Kruskal-Wallis). Para las variables cualitativas se realizó la prueba de chi-cuadrado.
Una vez identificados los factores clínicos y psicosociales determinantes, se estableció la relación entre estos factores y las características sociodemográficas de los pacientes. Para ello, se utilizó un modelo de regresión logística para cada factor determinante (como variable dependiente) mediante «eliminación progresiva» (backward stepwise) de las variables sociodemográficas (variables independientes) no significativas. Los resultados se expresaron como odds ratio, con sus respectivos IC del 95%.
Los análisis estadísticos se realizaron con el paquete estadístico SAS versión 9.1.3 o posterior.
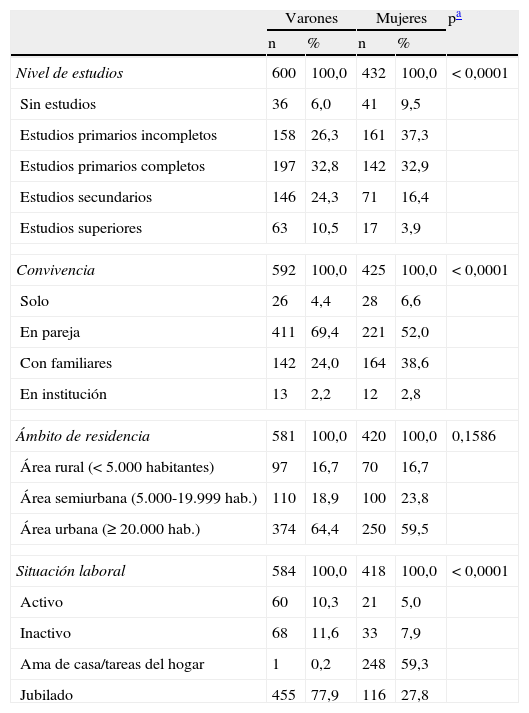
ResultadosSe obtuvo una muestra de 1.050 pacientes (58% varones; edad media: 71,3±8,7) evaluados por 102 neurólogos. El estado basal de los pacientes al inicio del tratamiento con LCE fue: Hoehn y Yahr (disponible en el 97,1% de los pacientes) estadio 1, 14,9%; estadio 2, 57,5%; estadio 3, 23,1%, y estadio 4, 4,5%; puntuación media UPDRS 2-AVD: 12,8±7.0; UPDRS 3-examen motor, 25,7±13,2 (UPDRS 2 y 3 disponibles en 62.7%), y puntuación media en la escala Schwab y England (disponible en el 76,5%), 73,4±15,7. En la tabla 1 se muestran otras características sociodemográficas e históricas de la muestra.
Características sociodemográficas de los pacientes al inicio del tratamiento con LCE
| Varones | Mujeres | pa | |||
| n | % | n | % | ||
| Nivel de estudios | 600 | 100,0 | 432 | 100,0 | < 0,0001 |
| Sin estudios | 36 | 6,0 | 41 | 9,5 | |
| Estudios primarios incompletos | 158 | 26,3 | 161 | 37,3 | |
| Estudios primarios completos | 197 | 32,8 | 142 | 32,9 | |
| Estudios secundarios | 146 | 24,3 | 71 | 16,4 | |
| Estudios superiores | 63 | 10,5 | 17 | 3,9 | |
| Convivencia | 592 | 100,0 | 425 | 100,0 | < 0,0001 |
| Solo | 26 | 4,4 | 28 | 6,6 | |
| En pareja | 411 | 69,4 | 221 | 52,0 | |
| Con familiares | 142 | 24,0 | 164 | 38,6 | |
| En institución | 13 | 2,2 | 12 | 2,8 | |
| Ámbito de residencia | 581 | 100,0 | 420 | 100,0 | 0,1586 |
| Área rural (< 5.000 habitantes) | 97 | 16,7 | 70 | 16,7 | |
| Área semiurbana (5.000-19.999 hab.) | 110 | 18,9 | 100 | 23,8 | |
| Área urbana (≥ 20.000 hab.) | 374 | 64,4 | 250 | 59,5 | |
| Situación laboral | 584 | 100,0 | 418 | 100,0 | < 0,0001 |
| Activo | 60 | 10,3 | 21 | 5,0 | |
| Inactivo | 68 | 11,6 | 33 | 7,9 | |
| Ama de casa/tareas del hogar | 1 | 0,2 | 248 | 59,3 | |
| Jubilado | 455 | 77,9 | 116 | 27,8 | |
LCE: levodopa/carbidopa/entacapona.
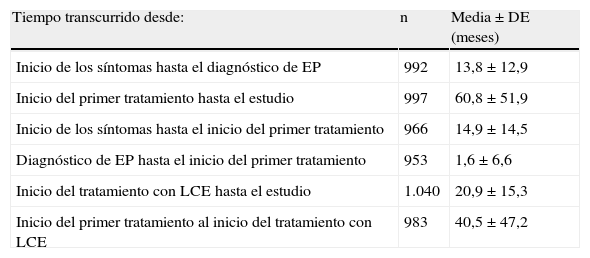
El tiempo transcurrido entre el comienzo de los síntomas característicos de EP y el estudio fue de 6,21±4,47 años y desde el diagnóstico, 5,18±4,40 años. Otros datos temporales de interés histórico y terapéutico se detallan en la tabla 2.
Períodos de interés en la historia clínica y terapéutica
| Tiempo transcurrido desde: | n | Media±DE (meses) |
| Inicio de los síntomas hasta el diagnóstico de EP | 992 | 13,8±12,9 |
| Inicio del primer tratamiento hasta el estudio | 997 | 60,8±51,9 |
| Inicio de los síntomas hasta el inicio del primer tratamiento | 966 | 14,9±14,5 |
| Diagnóstico de EP hasta el inicio del primer tratamiento | 953 | 1,6±6,6 |
| Inicio del tratamiento con LCE hasta el estudio | 1.040 | 20,9±15,3 |
| Inicio del primer tratamiento al inicio del tratamiento con LCE | 983 | 40,5±47,2 |
LCE: levodopa/carbidopa/entacapona.
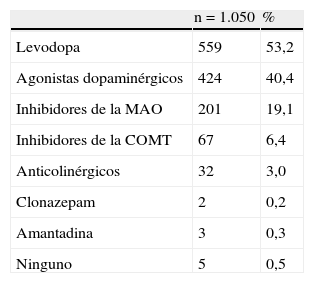
Los primeros síntomas característicos incluyeron temblor (70,6%), reducción de la habilidad y la destreza (43,2%), lentitud del movimiento (41,5%), rigidez (17,6%) y alteración del equilibrio (12,1%). Como se muestra en la tabla 3, la mayoría de los pacientes iniciaron tratamiento con levodopa (53%), agonista dopaminérgico (40%) y/o inhibidores de la MAO (19%).
Tratamiento inicial de la enfermedad de Parkinson en la muestra
| n = 1.050 | % | |
| Levodopa | 559 | 53,2 |
| Agonistas dopaminérgicos | 424 | 40,4 |
| Inhibidores de la MAO | 201 | 19,1 |
| Inhibidores de la COMT | 67 | 6,4 |
| Anticolinérgicos | 32 | 3,0 |
| Clonazepam | 2 | 0,2 |
| Amantadina | 3 | 0,3 |
| Ninguno | 5 | 0,5 |
Para un mismo paciente se podía especificar más de un tratamiento.
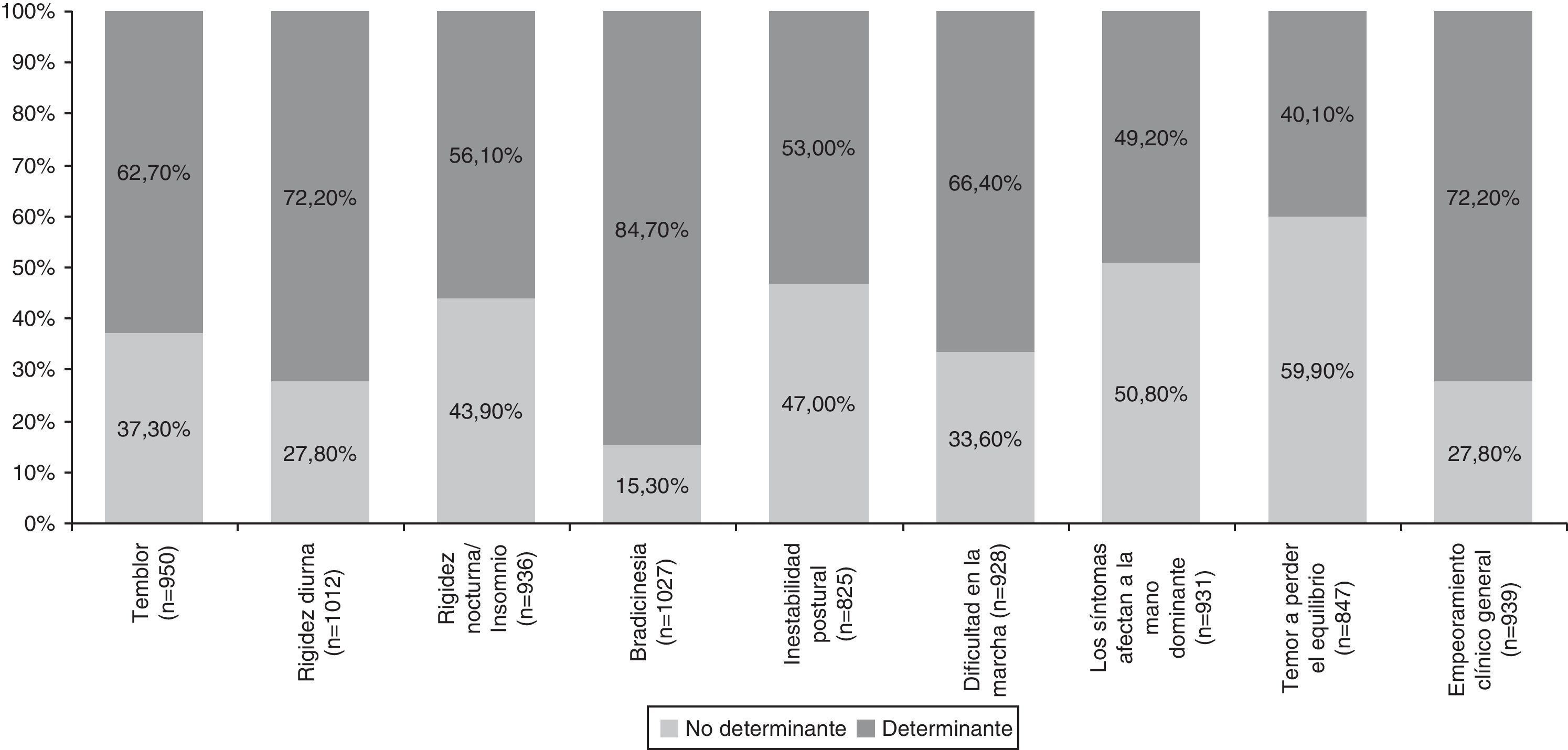
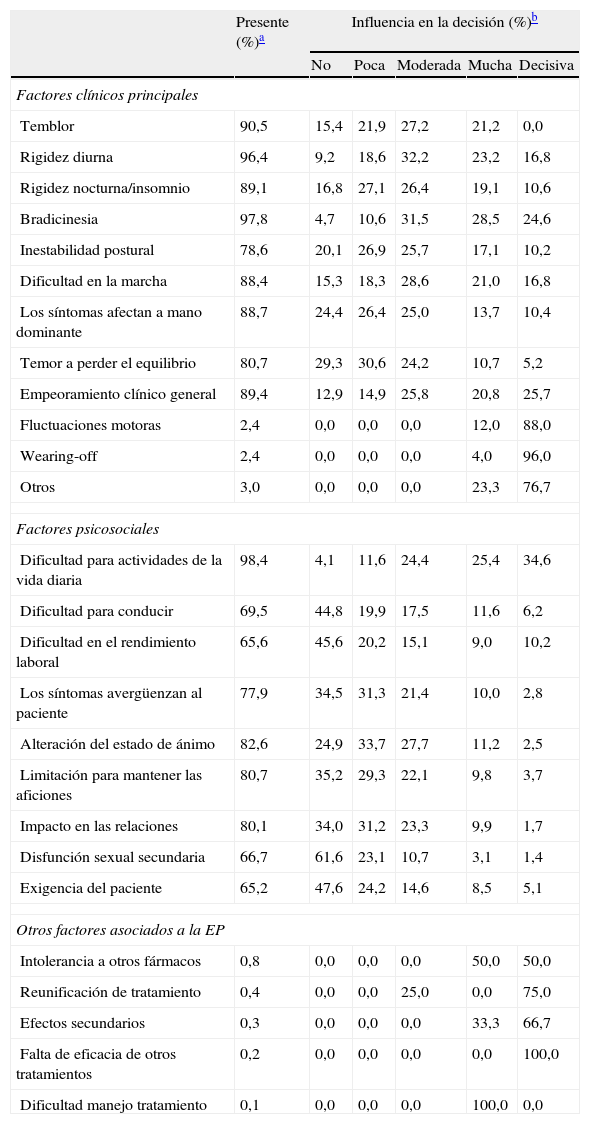
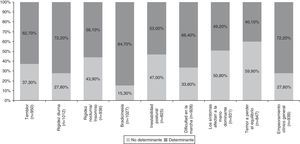
El conjunto de factores clínicos y psicosociales evaluados en el inicio del tratamiento con LCE se resumen en la tabla 4. Los factores clínicos evaluados incluyeron manifestaciones características de la EP (temblor, rigidez, bradicinesia), dificultad en la marcha, pérdida de destreza manual, fluctuaciones motoras y el empeoramiento clínico general. Entre los factores clínicos determinantes en la decisión de iniciar tratamiento con LCE destacaron por su importancia la bradicinesia (84,7%), el empeoramiento clínico general (72,2%) y la rigidez diurna (72,2%) (tabla 4 y fig. 1). Otros factores clínicos resultaron decisivos en algunos pacientes (wearing-off: 96%; fluctuaciones motoras: 88%) pero debido a su escasa representación en la muestra (< 5%) no se han considerado detalladamente ni tenido en cuenta en análisis secundarios.
Factores de influencia en la decisión del inicio del tratamiento LCE
| Presente (%)a | Influencia en la decisión (%)b | |||||
| No | Poca | Moderada | Mucha | Decisiva | ||
| Factores clínicos principales | ||||||
| Temblor | 90,5 | 15,4 | 21,9 | 27,2 | 21,2 | 0,0 |
| Rigidez diurna | 96,4 | 9,2 | 18,6 | 32,2 | 23,2 | 16,8 |
| Rigidez nocturna/insomnio | 89,1 | 16,8 | 27,1 | 26,4 | 19,1 | 10,6 |
| Bradicinesia | 97,8 | 4,7 | 10,6 | 31,5 | 28,5 | 24,6 |
| Inestabilidad postural | 78,6 | 20,1 | 26,9 | 25,7 | 17,1 | 10,2 |
| Dificultad en la marcha | 88,4 | 15,3 | 18,3 | 28,6 | 21,0 | 16,8 |
| Los síntomas afectan a mano dominante | 88,7 | 24,4 | 26,4 | 25,0 | 13,7 | 10,4 |
| Temor a perder el equilibrio | 80,7 | 29,3 | 30,6 | 24,2 | 10,7 | 5,2 |
| Empeoramiento clínico general | 89,4 | 12,9 | 14,9 | 25,8 | 20,8 | 25,7 |
| Fluctuaciones motoras | 2,4 | 0,0 | 0,0 | 0,0 | 12,0 | 88,0 |
| Wearing-off | 2,4 | 0,0 | 0,0 | 0,0 | 4,0 | 96,0 |
| Otros | 3,0 | 0,0 | 0,0 | 0,0 | 23,3 | 76,7 |
| Factores psicosociales | ||||||
| Dificultad para actividades de la vida diaria | 98,4 | 4,1 | 11,6 | 24,4 | 25,4 | 34,6 |
| Dificultad para conducir | 69,5 | 44,8 | 19,9 | 17,5 | 11,6 | 6,2 |
| Dificultad en el rendimiento laboral | 65,6 | 45,6 | 20,2 | 15,1 | 9,0 | 10,2 |
| Los síntomas avergüenzan al paciente | 77,9 | 34,5 | 31,3 | 21,4 | 10,0 | 2,8 |
| Alteración del estado de ánimo | 82,6 | 24,9 | 33,7 | 27,7 | 11,2 | 2,5 |
| Limitación para mantener las aficiones | 80,7 | 35,2 | 29,3 | 22,1 | 9,8 | 3,7 |
| Impacto en las relaciones | 80,1 | 34,0 | 31,2 | 23,3 | 9,9 | 1,7 |
| Disfunción sexual secundaria | 66,7 | 61,6 | 23,1 | 10,7 | 3,1 | 1,4 |
| Exigencia del paciente | 65,2 | 47,6 | 24,2 | 14,6 | 8,5 | 5,1 |
| Otros factores asociados a la EP | ||||||
| Intolerancia a otros fármacos | 0,8 | 0,0 | 0,0 | 0,0 | 50,0 | 50,0 |
| Reunificación de tratamiento | 0,4 | 0,0 | 0,0 | 25,0 | 0,0 | 75,0 |
| Efectos secundarios | 0,3 | 0,0 | 0,0 | 0,0 | 33,3 | 66,7 |
| Falta de eficacia de otros tratamientos | 0,2 | 0,0 | 0,0 | 0,0 | 0,0 | 100,0 |
| Dificultad manejo tratamiento | 0,1 | 0,0 | 0,0 | 0,0 | 100,0 | 0,0 |
Entre los factores psicosociales considerados fue determinante en la decisión de iniciar el tratamiento con LCE, la torpeza o la dificultad para llevar a cabo las actividades de la vida diaria, con un 84,4%.
Relación entre características sociodemográficas y factores determinantesEn cuanto a la relación entre los factores determinantes identificados y las características sociodemográficas, se resume del siguiente modo: a) no se encontró ninguna característica demográfica asociada a la bradicinesia como determinante en el inicio del tratamiento con LCE; b) la probabilidad de presentar inestabilidad postural como factor determinante era menor en pacientes con edad inferior a 65 años que en los mayores de 75 años (OR: 0,48; IC del 95%, 0,31-0,74); c) la probabilidad de presentar dificultad en la marcha como factor determinante era mayor entre los pacientes con edad menor que 65 años que en los mayores de 75 años (OR: 2,24; IC del 95%, 1,49-3,35); d) la probabilidad de presentar un empeoramiento clínico global como determinante del inicio del tratamiento era menor entre los pacientes que residían en un área rural respecto a los residentes en área urbana (OR: 0,57; IC del 95%, 0,39-0,85), y e) la probabilidad de presentar dificultad para las actividades de la vida diaria como factor determinante era significativamente menor entre pacientes en situación laboral «desempleado» que entre jubilados (OR: 0,29; IC del 95%, 0,17-0,48).
DiscusiónEste estudio ha permitido caracterizar el perfil clínico basal de los pacientes españoles con EP que inician tratamiento con LCE. El objetivo principal del estudio incluía la identificación de factores clínicos y psicosociales con potencial capacidad para influir significativamente en el neurólogo para iniciar la prescripción de este tipo de tratamiento para la EP.
La mayoría de pacientes de EP que iniciaron el tratamiento con LCE iniciaron los síntomas motores alrededor de los 65 años y eran, principalmente, hombres con estudios primarios o secundarios, que vivían en pareja y estaban jubilados. En conjunto, este perfil demográfico es coincidente con el reportado en otras series de origen asistencial especializado18,19. El tiempo medio transcurrido desde el diagnóstico hasta el primer tratamiento para EP fue alrededor de mes y medio, con una gran variabilidad (DE=6,6 meses), y desde el primer tratamiento hasta el inicio del tratamiento con LCE, alrededor de 3 años y medio.
Levodopa (diferente de LCE) y agonistas dopaminérgicos fueron los medicamentos más utilizados como tratamiento de inicio. La elección de agonistas dopaminérgicos como primer tratamiento en el 40% de los casos está de acuerdo con los criterios establecidos en la mayoría de guías clínicas. Al iniciar tratamiento con levodopa y a pesar de su eficacia en el rendimiento motor20, se recomienda considerar su asociación con complicaciones motoras en más de la mitad de pacientes tras los primeros 5 años del tratamiento21-23. La terapia inicial con un agonista dopaminérgico intenta disminuir el riesgo de dichas complicaciones23. Sin embargo, el desarrollo de nuevas formulaciones de levodopa, especialmente la combinación evaluada LCE, ha permitido optimizar el perfil farmacodinámico y la biodisponibilidad del compuesto activo (levodopa). En consecuencia, estas formulaciones se han establecido como alternativas útiles para el tratamiento de las manifestaciones motoras y la discapacidad subsecuente, con mejor tolerancia, en general, que los agonistas dopaminérgicos22. No obstante, el uso de la formulación LCE como tratamiento de inicio se ve limitado por las recomendaciones anteriormente mencionadas y por los resultados de estudios como el STRIDE-PD, que demostró que el inicio de la levodopaterapia con LCE no retrasaba ni disminuía la frecuencia de discinesias (incluso, podría aumentarlas)24.
En aquellos pacientes en los que se disponía de datos sobre el momento de inicio del tratamiento con LCE, el 80,6% presentaba estadios de Hoehn y Yahr 2.0 ó 3.0, con puntuaciones medias en la escala UPDRS (secciones 2+3) y Schwab y England indicativas de una afectación global moderada, en que la mayoría de pacientes no eran totalmente independientes para las tareas de la vida diaria o las llevaban a cabo con lentitud y dificultad17. Estos hallazgos evidencian el inicio relativamente tardío del tratamiento con LCE en pacientes españoles con EP, a pesar de haberse demostrado la eficacia de la terapia LCE tanto en pacientes estables como con fluctuaciones25,26 y la mejoría en aspectos de la calidad de vida de los pacientes27.
El análisis de los factores clínicos que influyeron para iniciar el tratamiento con LCE permitió observar que los principales determinantes fueron la bradicinesia, el empeoramiento clínico general y la rigidez diurna, seguidos por la dificultad en la marcha, el temblor, la rigidez nocturna y la inestabilidad postural. El fenómeno wearing-off y otras fluctuaciones motoras fueron decisivas en los pacientes que las presentaban. De los factores psicosociales, solo resultó determinante la dificultad para llevar a cabo las actividades de la vida diaria. Estos factores son concordantes con los aspectos que un reciente análisis post hoc ha evidenciado cómo aquellos que pueden beneficiarse más de la terapia con LCE en pacientes con wearing-off28.
No obstante, la decisión del inicio de este tipo de tratamiento viene matizada por la singularidad de la relación entre paciente y enfermedad. Una vez se decide empezar el tratamiento para EP se ha de elegir entre diversas estrategias (inhibidores MAO, agonistas dopaminérgicos y combinación de levodopa con inhibidor de la decarboxilasa), seleccionando la más apropiada en función de aspectos relacionados con el paciente (edad, nivel de discapacidad, profesión, etc.), el beneficio esperado (p. ej., mejoría funcional) y los riesgos potenciales (p. ej., desarrollo de discinesias y fluctuaciones)29. En cualquier caso, conviene recordar que la levodopa inicial incrementa el riesgo de complicaciones motoras a corto y medio plazo pero produce una ganancia funcional superior, circunstancia que debe ser considerada en razón de la edad y los requerimientos funcionales del paciente30.
Los diferentes modelos de regresión desarrollados indicaron que la edad, el área de residencia y la situación de actividad laboral estaban asociadas con varios factores clínicos determinantes, creando un marco complejo de interrelaciones individuales, clínicas y sociales en que la situación de movilidad general y capacidad funcional difieren entre los subgrupos y son relevantes en la toma de decisiones terapéuticas.
Como limitaciones importantes del estudio, destacamos las siguientes: a) su carácter retrospectivo; b) el escaso porcentaje de pacientes con wearing-off en esta serie, sin que se haya podido indagar la causa real de este dato debido al diseño del estudio; c) no se consideró la influencia de síntomas no motores en la decisión de prescribir LCE, aunque por datos en el apartado «Factores psicosociales» de la tabla 4 parece que su relevancia fue escasa, y d) no se analizaron las potenciales diferencias en prescripción de fármacos dependientes de factores socioeconómicos relacionados con aspectos geográficos y políticos.
La contribución fundamental del presente estudio, con todas las limitaciones anteriormente mencionadas, ha sido la constatación del inicio del tratamiento combinado LCE en relación con el empeoramiento semiológico y funcional del paciente. Futuros estudios centrados sobre la calidad de vida podrían evaluar el impacto beneficioso del tratamiento con LCE27,31 y la posible atenuación de dicho beneficio si se retrasa la instauración de la terapia apropiada8,9.
Conflicto de interesesEste estudio ha recibido financiación de Novartis Farmacéutica, S.A. para su realización. PMM ha recibido honorarios (como conferenciante o colaborador en la realización de estudios) de Novartis, Britannia, Orion Pharma, Abbott, UCB, y Movement Disorder Society. También ha recibido ayudas para investigación del FIS-ISCIII, IMSERSO, Université Clermont-Ferrand (Francia), Movement Disorder Society; Michael J. Fox Foundation (EE. UU), y Fundación Reina Sofía.
BH y JR son empleados de Novartis Farmacéutica, S.A.
Agradecemos la colaboración en la elaboración del presente manuscrito de Emili González-Pérez, del Departamento Científico de TFS Develop, y la revisión y las sugerencias realizadas por Pedro García Ruiz-Espiga, del Servicio de Neurología de la Fundación Jiménez Díaz (Madrid).
Vicente Bertol Alegre (H. U. Miguel Servet, Zaragoza), Sonia Santos Lasaosa (H. C. U. Lozano Blesa, Zaragoza), Cristina Iñiguez Martínez (H. C. U. Lozano Blesa, Zaragoza), Jose Angel Mauri Llerda (H. C. U. Lozano Blesa, Zaragoza), Pilar Larrode Pellicer (H. C. U.Lozano Blesa, Zaragoza), Sara Sánchez Valiente (C. M. especialidades Grande Covián, Zaragoza), Consuelo Rios Gómez (H. de Barbastro, Huesca), María Itziar Gastón Zubirendi (H. Virgen del Camino, Navarra), Francisco Lacruz Bescos (H. de Navarra, Navarra), Gerardo Joaquín Soriano Hernández (H. de Navarra, Navarra), José María Sánchez Álvarez (H. de Cabueñes, Asturias), Manuel Menéndez González (H. Álvarez Buylla, Asturias), Roberto Suárez Moro (H. Valle del Nalón, Asturias), Alejandro Formica Martínez (A. Ntra. Sra. del Coro, Guipúzcoa), Nerea Foncea Beti (H. de Galdakao, Vizcaya), Beatriz Tijero Merino (H. de Cruces, Vizcaya), Jesús Alberto Bergareche Yarza (H. Comarcal de Bidasoa, Guipúzcoa), Enrique Corredera García (H. Clínico Santiago, A Coruña), Jose Manuel Paz González (H. Xeral de Lugo, Lugo), Robustiano Pego Reigosa (H. Xeral de Lugo, Lugo), José Marey López (C. Saúde O Ventorrillo, A Coruña), Youssef Sayed Hachem (Clínica Rotger, Baleares), Eloy Elices Palomar (Clínica Rotger, Baleares), Esteban Taleti Depego (H. Mateu Orfila, Baleares), Bartolomé Rossiñol Miralles (C. de Neurodiagnosis, Baleares), Javier Esteve Balzola (H. Pius de Valls, Tarragona), Fernando Herrero Cerezo (H. de Mataró, Barcelona), Jordi Batlle Nadal (H. Santa Tecla, Tarragona), Jaume Burcet Darde (H. El Vendrell, Tarragona), Fernando Espada Olivan (H. Sant Jaume, Girona), Joan Bello López (H. G. de L’Hospitalet, Barcelona), Asunción Ávila Rivera (H. G. de L’Hospitalet, Barcelona), Francesc Valldeoriola Serra (H. Clínic i Provincial de Barcelona, Barcelona), Serge Jaumà Classen (H. U. de Bellvitge, Barcelona), Laura Gubieras Lillo (H. Duran i Reynals, Barcelona), Ana Jaén Peraire (CAP Numancia, Barcelona), Alain Luna Rodríguez (H. de Palamós, Girona), Mercè Martínez Corral (H. Sant Joan de Déu, Martorell, Barcelona), Matilde Calopa Garriga (H. U. de Bellvitge, Barcelona), Joan Massons Cirera (H. Sagrat Cor, L’Aliança, Barcelona), Jaume Camp de la Creu Fumado (H. Universitari de Bellvitge, Barcelona), Luis Borrás Roca (ABS Manso 4-Casanovas, Barcelona), Núria Caballol Pons (CAP La Rambla, Barcelona), Sonia Huertas Folch (H. Mutua de Terrassa, Barcelona), Sonsoles Aranceta Arilla (CAP Cerdanyola-Ripollet, Barcelona), Antonio Palasí Franco (H. G. Vall d’Hebron, Barcelona), César Castejón Gabriel (ABS Chafarinas, Barcelona), Marta Fragoso Martínez (Consorci Sanitari de Terrassa, Barcelona), Jose Antonio Arenas Sánchez (Clínica Ponent, Lleida), M. Eugenia Villar Villar (C. Especialidades Móstoles, Madrid), Pilar Sánchez Alonso (H. Puerta de Hierro, Madrid), María Ángeles del Real Francia (H. G. de Ciudad Real, Ciudad Real), Ramón Ernesto Ibáñez Alonso (H. G. de Ciudad Real, Ciudad Real), Fernando Alonso Frech (H. de Fuenlabrada, Madrid), Jacinto Duarte (H. G. de Segovia, Segovia), José Balseiro Gómez (H. de Getafe, Madrid), Samira Fanjul Arbos (H. Severo Ochoa, Madrid), Cristina Ruiz Huete (Sanatorio del Rosario, Madrid), Jerónimo Almajano Martínez (H. U. 12 de Octubre, Madrid), Antonio Yusta Izquierdo (H. G. Universitario Guadalajara, Guadalajara), Miguel Angel Conde Sendin (C. Salud Federica Montseny, Madrid), Miguel Angel Garcia Soldevila (C. Salud Virgen del Val, Madrid), Yasmina El Berdei Montero (A. Central Salamanca, Salamanca), Julián Benito León (A. Villaverde Cruce, Madrid), Hari Bhathal Guede (C. Especialidades Peña Prieta-Hermanos Sangro, Madrid), Paloma Alonso Béjar (H. del Tajo, Madrid), Yolanda Fernández Bullido (A. Moratalaz, Madrid), Ignacio López-Zuazo Aroca (H. U. de Guadalajara, Guadalajara), Wadih Bowakim Dib (H. G. U. de Alicante, Alicante), Antonio Ortiz Pascual (H. C. Cruz Roja, Madrid), Manuel Lara Lara (H. La Paz, Madrid), José Miguel Velázquez Pérez (H. Virgen de la Salud, Toledo), Pedro Enrique Jiménez Caballero (H. Virgen de la Salud, Toledo), Jesús Olivares Romero (H. Torrecardenas, Almería), Francisco Pérez Errazquin (H. Virgen de la Victoria, Málaga), María José Gómez Heredia (H. Virgen de la Victoria, Málaga), José María Ramírez Moreno (H. U. Infanta Cristina, Badajoz), Juan José Asencio Marchante (H. U. Puerto Real, Cádiz), Francisca Terriza Garcia (H. G. Santa Maria del Puerto, Cádiz), Esther Dionisia Cancho García (C. Especialidades Don Benito, Badajoz), José Carlos Estevez María (CPE VVA, Serena, Badajoz), Francisco Sánchez Caballero (H. Llerena, Badajoz), M. Carmen García de Casasola García (H. Rambla, S.L., Santa Cruz de Tenerife), Jesús Norelys Lorenzo Brito (H. Ntra. Sra. de la Candelaria, Santa Cruz de Tenerife), José Andrés Suárez Muñoz (H. G. de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria), Pablo Eguia del Rio (H. G. de Lanzarote, Las Palmas de Gran Canaria), Santiago Díaz Nicolás (H. G. de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria), Carlos Perla Muedra (H. Arnau de Vilanova, Lleida), Vicente Fernando Peset Mancebo (C. Salut Aldaia-Antic Regne, Valencia), José F. Folgado Montesinos (H. G. d’Ontinyent, Valencia), José Andrés Domínguez Morán (H. de la Ribera, Valencia), José Cerdà Fayos (H. Provincial de Castellón, Castellón), Pilar Taberner Andrés (H. U. Dr. Peset Aleixandre, Valencia), Alejandro Ponz De Tienda (H. Clínico U. de Valencia, Valencia), Silvia Martí Martínez (H. G. U. de Alicante, Alicante), José Manuel Puentes Gil (H. G. de Albacete, Albacete), Vicente Medrano Martínez (H. G. de Elda, Alicante), Eduardo Kahn Mesia (H. Santa María del Rosell, Murcia), Juan José Soria Torrecillas (H. Santa María del Rosell, Murcia), María Álvarez Sauco (H. G. U. de Elche, Alicante) y Francisco Gracia Fleta (H. G. U. de Alicante, Alicante).
Los miembros del Grupo de Estudio FAST se presentan en el anexo 1.