El hematoma espinal epidural espontáneo (HEEE) tiene una incidencia estimada de un caso por millón de habitantes al año. Se considera espontáneo cuando no se logra relacionar ninguna causa de forma directa con su aparición.
ObjetivoDescribir una muestra de pacientes con HEEE y analizar las variables relacionadas con el pronóstico funcional del mismo.
Pacientes y métodosEstudio retrospectivo de pacientes diagnosticados de HEEE en nuestro centro entre 2001 y 2013.
ResultadosTrece pacientes, 7 varones, con edad media de 71 años. El 62% presentaba hipertensión arterial (HTA) y el 54% utilizaba anticoagulantes orales, teniendo una razón normalizada internacional >3 el 57% de ellos. La presentación clínica más frecuente fue dolor en columna vertebral (85%). El 92% asoció déficit neurológico en forma de síndrome sensitivo-motor (70%), motor puro (15%) o sensitivo puro (7%). Cinco pacientes recibieron tratamiento quirúrgico y 8 fueron tratados de forma conservadora. Al año, 3 de los pacientes tratados de forma quirúrgica y 4 de los de manejo conservador tenían una puntuación igual o menor de 2 en la Escala Rankin Modificada. Se observó peor pronóstico en pacientes anticoagulados, en hematomas de mayor extensión, en hematomas localizados en región lumbar y cuando el compromiso motor inicial era mayor.
ConclusionesLa edad avanzada, la HTA y la anticoagulación son los principales factores asociados con el HEEE. La presentación típica consiste en dolor en la columna vertebral seguido de déficit motor. En pacientes con déficits motores establecidos, el tratamiento quirúrgico dentro de las primeras 24 h parece ser la mejor opción terapéutica.
Spontaneous spinal epidural haematoma (SSEH) has an estimated incidence of one per million inhabitants. It is classified as spontaneous when no identifiable cause can be linked to its onset.
ObjectiveTo describe a sample of patients with SSEH and analyse variables related to its functional prognosis.
Patients and methodsRetrospective study carried out in patients diagnosed with SSEH between 2001 and 2013 in our hospital.
ResultsWe included 13 subjects (7 men) with a mean age of 71 years. Of the total, 62% had hypertension and 54% were treated with oral anticoagulants; of the latter, 57% had an International Normalised Ratio above 3. The most frequent manifestation was spinal column pain (85%). Nearly all subjects presented an associated neurological deficit, whether sensory-motor (70%), pure motor (15%), or pure sensory (7%). Five patients underwent surgical treatment and 8 had conservative treatment. After one year, 3 of the patients treated surgically and 4 of those on conservative treatment had a score of 2 or lower on the modified Rankin Scale. Poorer prognosis was observed in patients with anticoagulant therapy, large haematomas, location in the lumbar region, and more pronounced motor disability at onset.
ConclusionsOld age, hypertension, and anticoagulant therapy are the main risk factors for SSEH. The typical presentation consists of back pain with subsequent motor deficit. In patients with established motor symptoms, surgical treatment within the first 24hours seems to be the best option.
El hematoma espinal epidural espontáneo (HEEE) es una patología infrecuente que puede producir un deterioro neurológico rápido e irreversible, siendo fundamental un diagnóstico y tratamiento precoz1-4. El hematoma se considera espontáneo cuando no se logra relacionar una causa de forma directa con su origen, lo cual ocurre hasta en un 40-50% de los casos5-7. No obstante, existen factores predisponentes bien conocidos, como las discrasias sanguíneas, la toma de anticoagulantes o antiagregantes, la patología tumoral (ependimomas, neurinomas o gliomas espinales), embarazo, etc1-18. Con una incidencia estimada de un caso por millón de habitantes por año, representan el 0,3-0,9% de las lesiones espinales ocupantes de espacio4,5,8,11-16,19-21.
La presentación clínica típica consiste en dolor en la columna vertebral con características radiculares que puede ir acompañado, o seguido, de signos clínicos de mielopatía aguda3,4,6-8,11-13,15,17,19,20,22-24. Es esencial un diagnóstico clínico rápido y su confirmación mediante una prueba de imagen, preferiblemente una resonancia magnética (RM)7,9,10,19,25. El HEE se considera una urgencia quirúrgica, ya que su evacuación de forma precoz está relacionada con un mejor pronóstico funcional1,4-6,9,11,21,23,26,27. En ciertos casos, en los que el déficit neurológico sea mínimo o bien, se haya experimentado una mejoría significativa espontánea en las primeras horas, puede optarse por un tratamiento conservador1.
ObjetivoEl objetivo de este trabajo es describir una muestra de pacientes diagnosticados de HEEE en nuestro centro, así como identificar y analizar variables que puedan estar relacionadas con el pronóstico funcional.
Pacientes y métodosSe realizó un estudio retrospectivo y de carácter descriptivo de los pacientes atendidos en el Hospital General Universitario Gregorio Marañón de Madrid, España, entre 2001 y 2013, con diagnóstico de HEEE. Los pacientes se obtuvieron de la base de datos del archivo hospitalario, el cual cumple con los criterios de codificación de la Clasificación Internacional de Enfermedades 9 (CIE-9), 8.a ed., enero del 2012; y fueron tomados del conjunto mínimo básico de datos de hospitalización. El diagnóstico de búsqueda fue «hemorragia espinal no traumática», «hematoma espinal no traumático», «hemorragia epidural espinal no traumática» (Código 336.1 de la CIE-9 en todos los casos). Nuestro centro es un hospital público perteneciente al Servicio Madrileño de Salud con una población asignada de 317.940 habitantes. Por año se atienden a más de 230.000 personas en el servicio de urgencias28. Los datos analizados fueron recogidos de sus historias clínicas (incluyendo informes de alta de hospitalización, quirófanos, consultas y cuidados intensivos). Se analizaron datos demográficos, factores de riesgo, características clínicas, hallazgos de neuroimagen y manejo terapéutico, así como la evolución clínica y pronóstico a largo plazo. Se recogió exclusivamente a pacientes con hematomas epidurales espinales en los que no se identificó ninguna causa directa relacionada con el sangrado. Hematomas en relación con traumatismos de cualquier tipo (incluidos traumatismos indirectos, leves o procedimientos terapéuticos) quedaron excluidos. Todas las exploraciones de RM se realizaron en un equipo de RM Achieva Philips 1,5T. Las secuencias empleadas fueron T1 Turbo Spin Eco (TSE), T2 TSE, Short Time Inversion Recovery (STIR) y eco de gradiente (EG) T2* (estrella). Se determinó la existencia de HEEE ante la presencia de una lesión ocupante de espacio en el canal raquídeo, en el espacio epidural, con las siguientes características: hiperintensidad en secuencias potenciadas en T1 TSE y T2 TSE, ausencia de anulación en secuencia STIR, posibilidad de presentar heterogeneidad de señal en EG T2* (estrella) correspondiente a la presencia de productos de degradación de la hemoglobina. Se determina la existencia de mielopatía cuando se evidencia un aumento de la señal de la médula en secuencias T2 TSE y STIR. La situación funcional de los pacientes fue valorada al año de ocurrido el HEEE mediante la Escala Rankin modificada (ERm) (0-6 puntos), considerando una buena situación funcional cuando la puntuación era menor o igual a 2. En los casos en los que no estaba reflejada la ERm, se calculó sobre la base de los datos recogidos en su historia.
Las variables categóricas se expresan en porcentajes y las variables numéricas según mediana y rango intercuartílico (RIC), excepto la edad, que se expresa tanto con la media ± con desviación estándar como con la mediana.
ResultadosDatos demográficosSe registraron un total de 13 pacientes con una media de edad de 71 ± 20,3 años (mediana 79 años, RIC 57,75- 85,75). La media de edad del 70% de los pacientes fue de 81 años. El 46% de los pacientes fueron mujeres. Las comorbilidades más frecuentes fueron los factores de riesgo vascular (FRV) y el tratamiento con anticoagulantes orales (ACO) o antiagregantes: hipertensión arterial 8 (62%), ACO 7 (54%), dislipidemia 5 (38%), diabetes mellitus 5, obesidad 4 (31%), antiagregantes 2 (15%) y cardiopatía isquémica 2. Un 42% de los pacientes asociaba 2 o más FRV. Otras comorbilidades identificadas fueron: enfermedades reumatológicas 4 (artritis reumatoide, polimialgia reumática y espondiloartrosis). Una paciente se encontraba en período puerperal. En los pacientes anticoagulados, la determinación de razón internacional normalizada (INR) a su llegada a urgencias fue: INR<2: 1(14%); INR 2-3: 2 (28%), y INR >3: 4 (57%). Los principales datos demográficos se encuentran recogidos en la tabla 1.
Principales características clínicas, diagnósticas, terapéuticas y pronósticas de los 13 pacientes
| Paciente | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sexo/Edad | M86 | M76 | M76 | M84 | V40 | V82 | V85 | M27 | M88 | V75 | V52 | V79 | V59 |
| Comorbilidades | HTA, DMEmbolismos pulmonares | HTA, DL, DMCardiopatía HTAEPOC, FA | HTAFA, TVP, trombocitopenia autoinmune | TVP, TEPPolimialgia reumática | No | DLCardiopatía isquémica | HTA, DLFA, EPOC, SAOS | No | HTAFA, infarto cerebral, cardiopatía, AR | HTA, DM | HTA, DL, DMCardiopatía, IRC terminal, retinopatía | HTA, DMCardiopatía isquémica, pénfigo, HSA, epilepsia | DLObesidad |
| Anticoagulación/antiagregación | AcenocumarolINR 2,4 | AcenocumarolINR 4,19 | AcenocumarolINR 2,73 | AcenocumarolINR 4,33 | No | AAS | AcenocumarolINR 5,83 | No | AcenocumarolINR 3,07 | AcenocumarolINR 1,16 | No | AAS | No |
| Dolor | Sí: dorsal | Sí: cervical | Sí: cervical | Sí: cervical | Sí: dorsal | Sí: cervical | Sí: cervical | Sí: cervical | No | No | Sí: dorsal | Sí | Sí: cervical |
| Irradiación | No | Sí: derecha | No | Sí: interescapular | No | Sí: lumbar | Sí: hombros bilateral | No | No | No | No | No | Sí: MMSS |
| Tipo de déficit | Paraplejía | Hemiparesia derecha | Hemiparesia izquierda | Tetraplejía | Paraplejía | Hemiparesia izquierda | Hemiplejía derecha | Paraparesia | Paraplejía | Paraparesia | Ninguno | Paraplejía | Ninguno |
| Otros síntomas medulares | Nivel sensitivo D8, retención urinaria | No | Hipoestesia miembro inferior derecho | Nivel sensitivo C7, retención urinaria | Alteración sensitiva | Nivel sensitivo D1 derecho | No | Nivel sensitivo D6 | Nivel sensitivo D6 | Nivel sensitivo L4, pérdida control esfínteres | No | Nivel sensitivo D5 | Nivel sensitivoC2 |
| Tiempos (h) | |||||||||||||
| Urgencias | 48 | 12 | 18 | 3 | Desconocido | 1,5 | 1 | 0 (I) | 0 (I) | 48 | 72 | 6,5 | 240 |
| Neurología | 96 | 14 | 20 | 5 | 4,5 | 1 | 8 | 72 | 48 | No | 7,5 | 240 | |
| Neurocirugía | 96 | 24.5 | 23 | 10 | 7,5 | 21 | 20 | 74 | 65 | 264 | 13 | Desconocido | |
| RM | 101 | 34 | 22 | 10 | 6,5 | 21 | 20 | 74 | 65 | 264 | 9,5 | 288 | |
| Tratamiento | 101 | 44 | 23 | 10 | 10 | 22 | 21 | No tratamiento específico | 65 | No tratamiento específico | 14 | No tratamiento específico | |
| Método diagnóstico | RMOtras: Rx lumbar, TC columna dorsal | RMOtras: Rx cervical, TC craneal | RMOtras: TC craneal, TC cervical | RM | RM | RM | RMOtras: TC craneal | RM | RM | RM | RM | RMOtras: Rx dorsal y lumbosacra | RMOtras: TC dorsolumbar |
| Tratamiento | Conservador, dexametasona 8mg iv y luego 4 mg/8 h en dosis descendentes | Quirúrgico:hemilaminectomía C4-C5 | Conservador:dexametasona | Conservador:metilprednisolona 1 g durante 5 días | Conservador | Quirúrgico:laminectomía C3-C6 | Quirúrgico:laminectomía C3-C6 | Quirúrgico:laminectomía C6-D1 | Conservador | Conservador:dexametasona | Conservador | Quirúrgico:laminectomía | Conservador |
| ERm al año | 6 | 3 | 0 | 4 | 0 | 2 | 1 | 1 | 4 | 4 | 0 | 4 | 0 |
AR: artritis reumatoide; AAS: ácido acetilsalicílico; C: cervical; D: dorsal; DL: dislipidemia; DM: diabetes mellitus; ERm: Escala Rankin Modificada; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HSA: hemorragia subaracnoidea; HTA: hipertensión arterial; I: ingresado cuando comenzaron los síntomas; INR: razón internacional normalizada; IRC: insuficiencia renal crónica; iv: intravenoso; M: mujer; mg: miligramos; MMSS: miembros superiores; RM: resonancia magnética; Rx: radiografía; SAOS: síndrome de apnea obstructiva del sueño; TC: tomografía computarizada; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; V: varón.
La presentación clínica más frecuente fue la de dolor brusco en la columna vertebral en la zona de localización del hematoma (85%). En 5 de ellos (38%), el dolor fue irradiado pero sin seguir un patrón metamérico. La mayoría de los pacientes (92%) presentó déficit neurológico, que se instauró de forma simultánea o posterior al inicio del dolor en forma de un síndrome sensitivo-motor (70%), motor puro (15%) o sensitivo puro (7%). Solo un paciente presentó dolor espinal aislado en ausencia de otros síntomas acompañantes. El déficit motor se presentó en forma de paraplejía en 4 casos, hemiparesia en 3, paraparesia en 2 y tetraplejía en un paciente. Siete pacientes presentaron nivel sensitivo y 2 tuvieron pérdida del control de esfínteres. El tiempo de evolución entre el inicio del dolor y la aparición de un déficit neurológico se recogió en 9 casos (75%), con una mediana de 3,5 h (RIC 0-7). Los principales hallazgos clínicos de nuestro trabajo se recogen en la tabla 1.
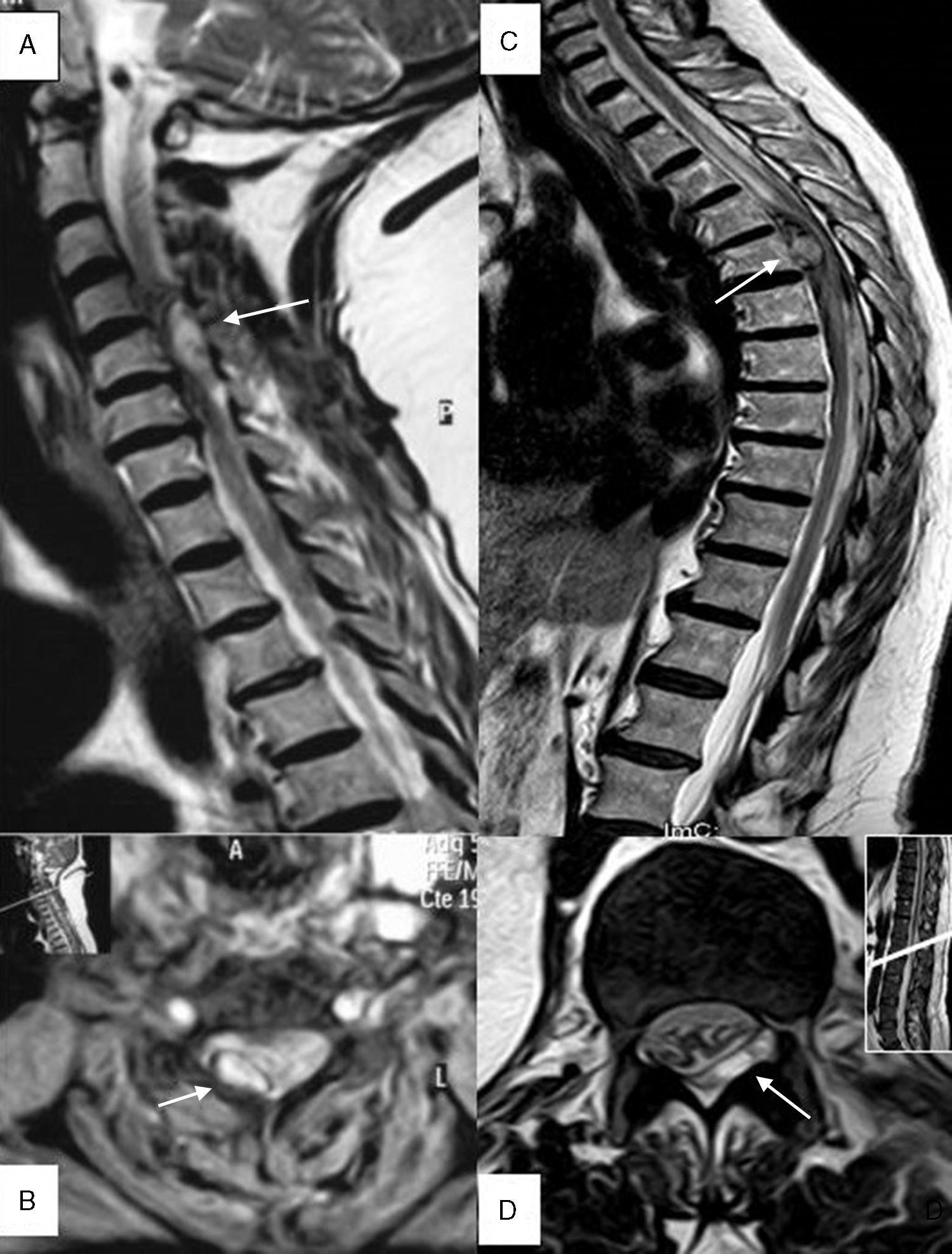
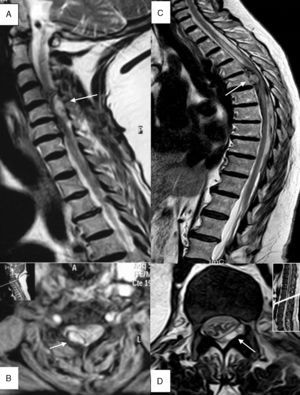
Pruebas diagnósticasLa mediana de tiempo que transcurrió desde el inicio de los síntomas hasta la consulta en urgencias fue de 6,5 h (RIC 1-48). La mediana de tiempo que transcurrió desde el inicio de los síntomas hasta disponer de una valoración por un neurólogo de guardia fue de 14 h (RIC 5-72). Se realizó una RM espinal a todos los pacientes. La mediana de tiempo que transcurrió desde el inicio de la clínica hasta su realización fue de 28 h (RIC 10-101). Se realizó una prueba de imagen previa a la RM espinal en 7 pacientes: radiografía simple de columna a 3, tomografía computarizada (TC) de cráneo a 2 y TC de columna a 3. De los 3 pacientes a los que se les hizo TC de columna, en 2 se evidenció una colección extramedular hiperdensa indicativa de hematoma epidural espinal. A 2 pacientes se les hizo angiografía tras haber sido diagnosticados mediante RM sin encontrar alteraciones patológicas. La mediana de tiempo desde la llegada a urgencias hasta la realización de la RM fue similar en los pacientes a quienes se les realizó solo RM (20 h, RIC 7-74) y en quienes recibieron otras pruebas diagnósticas previamente (20 h, RIC 4-48). Los principales hallazgos radiológicos se encuentran resumidos en la tabla 2. En la Figura 1 se muestran algunos ejemplos de RM espinal.
Principales hallazgos evidenciados en RM de los 13 pacientes
| Paciente | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sector anatómico afectado | D4-L2 | C4-C7 | C3-C7 | C4-D7 | D10- D11 | C3-C7 | C2-C7 | C6-C7 | D4-cono medular | D10- S1 | D12-L1 | D1-L3 | C7 |
| Localización | Anterior | Posterior | Posterior | Posterior | Anterior | Anterior | Posterior | Posterior | Posterior | Posterior | Posterior | Posterior | Posterior |
| Signos de mielopatía | Sí | Sí | No | Sí | No | Sí | No | Sí | Sí | No | No | No | Sí |
| Patología vertebral asociada | Cambios degenerativos | Cambios degenerativos | Cambios degenerativos | Cambios degenerativos | No | Cambios degenerativos | Cambios degenerativos con estenosis del canal C3-C4 | No | No | EspondilolistesisL4-L5 con estenosis del canal, cambios degenerativos, angiomas vertebrales | Cambios degenerativos | No | Cambiosdegenerativos, espondilolistesis C7-D1,raquiestenosisC3-C7 |
Cambios degenerativos: signos de espondiloartrosis y degeneración discal (formaciones osteofitarias, disminución del espacio intervertebral, esclerosis del hueso subcondral).
C: cervical; D: dorsal; L: lumbar; RM: resonancia magnética.
A) Paciente 4, corte sagital, secuencia T2 TSE. Hematoma epidural (flecha) en región posterior derecha localizado entre segmentos C4-C6 que ejerce importante efecto compresivo sobre la médula produciendo mielopatía. B) Paciente 4, EG T2* (estrella), corte axial a nivel C4 donde se identifica el hematoma en región posterior derecha (flecha). C) Paciente 1, corte sagital, secuencia T2 TSE. Hematoma epidural (flecha) de predominio anterior entre segmentos D6-L2 con compresión medular y signos de mielopatía asociada. D) Paciente 11, T2 TSE, corte axial a nivel D12-L1, hematoma epidural (flecha) en región lateral y posterior, con desplazamiento y compresión del saco tecal.
De los 13 pacientes analizados, a 5 (38%) se les realizó tratamiento quirúrgico urgente (hemilaminectomía en uno, laminectomía bilateral en 4) y a 8 (61%) se les trató de forma conservadora (corticoides a 4 y a otros 4 se les aplicó solo tratamiento sintomático). De los 5 pacientes que recibieron tratamiento quirúrgico, 3 presentaban una puntuación igual o menor a 2 en la ERm al año (60%) frente a 4 de los 8 pacientes tratados de forma conservadora (50%). Todos los pacientes, excepto el que falleció y los 2 que cursaron sin déficit motor, recibieron tratamiento rehabilitador.
DiscusiónLa fisiopatología del HEEE aún no está bien definida y el origen exacto del sangrado epidural genera controversias11. Algunos autores defienden un origen venoso del sangrado epidural y postulan que la hemorragia se produce por un incremento de la presión intratorácica o abdominal que se transmite directamente a las venas del plexo venoso epidural, causando su rotura2-5,7,9,11,14,15,17,29. Esta teoría se ha puesto en duda porque el plexo venoso epidural es un sistema avalvular de baja presión por lo que, en teoría, un sangrado venoso no sería capaz de progresar y comprimir el contenido intradural4. Hay autores que apoyan un origen arterial del sangrado3-5,8,9. Lo atribuyen a la rotura de las arterias radiculares que acompañan las raíces nerviosas dentro del espacio epidural. Esta rotura podría estar facilitada por traumatismos o movimientos bruscos, especialmente en personas con espondiloartrosis3,5,9. No obstante, en la mayoría de los casos publicados, no se evidenció, en el momento de la cirugía evacuadora, ninguna rotura arterial pero sí sangrado venoso epidural, por lo que el origen más aceptado del HEEE es el venoso3,4.
Esta patología ocurre más frecuentemente entre los 40 y 80 años8,9,11. La relación hombre-mujer es 1,5-14,9,11. En nuestra serie, la media de edad es de 71 años, estando la mayoría de los casos concentrados entre los 75 y 88 años. La relación hombre-mujer es 1,4-1. Algunas series afirman que no existen diferencias en cuanto al pronóstico en función de la edad y el sexo1,30. En nuestra serie encontramos una mejor ERm al año en los varones y en los menores de 75. Nuestros resultados coinciden con los trabajos previos en que los principales factores predisponentes son la HTA y la toma de ACO con INR por encima del rango terapéutico14,22,25. Los pacientes sin tratamiento con ACO ni antiagregantes presentaron un mejor pronóstico a largo plazo, así como los que tenían un INR <3.
En cuanto al pronóstico en función de la clínica, el grado de déficit neurológico inicial se ha considerado tradicionalmente uno de los factores pronósticos más importantes, siendo peor en los pacientes que presentan desde el inicio déficit medular sensitivo-motor completo1,5-7,15,19. En nuestra serie, al igual que en las series previas, obtuvieron mejores resultados los pacientes con déficit motor parcial (hemiparesia, paraparesia). Los pacientes que no presentaron dolor son los que solicitaron ayuda médica de forma más tardía, obteniendo una peor puntuación en la ERm al año, a pesar de presentar menor deterioro neurológico inicial.
Todos los reportes previos coinciden en que la precocidad del tratamiento es uno de los factores pronósticos más importantes, siendo óptimo en las primeras 12-36 h desde el inicio de los síntomas1,5,6,10,19,31,32. Por lo tanto, un diagnóstico temprano es fundamental. En nuestro caso, el diagnóstico definitivo de HEEE, estuvo determinado por distintas variables según el caso, como son el tiempo transcurrido hasta que el paciente consultó en urgencias, la demora en solicitar valoración por un neurólogo de guardia y el retraso en realizar una RM de urgencia.
Actualmente, el método diagnóstico de elección es la RM3,4,7,8,11,12,15,16,19-22,26,33. En los centros que no disponen de RM una alternativa válida sería la realización de una TC de columna8,11,33. La realización de una arteriografía nos permitiría descartar fístulas durales u otras malformaciones que pudieran haber ocasionado el sangrado y pasaran inadvertidas en la RM7.
Respecto a la localización del hematoma, los niveles medulares más afectados son las regiones cervicodorsal y dorsolumbar4,7,8,11,14-16,20. La mayoría tiene una localización posterior3,9,14,15,20. Algunos estudios han analizado la posición anterior o posterior, la extensión y el grado de compresión en RM, llegando a conclusión de que no existían diferencias significativas para atribuir un valor pronóstico a estas variables1,30.
En nuestra serie, la realización de otras pruebas de imagen antes que la RM no condicionó retraso diagnóstico ni terapéutico significativo. Los sectores anatómicos que más se afectaron fueron el cervical y la región dorsolumbar, siendo la mayoría de localización posterior. Los pacientes con hematomas extensos y localizados en las uniones cervicodorsales o dorsolumbares presentaron peor puntuación en la ERm al año, sin llegar a alcanzar significación estadística.
La mayoría de las series publicadas recomiendan realizar tratamiento quirúrgico precoz, siendo preferible la cirugía entre las 12 y 24 h iniciales del compromiso motor1,5,7,15,18,20. En déficits motores leves, podría realizarse dentro de las 48 h iniciales4,7,8,19,20,22. No se recomienda cirugía en déficits motores importantes pasadas las 36 h1,4,7,8,22. De forma excepcional, se han descrito recuperaciones completas al realizar tratamiento quirúrgico pasadas las 96 h6.
Cada vez existe un número creciente de casos descritos en la literatura que han recibido tratamiento conservador (corticoides o tratamiento sintomático)1,7,8. Los pacientes subsidiarios de tratamiento conservador son los que no tienen síntomas de compresión medular tienen una afectación mínima o presentan mejoría clínica significativa en las primeras horas4,12,16,20,34. En estos es necesario un estrecho seguimiento clínico y de neuroimagen para la detección precoz de cualquier empeoramiento que aconseje cirugía1,3,9,12,33. El tratamiento conservador también se aplica a pacientes no subsidiarios de cirugía por coagulopatía o por que su estado general la contraindique4,8,20.
En nuestra serie obtuvieron una mejor puntuación en la ERm al año los pacientes a los que se les realizó tratamiento quirúrgico, especialmente a los que se les practicó en un periodo menor a 24 h. Entre los pacientes que fueron tratados de forma conservadora, los que presentaron una mejor ERm al año fueron los que mejoraron espontáneamente en las primeras horas o tenían déficit leve y se inició tratamiento corticoideo de forma precoz (< 24 h). No se observó mejoría en déficits completos.
Las limitaciones de nuestro estudio están relacionadas con la baja incidencia de esta patología, lo que dificulta un análisis estadístico complejo y la realización de un ensayo terapéutico. Debido a la naturaleza retrospectiva del estudio, no pudimos obtener ciertos datos relacionados con el tratamiento conservador (tipo de corticoide, dosis, vía de administración, etc.) y rehabilitador utilizado. Para evaluar la situación funcional y la discapacidad posterior tras una lesión medular, puede que la ERm no sea la escala más adecuada. Existen otras escalas que analizan mejor las secuelas tras una mielopatía, como son la Walking Index for Spinal Cord Injury (WISCI-WISCII) o la American Spinal Injury Association (ASIA) Impairment Scale. En nuestro caso, no se pudieron utilizar porque analizan ítems difíciles de recoger de forma retrospectiva.
Como conclusiones, podríamos decir que los principales factores predisponentes en los HEEE son la HTA y la anticoagulación. Por ello, en un paciente con factores de riesgo cardiovascular que presente dolor en la columna vertebral brusco, acompañado de déficit neurológico, hemos de sospechar la existencia de un HEEE.
Los factores asociados a peor pronóstico son la toma de anticoagulación por vía oral con INR >3, los hematomas de gran extensión, la localización lumbar y el grado de compromiso motor. En pacientes con déficits motores establecidos, la mejor opción terapéutica es el tratamiento quirúrgico precoz. En aquellos pacientes con compromiso medular leve, que experimenten una mejoría espontánea en las primeras horas o en los casos donde esté contraindicada la cirugía, el tratamiento conservador puede ser una buena opción, utilizando corticoterapia de forma precoz.
FinanciaciónNuestro trabajo ha sido redactado libremente, sin financiación por ninguna empresa o entidad pública o privada.
Conflicto de interesesTodos los autores firmantes han aprobado la presentación de este manuscrito. No existe conflicto de intereses.