La hemorragia intracerebral lobular (HIL) es una causa poco frecuente de ictus y representan cerca del 20% de las hemorragias intracerebrales primarias. La causa más frecuente son la angiopatía amiloidea cerebral (AAC), la hipertensión arterial (HTA) y otras como el tratamiento antiagregante o anticoagulante.
Analizar una serie de pacientes con HIL y compararla con subgrupos de pacientes con HIL antiagregados o anticoagulados previamente. Determinar el volumen de la hemorragia y su valor predictivo de mortalidad.
Pacientes y métodosSe incluyó de forma consecutiva y retrospectiva a 162 pacientes diagnosticados de HIL y atendidos en el servicio de neurología del Hospital Meixoeiro de Vigo entre los años 1991 y 2009. Se recogieron características demográficas, factores de riesgo, etiologías y clínica, y se realizó un análisis comparativo entre la serie general y los subgrupos de paciente antiagregados y anticoagulados.
ResultadosEn la serie general la causa más frecuente fue la AAC posible o probable seguida de la HTA. En los subgrupos de pacientes antiagregados o anticoagulados no había diferencias en las variables estudiadas excepto en la frecuencia de cardiopatía. Sí existían diferencias en cuanto a la edad, la cardiopatía y la volumen de la hemorragia entre la serie general (sin los pacientes antiagregados o anticoagulados) cuando se compararon con los subgrupos de antiagregados y anticoagulados.
ConclusionesAportamos algunas novedades respecto al comportamiento clínico de la HIL y sus diferencias en los pacientes antiagregados o anticoagulados. La mortalidad es superior en las HIL anticoaguladas. Son variables predictivas de defunción el sexo femenino y el volumen de la hemorragia.
Lobar intracerebral haemorrhage (LIH), is a rare cause of stroke which accounts for about 20% of primary intracerebral haemorrhages. The most common causes are cerebral amyloid angiopathy (CAA), high blood pressure and others, such as using anti-platelet or anticoagulation agents.
We analysed a series of patients with LIH and compared it with subgroups of patients with LIH who were previously receiving anti-platelet or anticoagulation agents. We determined the volume of the bleeding and its predictive value for mortality.
Patients and methodsWe consecutively and retrospectively included 162 patients diagnosed with LIH and cared for in the Neurology Department of Hospital Meixoeiro in Vigo between 1991 and 2009. We collected demographic characteristics, risk factors, aetiologies and symptoms, and conducted a comparative analysis between the general series and the subgroups of patients receiving anticoagulation and anti-platelet agents.
ResultsIn the general series, the most common cause was possible or probable CAA followed by hypertension. In the subgroup of patients receiving anti-platelet or anticoagulation agents there were no differences in the variables studied, except for the frequency of heart disease. Nonetheless, there were differences with respect to age, heart disease and bleeding volume between the general series (patients not treated with anti-platelet or anticoagulation agents) when compared with the subgroups of patients receiving anti-platelet and anticoagulation agents.
ConclusionsWe provide new information regarding the clinical behaviour of LIH and its differences in patients receiving anti-platelet or anticoagulation agents. Mortality is higher in cases of LIH on anticoagulants. LIH. Female sex and the volume of bleeding are predictors of mortality.
La hemorragia intracerebral lobular (HIL) constituye una entidad diferente dentro de las hemorragias intracerebrales (HIC), dada su especial localización, etiología y pronóstico respecto de las otras hemorragias cerebrales. Representan según las series, entre el 14 al 39% de todas las HIC1–5.
La HIL se localiza en la unión córtico subcortical de los lóbulos cerebrales y generalmente se extiende en un plano paralelo al córtex adyacente. Puede afectar a cualquier lóbulo cerebral, pero tiene especial predilección por el lóbulo parietal, o la región temporo-occipital y sus combinaciones2–5.
Las distintas etiologías de la HIL se comparten con las de los otros tipos de HIC, aunque el peso de la HTA disminuye en la HIL y la angiopatía amiloidea cerebral (AAC) es más frecuente en estas, de tal manera que mientras la HTA aparece como causa del 80% de las hemorragias de ganglios basales, solo ocurre en el 30 al 50% de las HIL4–8. Otros factores etiológicos, como malformaciones arteriovenosas, ocurren entre el 7 y el 20% de las HIL, tumores en el 7 al 9% y discrasias sanguíneas o anticoagulación en el 5 al 20% de estas hemorragias2–5,9.
El objetivo del presente trabajo es estudiar una serie consecutiva de 162 pacientes con HIL y analizar los subgrupos de pacientes con HIL previamente anticoagulados o antiagregados, valorándose diferencias demográficas, etiológicas o clínicas, evolución, volumen de la hemorragia y su valor predictivo respecto de la mortalidad.
Pacientes y métodosLa serie retrospectiva de 162 pacientes diagnosticados de HIL analizada en este estudio proceden del banco de datos de pacientes con ictus ingresados consecutivamente en el servicio de neurología del Hospital Meixoerio de Vigo (CHUVI) entre enero de 1991 y diciembre de 2009. Los subtipos de ictus se clasificaron según las indicaciones del Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología (SEN)1. Todos los pacientes de la serie fueron ingresados en el servicio de neurología en las primeras 24 h de la aparición de los síntomas, diagnosticados y seguidos por alguno de los neurólogos del servicio, aplicándose los protocolos de atención al ictus SEN1. No se incluyó a los pacientes atendidos en otros servicios del hospital.
Fueron considerados pacientes con HIL los que presentaban hemorragias cerebrales intraparenquimatosas, no traumáticas, que reunían los siguientes criterios: a) historia clínica, exploración y TC craneal compatibles con hemorragia intracerebral; b) localización primaria de la hemorragia a nivel cortical o córtico-subcortical, en uno o varios lóbulos cerebrales. En algunas ocasiones podía existir dificultad para distinguir entre lobular o profunda, considerándose la profunda o de ganglios basales la que se encontraba dentro de 1cm próximo a la pared del ventrículo lateral. Cuando la localización de la hemorragia era dudosa, la TC fue revisada por un grupo de neurólogos y radiólogos para alcanzar un consenso, y c) puede existir rotura cortical de la hemorragia con sangrado en el espacio subaracnoideo o invasión de los ventrículos cerebrales2.
En este estudio se excluyeron: HIL traumáticas, secundarias a sangrado de malformaciones arteriovenosas, cavernomas, tumores cerebrales primarios o metastáticos, o infartos cerebrales hemorragizados. Las HIL asociadas a hemorragia subaracnoidea fueron incluidas en caso de considerarse el componente subaracnoideo secundario a la hemorragia lobular y siempre que no estuviera asociado a aneurisma o malformación arteriovenosa. En todos los pacientes se descartó patología subyacente a la hemorragia mediante estudios posteriores de neuroimagen (TC o RM cerebral).
El protocolo de recogida de datos de los pacientes incluía: edad, sexo, factores de riesgo de hemorragia intracerebral según criterios internacionales3,10,11 debiendo existir constancia en la historia clínica del diagnóstico de alguno o varios de los factores de riesgo y su tratamiento correspondiente en el momento de la hemorragia. También se recogían las manifestaciones clínicas al ingreso del paciente, etiología/s posibles de la HIL indicadas por el neurólogo en el informe de alta del paciente y la evolución como fallecimiento o no. Las HIL asociadas a posible, probable o definitiva AAC se clasificaron siguiendo los criterios de Boston12. Se recogía específicamente el tratamiento previo con antiagregantes plaquetarios o anticoagulación oral.
Todos los pacientes tenían realizada una TC craneal en las primeras 6 h de su ingreso, sobre la cual se calculó el volumen de la hemorragia según la fórmula estandarizada de volumen (cc) = A.B.C/2, siendo A el diámetro mayor de la hemorragia en cm; B el diámetro mayor perpendicular a A, y C el número de cortes tomográficos de 1cm de espesor13. Las TC utilizadas durante esos años fueron General Electric modelos Pro Speed, Espiral Hispeed y VCT Lightspeed.
En algunos pacientes se realizó una RM cerebral entre el primer y el sexto mes de la hemorragia para descartar lesión subyacente a la HIL.
Dentro de esta serie, se analizan dos subgrupos: aquellas HIL en pacientes en tratamiento previo anticoagulante con Sintrom® y otro subgrupo de pacientes antiagregados con aspirina, trifusal o clopidogrel. Las distintas variables demográficas, clínicas, etiológicas, o volumen de la hemorragia de estos dos subgrupos, se comparan con los pacientes con HIL que no estaban previamente anticoagulados o antiagregados.
El análisis estadístico se llevó a cabo con el programa Statistical Package for Social Sciences versión 15.0 (SPSS, Chicago, Estados Unidos).
Se realizó un análisis descriptivo de las variables incluidas en el estudio utilizando la frecuencia y el porcentaje para las variables cualitativas y la media, la desviación estándar, el rango, la mediana y el rango intercuartílico para las variables cuantitativas.
Se utilizó la prueba de la t de Student para comparar la edad entre los dos subgrupos de pacientes antiagregados y anticoagulados o bien entre la serie general, sin antiagregados y sin anticoagulados con los anticoagulados; o bien con los antiagregados, y la prueba de la mediana para el volumen de la TC según estos distintos subgrupos de pacientes.
Se compararon los factores de riesgo, los datos clínicos y la etiología entre los distintos subgrupos de pacientes mediante un análisis univariante, utilizando la prueba de la χ2 o la prueba exacta de Fisher. Para el estudio de la normalidad se usó la prueba de Kolmogorov-Smirnov. Se consideró estadísticamente significativa una p<0,05.
Las variables que mejor predicen el riesgo de defunción se determinaron mediante un modelo de regresión logística por pasos hacia atrás basada en el método de máxima verosimilitud, considerando como variable dependiente la variable defunción (codificada: 1=sí, 0 =no) y como covariables las que resultaron significativas en el análisis univariante o de interés clínico, estimando las odds ratio (OR) y su intervalo de confianza del 95% a partir de los coeficientes y de las desviaciones estándar. Se determinaron la sensibilidad y la especificidad del volumen de la hemorragia respecto de la defunción utilizando curvas ROC (Receiver Operating Characteristic) para determinar el mejor punto de corte.
ResultadosEn el servicio de neurología del Hospital Meixoeiro se atendieron entre enero de 1991 y diciembre de 2009 un total de 5.248 ictus, de los cuales un total de 994 fueron HIC (18,9% de todos los ictus). De todas las HIC encontramos un total de 162 HIL, lo que representa el 16,4% de las HIC, y un 3% de todos los ictus atendidos.
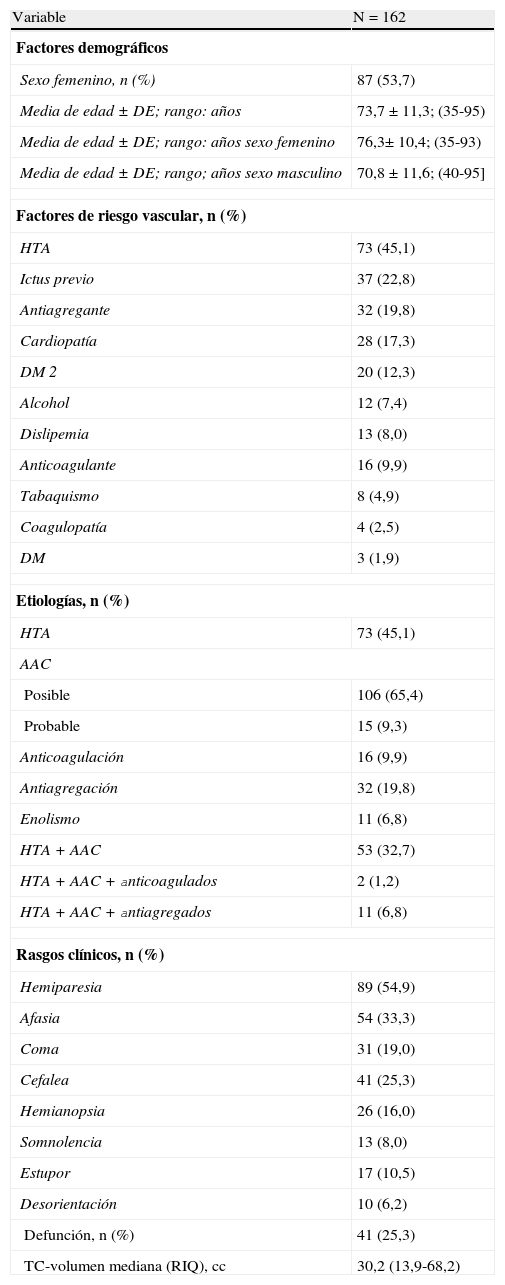
Los resultados de la serie general de 162 pacientes con HIL incluidos de forma retrospectiva se muestran en la tabla 1. El 54% de las HIL eran mujeres y la media de edad de ambos sexos era de 73,7 años, con un rango de 35 a 95 años. Las mujeres tenían una media de 76,3 años con rango de 35 a 93 años y los hombres 70,8 años con rango de edad de 40 a 95 años. Los factores de riesgo vascular, la etiología, la presentación clínica, el resultado de defunción y el volumen de la hemorragia en la TC se indican en la tabla 1. Dado que la etiología de la HIL puede ser múltiple, consideramos el número de pacientes que presentaban HTA y AAC o la combinación de HTA, AAC, antiagregación o anticoagulación.
Resultados descriptivos de la serie general
| Variable | N=162 |
| Factores demográficos | |
| Sexo femenino, n (%) | 87 (53,7) |
| Media de edad ± DE; rango: años | 73,7 ± 11,3; (35-95) |
| Media de edad ± DE; rango: años sexo femenino | 76,3± 10,4; (35-93) |
| Media de edad ± DE; rango; años sexo masculino | 70,8 ± 11,6; (40-95] |
| Factores de riesgo vascular, n (%) | |
| HTA | 73 (45,1) |
| Ictus previo | 37 (22,8) |
| Antiagregante | 32 (19,8) |
| Cardiopatía | 28 (17,3) |
| DM 2 | 20 (12,3) |
| Alcohol | 12 (7,4) |
| Dislipemia | 13 (8,0) |
| Anticoagulante | 16 (9,9) |
| Tabaquismo | 8 (4,9) |
| Coagulopatía | 4 (2,5) |
| DM | 3 (1,9) |
| Etiologías, n (%) | |
| HTA | 73 (45,1) |
| AAC | |
| Posible | 106 (65,4) |
| Probable | 15 (9,3) |
| Anticoagulación | 16 (9,9) |
| Antiagregación | 32 (19,8) |
| Enolismo | 11 (6,8) |
| HTA+AAC | 53 (32,7) |
| HTA+AAC+anticoagulados | 2 (1,2) |
| HTA+AAC+antiagregados | 11 (6,8) |
| Rasgos clínicos, n (%) | |
| Hemiparesia | 89 (54,9) |
| Afasia | 54 (33,3) |
| Coma | 31 (19,0) |
| Cefalea | 41 (25,3) |
| Hemianopsia | 26 (16,0) |
| Somnolencia | 13 (8,0) |
| Estupor | 17 (10,5) |
| Desorientación | 10 (6,2) |
| Defunción, n (%) | 41 (25,3) |
| TC-volumen mediana (RIQ), cc | 30,2 (13,9-68,2) |
AAC: angiopatía amiloidea cerebral; DE: desviación estándar; DM 2: diabetes mellitus tipo 2; HTA: hipertensión arterial; RIQ: rango intercuartílico; TC: tomografía cerebral.
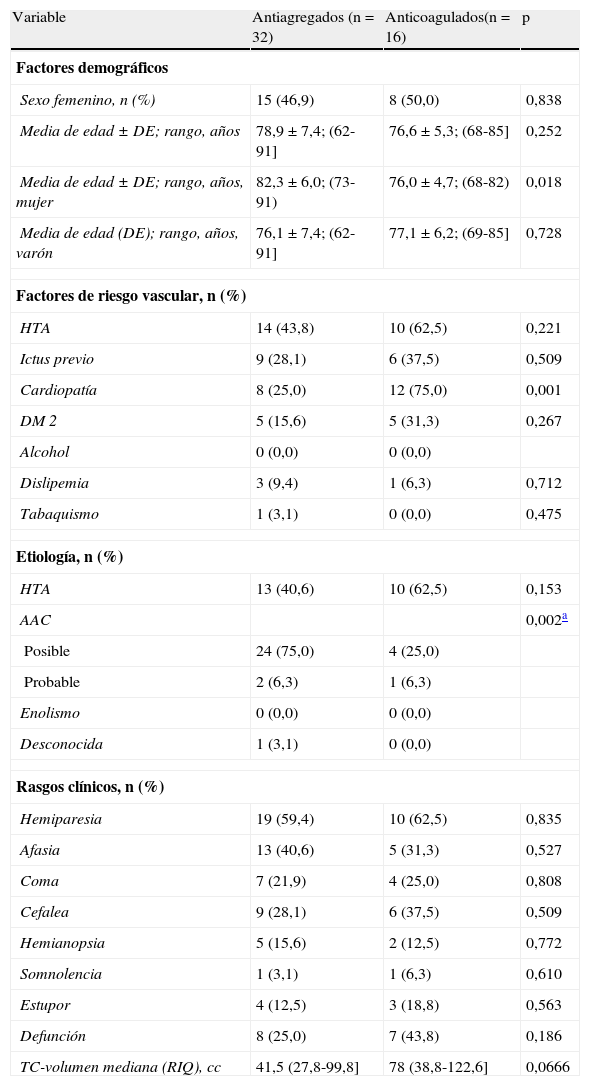
En la tabla 2 se presentan los resultados de los subgrupos de pacientes antiagregados (n=32) y anticoagulados (n=16) previamente a la HIL. Se muestran la distribución por edad y sexo, los factores de riesgo vascular, la etiología, las características clínicas, la defunción y el volumen de la hemorragia.
Resultados del análisis comparativo univariante entre los subgrupos de pacientes antiagregados y anticoagulados
| Variable | Antiagregados (n=32) | Anticoagulados(n=16) | p |
| Factores demográficos | |||
| Sexo femenino, n (%) | 15 (46,9) | 8 (50,0) | 0,838 |
| Media de edad ± DE; rango, años | 78,9 ± 7,4; (62-91] | 76,6 ± 5,3; (68-85] | 0,252 |
| Media de edad ± DE; rango, años, mujer | 82,3 ± 6,0; (73-91) | 76,0 ± 4,7; (68-82) | 0,018 |
| Media de edad (DE); rango, años, varón | 76,1 ± 7,4; (62-91] | 77,1 ± 6,2; (69-85] | 0,728 |
| Factores de riesgo vascular, n (%) | |||
| HTA | 14 (43,8) | 10 (62,5) | 0,221 |
| Ictus previo | 9 (28,1) | 6 (37,5) | 0,509 |
| Cardiopatía | 8 (25,0) | 12 (75,0) | 0,001 |
| DM 2 | 5 (15,6) | 5 (31,3) | 0,267 |
| Alcohol | 0 (0,0) | 0 (0,0) | |
| Dislipemia | 3 (9,4) | 1 (6,3) | 0,712 |
| Tabaquismo | 1 (3,1) | 0 (0,0) | 0,475 |
| Etiología, n (%) | |||
| HTA | 13 (40,6) | 10 (62,5) | 0,153 |
| AAC | 0,002a | ||
| Posible | 24 (75,0) | 4 (25,0) | |
| Probable | 2 (6,3) | 1 (6,3) | |
| Enolismo | 0 (0,0) | 0 (0,0) | |
| Desconocida | 1 (3,1) | 0 (0,0) | |
| Rasgos clínicos, n (%) | |||
| Hemiparesia | 19 (59,4) | 10 (62,5) | 0,835 |
| Afasia | 13 (40,6) | 5 (31,3) | 0,527 |
| Coma | 7 (21,9) | 4 (25,0) | 0,808 |
| Cefalea | 9 (28,1) | 6 (37,5) | 0,509 |
| Hemianopsia | 5 (15,6) | 2 (12,5) | 0,772 |
| Somnolencia | 1 (3,1) | 1 (6,3) | 0,610 |
| Estupor | 4 (12,5) | 3 (18,8) | 0,563 |
| Defunción | 8 (25,0) | 7 (43,8) | 0,186 |
| TC-volumen mediana (RIQ), cc | 41,5 (27,8-99,8] | 78 (38,8-122,6] | 0,0666 |
DE: desviación estándar; RIQ: rango intercuartílico.
El nivel de anticoagulación que mostraban los pacientes con Sintrom® a su llegada al servicio de urgencias, expresado por el International Normalised Ratio (INR) fue de 3,26, con un rango entre 1,35 y 11,28 y desviación típica de 2,4.
En la comparación entre ambos subgrupos se observan diferencias significativas en la edad entre mujeres antiagregadas y anticoaguladas. La cardiopatía, como era de esperar, es más frecuente en los pacientes anticoagulados de forma significativa. También tuvo significación la existencia de HTA, diabetes mellitus tipo 2 (DM 2) y fallecimientos, que fueron más frecuentes en el grupo anticoagulado. El volumen de la hemorragia era mayor en los anticoagulados, pero no llegó a ser significativo.
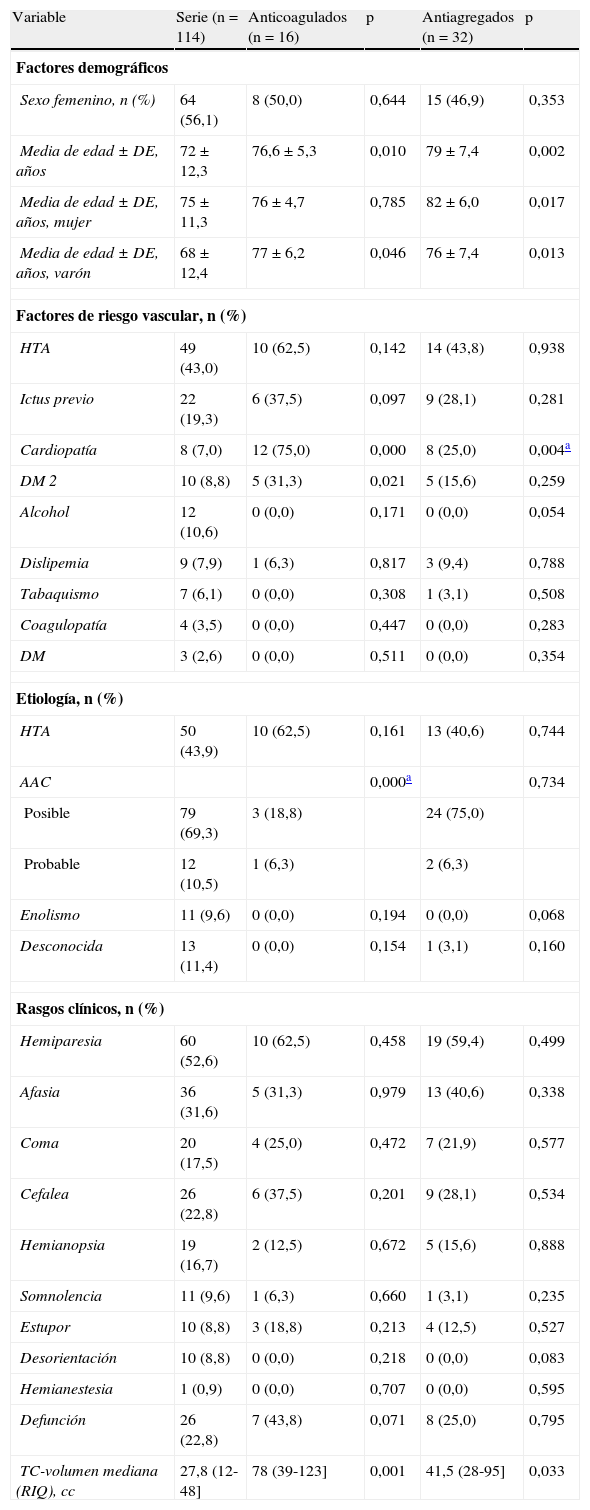
En el análisis comparativo entre la serie general de HIL (sin los pacientes antiagregados y anticoagulados) y los pacientes anticoagulados (tabla 3) hay diferencias significativas en cuanto a la edad pero no respecto al sexo. También hay diferencia significativa en la existencia de cardiopatía que es superior, como era de esperar, en el grupo anticoagulado.
Resultados del análisis comparativo univariante entre la serie general (sin los antiagregados y sin anticoagulados) y los subgrupos de pacientes anticoagulados o los antiagregados
| Variable | Serie (n=114) | Anticoagulados (n=16) | p | Antiagregados (n=32) | p |
| Factores demográficos | |||||
| Sexo femenino, n (%) | 64 (56,1) | 8 (50,0) | 0,644 | 15 (46,9) | 0,353 |
| Media de edad ± DE, años | 72 ± 12,3 | 76,6 ± 5,3 | 0,010 | 79 ± 7,4 | 0,002 |
| Media de edad ± DE, años, mujer | 75 ± 11,3 | 76 ± 4,7 | 0,785 | 82 ± 6,0 | 0,017 |
| Media de edad ± DE, años, varón | 68 ± 12,4 | 77 ± 6,2 | 0,046 | 76 ± 7,4 | 0,013 |
| Factores de riesgo vascular, n (%) | |||||
| HTA | 49 (43,0) | 10 (62,5) | 0,142 | 14 (43,8) | 0,938 |
| Ictus previo | 22 (19,3) | 6 (37,5) | 0,097 | 9 (28,1) | 0,281 |
| Cardiopatía | 8 (7,0) | 12 (75,0) | 0,000 | 8 (25,0) | 0,004a |
| DM 2 | 10 (8,8) | 5 (31,3) | 0,021 | 5 (15,6) | 0,259 |
| Alcohol | 12 (10,6) | 0 (0,0) | 0,171 | 0 (0,0) | 0,054 |
| Dislipemia | 9 (7,9) | 1 (6,3) | 0,817 | 3 (9,4) | 0,788 |
| Tabaquismo | 7 (6,1) | 0 (0,0) | 0,308 | 1 (3,1) | 0,508 |
| Coagulopatía | 4 (3,5) | 0 (0,0) | 0,447 | 0 (0,0) | 0,283 |
| DM | 3 (2,6) | 0 (0,0) | 0,511 | 0 (0,0) | 0,354 |
| Etiología, n (%) | |||||
| HTA | 50 (43,9) | 10 (62,5) | 0,161 | 13 (40,6) | 0,744 |
| AAC | 0,000a | 0,734 | |||
| Posible | 79 (69,3) | 3 (18,8) | 24 (75,0) | ||
| Probable | 12 (10,5) | 1 (6,3) | 2 (6,3) | ||
| Enolismo | 11 (9,6) | 0 (0,0) | 0,194 | 0 (0,0) | 0,068 |
| Desconocida | 13 (11,4) | 0 (0,0) | 0,154 | 1 (3,1) | 0,160 |
| Rasgos clínicos, n (%) | |||||
| Hemiparesia | 60 (52,6) | 10 (62,5) | 0,458 | 19 (59,4) | 0,499 |
| Afasia | 36 (31,6) | 5 (31,3) | 0,979 | 13 (40,6) | 0,338 |
| Coma | 20 (17,5) | 4 (25,0) | 0,472 | 7 (21,9) | 0,577 |
| Cefalea | 26 (22,8) | 6 (37,5) | 0,201 | 9 (28,1) | 0,534 |
| Hemianopsia | 19 (16,7) | 2 (12,5) | 0,672 | 5 (15,6) | 0,888 |
| Somnolencia | 11 (9,6) | 1 (6,3) | 0,660 | 1 (3,1) | 0,235 |
| Estupor | 10 (8,8) | 3 (18,8) | 0,213 | 4 (12,5) | 0,527 |
| Desorientación | 10 (8,8) | 0 (0,0) | 0,218 | 0 (0,0) | 0,083 |
| Hemianestesia | 1 (0,9) | 0 (0,0) | 0,707 | 0 (0,0) | 0,595 |
| Defunción | 26 (22,8) | 7 (43,8) | 0,071 | 8 (25,0) | 0,795 |
| TC-volumen mediana (RIQ), cc | 27,8 (12-48] | 78 (39-123] | 0,001 | 41,5 (28-95] | 0,033 |
DE: desviación estándar; RIQ=rango intercuartílico.
No hay diferencias significativas en el resto de los factores de riesgo vascular excepto en la DM 2. Tampoco hay diferencias significativas en la etiología ni la clínica entre ambos subgrupos. Las defunciones fueron más frecuentes en el grupo anticoagulado, pero no llega a ser significativo respecto a las HIL no anticoaguladas ni antiagregadas. Sin embargo, el volumen (mediana) de la hemorragia fue unas 3 veces superior en el subgrupo anticoagulado y claramente significativo (tabla 3).
La mediana del volumen de la hemorragia de nuestra serie fue de 30,2 cc. En nuestros pacientes, el volumen de la TC tiene un alto poder de clasificación respecto de la defunción (el área bajo curva ROC es de 0,88; p<0,001), con un punto de corte de 37,8 cc (sensibilidad 78% y especificidad del 72%).
En el grupo de antiagregados, la mediana del volumen fue de 41,5 cc y en el grupo de las HIL sin antiagregación ni anticoagulación fue de 27,8 cc, siendo esta diferencia significativa (tabla 3). El punto de corte para defunción de este subgrupo está en un volumen de hemorragia de 58 cc, con una sensibilidad del 100% y una especificidad del 76% (área bajo curva ROC de 1; p<0,001).
En el grupo de anticoagulados no existía relación entre el INR (3,2 de media) a su llegada al hospital y el volumen de la hemorragia, con casos como el de un paciente con INR de 11,28 y un volumen de 84 cc, o el de otro paciente con un INR de 2,7 y un volumen de 283 cc. Tampoco en este subgrupo el volumen de hemorragia tuvo un aceptable poder predictivo de defunción, ya que el área bajo curva ROC solo fue de 0,68, lo que indica escaso poder de clasificación de fallecimientos según el volumen alcanzado por la hemorragia.
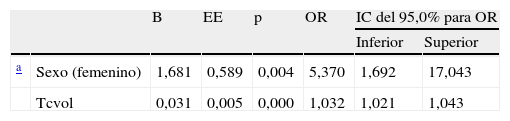
Mediante el análisis multivariante de regresión logística, en la serie general, las variables sexo y volumen de la hemorragia en la TC permanecieron significativamente asociadas a defunción, con una OR de 1,032 para el volumen de la hemorragia y una OR de 5,37 para el sexo femenino (tabla 4). En la serie de anticoagulados el volumen de la hemorragia no fue significativo respecto a la defunción debido a la gran dispersión de los datos para el escaso número de pacientes.
Estimación del riesgo de defunción asociado a las variables predictoras
| B | EE | p | OR | IC del 95,0% para OR | |||
| Inferior | Superior | ||||||
| a | Sexo (femenino) | 1,681 | 0,589 | 0,004 | 5,370 | 1,692 | 17,043 |
| Tcvol | 0,031 | 0,005 | 0,000 | 1,032 | 1,021 | 1,043 | |
EE: error estándar; OR: odds ratio; IC: intervalo de confianza.
Las HIL representan el 3% del total de los ictus atendidos en el servicio de neurología del Hospital Meixoeiro de Vigo entre los años 1991 y 2009. Esta cifra es similar a la aportada en otra serie4 y suponen el 16,4% de las HIC atendidas, algo inferior a lo referido en otras publicaciones2,14. Existe un ligero predominio del sexo femenino y una media de edad similar a otros estudios4,15.
Los factores de riesgo vascular recogidos en nuestra serie son muy similares a los de la bibliografía2–4, salvo una serie que presentaba una mayor incidencia de HTA que la nuestra8. Tampoco existían diferencias significativas en el subgrupo de pacientes antiagregados respecto de los anticoagulados salvo, y como era de esperar, en la existencia de cardiopatía previa más frecuente en el grupo anticoagulado.
Las manifestaciones clínicas de nuestra serie general fueron similares a otras series de HIL en la frecuencia de hemiparesia, afasia, estado de alerta2,4,8,9, pero difiere en la existencia de cefalea con menor frecuencia en nuestros pacientes2–4. En nuestro estudio no existen diferencias significativas en la presentación clínica entre la serie general y los subgrupos de HIL antiagregadas o anticoaguladas o entre los dos subgrupos.
Las HIL tienen una alta mortalidad siendo de un 25% en nuestra serie, muy similar a otras publicaciones3–5,7. En este estudio no hubo diferencias significativas en el porcentaje de defunciones entre la serie general sin los antiagregados ni anticoagulados (114 pacientes) cuando se comparaba con el grupo antiagregado (tabla 3). Cuando se compara la misma serie con el grupo anticoagulado, la mortalidad es casi el doble en los anticoagulados y está próxima a la significación, pero no la alcanza probablemente por el escaso número del subgrupo de pacientes anticoagulados (tabla 3). La comparación entre el grupo de antiagregados y anticoagulados (tabla 2) muestra más defunciones en el grupo anticoagulado pero tampoco es significativo.
No existen datos en la literatura sobre la incidencia de defunción en HIL previamente antiagregadas o anticoaguladas, lo que supone una aportación novedosa de este estudio. Sí está publicada una serie de pacientes con HIC y antiagregación previa en que la mortalidad intrahospitalaria fue casi idéntica a la nuestra en HIL antiagregadas (alrededor del 25% en ambas)16. También hay series de pacientes con HIC asociada a anticoagulación, en que la mortalidad intrahospitalaria es muy similar a la de nuestro subgrupo de anticoagulados que oscilarían entre el 35 y el 45%17–19.
La etiología o la combinación de ellas que se consideraron la causa de la HIL fueron similares a otras series publicados en relación a HTA, diabetes, cardiopatía, ictus previo o dislipemia2–5. La existencia de AAC posible o probable siguiendo los criterios de Boston, cercana al 75%, fue similar a otra con comprobación anatomopatológica12, lo que indica la importancia de esta patología en estas hemorragias lobulares. La incidencia de esta patología en el grupo de los antiagregados fue similar, pero menor en los anticoagulados.
La mediana del volumen de la hemorragia de nuestra serie fue de 30,2 cc, algo inferior al de una serie anterior publicada por nuestro grupo5 y al de otras publicaciones3,15,20. El volumen de la hemorragia en la TC de ingreso mostró un alto poder predictivo de fallecimiento en la serie general, como ya indicamos en otro estudio previo5.
También encontramos que el volumen de la hemorragia tenía un alto poder predictivo de defunción en el grupo de pacientes antiagregados con HIL con un punto de corte de 58 cc. Este dato es novedoso y de interés respecto al manejo de las HIL y posibles actitudes terapéuticas. Esto mismo no pudo demostrarse en el grupo anticoagulado, probablemente por ser un subgrupo de pocos pacientes y presentar una gran dispersión del volumen de la hemorragia.
La importante diferencia en la mediana del volumen entre el subgrupo de pacientes no antiagregados ni anticoagulados, respecto al subgrupo de los antiagregados (27,8 cc frente a 41,5 cc), puede explicarse por la propia actividad antiagregante y también en parte por la diferencia significativa de edad. Recientemente, se ha encontrado que el volumen de la HIL está relacionado con la edad, con mayor volumen en los grupos de edad avanzada15.
La AAC es la causa más frecuente de HIL5,12 y está asociada a los alelos ¿2 y ¿4 de la ApoE14 y su presencia en pacientes con enfermedad de Alzheimer21. Los microsangrados cerebrales, especialmente los de localización cortical son detectables mediante RM cerebral en gradiente eco, e indicativos de la existencia de AAC22,23. También se ha encontrado que estos microsangrados son predictivos de una mayor tendencia a HIC en pacientes anticoagulados, por lo que deberían ser explorados en pacientes mayores antes de ser anticoagulados e incluirlos dentro del balance beneficio-riesgo de la anticoagulación17,24. Recientemente, se ha mostrado que la antiagregación con aspirina en pacientes con HIL pueden incrementar el riesgo de recurrencias25.
El presente estudio tiene sus limitaciones, ya que se trata de una serie retrospectiva a lo largo de 19 años. No se realizó seguimiento protocolizado de los pacientes después de su alta hospitalaria por lo que desconocemos evolución a largo plazo, recidivas u otras posibles variables de interés. El pequeño subgrupo de pacientes con HIL anticoagulados no nos permite extraer datos significativos, aunque el porcentaje de defunción es muy superior al resto de la serie.
Nuestro estudio aporta datos de interés de las HIL respecto a la etiología, las manifestaciones clínicas y las diferencias de mortalidad según la antiagregación o la anticoagulación previa. También consideramos de interés la existencia de puntos de corte del volumen de la hemorragia que nos permiten predecir la defunción del paciente en los distintos subgrupos estudiados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.