El síndrome de Vogt-Koyanagi-Harada (VKH) es una enfermedad autoinmune granulomatosa sistémica, cuya diana son células con antígenos asociados con la melanina. Presenta principalmente manifestaciones oculares, neurológicas, óticas y tegumentarias1. La enfermedad se presenta en 4 fases: fase prodrómica, uveítica aguda, de convalecencia y crónica recurrente. La fase prodrómica suele cursar con cefalea y meningismo, siendo los síntomas oculares de inicio más tardío2. Teniendo en cuenta la importancia de instaurar un tratamiento inmunosupresor precoz para evitar recurrencias y prevenir la afectación ocular, es fundamental una alta sospecha clínica y realizar un diagnóstico adecuado.
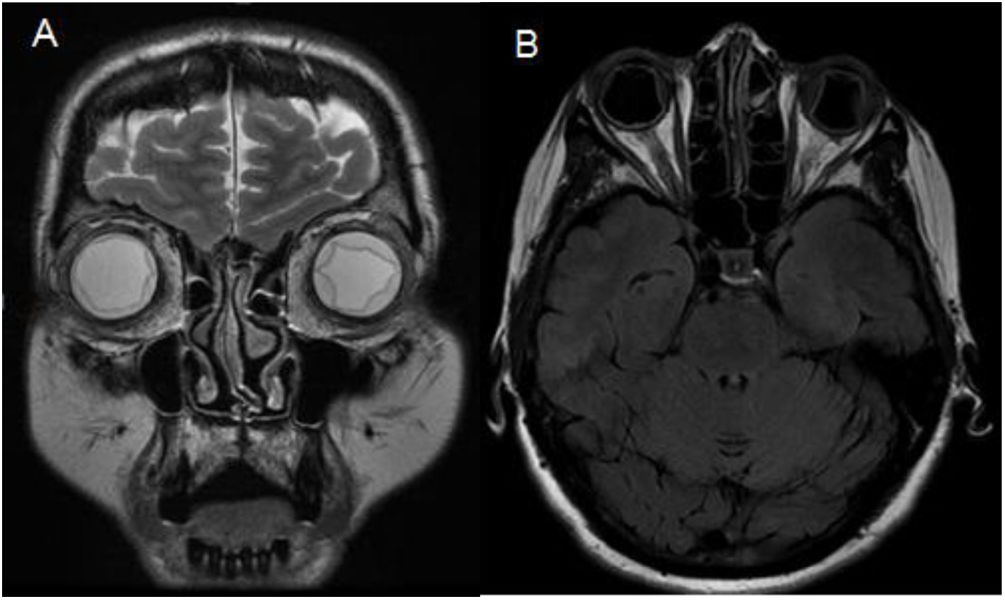
Presentamos el caso de una mujer de 58 años natural de Moldavia, con antecedentes de trastorno depresivo mayor y dislipidemia sin tratamiento activo. Acudió en 3 ocasiones a urgencias por un cuadro de cefalea de inicio agudo, fotopsias y visión borrosa. En todas las visitas la paciente presentaba cifras elevadas de tensión arterial. Se practicó un fondo de ojo que evidenció edema de papila bilateral e ingresó en neurología con sospecha de hipertensión intracraneal a estudio. Durante el ingreso se realizó una RMN cerebral en la que no se observaron lesiones parenquimatosas, pero sí un desprendimiento coroideo bilateral (fig. 1).
Dados los resultados de la RMN, se realizó una punción lumbar en la que se obtuvo una presión de salida de 20,5cmH2O. El análisis del LCR mostró 320 leucocitos/mm3 de predominio linfocítico, 10 hematíes/mm3, ratio de glucosa LCR/plasma 0,49 y proteínas 1,03g/L. Los cultivos y PCR de virus neurotropos fueron negativos, así como la citología. Tras los resultados mencionados, se llevó a cabo una revisión oftalmológica mediante tomografía de coherencia óptica (OCT) y angiografía fluoresceínica, informando de panuveítis bilateral con desprendimiento coroideo y de retina seroso.
El conjunto de la clínica y los resultados suponen un síndrome úveo-meníngeo, presentando la paciente una meningitis aséptica, que junto a los hallazgos oftalmológicos indican una enfermedad de VKH.
Se completó el estudio mediante serologías para VEB, CMV, VHS, sarampión, rubéola, parotiditis, Toxoplasma, VHB, VHC, Coxiella, Rickettsia, Brucellla y Mycoplasma, VIH y Treponema pallidum que fueron negativas para infección activa o reciente. Sí se observaron títulos altos de IgG para Chlamydophila pneumoniae que sugerían una infección reciente por dicho microorganismo.
La paciente cumplía así criterios diagnósticos de VKH incompleto3. Se administró tratamiento de forma inmediata con metilprednisolona intravenosa a dosis de 1000mg/24h durante 5 días, seguido de una pauta oral de prednisona a 1mg/kg/día durante un mes y medio, dado que la paciente tuvo que disminuir la dosis debido a efectos adversos de la medicación. También asoció tratamiento tópico con ciclopléjico y dexametasona. La paciente presentó notable mejoría tras el inicio de la medicación, pasando de una agudeza visual de 0,1 bilateral a 0,4 bilateral a los 6 días del inicio del tratamiento y de 1/1 a los 4 meses de tratamiento. Dada la intolerancia a los corticoides a dosis altas y con la intención de conseguir un mejor control de la inflamación y de la neovascularización coroidea, se decidió asociar azatioprina al tratamiento4–6. Además, se fue monitorizando la respuesta mediante OCT, obteniendo una resolución rápida y llamativa del desprendimiento de retina así como de la inflamación coroidea.
El tratamiento inicial de esta patología es un tema debatido en la actualidad. El abordaje clásico consiste en el tratamiento inicial con corticoides, continuando en fases más tardías con inmunoterapia. En la última década se ha visto una correlación clara entre el inicio precoz y a altas dosis de glucocorticoides por vía intravenosa (entre 500 y 1000mg durante 3 días) con la mejoría clínica inicial7. Además, en algunos estudios recientes, se aboga por una terapia concomitante con inmunosupresores desde el inicio, puesto que los datos indican una disminución del número de complicaciones tardías con esta terapia combinada8. Sin embargo no está implementado en la práctica clínica habitual.
En el caso de nuestra paciente, utilizamos monoterapia inicial a dosis de 1000mg por vía intravenosa durante 5 días, aumentando así el tiempo de exposición clásico a altas dosis de inmunosupresión, obteniendo un muy buen resultado clínico con resolución de la afectación neurológica, además de la inflamación coroidea corroborado por OCT.
Es importante mencionar la reciente infección por Chlamydophila pneumoniae como posible precipitante de la enfermedad. Es conocido que el VKH puede ser desencadenado por distintas infecciones principalmente víricas, sin embargo, no hemos encontrado en la bibliografía ningún caso en el que dicho microorganismo fuese Chlamydophila pneumoniae, infección que sí se ha relacionado con otras enfermedades autoinmunes como la enfermedad de Kawasaki o la esclerosis múltiple9.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.