Los síntomas conductuales y psicológicos (SCP) son muy prevalentes en la enfermedad de Alzheimer (EA) presentándose en más del 90% de los pacientes a lo largo del curso de la enfermedad. Los SCP disminuyen la calidad de vida, tanto del paciente, como de sus cuidadores, al tiempo que incrementan los costes asistenciales. Son los principales responsables de la carga que experimentan los cuidadores, favoreciendo la institucionalización prematura de los pacientes.
DesarrolloEn la actualidad existe consenso en considerar más eficaces aquellos modelos de intervención que combinan los tratamientos farmacológicos y los no farmacológicos para personas con EA. En varios estudios se ha comprobado la eficacia de los fármacos anticolinesterásicos y de la memantina combinados con terapias de intervención cognitiva (TIC), para mejorar el funcionamiento cognitivo y la capacidad funcional de los pacientes en el desempeño de las actividades de la vida diaria. Sin embargo, la eficacia de las TIC sobre los SCP no está aun claramente establecida, lo que ha limitado su aplicación con esta finalidad en la práctica clínica. El objetivo de esta revisión es el de recoger la información disponible acerca de la eficacia de las TIC en el tratamiento de los SCP en los pacientes con EA.
ConclusionesLos resultados de esta revisión sugieren que las TIC puede tener efectos beneficiosos sobre los SCP de la EA, por lo que debería ser considerada como una opción terapéutica para el abordaje de los mismos.
The prevalence of behavioural and psychological symptoms (BPS) is very high among patients with Alzheimer disease (AD); more than 90% of AD patients will present such symptoms during the course of the disease. These symptoms result in poorer quality of life for both patients and caregivers and increased healthcare costs. BPS are the main factors involved in increases to the caregiver burden, and they often precipitate the admission of patients to residential care centres.
DevelopmentCurrent consensus holds that intervention models combining pharmacological and non-pharmacological treatments are the most effective for AD patients. Several studies have shown cholinesterase inhibitors and memantine combined with cognitive intervention therapy (CIT) to be effective for improving patients’ cognitive function and functional capacity for undertaking daily life activities. However, the efficacy of CIT as a treatment for BPS has not yet been clearly established, which limits its use for this purpose in clinical practice. The objective of this review is to gather available evidence on the efficacy of cognitive intervention therapy (CIT) on BPS in patients with AD.
ConclusionsThe results of this review suggest that CIT may have a beneficial effect on BPS in patients with AD and should therefore be considered a treatment option for patients with AD and BPS.
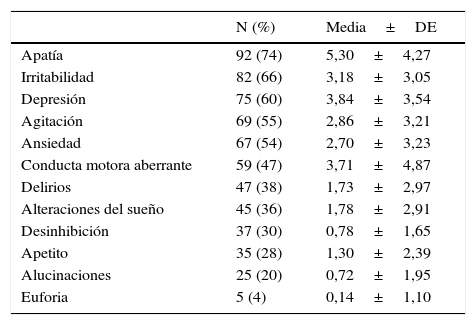
Los síntomas conductuales y psicológicos (SCP) están presentes en la mayoría de los pacientes con enfermedad de Alzheimer (EA)1. Más del 90% de los pacientes presentarán a lo largo del curso de la enfermedad síntomas tales como apatía, agitación, ansiedad, depresión, alucinaciones, delirios, actividad motora aberrante, irritabilidad, alteraciones del sueño, alteraciones de la conducta alimentaria, euforia o desinhibición (tabla 1)2–4.
Síntomas conductuales y psicológicos en una muestra comunitaria de 125 pacientes con enfermedad de Alzheimer evaluados con el NPI
| N (%) | Media±DE | |
|---|---|---|
| Apatía | 92 (74) | 5,30±4,27 |
| Irritabilidad | 82 (66) | 3,18±3,05 |
| Depresión | 75 (60) | 3,84±3,54 |
| Agitación | 69 (55) | 2,86±3,21 |
| Ansiedad | 67 (54) | 2,70±3,23 |
| Conducta motora aberrante | 59 (47) | 3,71±4,87 |
| Delirios | 47 (38) | 1,73±2,97 |
| Alteraciones del sueño | 45 (36) | 1,78±2,91 |
| Desinhibición | 37 (30) | 0,78±1,65 |
| Apetito | 35 (28) | 1,30±2,39 |
| Alucinaciones | 25 (20) | 0,72±1,95 |
| Euforia | 5 (4) | 0,14±1,10 |
Fuente: tomado de García-Alberca et al.4.
DE: desviación estándar; NPI: Neuropsychiatric inventory; SCP: síntomas conductuales y psicológicos.
Los SCP ocasionan una disminución significativa de la calidad de vida, tanto del paciente, como de sus familiares y cuidadores5, así como un gran sufrimiento en ambos6,7, lo que favorece su internamiento prematuro en una institución8,9. Su presencia se asocia a un mayor consumo de psicofármacos, al incremento de los costes asistenciales10 y al empleo de las restricciones físicas en el paciente11. Asimismo, los cuidadores expresan una mayor necesidad de ayuda diaria en casa y para la supervisión, así como para los cuidados personales12, lo que se traduce en el gran número de cambios que tienen que introducir en su estilo de vida13 y la falta de tiempo para ellos mismos14. Estudios epidemiológicos demuestran que las tasas de diagnósticos psiquiátricos, especialmente la ansiedad y la depresión, son sistemáticamente mayores en los familiares que cuidan a los pacientes con EA que en la población general15.
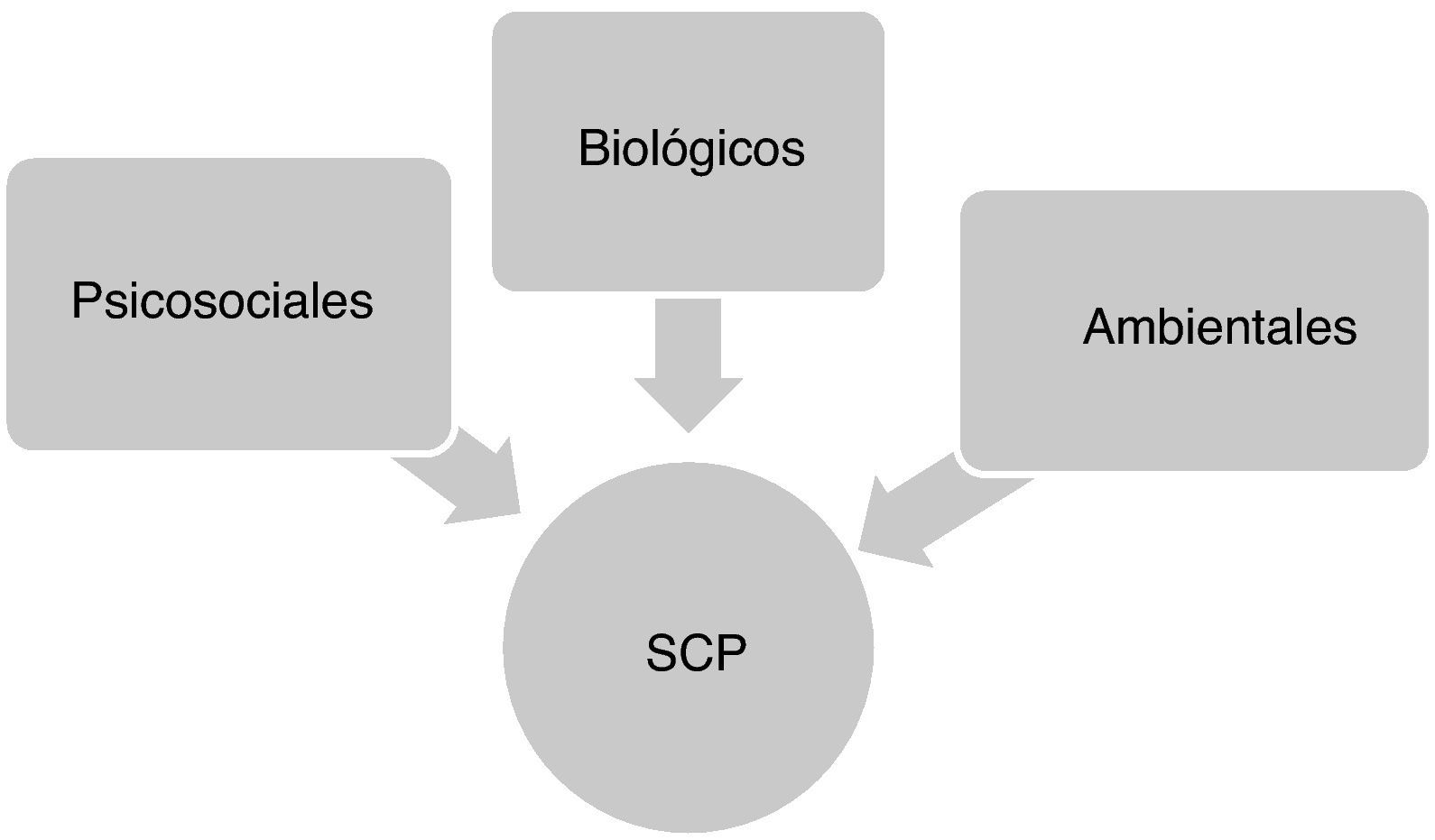
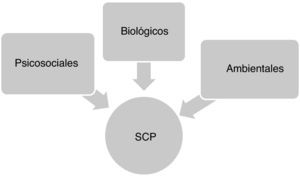
Factores que contribuyen a la aparición de los síntomas conductuales y psicológicos en la enfermedad de AlzheimerLa aparición y desarrollo de los SCP en la EA son el resultado de una compleja interacción de factores neurobiológicos, psicosociales y ambientales de tal forma que, aunque existe una gran variabilidad de unos pacientes a otros, su frecuencia y gravedad tienden a incrementarse de manera progresiva a medida que avanza el deterioro cognitivo y funcional (fig. 1)16.
Factores neurobiológicosAunque son relativamente escasos los estudios en este campo, los SCP se han relacionado con los cambios neurobiológicos subyacentes en el cerebro de los pacientes con EA. Se ha descrito que la apatía en la EA está asociada con la disfunción en las áreas que componen los circuitos fronto-subcorticles, evidenciándose hipoperfusión e hipometabolismo en el giro cingulado anterior (GCA)17,18, en el córtex órbitofrontal (COF)19, en el núcleo basal de Meynert y en el hipocampo. La presencia de apatía también se ha correlacionado con la pérdida neuronal y mayor densidad de ovillos neurofibrilares en estas mismas áreas.
La depresión se asocia con la disfunción en los circuitos fronto-surcorticales y límbicos subcorticales (locus ceruleus, sustancia negra, hipocampo e hipotálamo), hallándose hipoperfusión en el GCA y en el córtex prefrontal dorsolateral (CPDL)19–21, así como con hipometabolismo frontal y prefrontal19,20. Asimismo, varias líneas de investigación sugieren que la disfunción frontal o de los circuitos órbitofronto-subcorticales juega un papel primordial en la ocurrencia de agitación y desinhibición22.
Por su parte, los síntomas psicóticos han sido asociados a un incremento en el número de ovillos neurofibrilares en el neocórtex23, mientras que la agitación ha sido relacionada con un mayor acúmulo de ovillos neurofibrilares en el COF22.
Adicionalmente, algunos estudios han encontrado asociaciones genéticas para algunos SCP en la EA. Así, por ejemplo, se ha encontrado relación entre el genotipo ¿4 de la apolipoproteína E y la presencia de delirios y agitación24 o entre la presencia de depresión en la EA y una historia de antecedentes personales de depresión25. También se ha sugerido que algunos SCP podrían estar ligados a los cambios que ocurren en los sistemas de neurotransmisión implicados en la EA, especialmente los que implican al glutamato, acetilcolina, serotonina, noradrenalina o dopamina. Su disfunción podría estar relacionada con la presencia de cambios en el estado de ánimo (serotonina y noradrenalina), trastornos del movimiento (dopamina), agresividad (serotonina) y apatía (acetilcolina)26–28.
Factores psicosociales y ambientalesExisten diferentes modelos de orientación psicosocial en un sentido amplio del término que contribuyen a explicar en una proporción importante de casos el origen y mantenimiento de los cambios conductuales observados en la EA.
El modelo de las necesidades no satisfechas29 propone que los SCP podrían ser la consecuencia de las necesidades físicas, sociales o emocionales no satisfechas debido a la dificultad que tienen los pacientes para expresarlas y los cuidadores para percibirlas o atenderlas, tales como hambre, sed, dolor, sentimientos de abandono o de miedo. En consecuencia, el paciente reaccionaría ante situaciones adversas con conductas disruptivas que pueden ser estresantes, tanto para él mismo, como para los demás. Por ejemplo, gritos o insultos pueden ser indicativos de una tentativa del paciente para comunicar alguna necesidad o un estado de dolor o de malestar debido a algún problema médico subyacente.
El modelo del umbral de estrés progresivamente disminuido30 sugiere que la demencia causa una disminución progresiva del umbral de tolerancia al estrés o a estímulos adversos, y que cuando este umbral es traspasado, se pondrían en marcha conductas desorganizadas o inapropiadas. Por ejemplo, reacciones catastróficas pueden ser desencadenadas por experiencias frustrantes, tales como la incapacidad para manejar el dinero o para elegir la ropa que ponerse.
La teoría del aprendizaje31,32, por su parte, hipotetiza que determinados estímulos ambientales disparan conductas que los individuos aprenden a mantener o extinguir en función de las consecuencias positivas o negativas que tienen para ellos. Por ejemplo, un paciente puede recibir mucha atención de sus cuidadores mientras grita, pero es ignorado cuando está tranquilo, reforzando de esta manera inadvertidamente la conducta de gritar más que la de permanecer tranquilo.
Finalmente, factores ambientales tales como el ruido excesivo, inadecuada luminosidad, falta de rutinas diarias, excesivas demandas o la conducta estresante de los otros pueden estar también implicados en el desencadenamiento de algunos SCP33.
Considerando todo ello, y dado que a pesar de los avances experimentados en su tratamiento, la EA continúa siendo incurable, resulta de vital importancia retrasar su progreso y sus negativas consecuencias sobre las personas que la sufren34, aliviando por consiguiente la carga y el sufrimiento que experimentan sus familiares y cuidadores. En este sentido, en la actualidad existe consenso en considerar más eficaces aquellos modelos de intervención que combinan tratamientos farmacológicos y no farmacológicos para personas con EA33,35.
Los inhibidores de la colinesterasa y la memantina han sido aprobados para el tratamiento de pacientes con EA y los resultados de los ensayos clínicos llevados a cabo para establecer su eficacia han demostrado que son útiles para mejorar el funcionamiento cognitivo y la capacidad funcional de las personas afectadas36,37. Además, en varios estudios también se ha observado su eficacia para reducir la frecuencia y gravedad de los SCP6,38,39. Por su parte, dentro de los abordajes no farmacológicos, las terapias de intervención cognitiva (TIC), incluyendo el entrenamiento cognitivo, la rehabilitación cognitiva y la estimulación cognitiva, ha conseguido estabilizar o mejorar la función cognitiva y el desempeño de actividades de la vida diaria en la EA leve o moderada40–43. Sin embargo, su eficacia sobre los SCP no está aún claramente establecida, lo que ha limitado su aplicación con esta finalidad en la práctica clínica44. En esencia, los programas de estimulación cognitiva contemplan una intervención generalmente grupal en pacientes con EA leve o moderada, en sesiones de duración variable que incluyen tareas de estimulación de la memoria reciente y remota, estimulación sensorial, orientación a la realidad, etc. En la actualidad este tipo de programas suele complementarse con la práctica de ejercicios físicos, musicoterapia o la realización de diferentes tipos de juegos englobándose el conjunto con el nombre de estimulación cognitiva enriquecida. Por su parte, los programas de entrenamiento cognitivo consisten en la práctica de una manera más personalizada de estrategias y habilidades cognitivas específicas que se pueden llevar a cabo de manera individual o grupal, pudiendo incluir el entrenamiento basado en el uso de programas informáticos. Finalmente, la terapia de rehabilitación cognitiva comprende diferentes tipos de intervenciones desarrolladas sobre la base de la teoría del aprendizaje implícito. Se desarrollan de manera muy individualizada y están dirigidas a trabajar objetivos muy específicos y relevantes para el paciente, pudiendo incluir en muchas ocasiones a otros miembros de la familia45.
El objetivo de esta revisión es verificar la información disponible acerca de los beneficios de las TIC en el tratamiento de los SCP en los pacientes con EA, con el propósito de ofrecer una visión panorámica del tema más que centrarse en los resultados de estudios individuales.
MetodologíaLa revisión de los estudios relacionados con el tema se llevó a cabo en 2 fases. En la primera de ella se consultaron las revisiones existentes al respecto, mientras que en la segunda se identificaron aquellos estudios de investigación que han analizado la existencia de relación tanto neurobiológica como epidemiológica entre las TIC y los SCP en la EA. Para ello se consultaron las siguientes bases de datos electrónicas: Medline, PsycINFO, Embase y Biblioteca Cochrane. Se incluyeron los estudios publicados hasta el 15 de febrero de 2012.
DesarrolloLas terapias de intervención cognitiva para la mejora de la cognición en la enfermedad de AlzheimerLas TIC destinadas a la mejora de la función cognitiva y la capacidad funcional de los pacientes con EA implican la práctica guiada de un conjunto de tareas diseñadas para estimular o entrenar de manera particular funciones cognitivas tales como la memoria, la atención o las capacidades ejecutivas, que puede realizarse en una variedad de formatos y procedimientos46.
En una revisión reciente, Olazarán et al.47, encontraron evidencias a favor de que sesiones de entrenamiento o de estimulación de habilidades cognitivas llevadas a cabo tanto en pequeños grupos como de manera individual consiguen mejorar específicamente dichas destrezas cognitivas. Concretamente, el entrenamiento en grupo de habilidades cognitivas específicas produjo mejoría en el aprendizaje verbal y visual después de la enseñanza de estrategias de memoria llevadas a cabo diariamente48 o 2 veces por semana49, mientras que, por su parte, el entrenamiento en sesiones individuales dirigido por el terapeuta o por el propio cuidador también consiguieron efectos positivos sobre la cognición50,51. De manera similar, sesiones grupales de estimulación cognitiva consiguieron mejorías significativas en medidas de atención, memoria, orientación, lenguaje y funcionamiento cognitivo general52,53. Estos resultados se mantienen cuando se trata de intervenciones multicomponentes en las que la estimulación cognitiva forma parte de programas de tratamiento en los que esta se combina con la terapia de reminiscencia, ejercicio físico, entrenamiento en actividades de la vida diaria o terapia de apoyo54–56.
Las terapias de intervención cognitiva para la mejora de los síntomas conductuales y psicológicos en la enfermedad de AlzheimerAlgunos estudios clínicos han demostrado que las TIC en pacientes con EA consiguen reducciones significativas en la frecuencia y gravedad de los SCP (tabla 2). Sin embargo, el valor de estos estudios es limitado debido al empleo de muestras de tamaño pequeño35, o que no se estudió el efecto de las TIC sobre los SCP específicos57 o en relación a los diferentes niveles de severidad de la demencia58.
Resumen de los principales estudios de eficacia de las TIC sobre los SCP en los pacientes con enfermedad de Alzheimer
| Estudio | Diseño | Resultados |
|---|---|---|
| Estimulación cognitiva | ||
| Niu et al., 201067 | Estudio randomizado y controlado en 32 pacientes con EA leve a moderada. Se realizaron sesiones de 45min, 2 días por semana, durante 10 semanas | Reducción significativa de los síntomas de apatía y depresión |
| Entrenamiento cognitivo | ||
| Olazarán et al., 200455 | Estudio randomizado y controlado en 84 sujetos diagnosticados de deterioro cognitivo leve y de EA leve a moderada que recibían tratamiento farmacológico con inhibidores de la colinesterasa. Se realizaron 103 sesiones a los largo de un año de duración | El 75% de los sujetos del grupo experimental mantuvo o mejoró su estado de ánimo al finalizar el tratamiento |
| Chapman et al., 200454 | Estudio randomizado y controlado en 54 sujetos con EA leve a moderada, a lo largo de 2 meses, comparando los que recibían solo tratamiento con donepezil con los que recibían donepezil más entrenamiento cognitivo | Mejoría en apatía e irritabilidad 12 meses después de iniciado el tratamiento |
| Rehabilitación cognitiva | ||
| Talassi et al., 200758 | Estudio controlado en 24 sujetos con demencia leve. Se efectuaron sesiones de 30-45min, 4 días en semana, durante 3 semanas | Reducción significativa de los síntomas de ansiedad y depresión |
| Raggi et al., 200757 | Estudio con 50 pacientes de EA leve a severa durante 17 meses de duración | Reducción global significativa de los síntomas conductuales evaluados con el NPI |
EA: enfermedad de Alzheimer; NPI: Neuropsychiatric inventory; SCP: síntomas conductuales y psicológicos; TIC: terapias de intervención cognitiva.
En la mencionada revisión sistemática de Olazarán et al.47, el efecto más notable sobre la conducta se obtuvo a partir de la síntesis de los resultados de 3 pequeños estudios randomizados y controlados de estimulación cognitiva, que se llevaron a cabo con pacientes dementes institucionalizados. Las medidas utilizadas incluyeron problemas de conducta59, control de las emociones60 y conductas disruptivas61. Además, programas de intervención multicomponente enriquecidos con estimulación cognitiva en grupo mostraron moderadas mejorías en la conducta54,62 y el aislamiento social42,63 en pacientes con demencia no institucionalizados.
En un estudio clínico no controlado57, 50 pacientes diagnosticados de demencia de intensidad leve a severa fueron tratados durante un periodo de 17 meses con terapia de orientación a la realidad, complementada, cuando fue necesario, con intervenciones cognitivas individualizadas. Los SCP fueron evaluados mediante el Neuropsychiatric Inventory (NPI)64 (Cummings et al., 1994). Los resultados mostraron una reducción cercana al 60% de la puntuación total del NPI al finalizar el programa de tratamiento. Por otra parte, en un estudio controlado de 3 semanas de duración Talassi et al.58, compararon la eficacia de un programa de rehabilitación cognitiva (PRC) con otro de rehabilitación no cognitiva (PRNC) en pacientes que presentaban deterioro cognitivo leve (DCL) y demencia leve. El PRC estaba integrado por 3 tipos de actividades: entrenamiento cognitivo computarizado (ECC), terapia ocupacional (TO) y entrenamiento conductual (EC) dirigido al tratamiento de los síntomas afectivos mediante estrategias de comunicación y terapia de conducta. La evaluación de los SCP se llevó a cabo mediante la Escala de Depresión Geriátrica65, el State Trait Anxiety Inventory66 y el NPI. Los resultados mostraron que tanto los pacientes con DCL como los que padecían demencia leve que siguieron el PRC experimentaron una reducción significativa en los síntomas de ansiedad y depresión tras el periodo de tratamiento. Por el contrario, este efecto no se observó en el grupo de pacientes asignados al PRNC.
Más recientemente, un ensayo clínico controlado y aleatorizado de 10 semanas de duración llevado a cabo con pacientes con EA de intensidad leve o moderada67 demostró que la aplicación de un programa de estimulación cognitiva focalizado en tareas de activación de funciones ejecutivas y de memoria, combinado con la toma de una dosis estable un fármaco anticolinesterásico consiguió reducciones significativas en los niveles de apatía y depresión de los pacientes. Las personas que participaron en el estudio habían recibido una dosis estable de donepezil durante al menos 3 meses antes de la aplicación del programa de estimulación cognitiva, tiempo estimado como necesario para obtener la máxima eficacia del fármaco68, por lo que los autores sugieren que los resultados favorables del estudio no pueden ser atribuidos a los efectos de la medicación. Asimismo, el empleo de psicofármacos no se modificó ni antes ni durante la participación de los pacientes en el estudio con la finalidad de controlar su posible influencia en la mejoría de la cognición y los SCP. Además, todos los participantes vivían en la misma región bajo circunstancias ambientales similares, por lo que los autores excluyen la influencia de las condiciones ambientales en los resultados positivos del estudio.
ConclusionesContribuye a una mejor comprensión de los datos aquí descritos la toma en consideración de los resultados de recientes estudios mostrando un declinar de las funciones ejecutivas en pacientes con EA incluso desde las primeras etapas de la enfermedad69–71 y cómo las mismas áreas implicadas en la presencia de SCP frontales (apatía, depresión, agitación, desinhibición), especialmente el GCA, el COF y el CPDL, juegan un papel importante en el desempeño de importantes funciones ejecutivas específicas, particularmente el control inhibitorio, la atención dividida, la flexibilidad cognitiva o las habilidades de pensamiento complejo72,73.
La convergencia de estos datos sugiere que algunos SCP (apatía, depresión, agitación, desinhibición) y algunas funciones ejecutivas (control inhibitorio y atención dividida principalmente) podrían compartir bases neuroanatómicas en el lóbulo frontal y en los circuitos fronto-subcorticales18,74–76, de tal forma que la mejoría de la sintomatología conductual en los pacientes con EA que reciben TIC podría ser consistente con el hecho de la existencia de esta superposición en las regiones frontales implicadas. De hecho, la apatía es considerada en la actualidad como una de las primeras manifestaciones conductuales de la disfunción del sistema frontal, representando una forma de disfunción ejecutiva consecuencia de los cambios neuropatológicos en las regiones frontales del cerebro28,77.
En apoyo de esta hipótesis, varios estudios han demostrado cómo incrementos en el flujo sanguíneo cerebral regional y en el metabolismo están ligados a la ejecución de tareas cognitivas77,78. La activación de estas áreas corticales por medio de las TIC podría parcialmente mejorar el metabolismo y el flujo regional cerebral77,79 lo que conllevaría a mejoras en el funcionamiento ejecutivo de los pacientes. De manera más concreta, las TIC podrían estar asociadas con cambios neurobiológicos en las cortezas de asociación, especialmente en la región del lóbulo frontal80, de tal forma que al estimular funciones cerebrales tales como la atención compleja, la memoria de trabajo, la flexibilidad, las habilidades de autocontrol, el razonamiento y el pensamiento abstracto, todas las cuales son importantes características del funcionamiento ejecutivo, las TIC contribuiría a su vez a mejorar los SCP asociados con los déficits neurales subyacentes a la disfunción del lóbulo frontal73,81,82.
Por otra parte, de acuerdo con los planteamientos etiológicos propuestos por los modelos psicosociales y puesto que los pacientes cuentan con reserva cognitiva en las fases leves y moderadas de la enfermedad, las TIC podrían al mejorar el uso de las capacidades cognitivas y funcionales que aún conservan los pacientes, contribuir a incrementar su autoconfianza y motivación, conduciéndolos a una renovada actitud positiva ante la vida, lo que, a su vez, redundaría en una reducción de los SCP disruptivos. Además, en las fases leves y moderadas de la enfermedad, la mejora de la función cognitiva y de las capacidades funcionales conseguida con las TIC facilitaría que los pacientes expresaran mejor sus demandas y necesidades, lo que, a su vez, incrementaría su nivel de resistencia frente al estrés67,83. En este sentido, y aunque algunos estudios32,84 han demostrado los beneficios del contacto social para reducir los SCP, un reciente estudio controlado y randomizado67 evidenció la eficacia de un programa de estimulación cognitiva para reducir la apatía y la depresión en los pacientes tratados frente al grupo control, independientemente de los efectos beneficiosos del contacto social o de la atención prestada a los pacientes por parte de sus allegados.
Abundando en las hipótesis formuladas por estos modelos, se observa cómo los SCP en la EA son a menudo el resultado de la interacción que se establece entre los pacientes y sus familiares y cuidadores4,85,86. En este sentido, los pacientes con EA leve o moderada tienden a sobrestimar sus capacidades cognitivas y funcionales en comparación con lo que sus familiares informan al respecto. Debido a esta discrepancia en la evaluación de la capacidad cognitiva entre los pacientes y los familiares, los pacientes pueden sentir que ellos no son comprendidos y aceptados por sus familiares, lo cual podría acelerar la aparición de algunos SCP81,87. En tales casos, los familiares deberían participar en las sesiones de TIC, lo que les permitiría llegar a comprender las razones subyacentes a algunos de los SCP que manifiestan las personas a las que cuidan, lo que podría contribuir a una reducción de dicha sintomatología87.
En conclusión, esta revisión pone de manifiesto nuestras actuales limitaciones en el conocimiento de los factores que contribuyen a la aparición y desarrollo de los SCP en la EA, así como de las estrategias más adecuadas para su tratamiento. Sin embargo, los resultados aquí mostrados sugieren que los programas TIC tienen efectos beneficiosos sobre las manifestaciones conductuales de la demencia, especialmente en el caso de apatía, ansiedad, irritabilidad y depresión, por lo que estos deberían ser considerados como una opción terapéutica para el abordaje no solo del deterioro de las capacidades cognitivas y funcionales, sino también de los SCP en los pacientes con EA leve o moderada. El incremento de experiencias exitosas a través de las TIC podría mejorar la autoconfianza y el bienestar psicológico de los pacientes, disminuyendo su angustia psicológica y contribuyendo a la reducción de los SCP, al mismo tiempo, que en consecuencia aliviarían la carga y el sufrimiento de los cuidadores, mejorando en ambos su calidad de vida y disminuyendo las probabilidades de institucionalización del paciente.
Se necesitan estudios adicionales randomizados y controlados para clarificar la eficacia de las TIC sobre los SCP de la EA, así como los dominios conductuales en los cuales son más probables y de mayor magnitud las mejoras favorecidas por este tipo de terapias no farmacológicas. Futuras investigaciones deberían, además, profundizar en el conocimiento de las correlaciones neurobiológicas de los beneficios neuropsicológicos y conductuales conseguidos con las TIC, así como contribuir al desarrollo de programas de intervención diseñados de manera personalizada en función de las necesidades de cada persona.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.