Algunos vegetales destinados a la alimentación contienen compuestos tóxicos que, al ser consumidos, predisponen al desarrollo de algunas enfermedades. La yuca (Manihot esculenta Crantz) es una fuente importante de alimento, pero contiene glucósidos cianogénicos (linamarina y lotaustralina) que han sido asociados con el desarrollo de la neuropatía atáxica tropical y el konzo. En la rata, la administración intraperitoneal de acetonacianohidrina (un metabolito de la linamarina) produce alteraciones neurológicas y daño neuronal en el hipocampo. No obstante, se desconoce si el área CA1 del hipocampo participa en las alteraciones neurológicas asociadas a la acetonacianohidrina.
MétodoTreinta y dos ratas macho Wistar de 3 meses de edad fueron destinadas a 4 grupos (n=8 cada grupo): vehículo (1 de solución salina fisiológica) y 3 grupos con acetonacianohidrina (1 de solución 10, 15 y 20mM). Las sustancias fueron microinyectadas intrahipocampalmente durante 7 días consecutivos (cada 24h); los efectos fueron evaluados diariamente en las pruebas de actividad locomotora, rota-rod y nado. Al quinto día postratamiento se evaluaron nuevamente en las pruebas conductuales para identificar o descartar la permanencia del daño inducido por la acetonacianohidrina.
ResultadosLa microinyección de acetonacianohidrina 20mM produjo hiperactividad, incoordinación motora y reducción de la exploración a partir del tercer día del tratamiento. En la prueba de nado, todas las concentraciones de acetonacianohidrina produjeron la conducta de giro desde el primer día de microinyección.
ConclusiónEl área CA1 del hipocampo participa en las alteraciones motoras inducidas por la microinyección de acetonacianohidrina, como ha sido reportado para otros compuestos de la yuca.
Some vegetable foodstuffs contain toxic compounds that, when consumed, favour the development of certain diseases. Cassava (Manihot esculenta Crantz) is an important food source, but it contains cyanogenic glucosides (linamarin and lotaustralin) that have been associated with the development of tropical ataxic neuropathy and konzo. In rats, intraperitoneal administration of acetone cyanohydrin (a metabolite of linamarin) produces neurological disorders and neuronal damage in the hippocampus. However, it is unknown whether hippocampal area CA1 plays a role in neurological disorders associated with acetone cyanohydrin.
MethodA total of 32 male Wistar rats 3 months old were assigned to 4 groups (n=8 per group) as follows: vehicle (1μl physiological saline), and 3 groups with acetone cyanohydrin (1μl of 10, 15, and 20mM solution, respectively). The substances were microinjected intrahippocampally every 24hours for 7 consecutive days, and their effects on locomotor activity, rota-rod and swim tests were assessed daily. On the fifth day post-treatment, rats underwent further assessment with behavioural tests to identify or rule out permanent damage induced by acetone cyanohydrin.
ResultsMicroinjection of acetone cyanohydrin 20mM resulted in hyperactivity, motor impairment, and reduced exploration from the third day of treatment. All concentrations of acetone cyanohydrin produced rotational behaviour in the swim test from the first day of microinjection.
ConclusionThe hippocampal area CA1 is involved in motor alterations induced by microinjection of acetone cyanohydrin, as has been reported for other cassava compounds.
Los alimentos de origen vegetal, que cotidianamente se consumen en algunas regiones del mundo, contienen con frecuencia compuestos que bajo ciertas condiciones pueden producir efectos tóxicos. En condiciones normales, el procesamiento de dichos alimentos está adaptado para permitir su consumo seguro; sin embargo, cuando el proceso de preparación no es el adecuado, los componentes tóxicos pueden inducir enfermedades, incluidas las del sistema nervioso central1. Uno de estos alimentos es la raíz de yuca (Manihot esculenta Crantz) que provee de un alto contenido energético. La raíz y las partes aéreas de la yuca contienen compuestos cianogénicos (linamarina y lotaustralina) que, al hidrolizarse a través de la enzima linamarasa, originan glucosa y acetonacianohidrina, la cual se descompone en acetona y ácido cianhídrico, al que se atribuye la neurotoxicidad2.
En estudios previos se reportó que las ratas tratadas con el jugo de la raíz de yuca (equivalente a 0,30mg/2mL de linamarina) desarrollan hiperactividad e incoordinación motriz3, además de disminuir el número de neuronas en el área CA1 del hipocampo4. Lo anterior ha involucrado al hipocampo en el deterioro motor inducido por el consumo de yuca y probablemente en la etiología de enfermedades neurológicas como el konzo y la neuropatía atáxica tropical en consumidores de yuca4. En efecto, la microinyección de linamarina en el hipocampo (CA1) produce hiperactividad e incoordinación motora en la rata caracterizada por aumento en el número de cuadros cruzados en campo abierto, acortamiento de la latencia a la caída en el rota-rod y despliegue de la conducta de giro sobre su propio eje en la prueba de nado5. A pesar de estos hallazgos, aún se desconoce si otros componentes de la yuca, como la acetonacianohidrina, también producen alteraciones en la coordinación y la actividad motora cuando son microinyectados en el hipocampo, lo cual fue explorado en el presente estudio mediante la microinyección intrahipocampal de acetonacianohidrina y el análisis conductual en las pruebas de actividad locomotora, rota-rod y nado en la rata Wistar.
MétodosSujetosSe incluyeron 32 ratas macho de 3 meses de edad de la cepa Wistar, con un peso entre 250-300g al inicio de los experimentos. Fueron alojadas en cajas de acrílico en un bioterio con temperatura ambiente (25±20C) y ciclo de luz/oscuridad de 12/12 h (la luz se encendió a las 7:00 am). El acceso al agua y al alimento fue ad libitum. Las manipulaciones experimentales fueron realizadas bajo los lineamientos éticos internacionales basados en la Guide for care and use of laboratory animals6 y mexicanos de acuerdo con las Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio7.
Cirugía estereotáxicaEl implante unilateral de la cánula guía se realizó bajo anestesia profunda de acuerdo con estudios previos8. La cabeza de la rata fue fijada al aparato estereotáxico (Stoelting, Wood Dale, Illinois, EE. UU.A) para dejar al descubierto el cráneo. Se tomó como referencia la sutura Bregma y de acuerdo con las coordenadas estereotáxicas9; se realizó un trépano en el cráneo con un taladro (Saeshin Dental Lab 35000 RPM, Corea del Sur) para implantar la cánula en el área CA1 del hipocampo dorsal (Ap=–3,8mm, L=–2mm y H=–2mm). La cánula guía de acero inoxidable (8mm de longitud, 0,7mm de diámetro) fue descendida y fijada al cráneo con acrílico dental (Arias Distribuidora Dental, Tlalnepantla, México). Cuatro días después del implante, se procedió a la microinyección de los tratamientos.
Grupos experimentales y tratamientosLas ratas fueron asignadas aleatoriamente a 4 grupos (n=8, cada grupo): un grupo que recibió el vehículo (solución salina fisiológica) y 3 grupos más que recibieron las diferentes concentraciones de acetonacianohidrina (10, 15 y 20mM), las cuales fueron calculadas considerando estudios previos10. El vehículo o la acetonacianohidrina fueron microinyectados cada 24 h durante 7 días consecutivos, 5 min después de la microinyección, las ratas fueron evaluadas en las pruebas conductuales para verificar el efecto de los tratamientos, al quinto día postratamiento se volvieron a realizar las pruebas conductuales ya sin administrar el tratamiento para identificar o descartar la permanencia del daño inducido por la acetonacianohidrina.
MicroinyecciónSe utilizó una cánula guía (10mm de longitud, 0,7mm de Ø) construida a partir de una aguja calibre 32×7 (0,7×32mm) 22 G×1 1/4” de acero inoxidable, conectada a una jeringa Hamilton de 10μl por medio de un tubo de polietileno. Mediante una bomba de infusión automatizada (KD Scientific, Holliston, Massachusetts, EE. UU.) se microinyectó un volumen de 1μl a una velocidad constante de 0,1μl/min, durante 10min; bajo este procedimiento las ratas se mantuvieron en libre movimiento. Al concluir la microinyección, se dejó reposar la cánula inyectora durante 5 min más para permitir la difusión de la sustancia microinyectada y evitar que regresara por capilaridad. Inmediatamente, las ratas fueron evaluadas diariamente durante los 7 días consecutivos y al quinto día postratamiento en las pruebas conductuales.
Actividad locomotoraLa rata fue evaluada durante 5min en una caja de acrílico opaco (44×33×20cm) con la base dividida en cuadros de 11×11cm. Se evaluaron: a) número de cuadros cruzados, cuando la rata pasó al menos 3 cuartas partes de su cuerpo de un cuadro a otro; b) número de conducta vertical, definida como los periodos en los que la rata adquiere una postura vertical con respecto al piso, apoyada en sus extremidades posteriores. Los cuadros cruzados se tomaron como un indicador de actividad motora espontánea, mientras que la conducta vertical se utilizó para detectar posibles alteraciones en la coordinación motora.
Rota-rodLas ratas fueron entrenadas en un rota-rod (LE 8300, LSI Letica, Panlab Scientic Instruments, Barcelona, España), durante 5 días, previos a la microinyección de los tratamientos, a una velocidad de 18rpm. Las ratas se colocaron diariamente en el rota-rod después de la microinyección, en donde se evaluó la latencia a la caída, que es el periodo de tiempo que transcurre desde que la rata fue colocada en el rota-rod hasta que cayó del aparato. Esta variable permite identificar alteraciones en la coordinación motora y el equilibrio.
Prueba de nadoConsistió en colocar a la rata en un estanque de vidrio (26×29cm de base, por 50cm de altura) con agua (25±1°C). El nivel de agua se ajustó de manera que la rata pudiera tocar el fondo del estanque con las extremidades posteriores y la cola. En esta prueba se evaluó el número de giros, definidos como los periodos en los cuales la rata no tiene desplazamiento y nada girando sobre su propio eje11,12.
Todas las sesiones de prueba en actividad locomotora y nado fueron videograbadas. La cuantificación de las variables en campo abierto fue realizada por 2 observadores independientes hasta llegar a una concordancia de al menos el 95%. La cuantificación de la variable en la prueba de nado se realizó mediante un software (ANY-maze 4.73. Stoelting, Wood Dale, Illinois, EE. UU.), en el cual se analizaron automáticamente los vídeos.
Verificación del sitio de microinyecciónAl finalizar las pruebas conductuales, todos los animales fueron eutanizados por sobredosis de pentobarbital (PISA-Agropecuaria, Guadalajara, México) y perfundidos por vía intracardiaca con 100ml de solución salina fisiológica (NaCl al 0,9%), seguida de 100ml de formaldehído al 30% (J.T. Baker, Ecatepec, México). Se marcó el sitio de microinyección con azul de Evans, se extrajeron los cerebros y se realizaron cortes gruesos para verificar el sitio de microinyección bajo microscopio de luz y tomando como referencia el atlas estereotáxico de Paxinos y Watson9. Solo los datos obtenidos de las ratas en las que se identificó el correcto implante de las cánulas en CA1 de hipocampo fueron incluidos para el análisis estadístico.
Análisis estadísticoLos datos fueron analizados mediante ANOVA de 2 vías para muestras repetidas tomando como factores el tratamiento y los días de tratamiento. Cuando se alcanzaron valores de p ≤ 0,05 se aplicó la prueba post hoc de Student-Newman-Keuls. Los resultados son presentados como la media±error estándar.
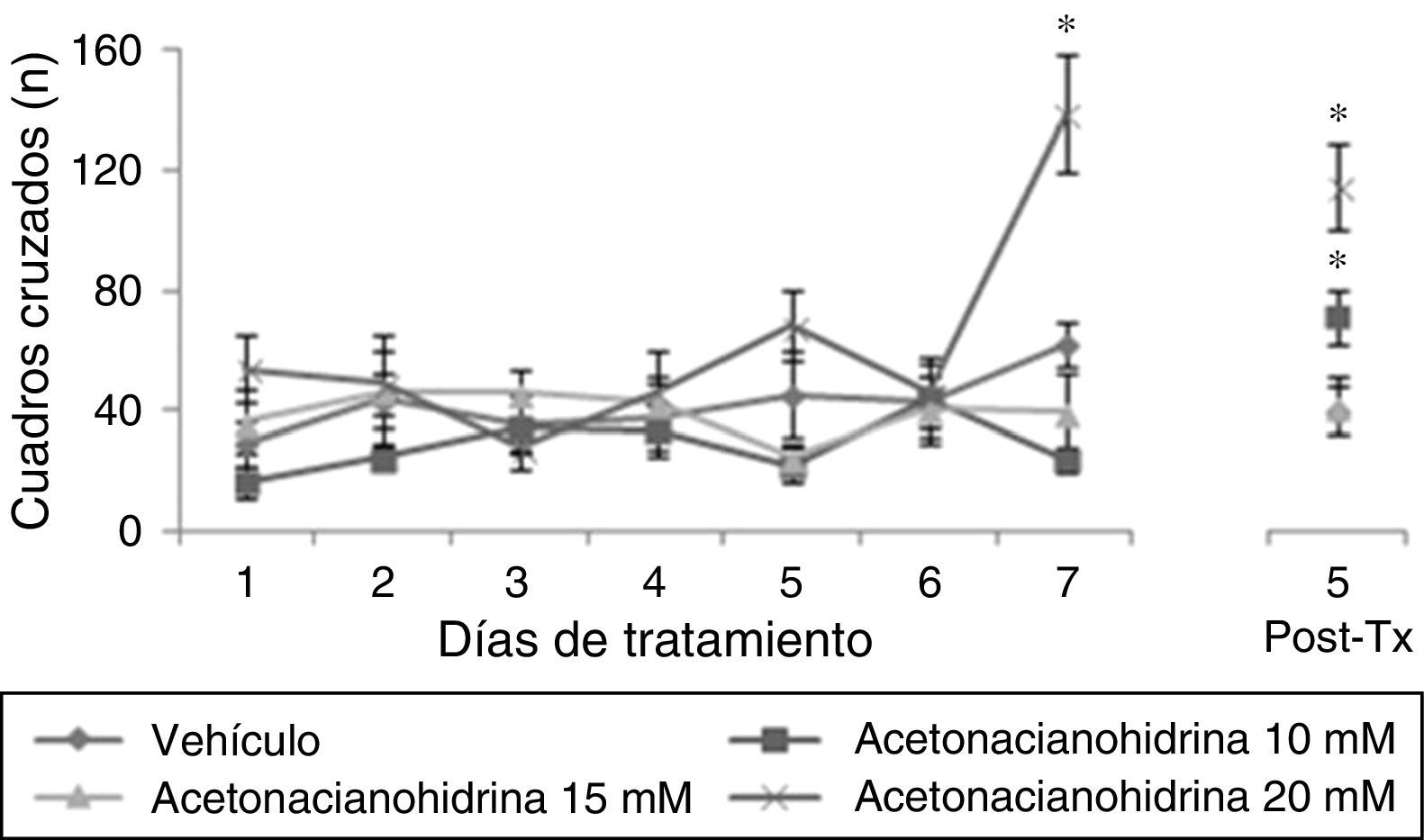
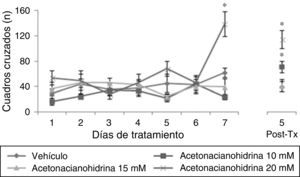
ResultadosActividad locomotoraEl análisis del número de cuadros cruzados reveló diferencias significativas de acuerdo con el tratamiento (F [3,177]=15.906, p<0,001), días de tratamiento (F [7,177]=5.878, p<0,001) y en la interacción de factores (F [21,177]=3.578, p<0,001). La prueba post hoc indicó que el grupo que recibió acetonacianohidrina 20mM cruzó un mayor número de cuadros cruzados en el días 7 de tratamiento que se mantuvo hasta el día 5 postratamiento, con respecto a los grupos vehículo y acetonacianohidrina 10 y 15mM, en el día respectivo (fig. 1).
Número de cuadros cruzados en actividad locomotora. El grupo acetonacianohidrina 20mM incrementó esta variable en el día 7 de tratamiento, con respecto al resto de los grupos en el mismo día.
Post-Tx: 5 días postratamiento.
*p< 0,001 vs. todos los grupos en el día 7 de tratamiento y 5 postratamiento.
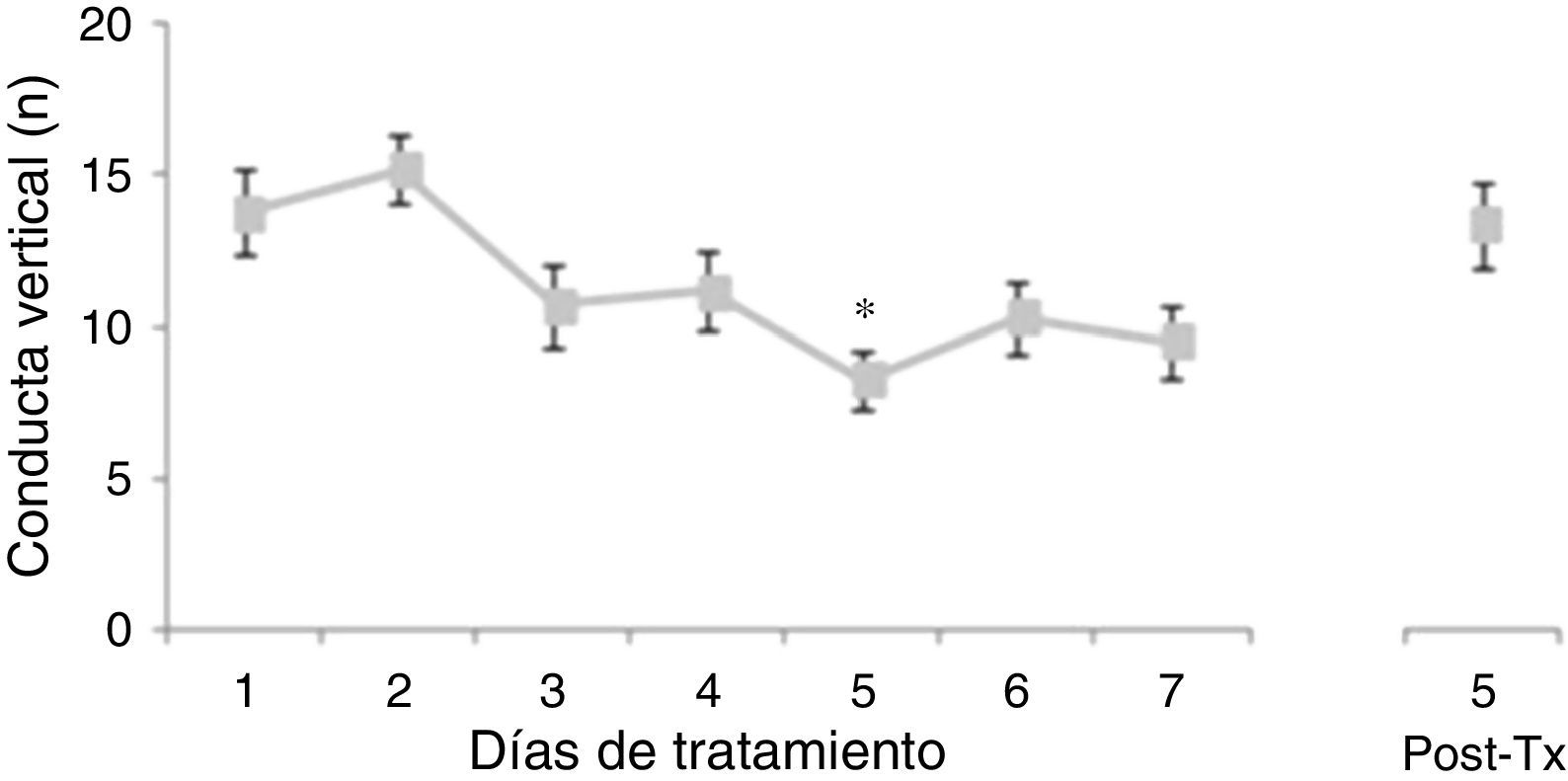
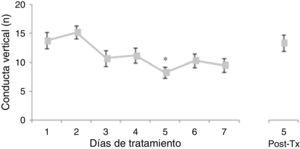
El análisis del número de conducta vertical no reveló diferencias significativas de acuerdo con el tratamiento (F [3,177]=0,645, p=0,578) ni con la interacción de factores (F [21,177]=0,796, p=0,723). No obstante, el análisis de acuerdo con los días de tratamiento reveló diferencias significativas (F [7,177]=3.437; p=0,002). La prueba post hoc reveló que el número de conducta vertical se redujo a partir del día 3 de tratamiento, alcanzando la diferencia significativa respecto a los días 1 y 2, lo cual se mantuvo hasta 5 días postratamiento (fig. 2).
Número de conducta vertical en la prueba de actividad locomotora. El número de conducta vertical disminuyó significativamente a partir del tercer día de tratamiento, alcanzándose el menor número de conductas verticales el día 5 de tratamiento.
*p<0,002 vs. días 1 y 2 de tratamiento.
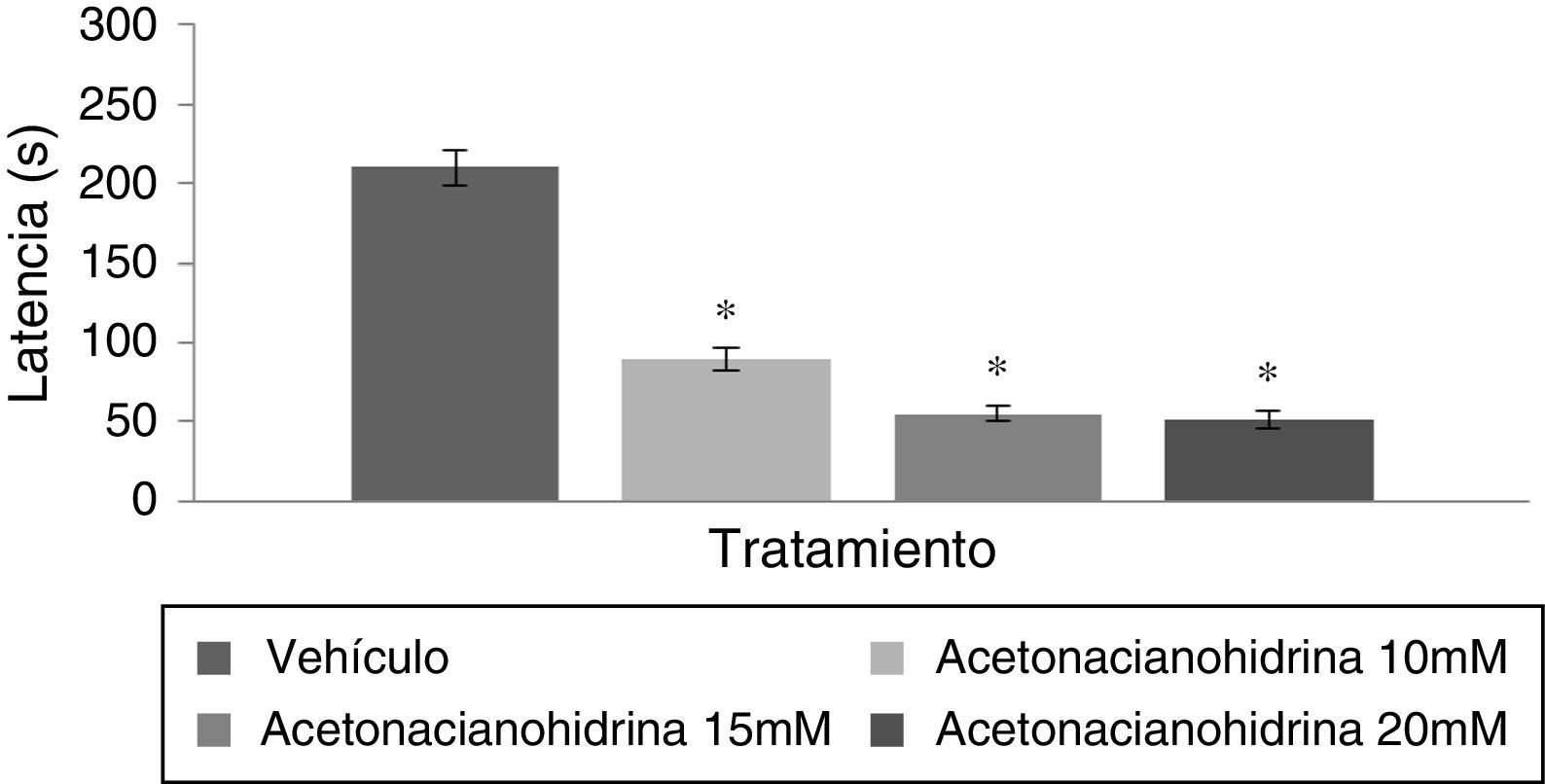
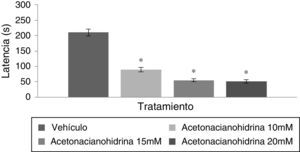
El análisis de la latencia a la caída del rota-rod reveló diferencias significativas entre tratamientos (F [3,192]=6.382, p<0,001); la prueba post hoc mostró que los grupos 10, 15 y 20mM tuvieron una latencia más corta a la caída del rota-rod con respecto al grupo vehículo. El grupo 20mM fue el que resistió menos tiempo en el rota-rod (fig. 3). Por otra parte, el análisis por días de tratamiento (F [7,192]=1.307; p=0,249) o por la interacción de factores (F [21,192]=0,342; p=0,997) no reveló diferencias significativas.
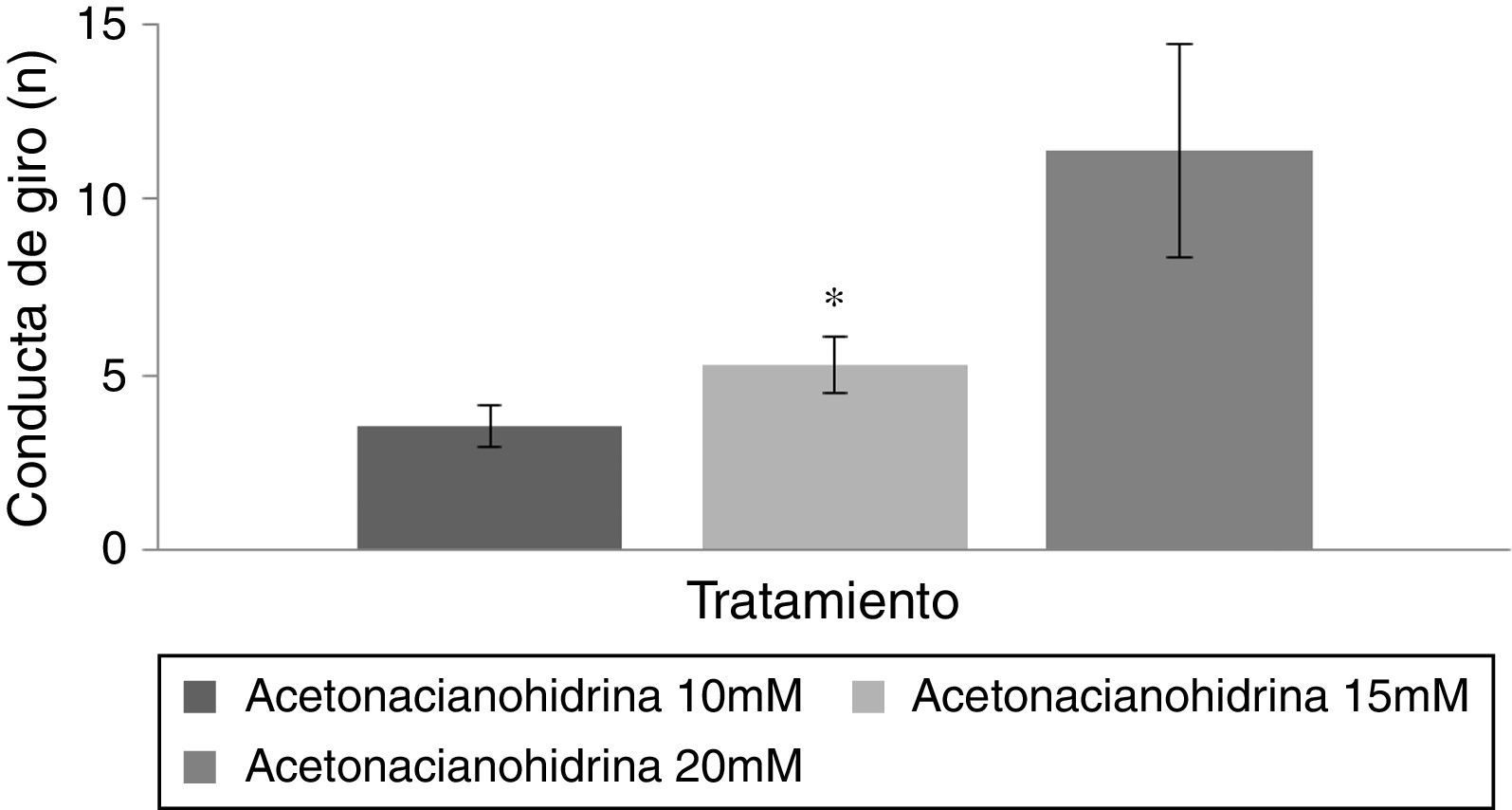
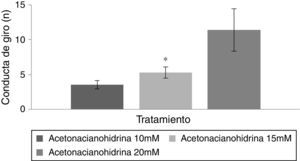
Prueba de nadoDebido a que el grupo vehículo no desplegó la conducta de giro, para el análisis estadístico solo se incluyeron los grupos acetonacianohidrina 10, 15 y 20mM.
Conducta de giroEl análisis del número de giros de acuerdo con el tratamiento reveló diferencias estadísticamente significativas (F [3,177]=8.840; p<0,001). La prueba post hoc indicó que el grupo acetonacianohidrina 20mM fue el que tuvo el mayor número de giros respecto al grupo acetonacianohidrina 10 y 15mM (fig. 4). En los días de tratamiento, el análisis no reveló diferencias significativas (F [7,177]=0,736; p=0,642). Finalmente, el análisis de la interacción de factores no reveló diferencias significativas (F [21,177]=0,560; p=0,940).
DiscusiónEn el presente estudio, la administración intrahipocampal de acetonacianohidrina produjo deterioro de la coordinación y la actividad motora en la rata, lo cual señala que este metabolito, al igual que otros compuestos contenidos en la yuca, pueden ser parte del sustrato neurotóxico asociado con el desarrollo de neuropatías en las personas que consumen la yuca y sus derivados bajo ciertas condiciones. La prueba de actividad locomotriz permite identificar cambios en la motricidad (hipoactividad o hiperactividad) y la exploración de la rata que permiten evidenciar posibles daños neurológicos (neuropatías periféricas) ocasionados en el sistema nervioso central por algunas sustancias tóxicas o fármacos13,14. En nuestro estudio, la prueba de actividad locomotriz permitió identificar las alteraciones en la función motora de las ratas, a través del análisis de su desplazamiento y la coordinación de sus movimientos, como ha sido identificado por otros autores15. Cuando existen lesiones a nivel hipocampal en ratas adultas, se producen alteraciones en conductas relacionadas con el sistema dopaminérgico, tales como el aumento en la actividad locomotora en ambiente novedoso y deficiencias en el aprendizaje y memoria16,17. En el presente trabajo se encontró que el grupo acetonacianohidrina 20mM incrementó la actividad motora espontánea en campo abierto; en este caso, la hiperactividad quizás está asociada con las acciones neurotóxicas de la acetonacianohidrina sobre el hipocampo impidiendo consolidar la memoria del animal, como se ha indicado para la linamarina en estudios previos5. En condiciones naturales, una rata evaluada repetidamente en la prueba de actividad locomotora reduce la actividad motora espontánea (cuadros cruzados, conducta vertical y acicalamiento), lo cual indica una habituación a las condiciones experimentales18. Mientras que en un animal con daño neuronal en el hipocampo, a pesar de ser evaluado repetidamente en campo abierto, se mantiene la actividad motora o incluso aumenta, lo cual indica un posible deterioro de la consolidación de la memoria que hace que el animal continúe explorando el ambiente novedoso18. Las personas con neuropatías asociadas al consumo de yuca desarrollan problemas de coordinación motriz19,20. En el presente estudio, se encontró que 10, 15 y 20mM de acetonacianohidrina promueven incoordinación motora y pérdida de equilibrio en el rota-rod, como ha sido reportado para otros compuestos neurotóxicos21.
Por otra parte, la microinyección intrahipocampal de acetonacianohidrina promovió la aparición de la conducta de giro en la prueba de nado, la cual fue disminuyendo conforme avanzaron los días de experimentación. Es importante señalar que la conducta de giro ha sido asociada a alteraciones en la coordinación motora de las extremidades de la rata y podría relacionarse con lo observado en pacientes con neuropatía atáxica tropical y konzo, específicamente por el desarrollo y la presencia de una parálisis lenta y progresiva de las extremidades inferiores y superiores22. Cabe mencionar que algunos compuestos presentes en la yuca pueden producir desmielinización de la médula espinal y ataxia asociada a falta de coordinación de las extremidades20. Así, la acetonacianohidrina podría contribuir al desarrollo de las alteraciones motoras asociadas al consumo de yuca a largo plazo, como ocurre en la neuropatía atáxica tropical y el konzo3.
En lo que respecta al efecto postratamiento, es decir, 5 días después de la última microinyección intrahipocampal, en la prueba de campo abierto, se mantuvo la hiperactividad motriz (incremento en el número de cuadros cruzados y de conducta vertical) en los animales del grupo acetonacianohidrina 20mM. En este caso, la hiperactividad exploratoria quizá esté relacionada con el daño neurotóxico que la acetonacianohidrina ejerce cuando es microinyectada sobre el área CA1 del hipocampo, afectando permanentemente al comportamiento exploratorio de la rata. Cabe mencionar que en estudios realizados por otros grupos de trabajo empleando roedores jóvenes se ha evidenciado que el daño en las neuronas piramidales del área CA1 del hipocampo produce alteraciones en el aprendizaje y la memoria espacial23, en las habilidades de locomoción y en estrategias de exploración y búsqueda24,25, mientras que otras investigaciones han indicado que puede deberse a cambios en la función y la morfología del hipocampo26, asociándolos con la disminución de la neurogénesis en esta región25. Lo anterior podría ser una explicación de cómo la acetonacianohidrina impide la consolidación de la memoria de la rata. Por otra parte, en la prueba de rota-rod se verificó que la lesión causada por la acetonacianohidrina, 5 días después de la microinyección intrahipocampal en los grupos (10, 15 y 20mM), afecta la coordinación y el equilibrio motor de la rata de manera permanente27, ya que disminuyeron de manera notable la latencia a la caída del rodillo giratorio en este día. Finalmente, en la prueba de nado, los animales de los grupos 15 y 20mM evaluados al 5.° día postratamiento ya sin la microinyección de los tratamientos, continuaron desplegando la conducta de giro, indicando un deterioro, una incoordinación y un desequilibrio motor persistentes inducidos por el daño neuronal causado por acetonacianohidrina sobre el hipocampo3,4,11. Finalmente, aunque en el presente estudio no se identificó el mecanismo por el cual ocurren las alteraciones motoras tras la microinyección de acetonacianohidrina en la región CA1 del hipocampo, es factible ofrecer una posible explicación. Diversas enfermedades neurológicas comparten características patológicas de una gradual y selectiva pérdida neuronal, además de que la mayor parte de ellas están relacionadas con alteraciones en el hipocampo. Esta estructura al contener la vía excitatoria glutamatérgica hipocampo-nucleus accumbens y al formar parte del sistema límbico tiene una función directa en la motivación para el inicio de las respuestas motoras asociadas a un evento motivado. Por lo anterior, se puede suponer que la aparición de conducta de nado lateral y giro en la prueba de nado resulta de la sobreactivación de los receptores glutamatérgicos en hipocampo tras su lesión química con acetonacianohidrina, sin descartar otras estructuras cerebrales. La pérdida de la integridad de las membranas neuronales da lugar a la pérdida de glutamato, lo cual contribuye a la activación prolongada de los receptores glutamatérgicos de las células vecinas28. A su vez, la entrada de calcio también estimula la liberación de glutamato por exocitosis, estableciéndose así un sistema de retroalimentación positiva que redunda en la sobreexcitación neuronal prolongada, llevando a la apoptosis neuronal29. Esto podría ser una posible explicación a las alteraciones motoras que pudiera inducir la acetonacianohidrina, un derivado de la yuca, en el hipocampo.
FinanciciónEste estudio fue apoyado parcialmente con recursos financieros del Cuerpo Académico Biología, Química y Funcionalidad Molecular de Metabolitos Vegetales (UV-CA-368) de la Universidad Veracruzana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.