Algunos fármacos resultan inconvenientes en pacientes con deterioro cognitivo. Se analiza su uso en 500 pacientes y se revisa la bibliografía.
DesarrolloLas benzodiacepinas producen dependencia y reducen la atención, memoria y agilidad motora. Pueden inducir desinhibición o agresividad, facilitan los episodios confusionales e incrementan los accidentes y la mortalidad en mayores de 60 años. En mayores de 65, la presión sistólica baja se asocia a deterioro cognitivo. Es recomendable mantenerla en 130-140 mmHg (145 en ≥ 80 años). La colesterolemia < 160mg/dl se asocia a mayor morbimortalidad, agresividad y suicidio, y el colesterol unido a las lipoproteínas de alta densidad (c-HDL) < 40mg/dl empeora la memoria y aumenta el riesgo vascular y la mortalidad. La edad avanzada predispone para que los opioides produzcan alteración cognitiva y confusión. En demencias no Alzheimer y no asociadas a Parkinson, deterioro cognitivo ligero y enfermedades psiquiátricas, los efectos adversos de anticolinesterásicos y memantina probablemente superan al beneficio. La alteración cognitiva por anticolinérgicos de acción preferentemente periférica también es posible. Hay que conocer la demencia o psicosis por corticoides, y saber que la polifarmacia facilita el síndrome confusional. El 70,4% de 500 pacientes con disfunción cognitiva analizados recibía polifarmacia y el 42%, benzodiacepinas. Los que compartían ambas situaciones representaron el 74,3% de los casos en los que se sospechó iatrogenia.
ConclusionesEn personas con edad avanzada o deterioro cognitivo, es necesario evitar la polifarmacia innecesaria y tener presente que las benzodiacepinas, los opioides y los anticolinérgicos producen frecuentemente alteraciones cognitivas y conductuales. Además, deben evitarse la presión sistólica < 130 mmHg, el colesterol < 160mg/dl y el colesterol HDL < 40mg/dl.
Some treatments are inappropriate for patients with cognitive decline. We analyse their use in 500 patients and present a literature review.
DevelopmentBenzodiazepines produce dependence, and reduce attention, memory, and motor ability. They can cause disinhibition or aggressive behaviour, facilitate the appearance of delirium, and increase accident and mortality rates in people older than 60. In subjects over 65, low systolic blood pressure is associated with cognitive decline. Maintaining this figure between 130 and 140mm Hg (145 in patients older than 80) is recommended. Hypocholesterolaemia<160mg/dl is associated with increased morbidity and mortality, aggressiveness, and suicide; HDL-cholesterol<40mg/dl is associated with memory loss and increased vascular and mortality risks. Old age is a predisposing factor for developing cognitive disorders or delirium when taking opioids. The risks of prescribing anticholinesterases and memantine to patients with non-Alzheimer dementia that is not associated with Parkinson disease, mild cognitive impairment, or psychiatric disorders probably outweigh the benefits. Anticholinergic drugs acting preferentially on the peripheral system can also induce cognitive side effects. Practitioners should be aware of steroid-induced dementia and steroid-induced psychosis, and know that risk of delirium increases with polypharmacy. Of 500 patients with cognitive impairment, 70.4% were on multiple medications and 42% were taking benzodiazepines. Both conditions were present in 74.3% of all suspected iatrogenic cases.
ConclusionsPolypharmacy should be avoided, if it is not essential, especially in elderly patients and those with cognitive impairment. Benzodiazepines, opioids and anticholinergics often elicit cognitive and behavioural disorders. Moreover, systolic blood pressure must be kept above 130mm Hg, total cholesterol levels over 160mg/dl, and HDL-cholesterol over 40mg/dl in this population.
Existen pautas de tratamiento que resultan aparentemente lógicas y, aplicadas a una persona de edad avanzada, o con enfermedad vascular cerebral, o con deterioro cognitivo ligero o demencia, tienen efectos nocivos. En este artículo se revisan los inconvenientes de tratar a determinados pacientes con benzodiacepinas (BZD), analgésicos opioides (AOP) o fármacos anticolinérgicos (AC), y los riesgos de ser muy estrictos con el tratamiento hipolipemiante o hipotensor.
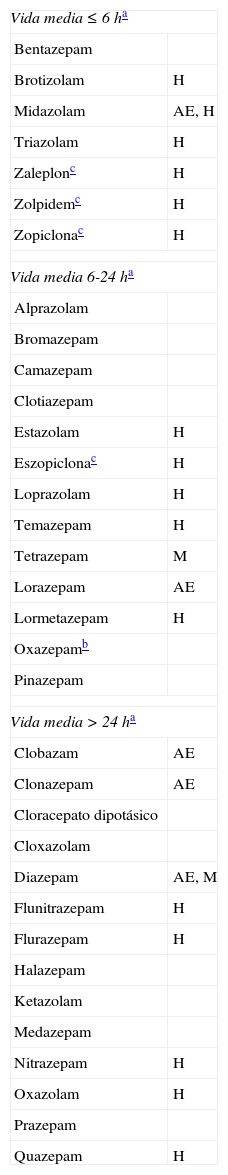
Desarrollo¿Son las benzodiacepinas la mejor elección para tratar la ansiedad, la agitación o el insomnio?En muchas situaciones clínicas, las BZD y los hipnóticos análogos representan el paradigma terapéutico de primera elección para combatir la ansiedad, el insomnio y otros síntomas relacionados. Existen principios activos de esta categoría con acción breve, intermedia o prolongada, algunos con propiedades miorrelajantes o anticonvulsivantes destacadas, y con diversa potencia sedativa o hipnótica (tabla 1). A partir de este abanico de propiedades, con un poco de destreza se controlan los síntomas diana. El feedback a corto plazo del enfermo y de sus convivientes, generalmente expresa satisfacción, lo cual incrementa la confianza del médico en esta prescripción. Eso contribuye a explicar por qué el consumo de BZD se ha incrementado paulatinamente. Atendiendo a una publicación de la Agencia Española de Medicamentos y Productos Sanitarios1, en 1992 se consumieron 30,25 DDD/1.000 habitantes (DDD=dosis diaria definida, o dosis teóricamente óptima de mantenimiento para una indicación determinada), mientras que en 2006 la cifra alcanzó las 62,14 DDD/1.000 habitantes (aumento del 105%). Los hipnóticos análogos a las BZD (zaleplon, zolpidem, zopiclona) pasaron de 1,64 a 6,71 DDD/1.000 habitantes (aumento del 309%).
Principales benzodiacepinas e hipnóticos análogos
| Vida media ≤ 6 ha | |
| Bentazepam | |
| Brotizolam | H |
| Midazolam | AE, H |
| Triazolam | H |
| Zaleplonc | H |
| Zolpidemc | H |
| Zopiclonac | H |
| Vida media 6-24 ha | |
| Alprazolam | |
| Bromazepam | |
| Camazepam | |
| Clotiazepam | |
| Estazolam | H |
| Eszopiclonac | H |
| Loprazolam | H |
| Temazepam | H |
| Tetrazepam | M |
| Lorazepam | AE |
| Lormetazepam | H |
| Oxazepamb | |
| Pinazepam | |
| Vida media>24 ha | |
| Clobazam | AE |
| Clonazepam | AE |
| Cloracepato dipotásico | |
| Cloxazolam | |
| Diazepam | AE, M |
| Flunitrazepam | H |
| Flurazepam | H |
| Halazepam | |
| Ketazolam | |
| Medazepam | |
| Nitrazepam | H |
| Oxazolam | H |
| Prazepam | |
| Quazepam | H |
AE: anticonvulsivante y antiepiléptica; H: acción hipnótica destacada; M: acción miorrelajante destacada.
Es necesario conocer los inconvenientes que acarrea el uso indiscriminado de estos productos. Actúan sobre los receptores GABAA, con acción inhibidora sobre múltiples funciones cerebrales. Reducen la atención, algunos aspectos de la memoria, la velocidad de procesamiento mental y la agilidad motora2,3. Desde los primeros días de tratamiento4 incrementan la incidencia de caídas y fracturas óseas4–6, tanto más cuanto mayor sea la edad, la dosis y la vida media del fármaco4,6. Además, elevan la incidencia de accidentes (de tráfico, en el hogar, deportivos y laborales)3,7. También pueden inducir efectos paradójicos, como conductas desinhibidas o agresivas8. Por otra parte, las BZD (y los hipnóticos análogos) producen un efecto amnésico anterógrado, agravan el deterioro mnésico en las personas que ya lo tienen9 y facilitan los episodios confusionales10. Diversos expertos concluyen que, en la población mayor de 60 años, los efectos adversos de los hipnóticos superan al beneficio que consiguen, además de incrementarse la mortalidad11,12. En las personas con edad avanzada y en cualquiera con deterioro cognitivo, la prescripción de BZD puede resultar conveniente para tratar un episodio de agitación. No obstante, si el tratamiento se prolonga 3 semanas o más, el paciente podría desarrollar dependencia (fenómenos de tolerancia farmacológica y síntomas de abstinencia por la supresión)13, y algunos efectos colaterales aparecen en un plazo inferior4. Así pues, cuando el trastorno conductual es continuado o muy frecuente, sería preferible establecer otros tratamientos de mantenimiento. Entre estos cabe mencionar los anticonvulsivantes estabilizadores del ánimo, como por ejemplo la pregabalina, una de cuyas indicaciones es el trastorno de ansiedad generalizada14,15; o antidepresivos con acción ansiolítica o sedante, como el escitalopram16, venlafaxina17, duloxetina18, trazodona19,20 o mirtazapina21, especialmente si hubiera síntomas depresivos asociados; o la melatonina, para combatir alteraciones de la conducta relacionadas con cambios en el ritmo circadiano22; o neurolépticos atípicos con experiencia en este tipo de enfermos, como la quetiapina en dosis baja (12,5 a 200mg/día, o.d. o b.i.d.)23; estos últimos serían más efectivos si el paciente mostrara también ideación delirante o alucinaciones. Estos neurolépticos deben seleccionarse adecuadamente y su uso no debe prolongarse mucho tiempo, debido a los efectos adversos previsibles para cada uno de ellos y el posible incremento de la mortalidad asociado24–26. Sea cual sea el tratamiento, es necesario revisar frecuentemente al enfermo, para reducir la dosis o suprimir el fármaco en cuanto sea posible. También son útiles tratamientos de apoyo no farmacológicos27.
En un fichero reciente de 500 pacientes (19 a 104 años [media 75,2, mediana 77]), correspondiente a una consulta de neurología cognitiva (todos con disfunción cognitiva, 141 con criterios de demencia), se ha realizado un recuento de los que tomaban alguna BZD o hipnótico análogo cuando fueron atendidos por primera vez. En las tablas 2–5 figuran los resultados. Un porcentaje elevado de pacientes tomaba esta medicación (42%), de forma más frecuente en las mujeres y en todos los grupos de diagnóstico (tabla 4). En el 74,2% de los enfermos con este tratamiento, el facultativo estimó que intervenía en la etiología de los síntomas cognitivos, y en el 86,7% de todos los pacientes en quienes los síntomas fueron considerados total o parcialmente iatrógenos, intervenían las BZD (tabla 4).
Edad, sexo y grupos de diagnóstico de los 500 pacientes seleccionados
| M | S | DEGEN | VASC | IATR | OTRO_DX |
| 318 (63,6) | 430 (86) | 64 (12,8) | 338 (67,6) | 180 (36) | 143 (28,6) |
Entre paréntesis figura el porcentaje.
DEGEN: diagnóstico clínico de enfermedad degenerativa; IATR: se considera que en la causa de los síntomas cognitivos interviene un efecto adverso de la medicación; M: mujer; OTRO_DX: cualquier diagnóstico etiológico del deterioro cognitivo no degenerativo, vascular ni iatrógeno; S: 65 años o más; VASC: diagnóstico clínico de enfermedad vascular cerebral.
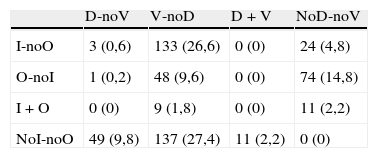
Distribución de los diagnósticos especificando los casos de origen combinado (entre paréntesis figura el porcentaje)
| D-noV | V-noD | D+V | NoD-noV | |
| I-noO | 3 (0,6) | 133 (26,6) | 0 (0) | 24 (4,8) |
| O-noI | 1 (0,2) | 48 (9,6) | 0 (0) | 74 (14,8) |
| I+O | 0 (0) | 9 (1,8) | 0 (0) | 11 (2,2) |
| NoI-noO | 49 (9,8) | 137 (27,4) | 11 (2,2) | 0 (0) |
D: diagnóstico clínico de enfermedad degenerativa; I: se considera que en la causa de los síntomas cognitivos interviene un efecto adverso de la medicación; O: cualquier diagnóstico etiológico del deterioro cognitivo no degenerativo, vascular ni iatrógeno; V: diagnóstico clínico de enfermedad vascular cerebral.
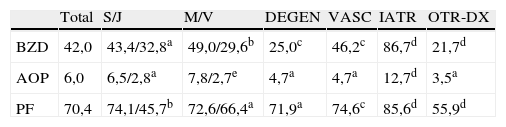
Distribución en los 500 pacientes de los tipos de tratamiento observados (los datos corresponden a porcentaje)
| Total | S/J | M/V | DEGEN | VASC | IATR | OTR-DX | |
| BZD | 42,0 | 43,4/32,8a | 49,0/29,6b | 25,0c | 46,2c | 86,7d | 21,7d |
| AOP | 6,0 | 6,5/2,8a | 7,8/2,7e | 4,7a | 4,7a | 12,7d | 3,5a |
| PF | 70,4 | 74,1/45,7b | 72,6/66,4a | 71,9a | 74,6c | 85,6d | 55,9d |
DEGEN: diagnóstico clínico de enfermedad degenerativa; IATR: se considera que en la causa de los síntomas cognitivos interviene un efecto adverso de la medicación; J: menor de 65 años; M: mujer; OTR_DX: cualquier diagnóstico etiológico del deterioro cognitivo no degenerativo, vascular ni iatrógeno; PF: polifarmacia; S: mayor de 64 años; V: varón; VASC: diagnóstico clínico de enfermedad vascular cerebral.
Prueba χ2: ano significativo; bp<0,001 (S frente a J y M frente a V); cp<0,05; dp<0,001 (del porcentaje expresado frente al complementario de pacientes con ese mismo diagnóstico que no toman el tratamiento); ep<0,05 (M frente a V).
La hipertensión arterial en la edad media de la vida aumenta el riesgo de presentar demencia en la edad avanzada28, y es probable que su tratamiento reduzca ese riesgo29. No obstante, el rango óptimo en el que deberían mantenerse las presiones sistólica y diastólica se ha ido modificando a lo largo del tiempo y aún es objeto de debate30.
Existe una asociación entre la presión arterial baja, sistólica o diastólica, y el deterioro cognitivo, especialmente en la edad avanzada31–33. La presión sistólica tiene mayor relevancia en este aspecto28,31. La atención y las funciones ejecutivas resultan más sensibles a las alteraciones de la presión arterial que otras funciones cognitivas, como el lenguaje o la memoria34.
Los pacientes con fracción de eyección cardíaca deficiente muestran alteración cognitiva y reducción de la agilidad motora, por hipoperfusión cerebral. Estas deficiencias son más acusadas cuando además tienen hipotensión sistólica35.
En un documento de consenso de expertos de academias de Cardiología, Neurología, Geriatría, Hipertensión y Nefrología, se considera deseable que la presión arterial sistólica no supere los 140mmHg en las personas de 65 a 79 años, y mantenerla entre 140 y 145 si la edad es ≥ 80 años36. La mayoría de los autores que revisan este tema recomiendan que la presión sistólica en estas personas no sea inferior a 130mm Hg, salvo si el paciente tiene simultáneamente insuficiencia cardíaca y coronaria.
¿Debemos reducir la colesterolemia todo lo posible para aminorar el riesgo cardiovascular?La hipercolesterolemia prolongada incrementa el riesgo de desarrollar enfermedad coronaria e ictus cerebral37. Su tratamiento resulta claramente beneficioso en la prevención secundaria de los eventos relacionados con la enfermedad coronaria. En la prevención primaria de los accidentes vasculares coronarios o cerebrales la eficacia es menos evidente, especialmente en las personas mayores de 75 años, y el tratamiento debe establecerse de forma más selectiva, en función del grado de riesgo38,39.
Por otra parte, la hipocolesterolemia (< 160mg/dl) resulta nociva para la salud mental y tiene relación con una mayor morbimortalidad40,41. Se ha observado su asociación con agresividad y mayor incidencia de suicidio42. En algunos estudios se ha notado que reducir el colesterol asociado a lipoproteínas de baja densidad (c-LDL) por debajo de 120mg/dl no reduce el riesgo cardiovascular43. Por otra parte, el decremento excesivo del colesterol asociado a lipoproteínas de alta densidad (c-HDL<40mg/dl) empeora la memoria44 y aumenta el riesgo de ictus cerebral y de enfermedad coronaria, sobre todo en diabéticos, así como la mortalidad45,46. Por tanto, en pacientes con dislipidemia debe ajustarse el tratamiento con una estatina para mantener la colesterolemia entre 160 y 200mg/dl y, si hay deficiencia de c-HDL, deben añadirse niaciana o fibratos39.
¿Debemos ser radicales en el tratamiento del dolor crónico?El dolor crónico es frecuente en las personas de edad avanzada y reduce la calidad de vida47. Además de intentar corregir la causa, el tratamiento sintomático incluye consejos adecuados y medicación, que puede ser oral, tópica o aplicada mediante infiltraciones en el tejido doloroso48. El tratamiento farmacológico engloba analgésicos simples (como paracetamol o metamizol), AOP (mayores -morfina, hidromorfona, buprenorfina, metadona, fentanilo, oxicodona, meperidona, tapentadol- y menores -tramadol, codeína, dihidrocodeína, dextropropoxifeno-), antiinflamatorios y otros medicamentos adyuvantes. Estos incluyen fármacos coanalgésicos y coadyuvantes. Los primeros mejoran determinado tipo de dolor, como algunos anticonvulsivantes (pregablalina, gabapentina, lamotrigina, carbamacepina, oxcarbazepina, clonazepam, topiramato), algunos antidepresivos (especialmente los tricíclicos -sobre todo la amitriptilina-, los inhibidores selectivos de la recaptación de serotonina y noradrenalina -duloxetina, venlafaxina- y la mirtazapina) y algunos miorrelajantes (baclofeno, tizanidina). Los fármacos coadyuvantes mejoran de forma indirecta el dolor o su repercusión (ansiolíticos y antidepresivos no analgésicos cuando hay un componente de ansiedad o depresión, miorrelajantes si hay contractura muscular, antibióticos si hay infección, laxantes si hay estreñimiento, etc.). Al prescribir medicación adyuvante, debemos recordar los inconvenientes ya referidos del tratamiento con BZD, y tener en cuenta que los antidepresivos tricíclicos tienen un efecto AC, que puede empeorar el estado cognitivo de las personas de edad avanzada o con cualquier proceso nosológico que curse con deficiencia colinérgica, además de facilitar la hipotensión ortostática o complicaciones graves en pacientes con arritmia o bloqueo cardíaco. Además, combinaciones como tramadol y antidepresivos pueden provocar en algún caso un síndrome serotoninérgico49.
El uso correcto de los fármacos analgésicos, incluidos los AOP, en enfermos con dolor prolongado, puede mejorar la capacidad funcional y de relación social de las personas mayores50. En el último cuarto de siglo han llegado al mercado AOP de fácil uso y con una tolerabilidad gradualmente mejor, desde la hidromorfona (morfina oral de liberación sostenida), pasando por el tramadol oral y el fentanilo en parche transdérmico, hasta el tapentadol. Este último, por su doble mecanismo opioide e inhibidor de la recaptación de noradrenalina, logra ser efectivo con menos efectos colaterales. Esta evolución de la farmacopea antiálgica opioide supuso que de 1992 a 2006 se incrementase el uso de estos fármacos en España un 1.284% (de 0,32 a 4,43 DDD/1.000 habitantes)51.
En las personas de edad avanzada, los AOP pueden alterar la cognición y la percepción, sobre todo si tienen insuficiencia renal o deshidratación52. También pueden resultar peligrosos en pacientes con una alteración respiratoria de base y en los que reciben tratamientos que producen depresión respiratoria52. Los posibles efectos adversos y la capacidad de generar dependencia de los AOP inducen a reservarlos para tratar el dolor (agudo o crónico) que no se controla con otros procedimientos antiálgicos.
En revisiones sobre el síndrome confusional agudo iatrógeno, se ha observado que los AOP incrementan el riesgo de desarrollarlo (entre doble y triple) en pacientes susceptibles10. Se consideran factores de susceptibilidad tener más de 65 años, deterioro cognitivo, enfermedad grave, una fractura de cadera en fase aguda, desnutrición o deshidratación, adicción a bebidas alcohólicas u otras drogas, deficiencia sensorial (visual o auditiva), privación de sueño e inactividad prolongada53. Los factores precipitantes incluyen el dolor intenso, las infecciones, la privación de alcohol o de drogas adictivas, el estrés, diversos procedimientos médicos y las alteraciones electrolíticas. Además, Solomon et al.54 han detectado que el tratamiento con AOP en las personas de edad avanzada se acompaña de un mayor riesgo de sufrir accidentes cardiovasculares o fracturas óseas, y de mayor mortalidad, si se compara con el uso de antiinflamatorios no esteroideos.
Por tanto, los AOP deben evitarse siempre que otros recursos alternativos obtengan una eficacia razonable para controlar el dolor, sobre todo en pacientes de edad avanzada y en los que tienen deterioro de funciones cognitivas. Si las alternativas disponibles no son eficaces, teniendo en cuenta que el propio dolor es un desencadenante de delirium, se puede recurrir a este tipo de analgésicos. En este caso, se debe tener en cuenta que dosis bajas o moderadas (equivalentes a menos de 40mg/día de morfina) mejoran más la calidad de vida que las dosis elevadas55. Además, muchas personas mayores requerirán un ajuste a la baja de la dosis, debido a la comorbilidad y a la interacción con otros medicamentos48. En todo caso, los pacientes deberán ser revisados con frecuencia, para detectar sin dilación la aparición de efectos adversos.
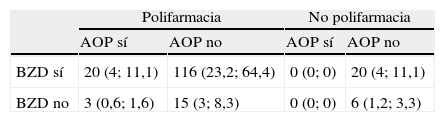
En el grupo de 500 enfermos aquí analizados, 30 tomaban AOP (6%), con mayor frecuencia mujeres (tabla 4). En 23 de ellos (todos en un marco de polifarmacia) se consideró que el tratamiento tenía parte de responsabilidad en la génesis de los síntomas cognitivos (12,7% de los casos con componente iatrógeno) (tablas 4–6).
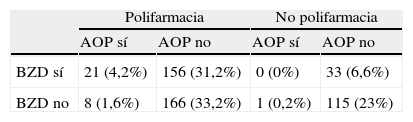
Distribución de los tipos de tratamiento observados en los 180 pacientes en los que se consideró que la medicación intervenía en la causa de los síntomas cognitivos
| Polifarmacia | No polifarmacia | |||
| AOP sí | AOP no | AOP sí | AOP no | |
| BZD sí | 20 (4; 11,1) | 116 (23,2; 64,4) | 0 (0; 0) | 20 (4; 11,1) |
| BZD no | 3 (0,6; 1,6) | 15 (3; 8,3) | 0 (0; 0) | 6 (1,2; 3,3) |
X (y; z): X=número de pacientes; y=porcentaje sobre los 500 pacientes de la muestra; z=porcentaje sobre los 180 pacientes en los que figura la iatrogenia entre los diagnósticos.
Cuando una persona cumple criterios clínicos de enfermedad de Alzheimer (EA), debe iniciar tratamiento con un inhibidor de colinesterasas (IC), salvo que concurran circunstancias que lo contraindiquen. La memantina se prescribe cuando la demencia alcanza la fase intermedia. El diagnóstico clínico de una EA típica se basa en comprobar que el paciente sufre una «amnesia hipocámpica» (dificultad para el registro de nueva información), y en las pruebas complementarias se detecta un marcador de la fisiopatología de la enfermedad (reducción del β-amiloide 42 e incremento de fosfo-tau en el líquido cefalorraquídeo, hipoactividad temporoparietal en neuroimagen funcional, atrofia de la región hipocámpica en neuroimagen estructural). En la práctica asistencial actual, y quizá mientras no exista en el mercado un fármaco modificador del curso de la enfermedad, lo más habitual es comprobar la alteración referida de la memoria episódica y, en una resonancia magnética, objetivar el adelgazamiento de los hipocampos y la ausencia de otras lesiones cerebrales que justifiquen todos los síntomas.
La EA no es la única causa de «amnesia hipocámpica». Los hipocampos y sus circuitos límbicos pueden alterarse, produciendo los síntomas amnésicos correspondientes, en pacientes con anoxia, isquemia, encefalitis herpética, traumatismo, cirugía, enfermedades autoinmunes (por ejemplo, neurolupus o encefalitis límbica autoinmune), neoplasia e hipotiroidismo56–59. Por tanto, el diagnóstico de EA no puede fundamentarse únicamente en la exploración neuropsicológica. Por otra parte, el hallazgo en la resonancia magnética de una atrofia de los hipocampos no significa que exista necesariamente una EA subyacente. La alteración puede corresponder a una esclerosis de los hipocampos de otra etiología (vascular, anóxica, por taupatía inespecífica o idiopática)60, a la edad avanzada61, enfermedad de Cushing u otro exceso crónico de actividad glucocorticoide (como en la depresión mayor recurrente y algunas situaciones de trastorno por estrés postraumático prolongado)62,63, pérdida crónica de la función vestibular64, tratamiento prolongado con ácido valproico65, antecedente de evento hipóxico o isquémico perinatal66, o a causa desconocida67. En la demencia vascular subcortical isquémica también se produce atrofia de los hipocampos68.
Los ensayos con IC en pacientes con deterioro cognitivo ligero han revelado que no reducen la progresión a demencia y sí producen más efectos adversos que el placebo69. En particular, cuadruplican el riesgo de síncope70. En pacientes con demencia vascular pura, donepecilo y galantamina mejoran la cognición, pero no todos los aspectos examinados de la capacidad funcional71,72. La rivastigmina tampoco resulta eficaz, y los efectos adversos vasculares y la mortalidad se incrementan73. La British Association for Psychopharmacology desaconsejó en 2011 el uso de estos fármacos en la demencia frontotemporal74. Los IC solo han conseguido indicación oficial, o recomendación en guías terapéuticas, para tratar la EA, la demencia asociada a enfermedad de Parkinson y la demencia con cuerpos de Lewy. La prescripción a enfermos con otras entidades como el síndrome de Down, parálisis supranuclear progresiva, enfermedad de Huntington, esclerosis múltiple, epilepsia, síndrome confusional agudo, daño cerebral traumático, trastornos del sueño, esquizofrenia o trastorno bipolar, no cuenta con un soporte científico suficiente que la respalde75. Antes de decidir la prescripción fuera de indicación, debería sopesarse el riesgo de efectos adversos a los que se expone el paciente. La estimulación colinérgica del córtex cerebral, estriado y tronco del encéfalo, así como el incremento de la actividad colinérgica periférica, pueden dar lugar a síntomas cognitivo-conductuales (confusión, agitación, ansiedad), extrapiramidales (temblor), del sueño (somnolencia, insomnio, pesadillas), cardiorrespiratorios (bradicardia, síncope, exacerbación de síntomas asmáticos o de enfermedad pulmonar obstructiva crónica) y digestivos (náuseas, vómitos, diarrea, dolor abdominal, anorexia, pérdida de peso), además de debilidad y calambres musculares o incontinencia urinaria, entre otros70,76,77. Las personas de edad avanzada y las que toman un antipsicótico (clásico o atípico) son más proclives a desarrollar efectos adversos graves78.
En muchos estados patológicos del sistema nervioso, la excitotoxicidad contribuye al daño funcional y estructural. Por esa razón, la memantina ha mostrado efectos neuroprotectores, experimentalmente, en situaciones como la isquemia cerebral, hemorragia cerebral intraparenquimatosa, demencia asociada al VIH, traumatismo craneoencefálico, intoxicaciones por insecticidas de carbamato, glaucoma, enfermedad de la neurona motora, enfermedad de Huntington, enfermedad de Parkinson y EA. Por el momento, solo en esta última enfermedad se ha acumulado evidencia clínico-terapéutica suficiente para alcanzar oficialmente la indicación para este tratamiento. En los pacientes con EA de grado ligero, los ensayos realizados con memantina no mostraron efectos beneficiosos significativos79. En pacientes con enfermedad de Parkinson y demencia o demencia con cuerpos de Lewy mejoró significativamente la impresión clínica global, pero no la cognición o la autonomía funcional80,81. Por el contrario, en la demencia vascular incipiente o moderada se ha observado un efecto positivo de la memantina sobre la cognición, pero no se traduce en una mejoría significativa de la impresión clínica global o de la autonomía funcional82,83. En un ensayo piloto con pacientes que padecían enfermedad de Huntington, la memantina produjo mejoría de los movimientos coreicos, pero no de la cognición, la conducta o la capacidad funcional84. En un ensayo de fase II, la memantina no produjo mejoría de funciones neuropsicológicas en pacientes con deterioro cognitivo asociado al VIH85. En otro ensayo con pacientes que presentaban esclerosis lateral amiotrófica, no se apreció eficacia del tratamiento con memantina86. Debido a que existe un desequilibrio glutamatérgico en la esquizofrenia y en trastornos del estado de ánimo, de ansiedad y obsesivo-compulsivos, se ha estudiado (y a veces se prescribe fuera de indicación) el tratamiento con memantina en pacientes con depresión, trastorno bipolar, esquizofrenia, trastorno generalizado del desarrollo, trastorno obsesivo-compulsivo, bulimia y adicción a sustancias. Algunos resultados muestran posible beneficio del tratamiento, por ejemplo en pacientes alcohólicos o con esquizofrenia catatónica. Sin embargo, el grado de evidencia es insuficiente, ya que hay pocos estudios amplios y los resultados son frecuentemente contradictorios87. Antes de decidir la prescripción fuera de indicación, debe valorarse que, aunque la memantina se tolera bien generalmente, puede producir síntomas como cefalea y estreñimiento76, y es posible que incremente ligeramente el riesgo de convulsiones.
MisceláneaResulta lógico que los AC de acción preferentemente cerebral, como los antiparkinsonianos (orfenadrina, biperideno, trihexifenidilo, benztropina, prociclidina, tetrabenacina), sean perjudiciales para la cognición de pacientes con enfermedades que provocan deficiencia colinérgica (EA, demencia con cuerpos de Lewy y algunos casos de demencia vascular, entre otras). También pueden alterar la cognición o la conducta de cualquier persona de edad avanzada, por tener una deficiencia colinérgica debida a la reducción fisiológica de la celularidad en los núcleos colinérgicos y de la densidad de receptores muscarínicos. Es menos conocido que algunos AC con acción periférica más selectiva pueden atravesar la barrera hematoencefálica y producir un efecto de ese tipo, y aún resulta más insospechado cuando se administran por vía inhalatoria o tópica88. Tal es el caso de fármacos contra la vejiga hiperactiva, y entre ellos existen diferencias. El abanico va de la oxibutinina, que atraviesa más fácilmente la barrera y se tolera peor que los demás, hasta el cloruro de trospio, que apenas penetra al sistema nervioso central89. Los colirios AC90, la atropina sublingual para reducir la sialorrea de la enfermedad de Parkinson y del enfermo terminal91,92, o la escopolamina para reducir secreciones bronquiales en este último o para prevenir la cinetosis92,93, son tratamientos poco frecuentes con posibles efectos AC centrales y periféricos. Se conocen casos de delirium por broncodilatadores AC inhalados, pero son excepcionales, porque la absorción a la sangre es muy reducida. Se ha detectado algo de acción AC en fármacos que pertenecen a otros grupos farmacológicos (AOP, antidepresivos tricíclicos, antihistamínicos, antipsicóticos, BZD, algunos antibióticos e inmunosupresores, captopril, ciproheptadina, clortalidona, codeína, corticosteroides, furosemida, digoxina, diltiazem, dinitrato de isosorbida, dipiridamol, disopiramida, hidroclorotiacida, metoclopramida, nifedipino, paroxetina, quinidina, ranitidina, teofilina, triamtereno, warfarina). Estos fármacos pueden ejercer una acción AC coadyuvante si se asocian entre sí o a otros AC más potentes89,94.
Merece mención que el tratamiento con esteroides (incluso con budesónida), a veces durante períodos poco prolongados, puede producir demencia (demencia esteroidea) o/y síntomas psicóticos (psicosis esteroidea)95,96.
A veces, el efecto adverso cognitivo o conductual no proviene de la falta de idoneidad del fármaco, sino de haber prescrito una dosis que resulta excesiva para el enfermo (como sucede con frecuencia en la edad avanzada) o de haber establecido una prescripción demasiado prolongada (mayor riesgo si el fármaco es sedativo y/o adictivo).
Según la OMS, polifarmacia significa consumir más de 3 fármacos simultáneamente. En ocasiones es necesaria, porque el paciente presenta varias enfermedades. En otros casos, ese grupo de fármacos contiene alguno no indicado, o que no muestra eficacia, o cuya acción se superpone o es incompatible con la de otro, o que está contraindicado en ese paciente. En polifarmacia, las interacciones son a veces imprevisibles, debido precisamente a la multiplicidad de las fórmulas químicas que se combinan. Esto ocurre con mayor frecuencia en las personas de edad avanzada, que frecuentemente no metabolizan y eliminan la medicación de forma óptima. En particular, la polifarmacia predispone al desarrollo de síndrome confusional y, a veces, el tratamiento que induce este trastorno conduce, directa o indirectamente, a prolongar el estado confusional97.
Los 500 pacientes examinados consumían de 0 a 19 fármacos (media 5,5). Se registró polifarmacia en el 70,4% de ellos, con mayor frecuencia en las personas con 65 años o más y en los que no fueron diagnosticados de enfermedad degenerativa (tabla 4). Tanto las BZD como los AOP se tomaban con mayor frecuencia en régimen de polifarmacia (ambos con p<0,001) (tabla 5), aunque solo en el caso de los AOP la frecuencia de los que tenían polifarmacia se asociaba significativamente a la consideración de ser partícipes en la causa de los síntomas cognitivos (p<0,05) (tabla 6).
ConclusionesEn la práctica asistencial conviene tener presente que, en las personas de edad avanzada, con deterioro de las funciones cognitivas, con enfermedad vascular cerebral o con enfermedades graves o que interfieren en el metabolismo sistémico o en la integridad de la barrera hematoencefálica, deben seleccionarse los tratamientos, sus dosis y su duración con gran cuidado, y evitar la polifarmacia innecesaria o inapropiada. En particular, las BZD y otros fármacos con acción sedativa, los AOP y cualquier fármaco con acción AC, producen con frecuencia alteraciones cognitivas y conductuales, agudas o crónicas, en esos enfermos vulnerables. También resulta prudente evitar la presión arterial sistólica inferior a 130mmHg, en los pacientes que tienen ateromatosis y pérdida de elasticidad en las arterias que se dirigen al cerebro, y la reducción inadecuada de la colesterolemia (colesterol total<160mg/dl, c-HDL<40mg/dl).
En un grupo de 500 pacientes con alteración de funciones cognitivas, fue notable el número de casos a tratamiento con BZD (42%, más frecuente en mujeres) y con polifarmacia (70,4%, más frecuente en los mayores de 64 años). Los que tomaban BZD en régimen de polifarmacia representaron el 74,3% de los casos en los que se sospechó un componente iatrógeno en la etiología de los síntomas cognitivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.