La hiponatremia es el trastorno hidroelectrolítico más prevalente en la práctica clínica, y está vinculada a una mayor morbimortalidad. La asociación de hiponatremia y síndrome de Guillain-Barré (SGB) está descrita, pero existen muy pocos estudios en los que se aborde la prevalencia exacta, etiología, fisiopatológica y manejo diagnóstico y terapéutico. Se presenta el caso de un paciente con SGB e hiponatremia marcada.
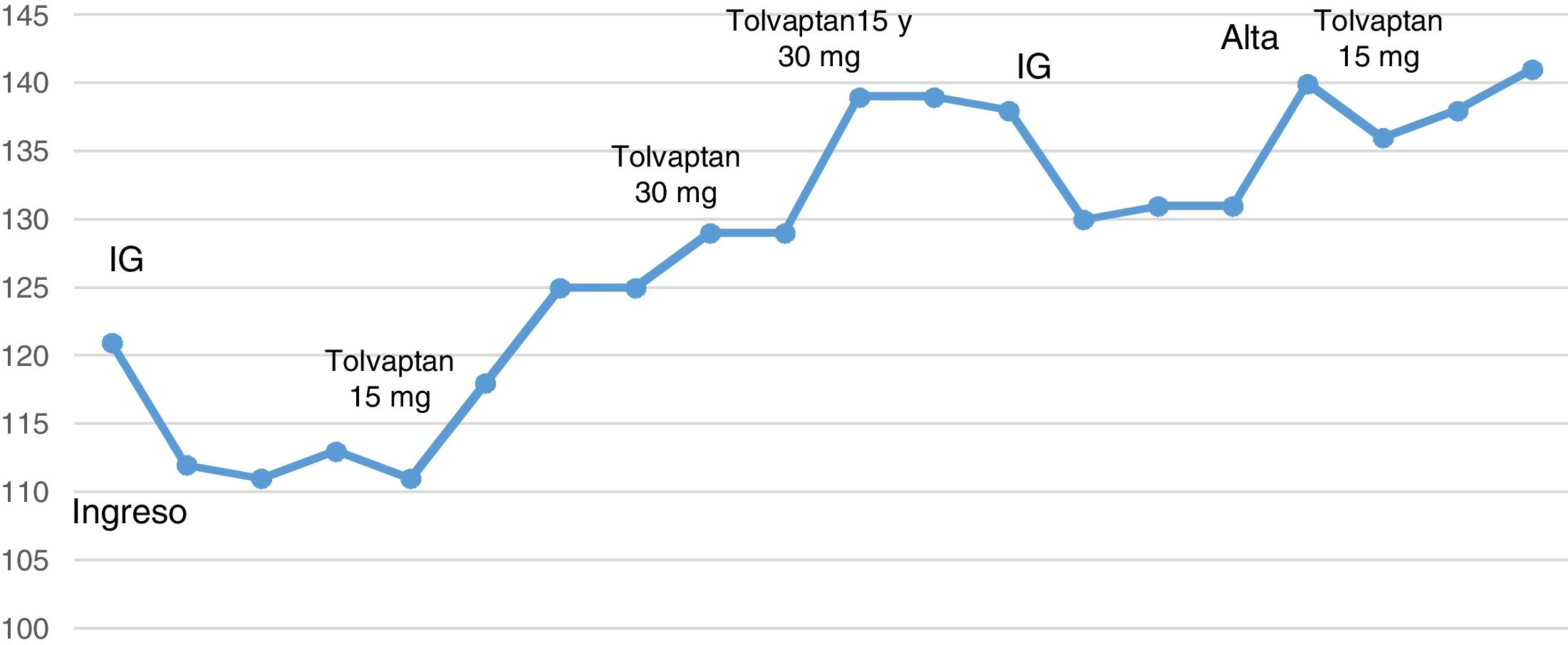
Varón de 59 años con antecedentes de diabetes tipo 2 con buen control metabólico. Consultó por un cuadro que comenzó con parestesias en manos y pies, seguido de dificultad para caminar; que le ocasionó 2 caídas en el domicilio, pérdida de control de esfínteres (precisando el sondaje urinario), así como malestar general y ligera tendencia al sueño. Tres semanas antes había tenido un cuadro de diarrea de 3 días de evolución con resolución espontánea. En la exploración destacaba una paraparesia simétrica de los miembros inferiores, hipoestesia en ambas manos y arreflexia generalizada. El nivel de hidratación era adecuado y no tenía edema. Inicialmente, se realizó una analítica donde llamaba la atención una hiponatremia de 121mEq/l (135-145mEq/l), con potasio, urea y creatinina, así como proteínas totales sin alteraciones, la glucemia fue de 168mg/dl (80-120mg/dl) y una TC de cráneo sin alteraciones. Posteriormente, se realizó una punción lumbar en la que se documentó una disociación albúmina-citológica con cifras de proteínas de 2,34g/l (0,15-0,5g/l) y 8cél/mm3. El estudio microbiológico fue negativo. A partir de estos hallazgos se diagnosticó de polirradiculoneuropatía desmielinizante inflamatoria aguda (subtipo del SGB) e hiponatremia euvolémica.
Se inició tratamiento con inmunoglobulinas (IG) a dosis de 0,4/kg/día, 5 bolos. Pero a pesar de ello, presentó únicamente una mejoría parcial a nivel motor, precisando un segundo ciclo 2 semanas más tarde. Durante el ingreso se realizó un electroneurograma-electromiograma que corroboró el diagnóstico. Progresivamente la clínica neurológica fue mejorando, aunque al alta, un mes más tarde del ingreso, persistía cierta debilidad de extremidades inferiores que impedía la deambulación.
En cuanto a la hiponatremia, la exploración física era compatible con euvolemia. La osmolaridad plasmática fue de 239mOsm/kg (275-295mOsm/kg), osmolaridad orina 591mOsm/kg (100-700mOsm/kg), sodio en orina 80mEq/l (20-200mEq/L), TSH 1,70mlU/ml (0,4-4mlU/ml), perfil lipídico normal y proteinograma negativo para componente monoclonal. Igualmente, se solicitó una radiografía de tórax, con dudoso ensanchamiento mediastino y una TC-tórax y abdomen que fue negativo para neoplasia. Con todos estos datos se diagnosticó una hiponatremia euvolémica en relación con un síndrome de secreción inadecuada de hormona antidiurética (SIADH) secundario al SGB. Durante las primeras horas se inició tratamiento con suero hipertónico al 3% (500cc/24h) y restricción hídrica (800cc/24h) y ante la ausencia de respuesta se inició tratamiento con tolvaptan 15mg. Precisó escalada de dosis hasta 30mg/día para alcanzar los niveles de normalidad. De forma ambulatoria se fue retirando progresivamente hasta quedar suspendido en un plazo de 4 meses.
Al año, la debilidad de extremidades inferiores mejoró con el apoyo de ejercicios de rehabilitación, no obstante, precisaba muletas para la deambulación. El nivel sérico de sodio era normal (141mEq/l).
Aunque se ha descrito la correlación de hiponatremia con el SGB las publicaciones que han analizado esta correlación son escasas. Se asocia con peores resultados hospitalarios incluso al año1–5, mayor estancia hospitalaria1–3, incremento de los costes1, y algunos incluso han demostrado que es un factor predictor independiente de mortalidad2,5, circunstancia también descrita en otros trastornos1. Por otra parte, hay datos publicados de que los pacientes con SGB e hiponatremia precisan con mayor frecuencia soporte ventilatorio1,2, lo que podría relacionarse con el hecho de que una hiponatremia grave puede manifestarse como un distress respiratorio6.
La mayoría de las hiponatremias en el SGB se desarrollan durante la hospitalización y se relacionan con el uso de las IG, por lo que la seudohiponatremia en relación con el aumento de proteínas podría jugar un papel importante. Otra posibilidad descrita, está relacionada con la translocación osmótica de agua desde el espacio intracelular al intravascular mediada por un aumento de la osmolaridad, secundaria a la infusión de IG a base de azúcares. Así fue descrito por un estudio, en el cual se examinó el efecto de la infusión de IG con los niveles de sodio, medidos por los métodos selectivos de iones directos, el cual evita la seudohiponatremia. Se encontró que la hiponatremia también estuvo presente a pesar de usar este método7. Igualmente, se ha descrito un fenómeno relacionado con el SIADH, siendo el mecanismo más frecuente dentro de las verdaderas hiponatremias2,8,9. Otro mecanismo descrito es el síndrome pierde sal, siendo el menos habitual de todos.
Nuestro paciente podría cumplir con los criterios del SIADH, según la última guía europea de hiponatremia (osmolalidad sérica<275 mOsm/kg, osmolalidad urinaria>100mOsm/kg, exploración euvolemia, ausencia de insuficiencia adrenal, tiroidea, pituitaria o renal y sin uso reciente de diuréticos)7. No se llegó a cuantificar los niveles del cortisol, si bien, no había datos clínicos ni de laboratorio compatibles con una insuficiencia suprarrenal. La prevalencia del SIADH en el SGB no es bien conocida, se dispone solo de escasos clínicos publicados. La fisiopatología no ha sido claramente dilucidada. Existen varias teorías, incluyendo la alteración de las células hipotalámicas que causa la liberación de ADH en la circulación, alteración del sistema de osmorregulación, el aumento de la sensibilidad de los receptores de ADH, mecanismos independientes de ADH9 e igualmente se ha propuesto una relación con la interleucina 6. Esta citocina inflamatoria puede aumentar la liberación de vasopresina10.
Como dato llamativo, podemos observar en la gráfica (fig. 1) cómo los niveles de sodio descienden tras la administración de las IG. Esta bajada podría estar en relación con cierto componente de seudohiponatremia y/o una translocación de agua al espacio intravascular, suplementario a la verdadera hiponatremia. Analizando retrospectivamente el caso, este acontecimiento podría justificar la insuficiente respuesta al suero hipertónico y restricción hídrica pautadas inicialmente, junto con el haber requerido subir la dosis de tolvaptan a 30mg para alcanzar los niveles normales de sodio.
Actualmente, existen escasos datos publicados en la literatura sobre la experiencia de tolvaptan en pacientes con SGB que desarrollan un SIADH, de hecho solo hemos encontrado un caso publicado.
Concluimos que en los pacientes diagnosticados de SGB se deberían vigilar los niveles de sodio. La seudohiponatremia, la translocación de agua y el SIADH, deben ser considerados en el diagnóstico diferencial de las hiponatremias. En nuestro caso, consideramos que la hiponatremia podría haber jugado un papel en la necesidad de un segundo ciclo de inmunoglobulinas, así como en una lenta recuperación motora.