La necesidad de una asistencia sanitaria segura en la que los cuidados y tratamientos no supongan daños diferentes a los derivados de la enfermedad de base, ha motivado este estudio. Nuestro objetivo ha sido determinar la frecuencia y describir los síndromes neurológicos atribuibles a fármacos, su evitabilidad y los niveles asistenciales implicados.
MétodosEstudio observacional. Cohorte prospectiva de todos los sujetos derivados desde atención primaria y especializada, en el período de diciembre de 2008 a enero de 2010, por síntomas neurológicos atribuibles a fármacos y enfermos neurológicos conocidos con clínica distinta o agravada de la enfermedad de base causada por fármacos. Las notificaciones quedaron reflejadas en un cuestionario. Se realizaron distribuciones de frecuencias, medidas de tendencia central, pruebas de la χ2 o Fisher y pruebas no paramétricas correspondientes.
ResultadosLa prevalencia de efectos adversos neurológicos respecto a la muestra total fue 0,586%. De los 105 pacientes seleccionados, los principales efectos adversos fueron: 25,7% síndrome rígido-acinético; 18,1% discinético; 11,4% síntomas neuropsiquiátricos, y 10,5% síndrome confusional. Los grupos farmacológicos más registrados fueron, en orden decreciente: antiepilépticos, dopaminérgicos, antidepresivos, neurolépticos, antivertiginosos y procinéticos. Describimos la población más susceptible y las asociaciones estadísticamente significativas entre la presencia de determinados grupos farmacológicos y síndromes neurológicos concretos.
ConclusionesLa baja prevalencia detectada puede deberse al diseño del estudio, aunque los efectos adversos neurológicos suponen el 2,84% de los ingresos en una unidad de neurología. Conocer la epidemiología permitirá identificar los abordajes más seguros, aplicarlos correctamente a la población de mayor riesgo y reducir necesidades asistenciales y recursos médicos.
The need for safe health care, in which the care and treatment of the patient does not cause any injuries in addition to those already arising from their baseline disease, has led to the present study. Our objective has been to determine the frequency and describe the neurological syndromes attributable to drugs, their preventability and the levels of medical care involved.
MethodsObservational study. Cohort of subjects referred from Primary and Specialized Care between December 2008 and January 2010 due to neurological symptoms attributable to drugs, and previously known neurology patients who began to have symptoms other than those of the baseline disease, also caused by drugs. The notifications were recorded in a questionnaire. Frequency distributions, central tendency measurements, X2 or Fisher tests and non-parametric tests were performed.
ResultsThe prevalence of adverse neurological events was 0.586% of the total sample. Of the 105 patients selected, the most frequent adverse events were: 25.7%, akinetic-rigid syndrome, 18.1%, dyskinetic syndrome, 11.4% neuro-psychiatric symptoms, and 10.5% confusional syndrome. The most commonly recorded pharmacological groups were, in decreasing order: anti-epileptic, dopaminergic, antidepressant, neuroleptic, antivertiginous and prokinetic drugs. We describe the most susceptible population and the statistically significant relationships between the presence of certain pharmacological groups and neurological syndromes.
ConclusionsThe low prevalence detected may be due to the study design, although adverse neurological events accounted for 2.84% of the admissions to a Neurology Unit. Understanding the epidemiology should help to identify the safest approaches, apply them correctly to the population at a higher risk, and reduce healthcare needs and consumption of medical resources.
Existe un interés creciente por los riesgos y los sucesos adversos en el ámbito sanitario, ya que la seguridad del paciente se ha convertido en un componente esencial en la asistencia. En ese sentido, la Organización Mundial de la Salud lanzó la «Alianza mundial para la seguridad de los paciente» y definió la calidad de los servicios sanitarios como aquélla en la que el paciente es diagnosticado y tratado de forma correcta (calidad científico-técnica), según los conocimientos actuales de la ciencia médica y según sus factores biológicos (estado de salud óptimo conseguible), con el coste mínimo de recursos (eficiencia), la mínima exposición de riesgo posible de un daño adicional (gestión de riesgos) y la máxima satisfacción para el paciente1,2.
Una mayor esperanza de vida genera mayores necesidades asistenciales; un grado de desarrollo socioeconómico mayor exige más en cuanto a la calidad asistencial y la información; la complejidad creciente de las tecnologías diagnósticas y recursos terapéuticos ocasiona problemas de sostenibilidad de los sistemas sanitarios. Por ello, una de las prioridades de la asistencia sanitaria es potenciar la identificación de los procedimientos diagnósticos y tratamientos más seguros y eficaces, y asegurar que estos no supongan daños o complicaciones diferentes a los derivados de la enfermedad de base, o al menos, se valoren los riesgos y beneficios de las actuaciones médicas en los casos predecibles inevitables3-5. A pesar de que la medida del riesgo que sufre un paciente en su contacto con los servicios sanitarios no es fácil de obtener, la frecuencia y gravedad de los incidentes, accidentes y errores no deben ignorarse, como se ha recomendado en los últimos años6-10.
Existen estudios en el ámbito internacional sobre la seguridad del paciente en el ámbito sanitario. El estudio de referencia se desarrolló en 1984 en Nueva York (Harvard Medical Practice-HMPS)11 y estimó una incidencia de efectos adversos (EA) medicamentosos de 3,7% en las 30.121 historias clínicas revisadas. En estudios posteriores, las tasas de EA encontradas han variado desde un 2,9%12 hasta cifras entre un 7-16%13-16. El estudio que ha alcanzado tasas más elevadas es el de Healey et al.17, sobre 4.743 pacientes que siguieron de una manera prospectiva, describiendo un 31,5% de EA. En Francia se realizó un estudio piloto coordinado por el Comité de Coordination de l’Évaluation Clinique et de la Qualité en Aquitaine en 2002, para fijar las bases del estudio nacional [ENEIS]18. En España, se publicó en el año 2004 el Proyecto IDEA en la Generalitat Valenciana que sirvió de piloto para el estudio nacional ENEAS en el 200519. En este se estimó la incidencia de pacientes con EA relacionados directamente con la asistencia hospitalaria en un 8,4%20. El último trabajo en el ámbito nacional fue el realizado en el año 2008, denominado estudio APEAS sobre la seguridad del paciente en el primer nivel asistencial. El 47,8% de los EA se relacionaron con la medicación, correspondiendo a las alteraciones neurológicas por fármacos un 5,1%21.
No hemos encontrado trabajos en España que aborden específicamente el problema de los EA que cursan con síntomas neurológicos. El objetivo principal de este estudio consiste en determinar la frecuencia y los tipos de síndromes neurológicos atribuidos al uso de medicamentos. Como objetivos secundarios se plantea determinar la asociación de EA según comorbilidades, politerapia, sexo, edad y grupos farmacológicos, valorar los EA evitables, el tiempo que transcurre hasta la resolución del síndrome y los niveles asistenciales en los cuales se hicieron dichas prescripciones.
Sujetos y métodosEl estudio se diseñó como observacional de una cohorte prospectiva del periodo comprendido entre diciembre de 2008 y enero de 2010 (periodo de inclusión) con un periodo de seguimiento hasta junio de 2010.
Se estudió a todos los sujetos mayores de 14 años remitidos al servicio de neurología (a través de urgencias, hospitalización o consultas externas), derivados desde atención primaria y atención especializada, siendo 17.896 el número de pacientes valorados durante el periodo de inclusión: 3.936 primeras consultas, 13.167 revisiones, 793 ingresos. De ellos, se seleccionó a los pacientes en los que el motivo de consulta parecía atribuible a fármacos tras la primera valoración, y a los enfermos neurológicos conocidos que consultaron por clínica distinta o agravamiento de su enfermedad de base que también pudiera relacionarse con fármacos (n=133). Tras esta primera selección, en todos los sujetos se realizó un seguimiento de 6 meses durante el cual se incluyó definitivamente a los pacientes en los que las revisiones clínicas y las pruebas complementarias posteriores descartaron otras etiologías, confirmando la causa farmacológica, apoyado por la recuperación total del cuadro neurológico que padecían, y sobre los que se hicieron los estudios estadísticos (n=105). Se excluyó a los sujetos cuyos síntomas neurológicos se debieron a una enfermedad neurológica independiente de la prescripción farmacológica (desde la primera valoración o tras realizar las pruebas complementarias) y aquéllos en los que al final del periodo de estudio no se había obtenido la información por estar pendiente de pruebas complementarias definitivas o abandonos. También quedaron excluidos los pacientes en los que no fue posible suspender el fármaco sospechoso por razones éticas (como pacientes cardiópatas con necesidad de tomar antiarrítmicos) o por dependencia (como enfermos psiquiátricos en los que el cambio de fármacos neurolépticos o ansiolíticos hubiera requerido más tiempo para confirmar el origen farmacológico), y los que al terminar el periodo de seguimiento mantenían la clínica neurológica (asumiendo posibles pérdidas de casos en síndromes que requieren mayor periodo de lavado o no son reversibles como las discinesias tardías).
No se estudiaron los efectos adversos de técnicas como la punción lumbar.
Se obtuvo el consentimiento por parte del comité ético y de la unidad de investigación del centro donde se realizó el estudio.
El ámbito de estudio correspondió a un hospital de 16 camas de neurología, con 4 consultas externas intrahospitalarias y guardias de neurología, que atiende a una población total de 223.669 habitantes, correspondiente al área de un hospital de segundo nivel de la Comunidad de Castilla-La Mancha (Ciudad Real). Para el cálculo del tamaño muestral se utilizó la información obtenida en el estudio APEAS21, acerca de la seguridad del paciente en atención primaria.
En la recogida de sujetos en la selección inicial participaron tres categorías profesionales: doctores especialistas en neurología, neurólogos y un médico interno residente de neurología formado específicamente en un curso de farmacología clínica para neurólogos. Para evitar sesgos se instruyó debidamente a los participantes.
En la primera valoración, los participantes preseleccionaron un total de 133 sujetos candidatos al estudio, anotaron los datos de identificación de los pacientes, el fármaco sospechoso y el síndrome neurológico, rellenando un formulario específico modificado a partir del cuestionario del estudio APEAS21 (fig. 1) (elaborado a partir de una investigación previa, de una lista de condiciones similar a la de los estudios de Nueva York13 y Utah y Colorado14, bajo técnicas de consenso). Se suspendió el fármaco y se citó a los pacientes para revisiones posteriores donde se reevaluaron, y según los casos, se solicitaron las pruebas complementarias oportunas de laboratorio e imagen. Los evolutivos del seguimiento quedaron reflejados en la historia clínica. Los datos se entregaron a dos revisores (doctor especialista y MIR supervisado) que estudiaron todas las historias clínicas y seleccionaron finalmente a los 105 pacientes. A partir de este cuestionario, se elaboró la base de datos para los análisis estadísticos.
La taxonomía universal utilizada es la desarrollada por organizaciones como la Organización Mundial de la Salud o la Joint Commission on Acreditation on Health Care Organizations (JCAHO)22.
Las variables resultado estudiadas fueron: síndrome neurológico (como efecto adverso), evitabilidad y tiempo de resolución del síndrome. Las variables independientes valoradas fueron: grupos farmacológicos, nivel asistencial, comorbilidades, edad, sexo y politerapia. Las definiciones operativas del estudio se reflejan en la tabla 1.
Definiciones operativas
| Suceso adverso | Todo accidente imprevisto e inesperado identificado en el momento de la consulta, que haya causado clínica neurológica, haya producido o no un daño (efecto adverso e incidente, respectivamente), que se deriva de la asistencia sanitaria (error o no) y no de la enfermedad de base del paciente. Para determinar que el suceso adverso se debe a la asistencia los revisores puntuaron en una escala de 3 puntos (1=ausencia completa de evidencia, 3=evidencia prácticamente segura) el grado de confianza que tenían de que el efecto adverso pudiera ser debido a la asistencia sanitaria. Para simplificar términos, llamaremos efecto adverso a todo suceso adverso |
| Efecto adverso evitable | Para determinar que el efecto adverso es evitable, se puntuó con 0 puntos la ausencia o prácticamente improbable de ser evitado, y con 1 punto a la evidencia segura de ser evitable |
| Impacto sobre el paciente | Efectos potenciales sobre la salud resultado de la asistencia sanitaria. Para evaluar el grado de impacto, los revisores puntuaron en una escala de 5 puntos (1=el efecto no ha ocurrido; 5=el efecto ha ocurrido y el resultado ha sido la muerte del paciente) el grado de confianza que tenían de que la asistencia sanitaria ocasionara efectos potenciales sobre la salud del paciente |
| Nivel asistencial | Para reflejar el nivel asistencial responsable del efecto adverso, se denominó como «0» si ocurrió en atención primaria y «1» si fue en atención especializada |
| Error médico | Acto de equivocación u omisión en la práctica de los profesionales sanitarios que puede contribuir a la aparición de un efecto adverso |
| Error de medicación | Efecto que puede evitarse y que es causado por una utilización inadecuada de un medicamento, produciendo lesión a un paciente mientras la medicación está bajo la supervisión del personal sanitario o paciente |
| Reacción adversa medicamentosa | Alteración y/o lesión producida cuando los medicamentos son utilizados de manera apropiada y, por tanto, difícilmente evitables |
| Comorbilidad | Presencia de uno o más trastornos (o enfermedades) además de la enfermedad o trastorno primario |
| Síndromes discinéticos | Se incluyen: temblor, corea, distonía, tics, mioclonías, balismo, acatisia, síndrome de piernas inquietas |
| Síndromes sensitivos | Se incluyen: anestesia, hipoestesia, hiperestesia, alodinia, hiperalgesia, parestesia, fotofobia, discromatopsia, alteraciones de la agudeza visual |
| Síntomas neuropsiquiátricos | Se incluyen: alucinaciones, ilusiones, depresión, ansiedad |
Los datos se manejaron mediante el programa PASW statistics 18. En el análisis de los datos se utilizaron los estadísticos descriptivos para las variables cualitativas y cuantitativas, se calcularon las asociaciones estadísticas entre las variables cualitativas mediante las pruebas de la ji al cuadrado o el test exacto de Fisher, se evaluaron las diferencias entre grupos de la variable cuantitativa continua edad por medio de prueba U de Mann-Whitney y las diferencias de rangos de las variables ordinales a través de la prueba Kruskal-Wallis.
Se garantizó la confidencialidad de los pacientes.
ResultadosEn el estudio colaboraron 13 profesionales de neurología. Durante el periodo de estudio se atendió a 17.896 pacientes. De todos ellos, se hicieron 133 notificaciones de posible síndrome neurológico como EA de fármacos en una primera valoración, de los cuales 105 pacientes quedaron finalmente incluidos en el estudio. De los 28 pacientes excluidos, 4 tenían una muy alta probabilidad EA farmacológicos que permanecían al concluir el estudio (discinesias tardías); 6 fueron excluidos ante la dificultad de sustituir el fármaco responsable por otro debido a las comorbilidades y dificultad de un manejo interdisciplinario (p. ej., amiodarona en pacientes con arritmia cardiaca); 11 finalmente tenían una enfermedad subyacente, en algunos casos desenmascarada por los fármacos (enfermedad de Parkinson y depleción dopaminérgica secundaria a neurolépticos), y en 7 no se obtuvo un diagnóstico de confirmación al concluir el estudio o no acudieron a las revisiones. De la totalidad de los pacientes incluidos, 5 acumularon 2 o más EA: un paciente con miastenia gravis resultó en situación crítica por tres crisis miasténicas; otro paciente presentó dos episodios desmielinizantes sin antecedentes neurológicos conocidos; los otros 3 casos, diagnosticados de enfermedad de Parkinson, presentaron agravamiento de su enfermedad en dos ocasiones.
El 21% de las notificaciones se recogieron en hospitalización (incluidos en este porcentaje las interconsultas solicitadas por otros servicios); el 19% en urgencias y el 59% en consultas externas de neurología.
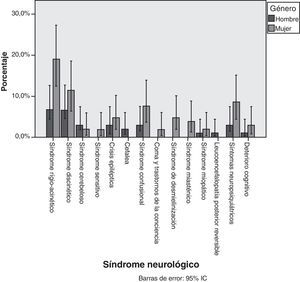
El 29,5% (IC del 95%, 20,7%-38,2%) de los pacientes incluidos en el estudio fueron hombres y el 70,5% (IC del 95%, 61,7%-79,2%) mujeres. La edad media registrada fue de 62,12 años. En hombres fue de 57,32 años (IC del 95%, 47,89-66,75; p=25,7) y en las mujeres, de 64,14 años (IC del 95%, 59,42- 68,85. p=20,34).
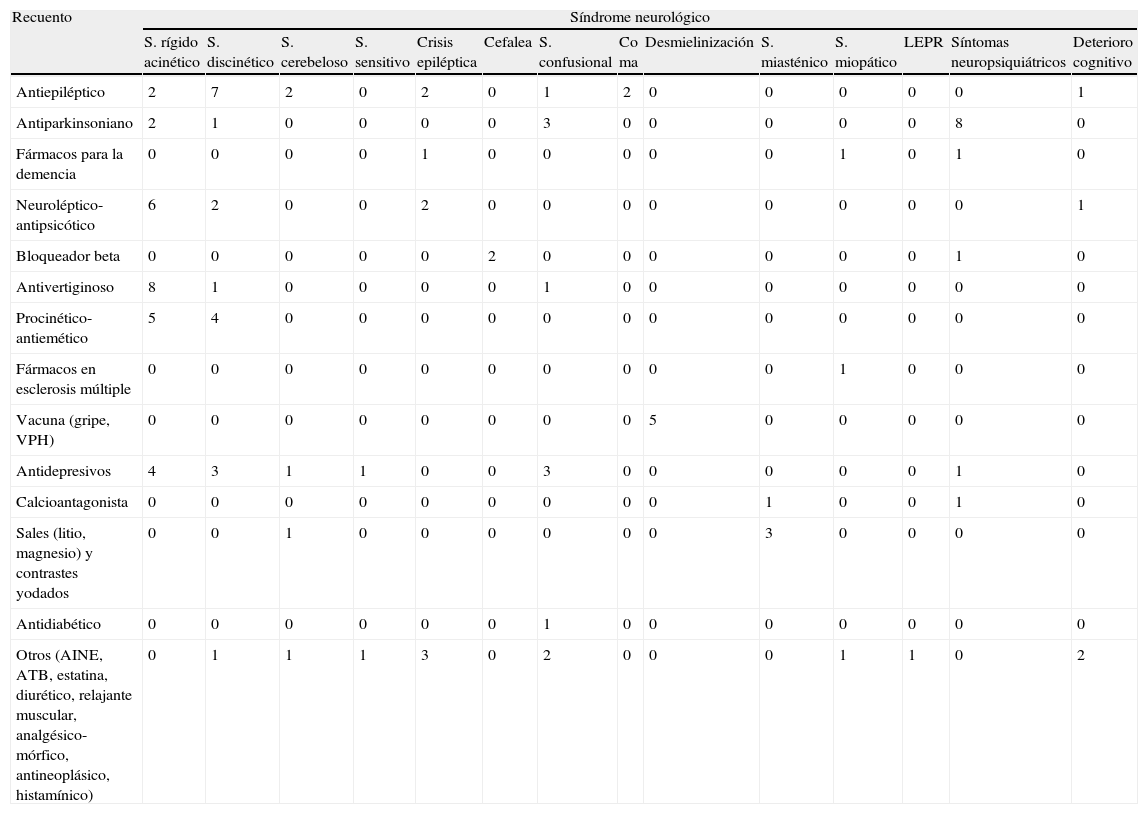
En las tablas 2 y 3 se reflejan las frecuencias observadas de síndromes neurológicos y fármacos responsables sospechosos, respectivamente. En la tabla 4, se muestra el recuento de cada síndrome neurológico observado en relación con los grupos farmacológicos.
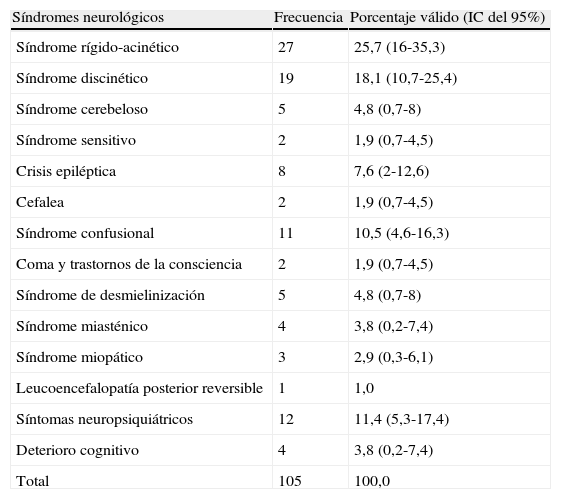
Porcentajes observados de síndrome neurológicos
| Síndromes neurológicos | Frecuencia | Porcentaje válido (IC del 95%) |
| Síndrome rígido-acinético | 27 | 25,7 (16-35,3) |
| Síndrome discinético | 19 | 18,1 (10,7-25,4) |
| Síndrome cerebeloso | 5 | 4,8 (0,7-8) |
| Síndrome sensitivo | 2 | 1,9 (0,7-4,5) |
| Crisis epiléptica | 8 | 7,6 (2-12,6) |
| Cefalea | 2 | 1,9 (0,7-4,5) |
| Síndrome confusional | 11 | 10,5 (4,6-16,3) |
| Coma y trastornos de la consciencia | 2 | 1,9 (0,7-4,5) |
| Síndrome de desmielinización | 5 | 4,8 (0,7-8) |
| Síndrome miasténico | 4 | 3,8 (0,2-7,4) |
| Síndrome miopático | 3 | 2,9 (0,3-6,1) |
| Leucoencefalopatía posterior reversible | 1 | 1,0 |
| Síntomas neuropsiquiátricos | 12 | 11,4 (5,3-17,4) |
| Deterioro cognitivo | 4 | 3,8 (0,2-7,4) |
| Total | 105 | 100,0 |
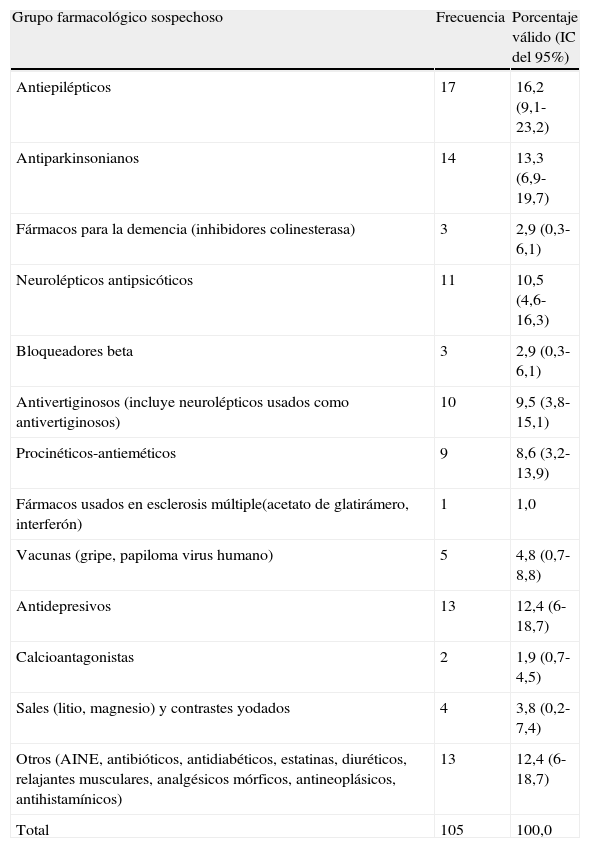
Frecuencias observadas de fármacos sospechosos
| Grupo farmacológico sospechoso | Frecuencia | Porcentaje válido (IC del 95%) |
| Antiepilépticos | 17 | 16,2 (9,1-23,2) |
| Antiparkinsonianos | 14 | 13,3 (6,9-19,7) |
| Fármacos para la demencia (inhibidores colinesterasa) | 3 | 2,9 (0,3-6,1) |
| Neurolépticos antipsicóticos | 11 | 10,5 (4,6-16,3) |
| Bloqueadores beta | 3 | 2,9 (0,3-6,1) |
| Antivertiginosos (incluye neurolépticos usados como antivertiginosos) | 10 | 9,5 (3,8-15,1) |
| Procinéticos-antieméticos | 9 | 8,6 (3,2-13,9) |
| Fármacos usados en esclerosis múltiple(acetato de glatirámero, interferón) | 1 | 1,0 |
| Vacunas (gripe, papiloma virus humano) | 5 | 4,8 (0,7-8,8) |
| Antidepresivos | 13 | 12,4 (6-18,7) |
| Calcioantagonistas | 2 | 1,9 (0,7-4,5) |
| Sales (litio, magnesio) y contrastes yodados | 4 | 3,8 (0,2-7,4) |
| Otros (AINE, antibióticos, antidiabéticos, estatinas, diuréticos, relajantes musculares, analgésicos mórficos, antineoplásicos, antihistamínicos) | 13 | 12,4 (6-18,7) |
| Total | 105 | 100,0 |
Recuento observado de los distintos síndromes neurológicos y grupos farmacológicos
| Recuento | Síndrome neurológico | |||||||||||||
| S. rígido acinético | S. discinético | S. cerebeloso | S. sensitivo | Crisis epiléptica | Cefalea | S. confusional | Co ma | Desmielinización | S. miasténico | S. miopático | LEPR | Síntomas neuropsiquiátricos | Deterioro cognitivo | |
| Antiepiléptico | 2 | 7 | 2 | 0 | 2 | 0 | 1 | 2 | 0 | 0 | 0 | 0 | 0 | 1 |
| Antiparkinsoniano | 2 | 1 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 8 | 0 |
| Fármacos para la demencia | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 |
| Neuroléptico-antipsicótico | 6 | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Bloqueador beta | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Antivertiginoso | 8 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Procinético-antiemético | 5 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Fármacos en esclerosis múltiple | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Vacuna (gripe, VPH) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 0 | 0 | 0 | 0 |
| Antidepresivos | 4 | 3 | 1 | 1 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Calcioantagonista | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 |
| Sales (litio, magnesio) y contrastes yodados | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 |
| Antidiabético | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Otros (AINE, ATB, estatina, diurético, relajante muscular, analgésico-mórfico, antineoplásico, histamínico) | 0 | 1 | 1 | 1 | 3 | 0 | 2 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
LEPR: leucoencefalopatía posterior reversible; VPH: vacuna antipapilomavirus humano.
La mayoría de los síndromes rígido-acinéticos se registraron en pacientes con un uso prolongado (algunos durante años) de antivertiginosos, procinéticos y antieméticos, y en otros, como efecto idiosincrásico. En su mayoría, los síntomas neuropsiquiátricos correspondieron a sujetos con larga evolución de una enfermedad neurodegenerativa y tratados con dopaminérgicos. Dentro del síndrome discinético, el temblor se observó más frecuentemente en personas jóvenes en tratamiento antiepiléptico (ácido valproico).
Un aspecto llamativo es el recuento de 4 casos (5 episodios desmielinizantes) con antecedente reciente de vacunaciones (en 4, vacuna del papilomavirus humano, y en 1, vacuna antigripal) que desarrollaron cuadros desmielinizantes. Solo el caso con la vacuna antigripal tenía antecedentes de esclerosis múltiple. Del resto, 2 pacientes llegaron a cumplir a posteriori criterios de esclerosis múltiple y el otro sujeto actualmente se mantiene sin enfermedad23. Estos hallazgos se deducen de nuestras observaciones, no habiéndose demostrado estadísticamente tal asociación.
Se encontró una asociación significativa entre tratamiento con antiepilépticos y síndrome discinético (p=0,013); fármacos dopaminérgicos y presencia de síntomas neuropsiquiátricos (p=0,000); antipsicóticos-neurolépticos y síndrome rígido-acinético (p=0,031), y antivertiginosos-procinéticos-antieméticos y síndrome rígido-acinético (p=0,000).
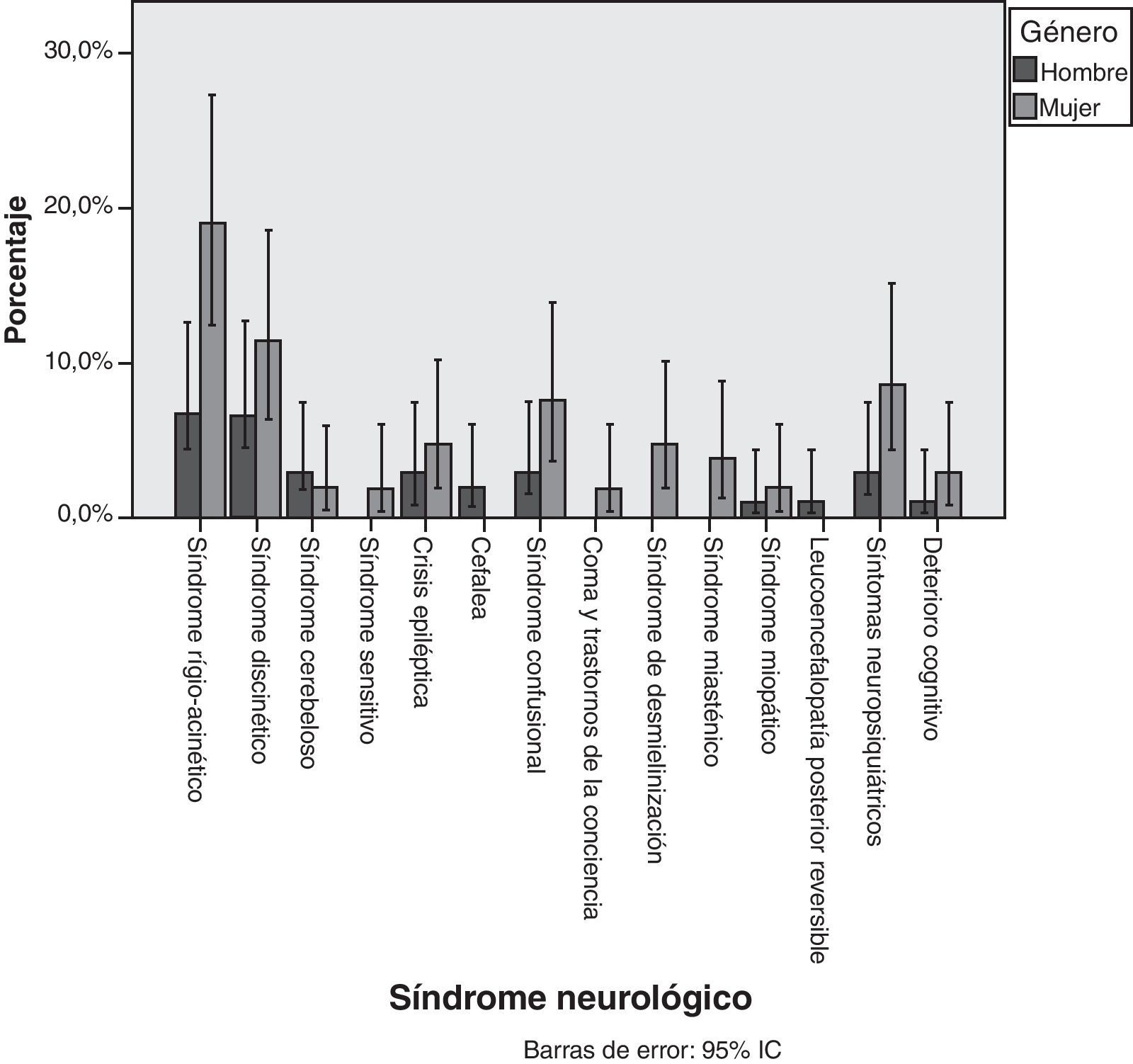
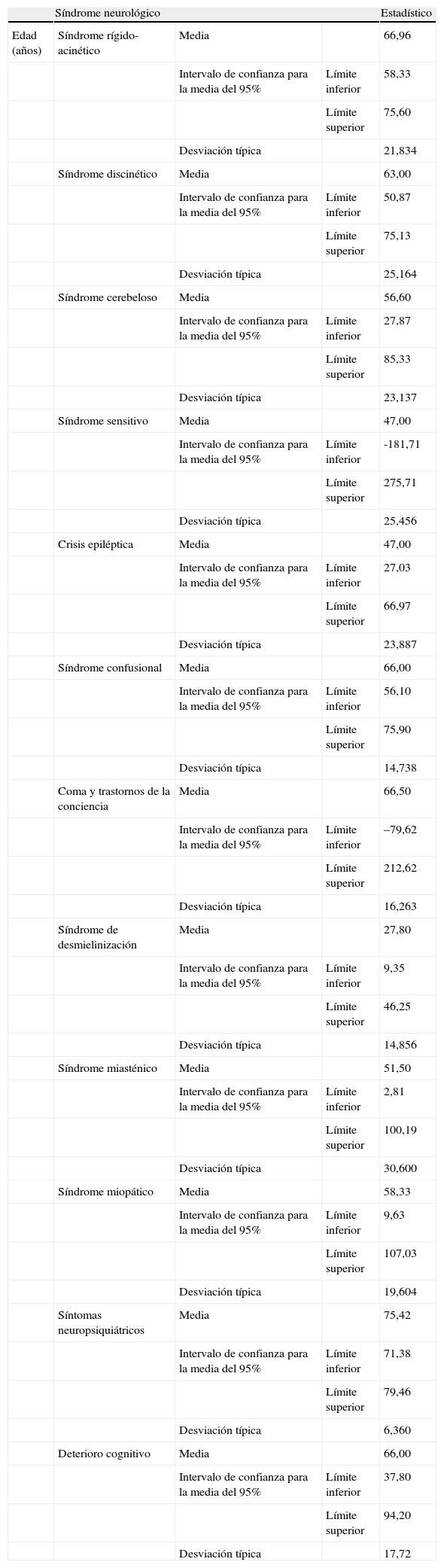
Las proporciones observadas en el género agrupado por síndromes se exponen en la fig. 2. Aunque el sexo femenino fue el género más observado en cada síndrome neurológico, no se llegó a demostrar estadísticamente que los EA se dieran más en mujeres que en hombres (p=0,848). La tabla 5 muestra las edades medias observadas en cada síndrome neurológico, sin haberse podido demostrar diferencias estadísticas entre los principales cuadros neurológicos.
Síndromes neurológicos y edades observadas
| Síndrome neurológico | Estadístico | |||
| Edad (años) | Síndrome rígido-acinético | Media | 66,96 | |
| Intervalo de confianza para la media del 95% | Límite inferior | 58,33 | ||
| Límite superior | 75,60 | |||
| Desviación típica | 21,834 | |||
| Síndrome discinético | Media | 63,00 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 50,87 | ||
| Límite superior | 75,13 | |||
| Desviación típica | 25,164 | |||
| Síndrome cerebeloso | Media | 56,60 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 27,87 | ||
| Límite superior | 85,33 | |||
| Desviación típica | 23,137 | |||
| Síndrome sensitivo | Media | 47,00 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | -181,71 | ||
| Límite superior | 275,71 | |||
| Desviación típica | 25,456 | |||
| Crisis epiléptica | Media | 47,00 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 27,03 | ||
| Límite superior | 66,97 | |||
| Desviación típica | 23,887 | |||
| Síndrome confusional | Media | 66,00 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 56,10 | ||
| Límite superior | 75,90 | |||
| Desviación típica | 14,738 | |||
| Coma y trastornos de la conciencia | Media | 66,50 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | –79,62 | ||
| Límite superior | 212,62 | |||
| Desviación típica | 16,263 | |||
| Síndrome de desmielinización | Media | 27,80 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 9,35 | ||
| Límite superior | 46,25 | |||
| Desviación típica | 14,856 | |||
| Síndrome miasténico | Media | 51,50 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 2,81 | ||
| Límite superior | 100,19 | |||
| Desviación típica | 30,600 | |||
| Síndrome miopático | Media | 58,33 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 9,63 | ||
| Límite superior | 107,03 | |||
| Desviación típica | 19,604 | |||
| Síntomas neuropsiquiátricos | Media | 75,42 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 71,38 | ||
| Límite superior | 79,46 | |||
| Desviación típica | 6,360 | |||
| Deterioro cognitivo | Media | 66,00 | ||
| Intervalo de confianza para la media del 95% | Límite inferior | 37,80 | ||
| Límite superior | 94,20 | |||
| Desviación típica | 17,72 | |||
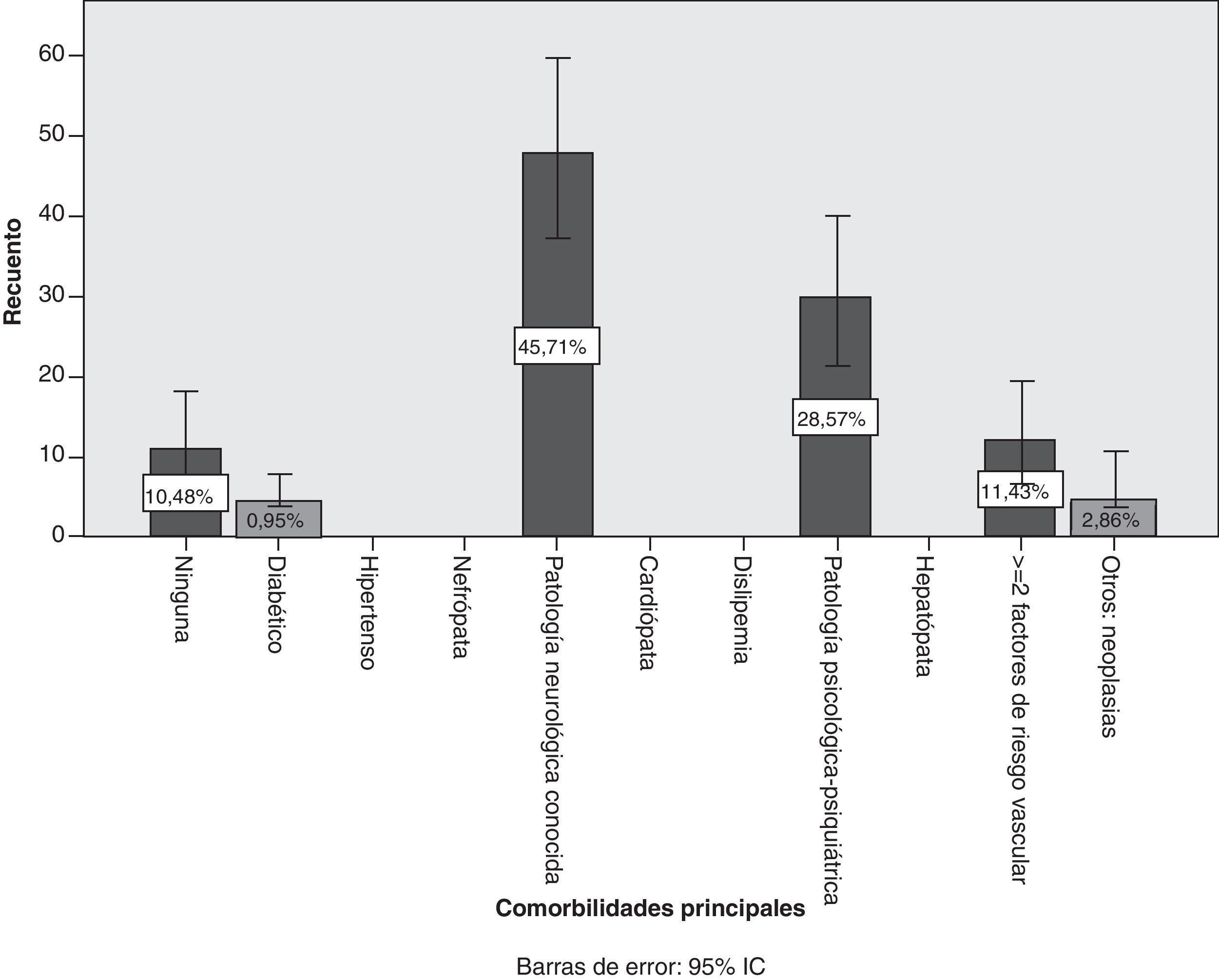
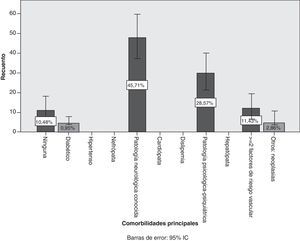
Del total de pacientes, el 75,2% (IC del 95%, 66,9%-83,4%) recibían politerapia, frente al 24,8% (IC del 95%, 16,5%-33%). No se encontró asociación estadística entre politerapia y la presencia de determinados síndromes neurológicos. El 89,5% de los pacientes con EA notificados presentaba alguna comorbilidad frente al 10,5% (fig. 3). Las comorbilidades más frecuentes detectadas fueron la enfermedad neurológica previa en el 45,7%. En orden decreciente estas fueron: enfermedad de Parkinson, epilepsia, cefalea, temblor esencial, deterioro cognitivo, patología vascular cerebral, enfermedad desmielinizante, miastenia gravis y tumor cerebral. El resto de comorbilidades notificadas fueron; el 28,6%, antecedente psiquiátrico-psicológico, y el 11,4% tenía dos o más factores de riesgo cardiovascular.
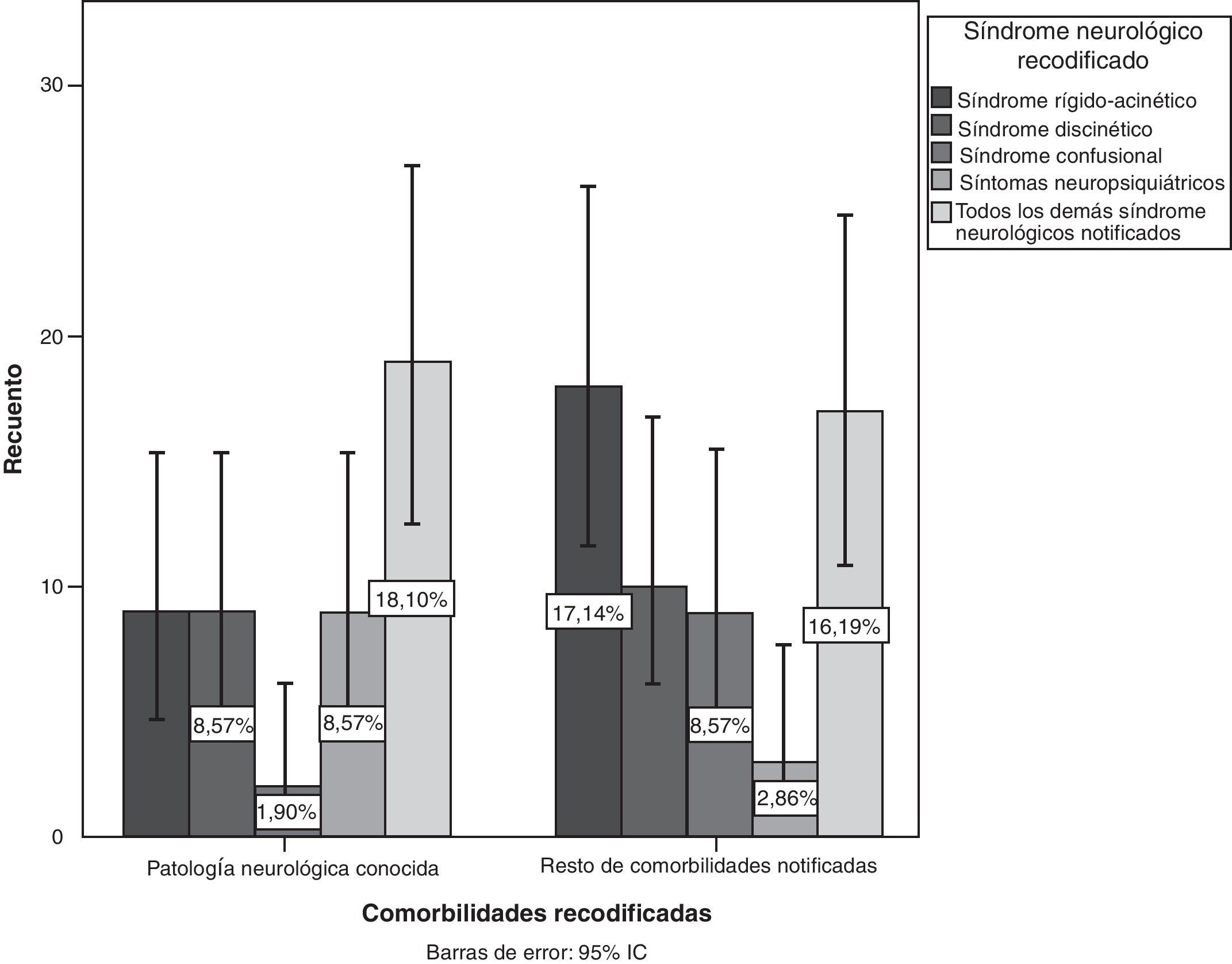
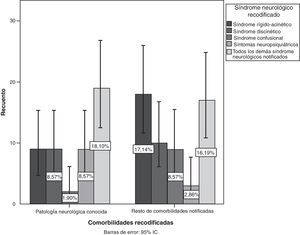
Tras la recodificación por síndromes neurológicos concretos, se vio que los pacientes con enfermedad neurológica previa tenían más EA (p=0,042; IC del 95%, 36,1%-55,2%), principalmente síntomas neuropsiquiátricos, y seguidamente síndrome rígido-acinético, discinético y confusional (fig. 4). Por el contrario, no se encontró asociación con la enfermedad psiquiátrica como antecedente (p=0,742).
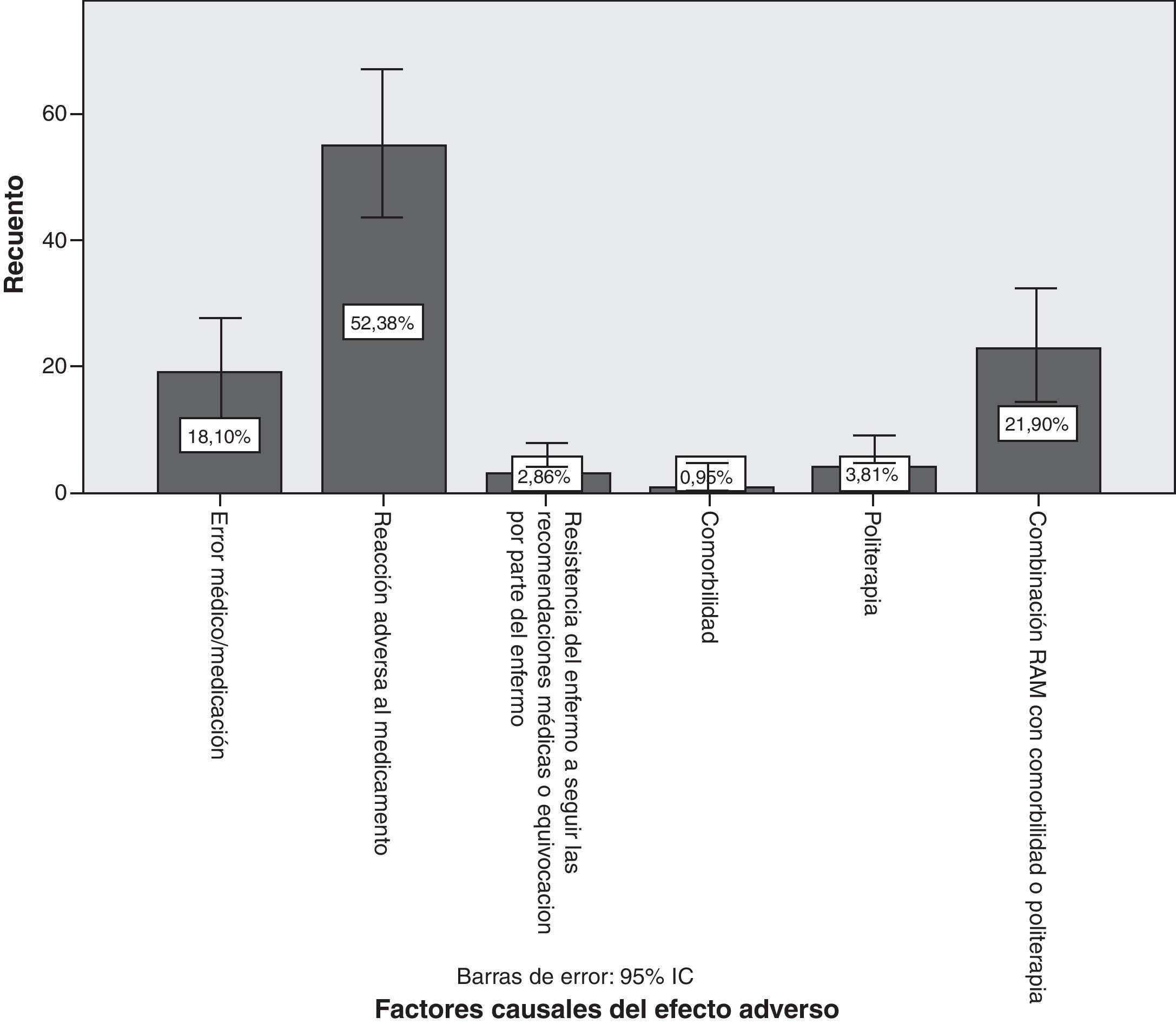
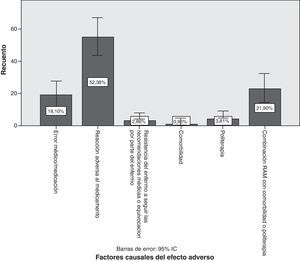
En relación con los factores causales (fig. 5), el 18,1% de los cuadros neurológicos se notificaron como error médico o de medicación: prescripción de sulpirida y derivados a pacientes con enfermedad de Parkinson conocida; uso prolongado (durante años) de antivertiginosos, antieméticos y procinéticos; medicamentos que contienen magnesio y calcio-antagonistas a pacientes con miastenia gravis; fármacos prescritos sin atender a comorbilidades como insuficiencia renal y hepática; sobredosificación por no tener en cuenta interacciones entre antiepilépticos registradas en ficha técnica —valproico y lamotrigina—; dosis no recomendadas de inicio de antidepresivos, relajantes musculares y analgésicos opiáceos y combinaciones de estos. Se demostró asociación estadística significativa entre el error como factor causal y los fármacos antivertiginosos/procinéticos con p=0,042 con un 95% de seguridad. De la totalidad de errores médicos, el 6,67% se relaciona con la prescripción de antivertiginosos o procinéticos.
El 52,4% (IC del 95%, 42,8-61,9%) se registraron como reacciones adversas medicamentosas (RAM) y, por tanto, difícilmente evitables. La proporción de pacientes con RAM era mayor en el grupo con antecedente psiquiátrico, seguido del antecedente de enfermedad neurológica y factores de riesgo cardiovascular (p=0,025). En el 21,9% (IC del 95%, 13,9-29,8%) de los casos se combinaron las RAM con las comorbilidades y posiblemente la politerapia, correspondiendo muchos de los pacientes de este último grupo a enfermos neurológicos conocidos de larga evolución. Así, los pacientes que tomaban antiparkinsonianos suponían un porcentaje mayor que aquéllos en tratamiento con otros fármacos (p=0,000).
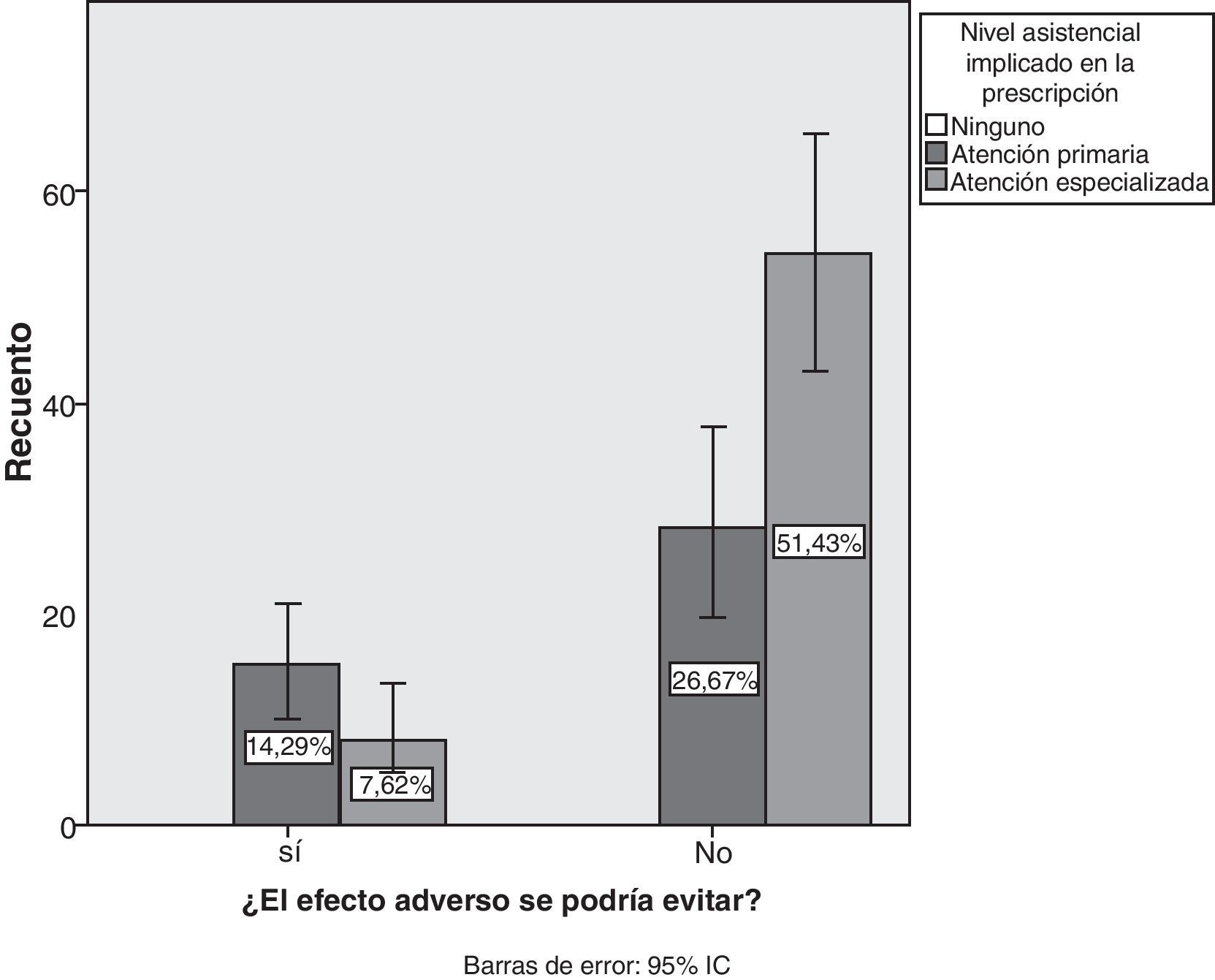
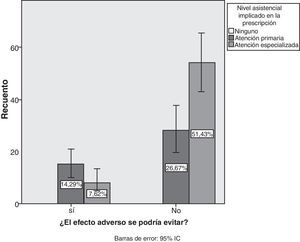
Estudiando el origen de los EA, la prescripción en el 41% (IC del 95%, 31,5-50,4%) procedía de atención primaria y el 59% (IC del 95%, 49,5-68,4%) de atención especializada. Solo se consideraron evitables un 21,9% de los EA (IC del 95%, 14-29,8%) e inevitables, el 78,10% (IC del 95%, 70-86%). El análisis de contingencia entre la evitabilidad y el nivel asistencial de prescripción demuestra que el porcentaje más elevado de evitabilidad correspondía a la atención primaria (p=0,007) (fig. 6).
En relación con el impacto de los EA, el 91,4% (IC del 95%, 86-96,7%) de los pacientes sufrieron un daño temporal leve, en contraste con el 8,6% (IC del 95%, 3,2-13,9%) que se encontraron en situación crítica. Estos últimos fueron pacientes con miastenia y crisis inducidas por fármacos que contenían magnesio y calcioantagonistas; pacientes en estatus epiléptico en tratamiento con neurolépticos, y pacientes con estado semicomatoso en tratamiento con sedantes, analgésicos y antiepilépticos.
El 93,3% (IC del 95%, 88,6-98%) de los casos requirió algún tipo de asistencia, desde suspensión del fármaco y revisión posterior, hasta la realización de pruebas complementarias, la necesidad de instaurar un tratamiento con múltiples revisiones o cuidados intensivos. Solo el 6,7% (IC del 95%, 1,9-11,5%) no requirió ningún tipo de asistencia. Se detectó que los casos de mayor gravedad ocurrieron en el primer nivel asistencial. No se pudo demostrar estadísticamente que el impacto del EA sobre el paciente tuviera relación con el nivel asistencial (p=0,058).
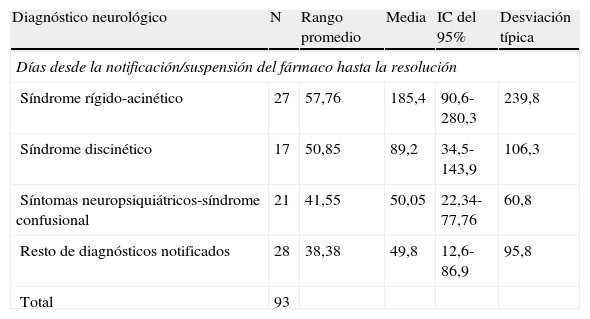
Para evaluar las diferencias en el tiempo medio de resolución del síndrome en los principales diagnósticos se hizo una valoración por la prueba Kruskal-Wallis, encontrando diferencias estadísticamente significativas entre los distintos grupos (p=0,038) (tabla 6).
Tabla de Kruskal-Wallis. Tiempo medio de resolución en cada diagnóstico neurológico
| Diagnóstico neurológico | N | Rango promedio | Media | IC del 95% | Desviación típica |
| Días desde la notificación/suspensión del fármaco hasta la resolución | |||||
| Síndrome rígido-acinético | 27 | 57,76 | 185,4 | 90,6-280,3 | 239,8 |
| Síndrome discinético | 17 | 50,85 | 89,2 | 34,5-143,9 | 106,3 |
| Síntomas neuropsiquiátricos-síndrome confusional | 21 | 41,55 | 50,05 | 22,34-77,76 | 60,8 |
| Resto de diagnósticos notificados | 28 | 38,38 | 49,8 | 12,6-86,9 | 95,8 |
| Total | 93 | ||||
El presente estudio es el primero que estima la frecuencia de EA específicamente neurológicos y los relaciona con determinados fármacos, comorbilidades y niveles asistenciales. La finalidad última es mostrar las necesidades asistenciales que se derivaron de las actuaciones médicas y la evitabilidad de estas, hechos recientemente revisados en nuestro entorno6,10.
Según los resultados obtenidos, el sexo femenino, una edad en torno a los 62 años, la presencia de comorbilidades principalmente neurológicas (de larga evolución) y psiquiátricas, y la polifarmacia son las características más frecuentes encontradas en nuestra muestra. Aunque el diseño de nuestro estudio no permite demostrar que sean factores de riesgo, sí sugiere que puede tratarse de una población de individuos más susceptibles, en la que sería recomendable un alto nivel de alarma. Ya se había descrito que la politerapia y la ancianidad eran factores de riesgo conocidos para las RAM en general10. La presencia de síndrome rígido-acinético, discinético, neuropsiquiátrico y confusional debe alertar al clínico acerca de la posibilidad de que su origen sea medicamentoso. Esto es más destacable en el mayor rango de edad, en el que además el tiempo de resolución de los síntomas es más prolongado, lo que conlleva mayor riesgo de cronicidad. Por el contrario, en la población más joven se han observado más reacciones idiosincráticas, como discinesias, principalmente temblor, en relación con el uso de fármacos antiepilépticos. Una anamnesis exhaustiva debería indagar acerca de todas las prescripciones médicas y el tiempo de administración, hecho destacado previamente en la literatura24. Determinados grupos farmacológicos serían de especial atención, teniendo en cuenta las asociaciones más frecuentemente encontradas: síndromes discinéticos y antiepilépticos, antiparkinsonianos y síndrome neuropsiquiátrico, neurolépticos (incluyendo antivertiginosos y procinéticos-antieméticos) y síndrome rígido-acinético. Una mayor precaución se tendría en pacientes con enfermedades neurológicas de larga evolución, en los que el margen terapéutico es estrecho, lo que obliga a prescribir fármacos asumiendo la mayor frecuencia de RAM. Apoyado por nuestros datos, en esta población se tendría que revisar frecuentemente la medicación habitual, retirar aquellos fármacos innecesarios o fuera de la indicación médica, evitar darlos más allá del tiempo aconsejado y seleccionar las prescripciones de nuevos fármacos en función del tipo de enfermedad neurológica. En este sentido, ciertos fármacos pueden suponer un riesgo vital para determinados pacientes como los miasténicos y en otros casos el tiempo prolongado de tratamiento aumenta el riesgo de desarrollo de síndromes crónicos y difíciles de manejar como las discinesias tardías.
Según nuestras observaciones en el grupo seleccionado, la prevalencia de EA neurológicos fue del 0,586% respecto a la muestra total inicial, de los cuales fueron evitables el 0,12% y no evitables el 0,457%. Dado que el 59% de los EA se notificaron en consultas externas, si atendemos al volumen total de enfermos vistos, encontramos que un 0,36% de los pacientes remitidos a consultas tenían EA. Estas cifras parecen indicar un menor impacto que en estudios previos, donde se describía hasta un 5,1% de RAM neurológicos (APEAS)21, o un 5,3% de RAM como causa de ingreso hospitalario en general10. Por otro lado, el 21,9% de las notificaciones procedían de hospitalización, por lo que respecto al total de ingresos en el periodo de estudio, el 2,89% correspondía a EA secundarios a fármacos. Estas cifras son similares a las descritas previamente, que definían las RAM como causa de un 2,7% de los ingresos en un departamento neurológico25.
La baja prevalencia obtenida en nuestro estudio en comparación con otros previos, puede explicarse por el tipo de diseño y los posibles sesgos que conlleva. Así, al tratarse de un estudio a nivel hospitalario, sólo se registraron los sujetos remitidos directamente a neurología, sin quedar constancia de los pacientes que se analizaron en atención primaria y no se consideraron tributarios de derivación ni de los sujetos atendidos en otros servicios hospitalarios (medicina interna, UCI). En todos estos casos, es posible que el índice de sospecha de EA fuera bajo, sobre todo ante síndromes neurológicos menos conocidos. Otras posibilidades que se deben considerar son que la causa farmacológica fuera detectada y tratada incluso desde el primer nivel asistencial, que hubiera fallecimientos, o que los síntomas se resolvieran antes de la consulta neurológica.
Otro factor que se debe considerar en la baja prevalencia obtenida es la exclusión de pacientes que al terminar el seguimiento mantenían la clínica, aun presuponiendo que el origen podría ser un fármaco, como los casos comentados previamente de discinesias tardías, dependencia de psicotropos o toma de antiarrítmicos.
Por otro lado, en nuestra serie se ha registrado una muy baja frecuencia de síndromes comunes dentro de la neurología, como son las discinesias secundarias al tratamiento dopaminérgico en enfermos parkinsonianos. Creemos que la explicación también está en el diseño del estudio: al ser efectos adversos muy conocidos para el neurólogo, podrían no haberse considerado al no tratarse de un motivo «nuevo» de consulta en enfermos ya diagnosticados de Parkinson, por lo que muchos no se incluyeron en el grupo seleccionado. Además, al ser un grupo con muy estrecho margen terapéutico, un periodo de seguimiento de meses puede ser insuficiente en muchos casos para observar mejorías tras cambios de tratamiento.
Aunque la proporción de EA haya sido inferior en atención primaria, los casos más críticos ocurrieron en este nivel. Esto nos lleva a alertar sobre la asistencia a pacientes con enfermedades crónicas con riesgo alto de presentar EA graves y potencialmente evitables (miastenia gravis, epilepsia y Parkinson). En atención especializada los casos eran, en su mayoría, leves, predecibles, no evitables, pero llama la atención la dificultad para el acuerdo interdisciplinar y para sospechar la causa de los síntomas.
Finalmente, el interés de nuestros resultados radica en potenciar el conocimiento y aumentar el nivel de alarma para reconocer tras una anamnesis detallada y una minuciosa exploración clínica, que el síndrome neurológico puede estar asociado a un fármaco concreto, evitando «etiquetar» al paciente con un diagnóstico de enfermedad y realizar pruebas complementarias o tratamientos innecesarios no exentos de riesgos, con el consumo de recursos sanitarios que conlleva. Nuestro estudio puede que sólo muestre «la punta del iceberg». Deberían incentivarse trabajos que obvien nuestras limitaciones e incluyan la colaboración de todos los niveles asistenciales, para conocer la epidemiología, proponer un planteamiento docente específico26,27, identificar las medidas más seguras y, por último, reducir necesidades asistenciales, sin olvidar el impacto del diagnóstico en el paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados preliminares de este trabajo fueron expuestos en presentación póster en la LXII Reunión anual de la Sociedad Española de Neurología.