La neumonía asociada al ictus es una complicación relacionada con mal pronóstico. Las escalas A2DS2 e ISAN se han desarrollado recientemente por un grupo alemán e inglés, respectivamente, para predecir la neumonía intrahospitalaria tras un ictus agudo. Realizamos una validación externa de estas escalas en una serie consecutiva de pacientes ingresados por ictus isquémico en nuestro centro.
MétodoEl modelo pronóstico se realiza sobre una muestra de 340 sujetos consecutivos ingresados por ictus en 2015. La discriminación se evaluó mediante el cálculo del área bajo la curva de eficacia diagnóstica (curva ROC). La calibración se evaluó mediante la realización del test de bondad de ajuste de Hosmer-Lemeshow y la representación gráfica de la curva. Se realiza un análisis de regresión logística para determinar los predictores independientes de infección respiratoria después del ictus.
ResultadosLa muestra final evaluada fue de 285 sujetos, entre los cuales 45 pacientes (15,8%) tuvieron infección respiratoria tras el ictus según unos criterios preestablecidos. La edad media de los pacientes fue de 71,01(DE 12,62) años. De ellos, 177 (62,1%) fueron varones. Setenta y dos pacientes (25,3%) tenían síntomas o signos de disfagia, 42 (14,7%) tenían fibrilación auricular, 14 (4,9%) tenían situación de dependencia previa al ictus y la mediana de la puntuación NIHSS fue de 4 puntos. La puntuación media de la escala A2DS2 fue 3,25 (DE 2,54) y la de ISAN fue 6,49 (DE 3,64). El análisis muestra que por cada punto en la escala A2DS2 se incrementa el riesgo de infección respiratoria (OR=1,576; IC 95%: 1,363-1,821), al igual que en la escala ISAN (OR=1,350; IC 95%: 1,214-1,501).
ConclusiónLa puntuación alta en las escalas A2DS2 e ISAN son un fuerte predictor de infección respiratoria asociada al ictus agudo en una cohorte consecutiva de pacientes con ictus. Estas escalas son simples de usar y realizar, siendo herramientas prometedoras para la predicción de esta complicación en la práctica habitual.
Pneumonia as a complication of stroke is associated with poor outcomes. The A2DS2 and ISAN scales were developed by German and English researchers, respectively, to predict in-hospital stroke-associated pneumonia. We conducted an external validation study of these scales in a series of consecutive patients admitted to our hospital due to ischaemic stroke.
MethodThese predictive models were applied to a sample of 340 consecutive patients admitted to hospital in 2015 due to stroke. Discrimination was assessed by calculating the area under the ROC curve for diagnostic efficacy. Calibration was assessed using the Hosmer-Lemeshow goodness-of-fit test and graphing the corresponding curve. Logistic regression analysis was performed to determine the independent predictors of respiratory infection secondary to stroke.
ResultsWe included 285 patients, of whom 45 (15.8%) had respiratory infection after stroke according to the study criteria. Mean age was 71.01±12.62 years; men accounted for 177 of the patients (62.1%). Seventy-two patients (25.3%) had signs or symptoms of dysphagia, 42 (14.7%) had atrial fibrillation, and 14 (4.9%) were functionally dependent before stroke; the median NIHSS score was 4 points. Mean scores on A2DS2 and ISAN were 3.25±2.54 and 6.49±3.64, respectively. Our analysis showed that higher A2DS2 scores were associated with an increased risk of infection (OR=1.576; 95% CI: 1.363-1.821); the same was true for ISAN scores (OR=1.350; 95% CI: 1.214-1.501).
ConclusionHigh scores on A2DS2 and ISAN were found to be a strong predictor of respiratory infection associated with acute stroke in a cohort of consecutive patients with stroke. These easy-to-use scales are promising tools for predicting this complication in routine clinical practice.
Las infecciones se presentan en el 5-40% de los pacientes con ictus en la fase aguda1-6. Estos pacientes que desarrollan infección, especialmente neumonía, experimentan un peor pronóstico clínico y tienen mayor riesgo de muerte7-10.
El riesgo de infección se relaciona fundamentalmente con el estado clínico y la edad del paciente11 y suele ocurrir entre el día 2 y el día 7 tras el inicio del ictus12,13. Los pacientes con ictus más severos y que cursan con bajo nivel de conciencia muestran tasas más altas de infección, en particular de neumonía11,14-19. El riesgo de aspiración se incrementa en estos pacientes por la pérdida del reflejo de deglución y el bajo nivel de conciencia. Muchos de los pacientes con neumonía presentan disfagia y esta favorece la aspiración de material orofaríngeo o de contenido gástrico2.
La infección afecta al pronóstico del ictus por varias vías: prolongación de la inmovilización, mayor fragilidad y retraso en la rehabilitación por mayor estancia hospitalaria. Además, la infección —sobre todo respiratoria— incrementa de una forma muy importante el coste del proceso3,5,6. Según datos de un estudio estadounidense, el ictus para pacientes con neumonía tendría un coste incremental de más de 14.836 dólares; además, y de forma significativa, los pacientes con neumonía necesitarían una extensión de los cuidados (OR 1,73; 95% CI: 1,32-2,26)20.
La recomendación actual es tratar las infecciones de forma precoz, pero no está indicada la administración profiláctica de antibióticos21. Los ensayos clínicos realizados hasta el momento para evaluar si la antibioticoterapia preventiva mejora las tasas de infección no han tenido la suficiente potencia para demostrarlo22. Identificar a los pacientes que en el momento del ingreso tienen un mayor riesgo de sufrir una infección respiratoria aguda (IRA) tras el ictus puede ayudar en el manejo de este proceso17,19.
Estos modelos de predicción deben estar basados en marcadores patogénicamente relevantes, que estén presentes en las primeras 24h y sean sencillos de conseguir17. En los últimos años se han publicado diferentes modelos predictivos, como por ejemplo: Pneumonia score11, Chumbler's score14, AIS-APS score16, PANTHERIS score17, ISAN score19 o la A2DS2 score15. Estas 2 últimas escalas son especialmente sencillas de utilizar y los datos necesarios pueden ser recogidos de manera sistemática en el momento del ingreso en las unidades de ictus. El objetivo de nuestro estudio es validar el poder predictor de IRA de las escalas ISAN y A2DS2 en una cohorte consecutiva de pacientes con ictus isquémico.
MétodoSe incluyen los pacientes ingresados consecutivamente por un ictus isquémico agudo durante el año 2015; todos los casos fueron confirmados mediante resonancia magnética cerebral. Se excluyeron los pacientes con ataque isquémico transitorio o ictus minor, ictus de más de 72h desde el inicio de los síntomas y aquellos con síntomas o signos de infección en el momento de su ingreso.
Se recogieron las siguientes variables: 1) demográficas (edad y sexo); factores de riesgo vascular (hipertensión, diabetes mellitus, dislipidemia, fibrilación auricular, cardiopatía isquémica, ictus o AIT previo, historia de hábito tabáquico o enolismo, demencia y Rankin previo); 2) gravedad del ictus al ingreso según la escala National Institute of Health Stroke Scale (NIHSS) y presencia de disfagia mediante test de cribado o evaluación clínica, y 3) las variables pronósticas: IRA, estancia media, situación funcional al alta y mortalidad hospitalaria.
La IRA fue definida de acuerdo con el estudio PANTHERIS23 como la presencia de al menos uno de los criterios A y al menos uno de los criterios B siguientes: A) examen respiratorio anormal o infiltrados pulmonares en la radiografía de tórax; B) tos con expectoración purulenta, cultivos microbiológicos, hemocultivos positivos, leucocitosis o elevación de PCR. A esta definición se añadió la necesidad de tratamiento antibiótico. Por protocolo no utilizamos antibióticos de forma profiláctica para prevenir la infección respiratoria.
La escala A2DS2 se calculó según la puntuación siguiente: edad mayor o igual a 75 años=1, fibrilación auricular=1, disfagia=2, sexo masculino=1, puntuación en la NIHSS: 0-4=0; 5-15=3, y más de 16=515. La escala la dicotomizamos en riesgo bajo (0-4) y alto (5-10) para facilitar el análisis, tal y como se ha hecho en otros estudios de validación18,19.
La escala ISAN se calculó según la puntuación siguiente: edad categorizada <60 años=0; 60-69=3; 70-79=4; 80-89=6, y más de 90 años=8, sexo masculino=1, puntuación en la NIHSS al ingreso: 0-4=0; 5-15=4; 16-20=8, y más de 21=10, y situación de dependencia previa al ictus=2 puntos19. La escala la categorizamos en 4 grupos de riesgo (bajo [0-5], medio [6-10], alto [11-14], y muy alto [más de 14])19.
Análisis estadísticoLos datos se presentan como la media±desviación estándar (DE), la mediana con rangos intercuartil (IQR), y las frecuencias con porcentajes, según el caso. Las variables continuas se analizaron con la t de Student o la prueba de Kruskal-Wallis y las variables categóricas se analizaron con el test de chi-cuadrado. La puntuación A2DS2 se analizó tanto como variable continua como binaria. Para estimar la fuerza de asociación cruda y ajustada de las variables que conforman las escalas A2DS2 e ISAN, los análisis de regresión logística se realizaron con la variable pronóstico neumonía como resultado binario. Las probabilidades calculadas con el modelo de regresión se utilizaron para el cálculo de la curva ROC; un estadístico C de 0,5 indica que no hay capacidad, mientras que un estadístico C de 1 indica una perfecta habilidad del modelo para discriminar entre pacientes con o sin neumonía durante la hospitalización. Como pruebas de bondad de ajuste utilizamos R2 de Cox y Snell, y Nagelkerke. Todas las pruebas fueron de 2 colas y los valores de p<0,05 se consideraron estadísticamente significativos. Los análisis estadísticos se realizaron con el paquete de software SPSS 19.0.
Cuestiones éticasEl estudio fue valorado y aprobado por el comité de ética de nuestro Hospital. No hubo consentimiento de los pacientes, pero para el análisis todos los datos se incluyeron en una base de datos específica para el estudio y se analizaron de forma completamente anónima.
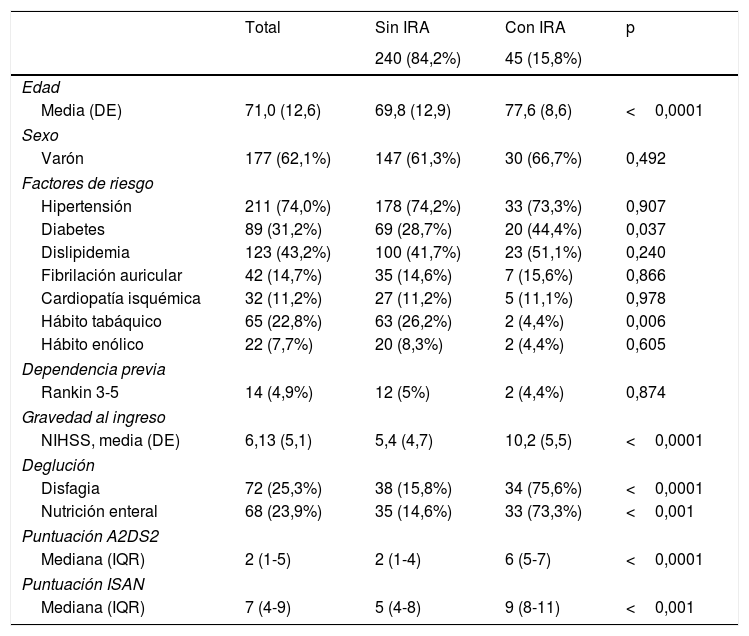
ResultadosSe analizaron 340 pacientes, de los cuales 55 presentaban alguno de los criterios de exclusión. La muestra final evaluada fue de 285 sujetos, entre los cuales 45 pacientes (15,8%) tuvieron infección respiratoria tras el ictus según los criterios establecidos. La edad media de los pacientes fue de 71,01(DE 12,62) años. De ellos, 177 (62,1%) fueron varones. Setenta y dos pacientes (25,3%) tenían síntomas o signos de disfagia, 42 (14,7%) tenían fibrilación auricular, 14 (4,9%) tenían situación de dependencia previa al ictus y la mediana de la puntuación NIHSS fue de 4 puntos. Los subtipos etiológicos por orden de frecuencia fueron: cardioembólicos 104 (36,1%), indeterminados 67 (23,5%), aterotrombóticos 64 (22,5%), lacunares 43 (15,1%) e inhabituales 8 (2,8%). La puntuación media de la escala A2DS2 fue 3,25 (DE 2,54) y la de la ISAN fue 6,49 (DE 3,64). Un 74,7% (195) de los pacientes estaban en el grupo de bajo riesgo en la escala A2DS2 y un 25,3% (72) se encontraban en el grupo de puntuación alta. La tabla 1 ofrece un resumen de las características de la población.
Características de la población de estudio
| Total | Sin IRA | Con IRA | p | |
|---|---|---|---|---|
| 240 (84,2%) | 45 (15,8%) | |||
| Edad | ||||
| Media (DE) | 71,0 (12,6) | 69,8 (12,9) | 77,6 (8,6) | <0,0001 |
| Sexo | ||||
| Varón | 177 (62,1%) | 147 (61,3%) | 30 (66,7%) | 0,492 |
| Factores de riesgo | ||||
| Hipertensión | 211 (74,0%) | 178 (74,2%) | 33 (73,3%) | 0,907 |
| Diabetes | 89 (31,2%) | 69 (28,7%) | 20 (44,4%) | 0,037 |
| Dislipidemia | 123 (43,2%) | 100 (41,7%) | 23 (51,1%) | 0,240 |
| Fibrilación auricular | 42 (14,7%) | 35 (14,6%) | 7 (15,6%) | 0,866 |
| Cardiopatía isquémica | 32 (11,2%) | 27 (11,2%) | 5 (11,1%) | 0,978 |
| Hábito tabáquico | 65 (22,8%) | 63 (26,2%) | 2 (4,4%) | 0,006 |
| Hábito enólico | 22 (7,7%) | 20 (8,3%) | 2 (4,4%) | 0,605 |
| Dependencia previa | ||||
| Rankin 3-5 | 14 (4,9%) | 12 (5%) | 2 (4,4%) | 0,874 |
| Gravedad al ingreso | ||||
| NIHSS, media (DE) | 6,13 (5,1) | 5,4 (4,7) | 10,2 (5,5) | <0,0001 |
| Deglución | ||||
| Disfagia | 72 (25,3%) | 38 (15,8%) | 34 (75,6%) | <0,0001 |
| Nutrición enteral | 68 (23,9%) | 35 (14,6%) | 33 (73,3%) | <0,001 |
| Puntuación A2DS2 | ||||
| Mediana (IQR) | 2 (1-5) | 2 (1-4) | 6 (5-7) | <0,0001 |
| Puntuación ISAN | ||||
| Mediana (IQR) | 7 (4-9) | 5 (4-8) | 9 (8-11) | <0,001 |
A2DS2: acrónimo de Age, Atrial fibrillation, Dysphagia, Sex, Stroke severity; DE: desviación estándar; IQR: rango intercuartil; IRA: infección respiratoria aguda; ISAN: acrónimo de Independence, Sex, Age, NIHSS; NIHSS: National Institutes of Health Stroke Scale.
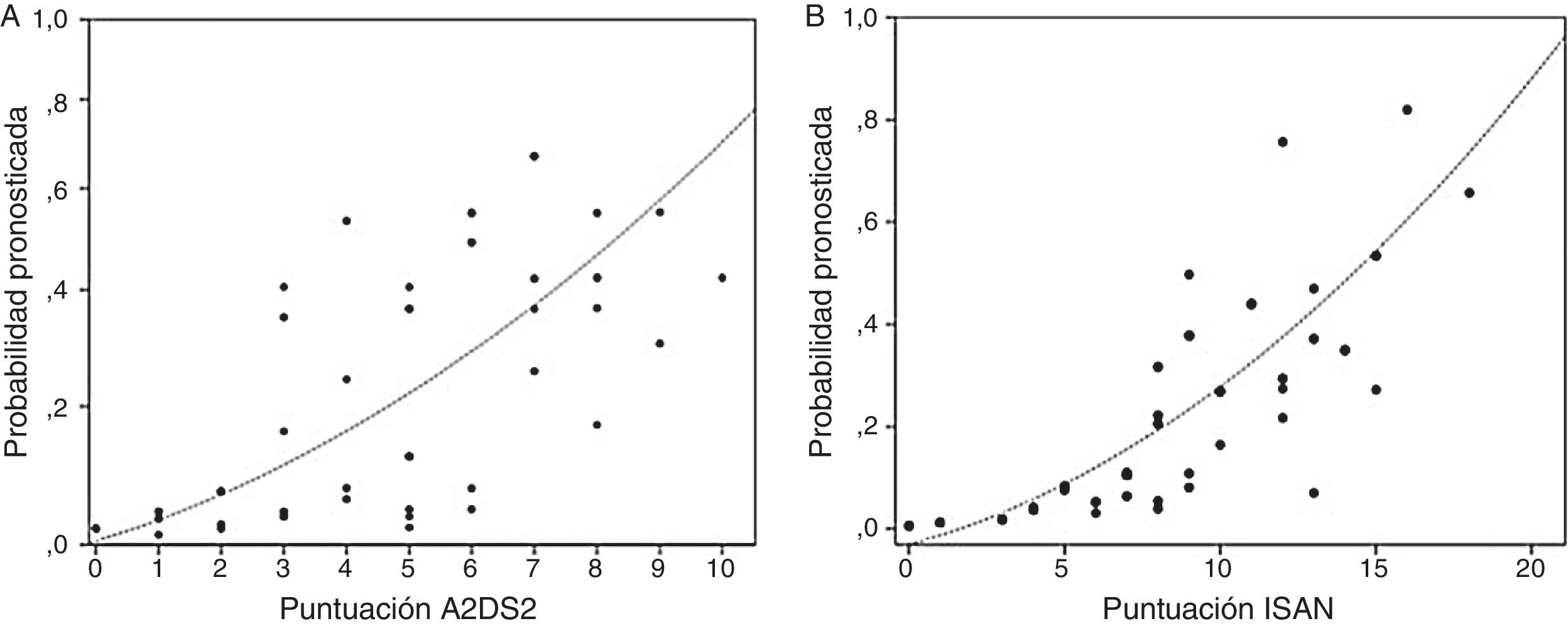
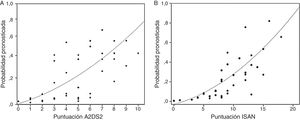
La tasa de incidencia de IRA durante la hospitalización en los grupos de baja y alta puntuaciones fueron del 5,1 y del 38,9% (p<0,0001), respectivamente. La frecuencia de IRA en las 4 categorías de riesgo (bajo, medio, alto y muy alto) según la escala ISAN fue 4,7, 22,2, 28,1 y 57,1%, respectivamente (fig. 1A,B).
Durante la hospitalización, un 0,5% de los pacientes con A2DS2 de bajo riesgo y un 7,8% de los del grupo de alto riesgo fallecieron (p<0,002). La estancia media fue 6,4 (IC 95%: 4,6-8,1) días mayor en el grupo de alta puntuación en la escala (p<0,0001).
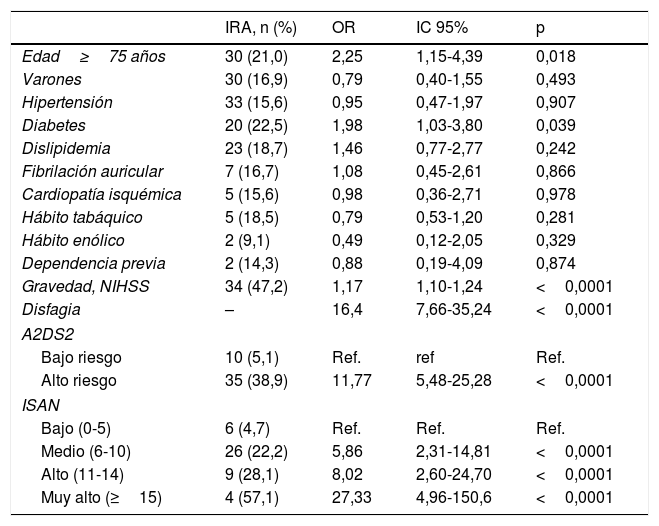
El análisis univariante mostró que la edad, la disfagia, la puntuación NIHSS en el momento del ingreso, la diabetes, y la puntuación más alta de las escalas A2DS2 e ISAN fueron factores de riesgo para IRA (tabla 2). El análisis muestra que por cada punto en la escala A2DS2 se incrementa el riesgo de IRA (OR=1,576; IC 95%: 1,363-1,821), al igual que en la escala ISAN (OR=1,350; IC 95%: 1,214-1,501). Los sujetos del grupo de riesgo alto en la A2DS2 tenían significativamente mayor riesgo de IRA (OR=11,773; IC 95%: 5,481-25,288) que el grupo de baja puntuación. Para la escala ISAN existe un gradiente significativo de mayor riesgo de IRA para los grupos de mayor puntuación comparado con el grupo de bajo riesgo, siendo las OR 5,86 (IC 95%: 2,31-14,81), 8,02 (IC 95%: 2,60-24,70) y 27,33 (IC 95%: 4,96-150,60) para los grupos de riesgo medio, alto y muy alto, respectivamente.
Análisis univariante de los factores asociados con la infección respiratoria asociada al ictus
| IRA, n (%) | OR | IC 95% | p | |
|---|---|---|---|---|
| Edad≥75 años | 30 (21,0) | 2,25 | 1,15-4,39 | 0,018 |
| Varones | 30 (16,9) | 0,79 | 0,40-1,55 | 0,493 |
| Hipertensión | 33 (15,6) | 0,95 | 0,47-1,97 | 0,907 |
| Diabetes | 20 (22,5) | 1,98 | 1,03-3,80 | 0,039 |
| Dislipidemia | 23 (18,7) | 1,46 | 0,77-2,77 | 0,242 |
| Fibrilación auricular | 7 (16,7) | 1,08 | 0,45-2,61 | 0,866 |
| Cardiopatía isquémica | 5 (15,6) | 0,98 | 0,36-2,71 | 0,978 |
| Hábito tabáquico | 5 (18,5) | 0,79 | 0,53-1,20 | 0,281 |
| Hábito enólico | 2 (9,1) | 0,49 | 0,12-2,05 | 0,329 |
| Dependencia previa | 2 (14,3) | 0,88 | 0,19-4,09 | 0,874 |
| Gravedad, NIHSS | 34 (47,2) | 1,17 | 1,10-1,24 | <0,0001 |
| Disfagia | – | 16,4 | 7,66-35,24 | <0,0001 |
| A2DS2 | ||||
| Bajo riesgo | 10 (5,1) | Ref. | ref | Ref. |
| Alto riesgo | 35 (38,9) | 11,77 | 5,48-25,28 | <0,0001 |
| ISAN | ||||
| Bajo (0-5) | 6 (4,7) | Ref. | Ref. | Ref. |
| Medio (6-10) | 26 (22,2) | 5,86 | 2,31-14,81 | <0,0001 |
| Alto (11-14) | 9 (28,1) | 8,02 | 2,60-24,70 | <0,0001 |
| Muy alto (≥15) | 4 (57,1) | 27,33 | 4,96-150,6 | <0,0001 |
A2DS2: acrónimo de Age, Atrial fibrillation, Dysphagia, Sex, Stroke severity; IC: intervalo de confianza; IRA: infección respiratoria aguda; ISAN: acrónimo de Independence, Sex, Age, NIHSS; NIHSS: National Institutes of Health Stroke Scale; OR: odds ratio; Ref.: categoría de referencia.
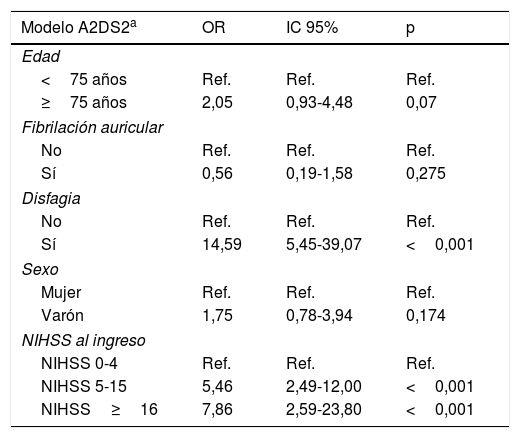
En esta cohorte de validación no todos los predictores individuales para la IRA de las escalas A2DS2 e ISAN mostraron una asociación significativa en el análisis multivariable (tabla 3).
Análisis multivariante de los modelos que componen las escalas evaluadas
| Modelo A2DS2a | OR | IC 95% | p |
|---|---|---|---|
| Edad | |||
| <75 años | Ref. | Ref. | Ref. |
| ≥75 años | 2,05 | 0,93-4,48 | 0,07 |
| Fibrilación auricular | |||
| No | Ref. | Ref. | Ref. |
| Sí | 0,56 | 0,19-1,58 | 0,275 |
| Disfagia | |||
| No | Ref. | Ref. | Ref. |
| Sí | 14,59 | 5,45-39,07 | <0,001 |
| Sexo | |||
| Mujer | Ref. | Ref. | Ref. |
| Varón | 1,75 | 0,78-3,94 | 0,174 |
| NIHSS al ingreso | |||
| NIHSS 0-4 | Ref. | Ref. | Ref. |
| NIHSS 5-15 | 5,46 | 2,49-12,00 | <0,001 |
| NIHSS≥16 | 7,86 | 2,59-23,80 | <0,001 |
| Modelo ISANb | OR | IC 95% | p |
|---|---|---|---|
| Edad | |||
| <60 | Ref. | Ref. | Ref. |
| 60-69 | 3,12 | 0,52-18,81 | 0,213 |
| 70-79 | 7,30 | 1,15-34,54 | 0,012 |
| 80-89 | 9,43 | 1,99-44,58 | 0,005 |
| ≥90 | 79,6 | 8,44-751,8 | <0,001 |
| Sexo | |||
| Mujer | Ref. | Ref. | Ref. |
| Varón | 2,12 | 0,95-4,75 | 0,065 |
| NIHSS al ingreso | |||
| 0-4 | Ref. | Ref. | Ref. |
| 5-15 | 6,69 | 2,90-15,46 | <0,001 |
| 16-20 | 9,77 | 2,81-33,98 | <0,001 |
| ≥21 | 4,13 | 0,21-78,21 | 0,344 |
| Situación pre-ictus | |||
| Independ. | Ref. | Ref. | Ref. |
| Depend. | 1,75 | 0,14-4,07 | 0,742 |
A2DS2: acrónimo de Age, Atrial fibrillation, Dysphagia, Sex, Stroke severity; IC: intervalo de confianza; ISAN: acrónimo de Independence, Sex, Age, NIHSS; NIHSS: National Institutes of Health Stroke Scale; OR: odds ratio; Ref.: categoría de referencia.
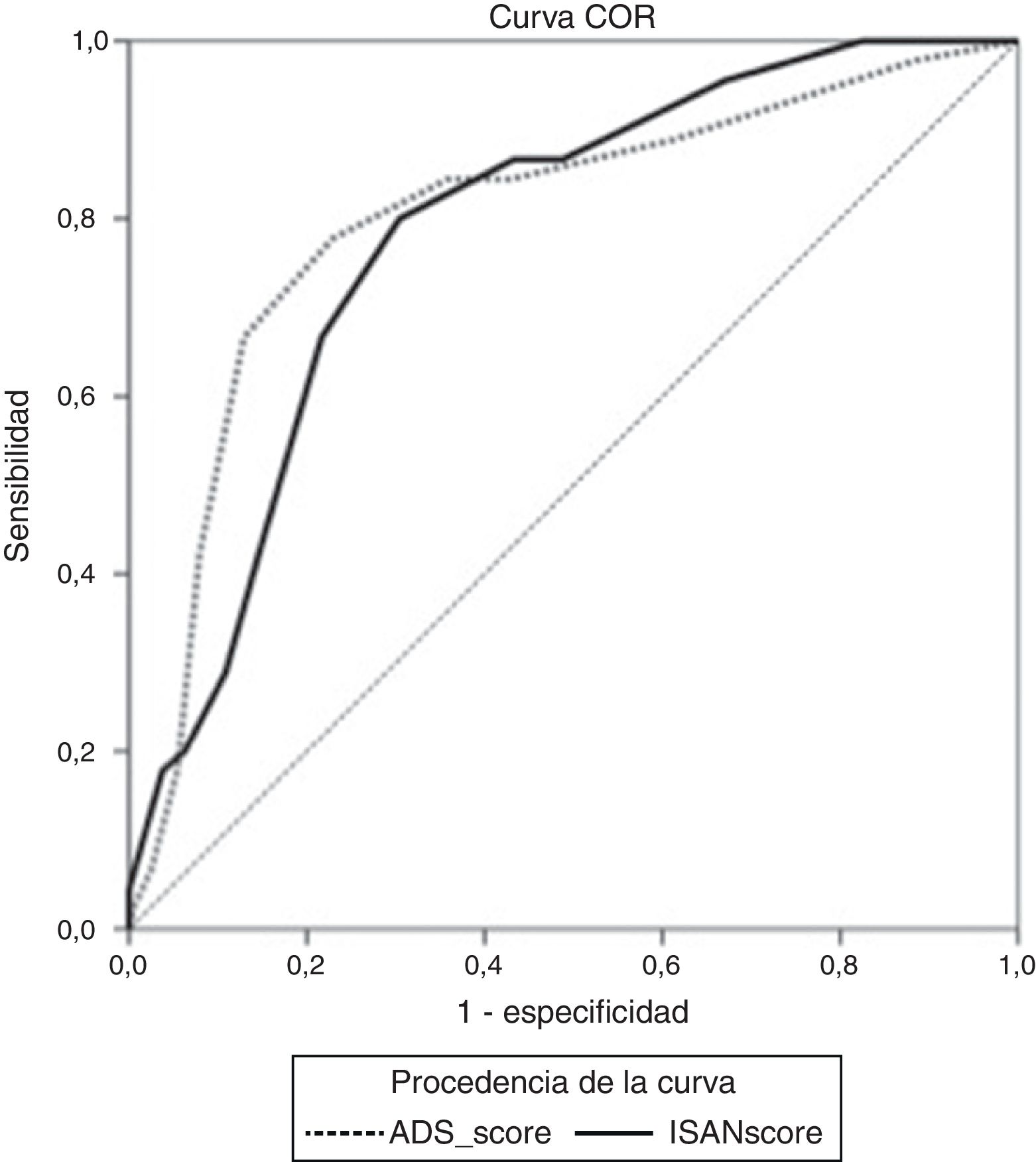
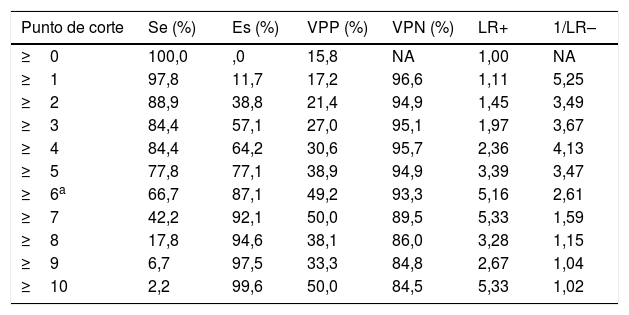
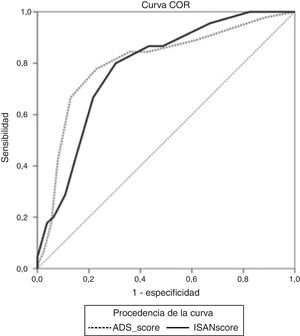
Los puntos de corte de sensibilidad y especificidad específica de la puntuación A2DS2 en nuestra cohorte de validación se muestran en la tabla 4. El punto de corte óptimo sería de 6 puntos, teniendo en cuenta una prevalencia de IRA en torno al 15%, con una sensibilidad del 66,67% (IC 95%: 52,07-78,64), una especificidad del 87,08% (IC 95%: 82,25-90,75), un valor predictivo positivo del 49,18% (IC 95%: 29,80-68,81) y negativo del 93,30% (IC 95%: 85,52-97,05). La escala muestra un excelente poder de discriminación (área bajo la curva ROC: 0,803 [IC 95%: 0,728-0,878]; p<0,0001) con adecuadas medidas de calibración (Cox & Snell R2: 0,153; Nagelkerke R2: 0,263) (fig. 2).
Capacidad discriminativa de cada puntuación de la escala A2DS2
| Punto de corte | Se (%) | Es (%) | VPP (%) | VPN (%) | LR+ | 1/LR– |
|---|---|---|---|---|---|---|
| ≥0 | 100,0 | ,0 | 15,8 | NA | 1,00 | NA |
| ≥1 | 97,8 | 11,7 | 17,2 | 96,6 | 1,11 | 5,25 |
| ≥2 | 88,9 | 38,8 | 21,4 | 94,9 | 1,45 | 3,49 |
| ≥3 | 84,4 | 57,1 | 27,0 | 95,1 | 1,97 | 3,67 |
| ≥4 | 84,4 | 64,2 | 30,6 | 95,7 | 2,36 | 4,13 |
| ≥5 | 77,8 | 77,1 | 38,9 | 94,9 | 3,39 | 3,47 |
| ≥6a | 66,7 | 87,1 | 49,2 | 93,3 | 5,16 | 2,61 |
| ≥7 | 42,2 | 92,1 | 50,0 | 89,5 | 5,33 | 1,59 |
| ≥8 | 17,8 | 94,6 | 38,1 | 86,0 | 3,28 | 1,15 |
| ≥9 | 6,7 | 97,5 | 33,3 | 84,8 | 2,67 | 1,04 |
| ≥10 | 2,2 | 99,6 | 50,0 | 84,5 | 5,33 | 1,02 |
A2DS2: acrónimo de Age, Atrial fibrillation, Dysphagia, Sex, Stroke severity; Es: especificidad; LR+: likelihood ratio positivo; LR–: likelihood ratio negativo; NA: no aplicable; Se: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
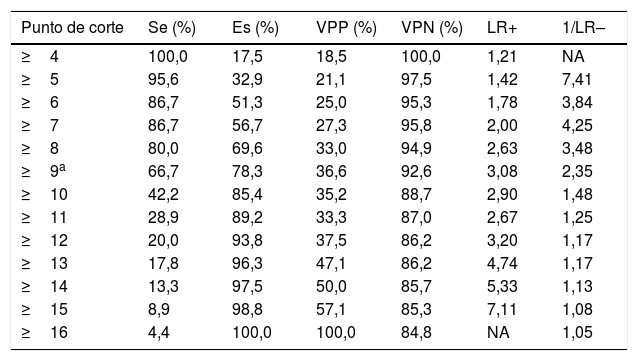
Los puntos de corte de sensibilidad y especificidad específica de la puntuación ISAN en nuestra cohorte de validación se muestran en la tabla 5. El punto de corte óptimo sería de 9 puntos, teniendo en cuenta una prevalencia de IRA en torno al 15%, con una sensibilidad del 66,67% (IC 95%: 52,07-78,64), una especificidad del 78,33% (IC 95%: 72,70-83,08), un valor predictivo positivo del 36,59% (IC 95%: 21,56-54,77) y negativo del 92,61% (IC 95%: 84,12-96,74). La escala muestra un buen poder de discriminación (área bajo la curva ROC: 0,783 [IC95%: 0,731-0,829]; p<0,0001) con adecuadas medidas de calibración (Cox & Snell R2: 0,125; Nagelkerke R2: 0,215) (fig. 2).
Capacidad discriminativa de cada puntuación de la escala ISAN
| Punto de corte | Se (%) | Es (%) | VPP (%) | VPN (%) | LR+ | 1/LR– |
|---|---|---|---|---|---|---|
| ≥4 | 100,0 | 17,5 | 18,5 | 100,0 | 1,21 | NA |
| ≥5 | 95,6 | 32,9 | 21,1 | 97,5 | 1,42 | 7,41 |
| ≥6 | 86,7 | 51,3 | 25,0 | 95,3 | 1,78 | 3,84 |
| ≥7 | 86,7 | 56,7 | 27,3 | 95,8 | 2,00 | 4,25 |
| ≥8 | 80,0 | 69,6 | 33,0 | 94,9 | 2,63 | 3,48 |
| ≥9a | 66,7 | 78,3 | 36,6 | 92,6 | 3,08 | 2,35 |
| ≥10 | 42,2 | 85,4 | 35,2 | 88,7 | 2,90 | 1,48 |
| ≥11 | 28,9 | 89,2 | 33,3 | 87,0 | 2,67 | 1,25 |
| ≥12 | 20,0 | 93,8 | 37,5 | 86,2 | 3,20 | 1,17 |
| ≥13 | 17,8 | 96,3 | 47,1 | 86,2 | 4,74 | 1,17 |
| ≥14 | 13,3 | 97,5 | 50,0 | 85,7 | 5,33 | 1,13 |
| ≥15 | 8,9 | 98,8 | 57,1 | 85,3 | 7,11 | 1,08 |
| ≥16 | 4,4 | 100,0 | 100,0 | 84,8 | NA | 1,05 |
ISAN: acrónimo de Independence, Sex, Age, NIHSS; Es: especificidad; LR+: likelihood ratio positivo; LR–: likelihood ratio negativo; NA: no aplicable; Se: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En los últimos años se han introducido numerosos cambios en la atención al ictus que han cambiado de forma clara y positiva la evolución de este proceso, pero a pesar ello, el impacto de la infección sobre el pronóstico, la mortalidad y el coste ha cambiado poco2,9,20,24. Predecir cuáles son los pacientes con un mayor riesgo de presentar esta grave complicación es importante para individualizar los cuidados y para poder estratificar a los pacientes en ensayos sobre terapias preventivas19,21. Se han publicado varios modelos de predicción con el objetivo de obtener y validar internamente una puntuación que prediga el riesgo clínico de neumonía11,14-17,19. Las escalas A2DS2 e ISAN exhibieron una excelente discriminación y calibración en sus cohortes nacionales de derivación y validación15,19, siendo necesaria una validación externa de las mismas que ha sido el motivo de nuestro estudio.
Hemos optado por validar estas 2 escalas por su utilidad de predicción en la práctica clínica habitual. Como es sabido, la IRA se desarrolla con mayor frecuencia en los primeros días tras el ictus1, así las estrategias de prevención deberían administrarse tan pronto como sea posible tras el ingreso hospitalario. La ventaja de estas 2 escalas es que están compuestas por parámetros válidos, fiables, fácilmente disponibles y rápidos de aplicar en las primeras 24-48h15,18,19.
La escala A2DS2 incluye 5 variables: edad, fibrilación auricular, presencia de disfagia, sexo masculino, y puntuación en la NIHSS15. De estas, la disfagia es el único parámetro que puede tener cierta variabilidad en su forma de medirse y cuyo diagnóstico puede tener mayor complejidad; la frecuencia de disfagia depende del método de diagnóstico, siendo superior si se utiliza una evaluación instrumental (videofluoroscopia o nasofibrolaringoscopia) que si se utilizan técnicas de cribado o de evaluación clínica25. La mayoría de unidades de ictus incluyen en sus protocolos test de cribado de disfagia que permiten de una forma fiable medir este parámetro. La presencia de fibrilación auricular es una información recogida y buscada de forma sistemática en las unidades de ictus y aunque puede verse influida por la frecuencia en la realización de electrocardiogramas, la duración de la monitorización o del holter de electrocardiografía es un dato que no debe mostrar gran variabilidad26. La escala A2DS2 tiene en nuestra cohorte un excelente poder discriminativo de infección pulmonar, siendo la calibración del modelo muy buena. La escala ISAN es más simple, incorporando solo 4 factores clínicos que están disponibles en el momento del ingreso del paciente en la puerta de urgencias; estos factores son: edad, sexo masculino, grado de independencia previa al ictus según la escala modificada de Rankin y puntuación en la NIHSS19. En nuestra cohorte, la escala ISAN también tiene un excelente poder discriminativo de infección pulmonar, y una buena calibración del modelo. Ambas escalas pueden ser fáciles de aplicar y probablemente con poca tendencia a la variación entre observadores.
Estudios previos han identificado varios factores que se asocian de forma independiente con la neumonía post-ictus en la fase aguda de este proceso. La fuerza de asociación es consistente para la edad, la gravedad del ictus, la presencia de disfagia y la alteración del nivel de conciencia. En los últimos años, estos y otros factores se han incorporado a diferentes sistemas de puntuación destinados a la estratificación del riesgo de neumonía post-ictus. Chumbler et al.14, en un estudio basado en la recogida de datos retrospectiva, presentaron una escala para predecir la neumonía asociada al ictus; los ítems incluidos fueron: historia clínica previa de neumonía, síntomas de disfagia, puntuación de la NIHSS, encontrar al paciente en el suelo y una edad mayor de 70 años; aunque mostró un aceptable estadístico C, la escala no fue validada externamente. La escala de neumonía publicada por Kwon et al.11 que incluyó la NIHSS, la edad, el sexo, la ventilación mecánica, y la disfagia se derivó de una pequeña cohorte y no se ha validado. Incluir la intubación como factor no parece muy útil en el contexto clínico de la mayoría de nuestros pacientes, ya que la neumonía asociada a la ventilación es una entidad propia que genera por sí misma la ventilación mecánica y otros factores de riesgo, y que difieren sustancialmente de las identificadas para el desarrollo de infección tras el ictus12. Algunos autores han demostrado que los criterios clave que indicarían alto riesgo de sufrir esta complicación tras el ictus serían: la edad avanzada, la presencia de disartria o afasia, una escala de Rankin modificada mayor o igual a 4 puntos, una prueba de deglución con agua alterada y una puntuación baja en test cognitivos breves1. Esta escala incluye la necesidad de realizar un minimental test, prueba que no se recoge de forma normalizada o por rutina durante el ingreso de los pacientes con un ictus.
El diagnóstico de infección respiratoria no es fácil ya que la presentación puede ser un tanto inespecífica, la presencia de tos no productiva es frecuente en estos pacientes, la fiebre puede aparecer sin foco de infección, las muestras microbiológicas de esputos con frecuencia son negativas, y una radiografía de tórax normal no excluye el diagnóstico en la fase temprana de esta complicación27. El uso de criterios diagnósticos estandarizados puede proporcionar un enfoque más riguroso para el diagnóstico de IRA. En nuestro estudio la variable resultado fue no solo la infección respiratoria condensante (o neumonía), sino la infección respiratoria de vías bajas según los criterios del estudio PANTHERIS23, que consideramos se ajusta más a lo que ocurre en la práctica clínica habitual. Incluir estos criterios probablemente hace que nuestras tasas de infección sean superiores a las tasas de neumonía que se informan en los estudios de derivación de las escalas validadas, que son del 7,2% para la escala A2DS2 y del 6,7% para la ISAN15,19. Y también superiores a las informadas en algunos amplios registros hospitalarios de nuestro país, que informan de tasas de neumonía en torno al 8%28; pero creemos que con ello se evita la subjetividad en el diagnóstico de la infección pulmonar y la subestimación de la prevalencia de esta complicación.
Nuestro trabajo tiene algunas limitaciones que debemos comentar. En primer lugar, el tamaño muestral es justo para el estudio de validación que nos propusimos y esto hace que los índices pronósticos para todos y cada uno de los casos potencialmente posibles no estén disponibles, pero esto no afecta al cálculo de los estadísticos. En segundo lugar, al basarnos en los estudios de derivación hay variables basales que no hemos registrado ni incluido en los modelos para el ajuste como, por ejemplo, el uso de fármacos previo al ictus que pudieran aumentar el riesgo de infección, los signos vitales, los síntomas clínicos, los datos analíticos, la localización del ictus (circulación anterior o posterior) o el subtipo de etiología, y que pudieran influir en el riesgo de neumonía. Y por último, no utilizamos técnicas instrumentales para definir la disfagia y no utilizamos un único criterio para definirla, además, la evaluación de la disfagia siempre se hace a partir de las primeras 24h, ya que todos los pacientes quedan en dieta absoluta el primer día.
En conclusión, la puntuación alta en las escalas A2DS2 e ISAN son un fuerte predictor de infección respiratoria asociada al ictus agudo en una cohorte consecutiva de pacientes con ictus. Estas escalas son simples en su uso y rápidas de ejecutar, siendo herramientas prometedoras para la predicción de esta complicación en la práctica habitual.
FinanciaciónEste trabajo ha sido posible gracias a una beca de intensificación investigadora del Servicio Extremeño de Salud.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.