Un porcentaje de casos diagnosticados inicialmente como infartos isquémicos son de causa no cerebrovascular o stroke mimics (SM). Los datos publicados al respecto son heterogéneos y, generalmente, con cohortes pequeñas.
ObjetivoNuestro objetivo es establecer qué enfermedades cursan como SM, definir sus características epidemiológicas y clínicas e identificar el porcentaje de casos tratados con fibrinólisis.
MétodosRegistro prospectivo de los eventos considerados cerebrovasculares desde junio del 2005 a abril del 2015, analizando datos demográficos, factores de riesgo cardiovascular, activación de Código Ictus e ingreso, severidad (NIHSS), destino al alta, morbilidad (mRS) y tratamiento recibido. Se han comparado los ictus isquémicos con los SM. Se excluyeron las hemorragias intracraneales, subaracnoideas y las causas de SM detectables en la TC inicial.
ResultadosSobre 4.570 casos, 404 (8,8%) son SM. Los pacientes con SM son más jóvenes (70,3 vs. 74 años, p<0,0001), tienen menos factores de riesgo cardiovascular y fibrilación auricular (13 vs. 34%, p<0,0001), una menor puntuación en NIHSS (2 vs. 4, p<0,0001) y menos afasia (9,4 vs. 19,6%, p<0,02) y disfagia (1,2 vs. 17%, p<0,0001). En los SM se activan menos códigos ictus (28 vs. 40%, p<0,0001) y requieren menos días de ingreso (4,9 vs. 7,8; p<0,0001) y menos ingresos en la unidad de ictus (47 vs. 60%, p<0,0001). Los SM son dados de alta a domicilio con mayor frecuencia (95 vs. 62%, p<0,0001) y con menor discapacidad (mRS 0-2; 76 vs. 54%, p<0,0001). Un 4,7% de los SM recibieron fibrinólisis. La primera causa de SM fueron las crisis epilépticas (26%).
ConclusionesLos SM supusieron el 8,8% de los ingresos con diagnóstico inicial de ictus isquémico. Los SM tienen características demográficas, clínicas y pronósticas diferentes, siendo la epilepsia la etiología más frecuente. Pese a recibir atención urgente especializada, 19 pacientes (4,7%) fueron trataron con fibrinólisis.
A considerable percentage of events initially diagnosed as ischaemic stroke have non-cerebrovascular causes; these are called stroke mimics (SM). Currently available evidence about these events is heterogeneous and comes from studies with small samples.
ObjectiveThe purpose of our study is to identify conditions that may present as SM, define their epidemiological and clinical characteristics, and determine the percentage of cases of SM treated with intravenous fibrinolysis.
MethodsProspective study including all patients admitted to a tertiary university hospital between June 2005 and April 2015 with a diagnosis of acute stroke. We analysed demographic data, cardiovascular risk factors, time from code stroke activation to admission, stroke severity (NIHSS), final destination after discharge, degree of disability (mRS), and treatment. We compared SM and ischaemic strokes. We ruled out patients with intracranial haemorrhage, subarachnoid haemorrhage, or other causes of SM that may be detected on the baseline CT scan.
ResultsFour hundred four of the 4,570 included patients (8.8%) were found to have SM. Patients with SM were younger (70.3 vs. 74, P<.0001), less likely to exhibit cardiovascular risk factors and atrial fibrillation (13 vs. 34%, P<.0001), scored lower on the NIHSS at baseline (2 vs. 4, P<.0001), and included fewer cases of aphasia (9.4 vs. 19.6%, P<.02) and dysphagia (1.2 vs. 17%, P<.0001) than patients with stroke. SM caused fewer code stroke activations (28 vs. 40%, P<.0001). Patients with SM required shorter hospital stays (4.9 vs. 7.8 days, P<.0001), were less frequently admitted to the stroke unit (47 vs. 60%, P<.0001) and more frequently discharged home (95 vs. 62%, P<.0001), and had better outcomes (mRS scores 0-2; 76 vs. 54%, P<.0001). Intravenous fibrinolysis was administered to 4.7% of these patients. Epileptic seizures were the most frequent cause of SM (26%).
ConclusionsIn our sample, 8.8% of all diagnoses of ischaemic stroke were SM. These events have different demographic, clinical, and prognostic characteristics; epilepsy is the most common aetiology. Despite receiving specialised emergency care, 19 patients with SM (4.7%) were treated with intravenous fibrinolysis.
La enfermedad cerebrovascular constituye en la actualidad la segunda causa global de muerte en España y la primera en mujeres, así como la principal responsable de invalidez en el adulto. Con la creación de las unidades de ictus y las medidas implementadas en los últimos años para el diagnóstico y el tratamiento precoz de la enfermedad vascular cerebral se ha conseguido que cada vez se ofrezca una atención más rápida y especializada al paciente. Pese a los esfuerzos realizados, continúa existiendo un porcentaje no desestimable de casos que son diagnosticados inicialmente como ictus y que, después de completar el estudio y ver la evolución, se clasifican como episodios de causa no cerebrovascular, comúnmente llamados «imitadores de ictus» o stroke mimics (SM).
Dado que la tomografía computarizada (TC) craneal solo tiene un 40% de sensibilidad para la detección de ictus isquémicos (II) en fase aguda1, es inevitable que pacientes valorados con clínica neurológica aguda y TC sin hallazgos se diagnostiquen como infartos isquémicos. De hecho, entre el 1,4 y el 16,7% de los SM acaban siendo tratados con fibrinólisis intravenosa2, porcentaje que podría aumentar con las medidas iniciadas para reducir los tiempos puerta-aguja en los centros terciarios de ictus3.
Gibson y Whiteley situaron el porcentaje de SM entre aquellos casos con sospecha inicial de ictus alrededor del 26% (IC 95% 17-44)4. La causa más frecuente de SM en esta revisión fueron las crisis epilépticas. Pese a que se observa una tendencia a que se den en edades más jóvenes, en mujeres, con antecedentes de ictus previo y deterioro cognitivo4, no se han podido identificar características clínicas específicas asociadas a SM de forma constante.
Los resultados descritos varían ampliamente entre estudios debido a la gran heterogeneidad del diseño de las publicaciones, haciéndolas poco reproducibles. El problema principal es la falta de una definición estándar de SM y con qué grupo se compara. Por otro lado, cabe esperar que tanto la frecuencia de SM como la etiología y las características clínicas puedan variar de forma significativa según si los casos han sido recogidos partiendo de la sospecha establecida desde medios extrahospitalarios (centros de atención primaria, servicios de emergencias médicas) e intrahospitalarios no especializados4 o si, por el contrario, se evalúan casos con examen inicial por neurólogo, que hayan sido ingresados en unidades de ictus o que hayan sido tratados2,5,6.
En este estudio se describe la tasa de SM tras completar un análisis neurovascular completo y una valoración por neurólogos especialistas en ictus. Se definen las características epidemiológicas y clínicas y se evalúan los casos tratados con fibrinólisis.
Pacientes y métodosSe han utilizado datos recogidos prospectivamente desde junio de 2005 hasta abril de 2015 en la base de datos BASICMAR, un registro continuo de pacientes con ictus agudo del Servicio de Neurología del Hospital del Mar.
El Hospital del Mar es el centro asistencial principal de la institución Parc de Salut Mar, que atiende a 3 de los 10 distritos de la ciudad de Barcelona –que abarcan una población de 305.000 habitantes– y que ofrece actividad terciaria en la atención a pacientes con ictus agudo.
En nuestro centro, todos los pacientes con sospecha de ictus son valorados por el neurólogo de guardia, ya sea de entrada (pacientes que son traídos a Urgencias como Código Ictus extrahospitalario, activación de Código Ictus intrahospitalario o focalidad neurológica detectada en medios extrahospitalarios o desde triaje de nuestro centro no tributaria de tratamiento en fase aguda) o actuando como interconsultores (pacientes valorados por equipo no especializado en el que cabe la sospecha de evento cerebrovascular).
La sospecha de ictus se fundamenta en la definición de la Organización Mundial de la Salud, que los describe como «el desarrollo rápido de síntomas clínicos indicativos de un trastorno local o generalizado de la función cerebral, con síntomas que persisten 24 o más horas o que conducen a la muerte sin que exista otra causa aparente que la vascular»7.
Tras evaluar al paciente, se realiza un estudio urgente mediante una analítica sanguínea (que incluye ionograma, glucosa, hemograma, coagulación, dímero D y fibrinógeno), un electrocardiograma, una radiografía de tórax y una TC cerebral.
Si tras la realización de la TC craneal de Urgencias se confirma o se continúa sospechando la etiología cerebrovascular del proceso, los pacientes son entonces recogidos en nuestra base de datos como «ictus».
Los pacientes con clínica compatible con II de menos de 4,5h de evolución se tratan con activador del plasminógeno tisular (tPA) por vía intravenosa, teniendo en cuenta los criterios de exclusión basados en el protocolo de registro SITS MOST8.
El paciente puede ser ingresado en la Unidad de Ictus o en la sala convencional de Neurología o permanecer en Urgencias, derivarse a otro servicio o centro hospitalario o ser dado de alta a domicilio. En todos estos casos, sea cual sea su destino, se realiza un estudio vascular mediante angiografía cerebral por TC o estudio ultrasonográfico mediante ecografía doppler/dúplex de troncos supraaórticos e intracraneal.
En función del paciente y la sospecha clínica y etiológica, se realizan otras exploraciones complementarias, como una analítica general completa, una TC craneal de control o una resonancia magnética según la clínica, un estudio de trombofilia, un ecocardiograma transtorácico/transesofágico o un registro Holter-ECG, ya sea durante el ingreso o de forma ambulatoria.
Todos los pacientes en los que finalmente se establece un diagnóstico de ictus son valorados en una visita ambulatoria a los 3 meses por un neurólogo especialista en enfermedad cerebrovascular, quien revalora el caso, los exámenes complementarios realizados durante el ingreso o ambulatorios y revisa nueva clínica o procesos que han podido aparecer en las semanas siguientes al ingreso. Se definen como SM aquellos casos en los que el síndrome clínico, que a priori era atribuible a un ictus, finalmente no se considera debido a enfermedad cerebrovascular, quedando registrado como tal en nuestra base de datos y, si es posible, se especifica una nueva orientación diagnóstica.
Para llevar a cabo nuestro estudio se excluyeron todos los pacientes con evidencia de enfermedad intracraneal en la TC inicial (hemorragias intraparenquimatosas y subaracnoideas, hematomas subdurales, tumores intracraneales y otras lesiones ocupantes de espacio).
Se evaluaron, por lo tanto, únicamente aquellos casos que presentaban una TC inicial sin lesiones (o con lesiones isquémicas), planteando el diagnóstico diferencial entre II/accidente isquémico transitorio versus SM. También se eliminaron aquellos de causa vascular (síntomas por fenómeno de robo de sangre arterial en fístulas, vasculitis, trombosis retinianas, etc.), ya que la definición estricta de SM excluye cualquier vasculopatía cerebral.
Así pues, se definen como SM aquellos casos inicialmente considerados como II y sin evidencia de otra lesión en la TC craneal inicial que, tras completar el estudio en fase aguda/subaguda y con la valoración a los 3 meses del caso y exámenes complementarios por neurólogos expertos en enfermedad cerebrovascular, se orientaron como de causa no vascular.
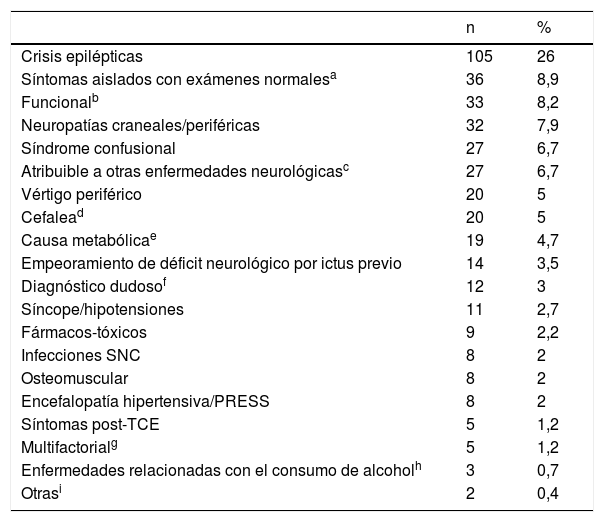
Los SM fueron clasificados según los diagnósticos finales establecidos tras el ingreso o en la visita a los 3 meses según se especifica en la tabla 1.
Clasificación etiológica de los stroke mimics (n=404)
| n | % | |
|---|---|---|
| Crisis epilépticas | 105 | 26 |
| Síntomas aislados con exámenes normalesa | 36 | 8,9 |
| Funcionalb | 33 | 8,2 |
| Neuropatías craneales/periféricas | 32 | 7,9 |
| Síndrome confusional | 27 | 6,7 |
| Atribuible a otras enfermedades neurológicasc | 27 | 6,7 |
| Vértigo periférico | 20 | 5 |
| Cefalead | 20 | 5 |
| Causa metabólicae | 19 | 4,7 |
| Empeoramiento de déficit neurológico por ictus previo | 14 | 3,5 |
| Diagnóstico dudosof | 12 | 3 |
| Síncope/hipotensiones | 11 | 2,7 |
| Fármacos-tóxicos | 9 | 2,2 |
| Infecciones SNC | 8 | 2 |
| Osteomuscular | 8 | 2 |
| Encefalopatía hipertensiva/PRESS | 8 | 2 |
| Síntomas post-TCE | 5 | 1,2 |
| Multifactorialg | 5 | 1,2 |
| Enfermedades relacionadas con el consumo de alcoholh | 3 | 0,7 |
| Otrasi | 2 | 0,4 |
PRESS: síndrome de leucoencefalopatía posterior reversible; SNC: sistema nervioso central; TCE: traumatismo craneoencefálico.
Síntomas claramente orientados como stroke mimic pero sin poderlos clasificar en ninguna otra categoría, ya sea por no cumplir criterios diagnósticos o por tratarse de síntomas abigarrados sin explicación orgánica, pero sin una clara enfermedad psiquiátrica asociada.
Se descarta la presencia de enfermedad médica orgánica, pudiéndose atribuir los síntomas a afección psiquiátrica –en su mayor parte se deben a trastornos de ansiedad o trastornos conversivos–.
Incluye casos de esclerosis múltiple y otras enfermedades desmielinizantes, enfermedad de Parkinson y parkinsonismos, deterioro cognitivo, amnesia global transitoria, encefalitis límbica, esclerosis lateral amiotrófica, neurosarcoidosis, carcinomatosis meníngeas.
Incluye diselectrolitemias, hipo/hiperglucemias, encefalopatías urémicas, hiperamoniemias o encefalopatías de origen hepático.
Casos en los que consta diagnóstico de stroke mimic, pero que se han seguido tratando como ictus por dudas importantes a la hora de establecer el diagnóstico.
Se recogieron datos demográficos como la edad y el sexo, y el estado funcional previo mediante la Escala de Rankin modificada (mRS)9. Los factores de riesgo cardiovascular se obtuvieron del paciente, familiares, cuidadores o reportes médicos previos, siguiendo las definiciones recomendadas por las guías internacionales. Los factores de riesgo se registraron en un cuestionario como sigue: hábito tabáquico (activo o exfumador de menos de un año o exfumador por más de un año); consumo de alcohol>60g/día (activo, exbebedor de menos de un año o exbebedor por más de un año, recogiéndose también los gramos en enol/día); hiperlipidemia (diagnóstico médico, uso de medicación o concentraciones séricas de colesterol>220mg/dl, colesterol LDL>130mg/dl o triglicéridos>150mg/dl); hipertensión arterial (evidencia de al menos 2 determinaciones de presión arterial>140mmHg sistólicas o>90mmHg diastólicas, registradas en días diferentes previas al ictus); diabetes (diagnóstico médico o uso de medicación); fibrilación auricular confirmada mediante ECG previa o durante el ingreso; cardiopatía isquémica (historia documentada de angina o infarto de miocardio); vasculopatía arterial periférica (diagnóstico médico de claudicación intermitente o índice tobillo-brazo<0,90); antecedentes de ictus establecido o accidente isquémico transitorio.
Se recogieron también características clínicas como la severidad, definida mediante la National Institutes of Health Stroke Scale (NIHSS), y la presencia de afasia (tanto aislada como junto con otros síntomas) o disfagia. Se reflejó la activación o no de Código Ictus (tanto intrahospitalario como extrahospitalario), el tratamiento con tPA intravenoso, el ingreso y la ubicación del paciente (Unidad de Ictus, sala convencional u otra unidad/servicio del hospital), los días de ingreso y el alta a domicilio u otro recurso (centro sociosanitario, servicio de rehabilitación, unidad de curas paliativas u otro centro hospitalario) tras finalizar el ingreso y se estableció el grado de dependencia en el momento del alta mediante la mRS, definiendo como independencia mRS≤2 y dependencia≥3.
Análisis estadísticoLos datos se presentan como media±desviación estándar o mediana con rango intercuartil para las variables continuas, en función de si siguen o no una distribución normal, y como frecuencias y porcentajes para las variables categóricas. Para evaluar diferencias en medias para variables continuas y en porcentajes para variables dicotómicas utilizamos las pruebas de la t de Student y de la chi-cuadrado de Pearson, respectivamente. Para las variables continuas que no siguen una distribución normal se ha utilizado el test no paramétrico de Mann-Whitney. Se realizó un estudio multivariado mediante modelo de regresión logística para evaluar los factores predictivos de SM. Se realizó el ajuste por las variables que en el estudio univariado tienen una p<0,1. Para el análisis estadístico utilizamos el programa SPSS 19.0.
ResultadosDurante el período comprendido entre junio de 2005 y abril de 2015 se recogieron un total de 5.726 casos con diagnóstico inicial de ictus. De estos, 678 eran hemorragias intraparenquimatosas (11,84%) y 402 hemorragias subaracnoideas (7,02%). Se eliminaron del estudio aquellos casos con enfermedad evidente en la TC craneal inicial, como son las hemorragias subdurales (12) y los tumores intracraneales (21), los imitadores de ictus de causa vascular (19) y aquellos en los que faltaban datos al revisar la historia clínica (24), quedando finalmente un total de 4.570 casos. De estos, 4.166 se diagnosticaron como II (91,2%) y 404 como SM (8,8%).
Las características demográficas y clínicas estudiadas, junto con las diferencias en diagnóstico, manejo, evolución y pronóstico, quedan reflejadas en las tablas 2 y 3.
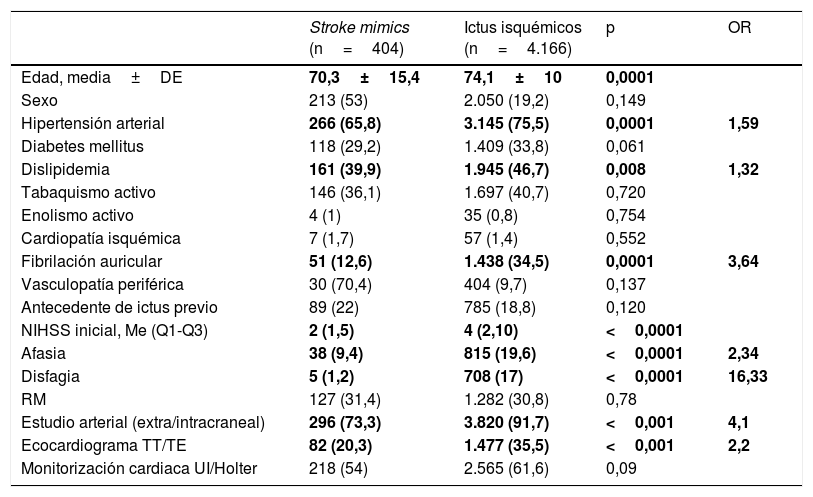
Características demográficas, clínicas y pruebas diagnósticas realizadas de los stroke mimics e ictus isquémicos
| Stroke mimics (n=404) | Ictus isquémicos (n=4.166) | p | OR | |
|---|---|---|---|---|
| Edad, media±DE | 70,3±15,4 | 74,1±10 | 0,0001 | |
| Sexo | 213 (53) | 2.050 (19,2) | 0,149 | |
| Hipertensión arterial | 266 (65,8) | 3.145 (75,5) | 0,0001 | 1,59 |
| Diabetes mellitus | 118 (29,2) | 1.409 (33,8) | 0,061 | |
| Dislipidemia | 161 (39,9) | 1.945 (46,7) | 0,008 | 1,32 |
| Tabaquismo activo | 146 (36,1) | 1.697 (40,7) | 0,720 | |
| Enolismo activo | 4 (1) | 35 (0,8) | 0,754 | |
| Cardiopatía isquémica | 7 (1,7) | 57 (1,4) | 0,552 | |
| Fibrilación auricular | 51 (12,6) | 1.438 (34,5) | 0,0001 | 3,64 |
| Vasculopatía periférica | 30 (70,4) | 404 (9,7) | 0,137 | |
| Antecedente de ictus previo | 89 (22) | 785 (18,8) | 0,120 | |
| NIHSS inicial, Me (Q1-Q3) | 2 (1,5) | 4 (2,10) | <0,0001 | |
| Afasia | 38 (9,4) | 815 (19,6) | <0,0001 | 2,34 |
| Disfagia | 5 (1,2) | 708 (17) | <0,0001 | 16,33 |
| RM | 127 (31,4) | 1.282 (30,8) | 0,78 | |
| Estudio arterial (extra/intracraneal) | 296 (73,3) | 3.820 (91,7) | <0,001 | 4,1 |
| Ecocardiograma TT/TE | 82 (20,3) | 1.477 (35,5) | <0,001 | 2,2 |
| Monitorización cardiaca UI/Holter | 218 (54) | 2.565 (61,6) | 0,09 |
DE: desviación estándar; Me (Q1-Q3): mediana (rango intercuartil); NIHSS: National Institutes of Health Stroke Scale; OR: odds ratio; RM: resonancia magnética; TE: transesofágico; TT: transtorácico; UI: Unidad de Ictus.
Los datos se expresan como n (%), excepto donde se indica. Se resaltan en negrita las variables estadísticamente significativas.
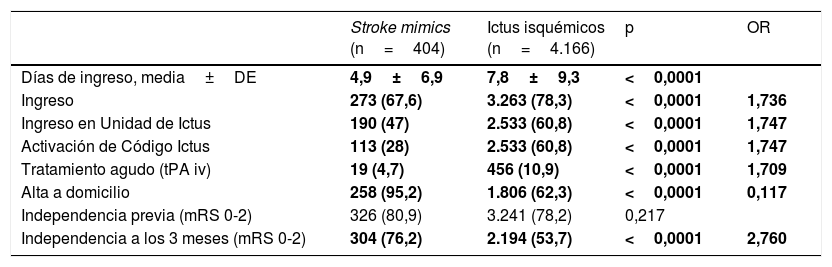
Diferencias en manejo, evolución y pronóstico de los stroke mimics e ictus isquémicos
| Stroke mimics (n=404) | Ictus isquémicos (n=4.166) | p | OR | |
|---|---|---|---|---|
| Días de ingreso, media±DE | 4,9±6,9 | 7,8±9,3 | <0,0001 | |
| Ingreso | 273 (67,6) | 3.263 (78,3) | <0,0001 | 1,736 |
| Ingreso en Unidad de Ictus | 190 (47) | 2.533 (60,8) | <0,0001 | 1,747 |
| Activación de Código Ictus | 113 (28) | 2.533 (60,8) | <0,0001 | 1,747 |
| Tratamiento agudo (tPA iv) | 19 (4,7) | 456 (10,9) | <0,0001 | 1,709 |
| Alta a domicilio | 258 (95,2) | 1.806 (62,3) | <0,0001 | 0,117 |
| Independencia previa (mRS 0-2) | 326 (80,9) | 3.241 (78,2) | 0,217 | |
| Independencia a los 3 meses (mRS 0-2) | 304 (76,2) | 2.194 (53,7) | <0,0001 | 2,760 |
DE: desviación estándar; iv: intravenoso; mRS: Escala de Rankin modificada; OR: odds ratio; tPA: activador del plasminógeno tisular.
Los datos se expresan como n (%), excepto donde se indica. Se resaltan en negrita las variables estadísticamente significativas.
Los pacientes con diagnóstico final de SM eran más jóvenes (70,3±15,4 vs. 74,1±10 años; p<0,0001) y con menos factores de riesgo vascular: hipertensión arterial (65,8 vs. 75,5%, p<0,0001), dislipidemia (39,9 vs. 46,7%, p<0,008) y fibrilación auricular (12,8 vs. 34,5%, p<0,0001). Se presentaban con NIHSS iniciales menores (2 [1-5], p<0,0001), y con menos alteraciones afásicas (9,4 vs. 19,6%, p<0,0001) y menos disfagia (1,2 vs. 17%, p<0,0001). No se observó asociación con el sexo, con otros factores de riesgo cardiovascular, consumo de alcohol o tabaco ni antecedentes de cardiopatía isquémica, vasculopatía periférica o de ictus previo.
Por otro lado, los SM requirieron menos ingresos que los II tanto a nivel hospitalario global (67,6 vs. 78,3%, p<0,0001) como en la Unidad de Ictus (47 vs. 60,8%, p<0,0001), con una menor estancia hospitalaria (4,9±6,9 vs. 7,8±9,3 días; p<0,0001). Al finalizar el ingreso hospitalario, los SM son dados de alta a domicilio con mayor frecuencia (93,5 vs. 32,3%), mientras que el resto de los pacientes son trasladados a otros servicios o precisan recursos sociales. Además, pese a no observarse diferencia respecto al grado de independencia previa al ingreso, sí que presentan una mayor frecuencia de independencia a los 3 meses (75,2 vs. 53,9%, p<0,0001). Los casos perdidos en el análisis de estas últimas 3 variables corresponden en gran parte a casos de ictus.
Un total de 19 casos (4,7%) fueron tratados con tPA intravenoso, sin evidencia de sangrados intracraneales sintomáticos o asintomáticos tras el tratamiento. De los casos con diagnóstico final de SM tras completar el estudio neurovascular y valoración a los 3 meses, el diagnóstico final más frecuente fue el de crisis epiléptica (105 casos, 26%). El resto quedan resumidos en la tabla 1.
DiscusiónEn este trabajo unicéntrico, tras realizar el estudio neurovascular completo, la proporción de SM fue del 8,8%. Existen muchas enfermedades de origen no cerebrovascular que pueden simular un ictus en cuanto al modo de instauración y a la clínica. Publicaciones clásicas, como la de Libman et al.10, situaban la proporción de SM alrededor del 19%. En una revisión más reciente4, donde se comparan 25 estudios realizados desde el 2012 y en el que se evalúan pacientes con sospecha inicial de ictus, encuentran un 26% de SM (IC 95% 17-44). Estos estudios están realizados en diferentes escenarios, por lo que la sospecha la establecen tanto médicos de atención primaria, personal de emergencias médicas, servicio de urgencias hospitalarias no especializado en neurología como neurólogos. En estas series, los datos están recogidos de forma heterogénea (pacientes admitidos en Urgencias con este diagnóstico, pacientes ingresados en unidades de ictus, etc.), lo cual podría explicar la variabilidad observada a la hora de comparar la proporción de SM entre los diferentes artículos revisados.
En el análisis realizado en los artículos mencionados, como en otros publicados sobre el tema, no se hace distinción entre II y hemorragias subaracnoideas e intraparenquimatosas, y se incluyen las hemorragias subdurales y los tumores intracraneales dentro de la clasificación de SM. Con la intención de adecuar el estudio a la realidad de la práctica clínica diaria, optamos por realizar un planteamiento diferente a la hora de enfocar el análisis respecto a lo publicado hasta la fecha, no teniendo constancia de la existencia de publicaciones previas con la misma metodología. Este nuevo planteamiento refleja la realidad actual de la atención al ictus agudo de un centro terciario de ictus, donde el neurólogo es el responsable del manejo y el diagnóstico. Las dudas diagnósticas en este caso son aquellos pacientes en los que la focalidad neurológica no tiene una explicación tras la realización de la TC inicial, lo que podría conllevar, en ausencia de criterios de exclusión, a la administración de tratamiento recanalizador en fase aguda (tPA intravenoso). Esto implica incluir únicamente los II, puesto que las hemorragias intraparenquimatosas y las subaracnoideas también son fácilmente detectables en la TC inicial.
Utilizando esta metodología, en nuestra cohorte el 91,2% de las sospechas de II tras realizar la TC urgente son finalmente ictus (4.166 casos) y el 8,8% son SM (404 casos). Si se consideran como SM las hemorragias subdurales y los tumores intracraneales, el porcentaje aumenta al 11,2%.
La causa más frecuente de SM fueron las crisis epilépticas (26%), coincidiendo con la mayoría de las publicaciones2,4,5. De hecho, si bien los porcentajes varían según el diseño del estudio y la clasificación empleada, los diagnósticos diferenciales principales más frecuentes no cambian: crisis epilépticas, cefaleas, lesiones ocupantes de espacio, toxicometabólicas y síndromes confusionales, síncopes, funcionales, neuropatías, vértigos periféricos o cuadro de origen dudoso. En nuestra serie, en segundo lugar de frecuencia (8,9%), consideramos los síntomas neurológicos aislados, con estudio completo normal, que no son indicativos claramente de origen vascular, pero que no han podido ser clasificados en otra categoría. De estos, 9 pacientes presentaban síndromes sensitivos aislados y en 15 de ellos se sospechó etiología vascular vertebrobasilar que no pudo confirmarse en la neuroimagen.
Existen numerosos estudios que intentan identificar qué variables clínicas y demográficas pueden ser predictoras de SM. En el estudio de Hand et al.11 se concluía que 8 ítems podían predecir el diagnóstico final de SM: la posibilidad de determinar la hora exacta en que se inicia la clínica, los síntomas de afectación focal, los hallazgos vasculares anómalos, la presencia de signos neurológicos, el poder localizar los síntomas a la derecha o a la izquierda y el poder clasificar el cuadro dentro de la clasificación TOAST12 van a favor del diagnóstico de ictus. A su vez, evidenciaban un SM la existencia de deterioro cognitivo y los signos anómalos en otros sistemas.
El estudio publicado por Demaerschalk et al.13 pretende desarrollar un modelo clínico predictivo de SM. Encuentran un 22% de SM entre los 196 pacientes con sospecha inicial de ictus. Concluyen que la ausencia inicial de signos lateralizadores, una presión arterial diastólica baja y el tener una historia previa de infarto o accidente isquémico transitorio son fuertes predictores de eventos de causa no vascular.
En la revisión sistemática realizada por Nguyen y Chang2 se hace referencia a que los pacientes con SM suelen tener menos factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus y dislipidemia), dato avalado en al artículo con mayor número de pacientes (un total de 8.187), al igual que se plasma la tendencia a presentarse en mujeres, en edades más tempranas y con menor puntuación inicial en la NIHSS, aunque destacan que no se observa una asociación constante de estas variables con el riesgo de SM.
En nuestro estudio, observamos asociación con la edad, la hipertensión arterial, la dislipidemia y la fibrilación auricular. A nivel clínico, los SM se presentaron con una menor puntuación inicial en la NIHSS y con menos afasia y disfagia, no pudiendo analizar más características clínicas por no disponer de datos suficientes.
En el análisis multivariado no se encontraron datos predictores de presencia de SM.
También encontramos diferencias en el manejo, la evolución y el pronóstico del paciente: los SM ingresan menos y si lo hacen requieren con menor frecuencia ingreso en la Unidad de Ictus, tienen menor estancia hospitalaria y son dados de alta a domicilio con mayor frecuencia. Además, tienen un mejor pronóstico funcional a los 3 meses.
La proporción de SM tratados en fase aguda mediante tPA es de alrededor del 1,4-16,7%, con solo 2 casos descritos de sangrado intracraneal sintomático, por lo que la fibrinólisis es segura en los SM, con una menor tasa de complicaciones respecto a los ictus2,14 (aunque no se han reportado datos de la tasa de sangrados no sintomáticos). A la hora de interpretar estos resultados hay que ser cauteloso, pues, como ya se ha comentado previamente, no hay uniformidad a la hora de definir qué se considera como SM y cuál es el grupo de comparación. Además, puede existir un sesgo a la hora de publicar datos que podrían considerarse negativos. Por otro lado, es probable que haya un infradiagnóstico de SM tratados al interpretar la normalidad en las pruebas de neuroimagen realizadas a posteriori como un ictus tratado a tiempo, también llamado aborted stroke15, concepto cada vez puesto más en duda con la sensibilidad actual para detectar isquemia aguda en técnicas de neuroimagen multimodal.
En nuestra serie un total de 19 SM fueron tratados con fibrinólisis (4,7%), de los cuales 8 fueron crisis epilépticas, 4 cefaleas, 2 infecciones del SNC, 2 de causa funcional, 2 síntomas de origen farmacológico y un vértigo periférico. No se detectaron sangrados intracraneales sintomáticos ni asintomáticos ni ninguna otra complicación hemorrágica (o de otra índole) derivada del tratamiento.
En los próximos meses probablemente aumente el interés en evaluar si el número de SM tratados se incrementa paralelamente a las medidas implementadas para reducir los tiempos puerta-aguja. Es de esperar un aumento de SM tratados, en gran parte debido a la disminución del tiempo para evaluar al paciente, aspecto ya observado en alguna publicación3. Es en este contexto en el que cobra todavía más importancia la necesidad de proponer y adoptar una metodología conjunta a la hora de realizar este tipo de estudio.
Con este trabajo proponemos una aproximación práctica al problema real que plantean los SM, que, bajo nuestro punto de vista, es el diagnóstico diferencial con los II, ya que es lo que puede llevar a errores en el tratamiento.
Además, pese a que a día de hoy no existen patrones clínicos predictivos definitivos que nos permitan discernir, únicamente mediante anamnesis y exploración física, lo que es una enfermedad simuladora de un ictus verdadero, concluimos que los pacientes con SM son más jóvenes, con menos antecedentes de hipertensión arterial y fibrilación auricular, con unas manifestaciones clínicas menos graves y una evolución y pronóstico más favorables, comparándolos con los pacientes que sí presentan un ictus.
FinanciaciónFinanciado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III FEDER, RD12/0042/0020 y RD12/0042/0061.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido presentado como comunicación oral en la XX Reunió Anual de la Societat Catalana de Neurologia. Barcelona, 25-27 de mayo del 2016.