El objetivo del presente trabajo es la valoración funcional y cinemática en pacientes con espasticidad de miembros inferiores tras lesión encefálica o medular con indicación de infiltración con toxina botulínica (TBA).
Material y métodosDiez pacientes (11 extremidades inferiores) atendidos en unidad de neurorrehabilitación. Examen clínico, funcional (functional ambulation categories, valoración marcha del Hospital de Sagunto) y biomecánico (plantillas instrumentadas Biofoot/IBV versión 5,0) antes y 3 semanas después de la infiltración con TBA. Estadísticos: prueba de la t para muestras relacionadas de las variables clínicas, funcionales y biomecánicas antes y después de la infiltración. Nivel de significación inferior a 0,05. Modo cualitativo para valorar si los cambios en las variables biomecánicas orientan a una aproximación a los parámetros de normalidad.
ResultadosLa infiltración con TBA mejora el tono muscular, el arco articular y la frecuencia de espasmos (p < 0,01). La población infiltrada muestra un nivel alto de satisfacción con la mejora de los síntomas. No hay cambios funcionales en habilidad para la marcha tras la infiltración. En los parámetros biomecánicos mejora de la cadencia de marcha y la presión máxima en retropié se aproxima a la significación estadística cercana a 0,1.
ConclusionesCon la disminución del tono muscular tras infiltración con TBA, mejoran los síntomas clínicos derivados de esta sin cambios funcionales en escalas de marcha. Los cambios en los parámetros biomecánicos indican la necesidad de ampliar los estudios con plantillas instrumentadas en población con espasticidad tras lesión del sistema nervioso central tratada con infiltración de TBA.
Botulinum toxin A (BTA) improves the kinematic parameters of gait in patients with spasticity of lower limbs, but there are no studies in which kinetic parameters are measured with instrumented insoles. We therefore used instrumented insoles to perform a functional assessment of therapeutic results in patients with lower limb spasticity after brain injury or spinal cord infiltration indicating BTA.
Material and methodsTen patients (11 lower limbs) seen in a Neurorehabilitation Unit. The tests carried out included clinical examination, gait assessment (Functional Ambulation Categories (FAC); Hospital de Sagunto Gait Scale), and biomechanical assessment (Biofoot / IBV version 5.0), before and three weeks after infiltration with BTA. Statistics: t-test for related samples of clinical variables, functional variables and biomechanical variables before and after infiltration. Level of significance P< .05. Qualitative method to assess whether changes in the biomechanical variables tended toward normal values.
ResultsBTA improves muscle tone, joint arch and frequency of spasms (P<.01). The patient sample showed a high level of satisfaction with the improvement in symptoms. There were no changes in walking ability after injection. There were no statistically significant changes in biomechanical parameters, but there was improved gait cadence. The relatively small statistical significance close to P=.1 of the peak pressure in the heel after injection indicates the need for further studies with instrumented insoles in people with spasticity due to central nervous system injury.
ConclusionsWith the decrease in muscle tone after infiltration with BTA the clinical symptoms associated with muscle tone improved without any functional changes in gait scales. The changes in the biomechanical parameters show that larger studies using instrumented insoles should be performed in the population with spasticity after a central nervous system injury treated with BTA infiltration.
La espasticidad es un desorden motor caracterizado por la hiperactividad —dependiente de la velocidad— del arco reflejo miotático, manifestado como aumento de la resistencia del músculo al estiramiento (reflejo tónico de estiramiento) y exageración de los reflejos osteotendinosos1, consecuencia de la liberación del haz piramidal. Se asocia a debilidad muscular y a la pérdida de la selectividad del movimiento (sincinesias).
Las causas más frecuentes de espasticidad en el adulto son el daño cerebral adquirido y la lesión medular (LM). La espasticidad afecta preferentemente a los músculos antigravitatorios y suele tener un patrón de aparición de proximal a distal. Según la patología neurológica causal, existen unos patrones comunes de distribución de la espasticidad: en la hemiplejía secundaria al ictus el miembro inferior suele mantenerse en extensión con equino varo del pie; en la LM y en la esclerosis múltiple, lo más frecuente es la postura en flexión y la aducción de los miembros inferiores2.
En el abordaje de la espasticidad es imprescindible establecer de antemano cuál es el objetivo de la medición y el contexto en el que se realiza.
Los objetivos pretendidos en el tratamiento de la espasticidad incluyen: mejora funcional (habilidad para transferencias y marcha, mejora del alcance y destreza, facilitación de la higiene y empleo de ortesis), reducción de síntomas (frecuencia de espasmos, alivio del dolor, prevención de contracturas), mejora de la imagen personal y optimización de otras terapias y servicios.
Para controlar la espasticidad se emplean diferentes medidas terapéuticas entre las que se encuentran las medidas farmacológicas que se consideran coadyuvantes a la cinesiterapia y posicionamiento correcto. Cuando se pretende actuar sobre grupos musculares concretos (espasticidad focal), está indicado el uso de yesos, ortesis y bloqueos neuromusculares. Entre estos últimos se encuentran el bloqueo local con anestésico, bloqueo con fenol y alcohol, y la toxina botulínica, de elección en la actualidad.
La aplicación de instrumentos de medición, de forma reproducible3 y fiel, en el diagnóstico y el control evolutivo de enfermedades diversas, permite pequeños cambios que diferencien los patrones de normalidad de los patológicos, así como la respuesta a los diversos tratamientos aplicados. Entre estos instrumentos se encuentran las plantillas instrumentadas. Su característica principal es la cuantificación de las presiones plantares durante la marcha mediante el uso de transductores o sensores de presión fijos sobre la base de una plantilla flexible, que se coloca entre el pie y el zapato del individuo que se deben estudiar. Los datos obtenidos son transferidos a un ordenador con un software específico para su procesado. La portabilidad y los escasos requisitos de instalación facilitan su utilización en medios clínicos.
En población hemipléjica existen escasos estudios con plantillas instrumentadas para caracterizar la distribución de presiones y, generalmente, los estudios cinéticos hacen referencia a otros instrumentos de medición: las plataformas dinamométricas4. No hemos encontrado ninguno donde se estudien con esta metodología las variaciones en las presiones plantares que la infiltración de toxina botulínica podría condicionar.
El objetivo de este trabajo es comprobar la utilidad de la toxina botulínica en pacientes con espasticidad de miembros inferiores tras lesión encefálica o medular, mediante un examen clínico, escalas funcionales de marcha y plantillas instrumentadas, aprovechando la portabilidad y la utilidad descritas de este sistema de medida y así evaluar los cambios en los parámetros de apoyo plantar que la infiltración con TBA de músculos espásticos de la extremidad inferior supuestamente facilita, durante su periodo útil de tiempo de actuación.
Material y métodosSujetosPacientes atendidos en unidad de neurorrehabilitación por lesión cerebral o medular adquirida de distinta causa, con secuelas de espasticidad en miembros inferiores, en estadios evolutivos subagudo y crónico.
UbicaciónUnidad de neurorrehabilitación, Hospital La Magdalena, Castellón.
Criterios de inclusión- –
Pacientes mayores de 18 años.
- –
Presencia de espasticidad en uno o dos miembros inferiores tras lesión cerebral o medular.
- –
Presencia de pie equino o equino varo con/sin espasticidad en aductores e hiperextensión del primer dedo.
- –
Fase evolutiva de la lesión: subaguda o crónica.
- –
Seguimiento del paciente: régimen de ingreso o ambulatorio.
- –
Ausencia de déficits cognitivos.
- –
Firma del consentimiento informado.
- –
Edad pediátrica.
- –
Presencia de déficits cognitivo-conductuales.
- –
Existencia de lesión de nervios periféricos.
- –
Inestabilidad clínica.
- 1.
Valoración clínica
- a.
Valoración clínica escalar de espasticidad:
- b.
Valoración arco articular pasivo mediante goniometría convencional de la articulación o articulaciones implicadas, según el patrón de espasticidad presente (cadera, rodilla, tobillo).
- c.
Valoración de la fuerza en la extremidad inferior afectada de los músculos implicados mediante la escala del Medical Research Council7 (MRC), según el patrón de espasticidad presente.
- a.
- 2.
Valoración funcional de la marcha
- 3.
Valoración instrumentada de la marcha: plantillas instrumentadas Biofoot/IBV versión 5,0. Este sistema consta de dos plantillas flexibles de poliéster de 0,5mm de espesor con 64 sensores piezoeléctricos de 5mm de diámetro cada una, que van unidas a sendos amplificadores alojados en una caja que se sujeta sobre los tobillos del paciente mediante velcros. Los amplificadores se conectan por cables a un módulo de transmisión que se coloca en la cintura del paciente. Este envía los registros a un ordenador mediante telemetría digital. Los datos emitidos por las plantillas se visualizan en forma de mapas de presiones o numéricos, con diferentes formatos, gráficas (bi y tridimensional) y parámetros. Todas las mediciones se efectuaron sobre un pasillo de 15m de longitud. Las plantillas se incorporaron al calzado habitual del paciente. En caso de emplear ortesis antiequino, se solicitaba al paciente que la abandonara porque resultaba imposible el registro de presiones, pero se permitían las ayudas para la marcha habituales (bastón simple, andador) (fig. 1). En cada sesión se invita al paciente a caminar por el pasillo a velocidad confortable.
Se efectúa un número mínimo de mediciones (habitualmente dos) para asegurar la correcta adquisición de los datos, dado que la cadencia habitual de la marcha es lenta o muy lenta en este tipo de pacientes. La frecuencia de muestreo, por este motivo, es de 100Hz y el tiempo de medición de 15 s. Esta grabación permite la adquisición de 5-7 pasos de cada pie. La figura 2 representa la expresión gráfica de los datos obtenidos con las plantilla en una sesión.
Se calculó el promedio de los 5-7 pasos de cada paciente para establecer un paso representativo de todos los realizados. Este paso promedio es el que se exporta a la base de datos. El pie se divide en tres regiones anatómicas: antepié, mediopié y retropié para calcular las presiones en cada zona.
- 4.
Datos adicionales:
- a.
Valoración del grado de satisfacción como información adicional del beneficio subjetivo proporcionado por la infiltración con toxina mediante adaptación de la escala FACES10. La escala incluye 6 caras con expresión variable, desde sonrisa franca a gesto adusto, que se corresponden con numeración ordinal en salto de dos puntos. La cara más satisfecha se corresponde con la máxima puntuación (10) y la más agria con el 0. Se ha considerado un buen resultado las puntuaciones mayores de la media aritmética (6 puntos) que agrupa al 90% de los casos estudiados.
- b.
Consumo de fármacos que puedan influir en el tono muscular.
- a.
En la primera valoración de la indicación de infiltración con toxina, se firma el consentimiento informado, se efectúa primer estudio con plantillas instrumentadas y se procede a infiltración con toxina botulínica en misma sesión.
Se repiten la valoración clínica, funcional y biomecánica a las 3 semanas de la infiltración. En esta sesión se interroga el grado de satisfacción del paciente.
Toxina aplicadaToxina botulínica tipo A (TBA), Dysport®, Botox®. La tipificación comercial de la toxina, la dosificación y los músculos infiltrados se anotan en ficha personalizada del paciente. De manera estandarizada, la toxina Dysport® se diluye en 2,5ml de suero fisiológico y la toxina Botox® en 2ml. La infiltración de la toxina se realiza asistida con electromiografía (EMG) a fin de confirmar la exacta localización muscular.
Tratamiento de los datos clínicosPara facilitar la comprensión de los datos relativos al balance articular y muscular se han categorizado de la siguiente manera: el balance articular se ha categorizado en: déficit/sin déficit en relación con el valor de normalidad en la/s articulación/nes afectada/s. La valoración de la potencia muscular se recoge, mediante suma aritmética del balance muscular de los músculos implicados en cada paciente: flexores y aductores de cadera, extensores de rodilla, dorsiflexores e inversores de pie, extensor y flexor del hallux, y flexor común dedos de pie.
Procedimiento estadístico- 1.
Análisis descriptivo de las variables:
- a.
Clínicas: valoración espasticidad (Asworth modificado, frecuencia de espasmos y tono aductores de cadera), balance articular, balance muscular.
- b.
Funcionales (escalas de marcha): FAC, EMHS.
- c.
Datos adicionales (grado satisfacción; consumo de fármacos).
- a.
- 2.
Prueba de la t para muestras relacionadas para comparar medias antes y después de la infiltración de:
- a.
Variables clínicas,
- b.
Variables funcionales,
- c.
Variables biomecánicas:
- –
Espaciotemporales: cadencia de marcha; tiempo de apoyo para cada pie.
- –
Cinéticas: presión máxima (PM) en antepié para cada pie (sano y afecto); PM en mediopié para cada pie (sano y afecto); PM en retropié para cada pie (sano y afecto); media presión máxima (MPM) en antepié para cada pie (sano y afecto); MPM en mediopié para cada pie (sano y afectado); MPM en retropié para cada pie (sano y afectado).
- –
- a.
- 3.
Para valorar si los cambios producidos en las variables biomecánicas tras la infiltración de toxina botulínica orientan a una aproximación a los parámetros de normalidad recogidos en la literatura, se emplea el modo cualitativo.
Se establece nivel de significación inferior a 0,05. El programa estadístico utilizado ha sido: SPSS versión 15.0
Se infiltraron 11 extremidades inferiores de 10 pacientes, 7 varones y 3 mujeres de edades comprendidas entre los 30 y los 69 años (media: 52,90 años). La media de edad para los hombres fue de 51 años y para las mujeres de 57 años (tabla 1). La causa de la lesión fue: accidente vasculocerebral, 6 casos; LM, 2 pacientes; traumatismo craneal, 1 paciente; neurocirugía tumoral (meningioma), 1 paciente.
Características clínicas de la muestra estudiada
| N.° orden | Patología | SEXO | T.° evolución | Déficit motor |
| 1 | ACV | M | 4 años | Hemiplejía izq. |
| 2 | LM | M | 4 meses | Paraparesia |
| 3 | ACV | V | 3 meses | Hemiplejía izq. |
| 4 | LM | V | 3 años | Paraparesia |
| 5 | ACV | V | 9 años | Hemiplejía der. |
| 6 | ACV | V | 3 años | Hemiplejía der. |
| 7 | NCG | M | 3 años | Monoparesia der. |
| 8 | ACV | V | 1 años | Hemiplejía izq. |
| 9 | TCE | V | 9 años | Tetraparesia |
| 10 | ACV | V | 1 años | Hemiplejía der. |
ACV: accidente cerebrovascular; LM: lesión medular; NCG: neurocirugía; TCE: traumatismo craneal.
La focalidad neurológica se correspondía con: hemiplejía izquierda en 4 casos; hemiplejía derecha en 3 pacientes, paraparesia en 2 pacientes y afectación de las cuatro extremidades en un paciente. El tiempo de evolución desde la presentación de la patología hasta el momento del estudio es variable: máximo 9 años (1 paciente); mínimo 3 meses (2 pacientes, que seguían tratamiento de rehabilitación en régimen de ingreso en el momento del estudio).
En 6 casos (7 extremidades) la toxina empleada ha sido Dysport® y Botox® en 4 pacientes. Las dosis en ambos casos se han calculado de forma personalizada en función de la gravedad de la hipertonía y los músculos implicados. La tabla 2 refleja los músculos infiltrados, las dosis empleadas y el número de pacientes a los que se ha infiltrado los músculos especificados.
Descripción músculos infiltrados y dosificación media toxina administrada
| Músculo | Dysport® | Botox® | N.° pacientes |
| Aductor mayor | 125 | 2 | |
| Aductor menor | 75 | 2 | |
| Semimembranoso | 50 | 2 | |
| Semitendinoso | 50 | 2 | |
| Bíceps femoris | 50 | 1 | |
| Sartorio | 85 | 1 | |
| Gemelo interno | 166 (100-200 U) | 58 (50-75 U) | 9 |
| Gemelo externo | 166 (100-200 U) | 58 (50-75 U) | 9 |
| Sóleo | 150 (100-200) | 75 | 3 |
| Tibial posterior | 200 (150-300 U) | 87,5 (15-100) | 7 |
| Extensor hallux | 100 | 3 | |
| Flexor hallux | 125 (100-150 U) | 2 | |
| Flexor c. dedos | 85 | 1 |
Dosificación media de toxina administrada para cada presentación comercial. Entre paréntesis: mínimo y máximo de toxina/músculo administrada. Dilución: la toxina Dysport® se diluye en 2,5ml de suero fisiológico y la toxina Botox® en 2ml.
Los datos del examen clínico incluidos en el protocolo diseñado para el estudio previo a la infiltración y a las 3 semanas de la misma se describen en la tabla 3. El valor medio del tono muscular medido mediante la escala de Asworth modificada de la muestra estudiada antes de la infiltración fue de 2,1 (2-3) y a las 3 semanas de la misma de 1,2 (1-2).
Características clínicas de la muestra antes y después del empleo de BTA
| N.° | Tono muscular | BA (pasivo) | BM | Frec. espas. | Tono ad. | FAC | EMHS | Fco. | Satisfacción | ||||||||
| Pre-TBA | Post-TBA | Artic. | Pre-TBA | Post-TBA | Pre-TBA | Post-TBA | Pre-TBA | Post-TBA | Pre-TBA | Post-TBA | Pre-TBA | Post-TBA | Pre-TBA | Post-TBA | |||
| 1 | 3 | 2 | Tobillo | –10° | – | 8 | 12 | 0 | 0 | 0 | 0 | 5 | 5 | 4 | 4 | No | 10 |
| 2 | 2 | 1 | Tobillo | –10° | – | 6 | 8 | 1 | 0 | 0 | 0 | 2 | 3 | 1 | 2 | No | 6 |
| 3 | 3 | 1 | No | – | – | 10 | 10 | 0 | 0 | 1 | 0 | 3 | 3 | 2 | 2 | No | 6 |
| 4 | 1 | 0 | Rodilla | –10° | – | 15 | 15 | 0 | 0 | 0 | 0 | 3 | 3 | 2 | 2 | Sí | 10 |
| 5 | 2 | 1 | Tobillo (x2) | –10°/– | – | 15 | 15 | 0 | 0 | 1 | 0 | 4 | 4 | 4 | 4 | No | 8 |
| 6 | 3 | 2 | Rodilla | –20° | –20° | 15 | 5 | 3 | 0 | 3 | 0 | 2 | 3 | 2 | 2 | Sí | 6 |
| 7 | 2 | 1 | Cadera | 38° | 42° | 5 | 12 | 1 | 0 | 1 | 0 | 4 | 4 | 4 | 4 | No | 8 |
| 8 | 3 | 2 | Tobillo | –25° | –20° | 12 | 6 | 3 | 2 | 3 | 2 | 3 | 3 | 3 | 3 | Sí | 6 |
| 9 | 2 | 2 | Tobillo | –28° | –28° | 6 | 10 | 2 | 0 | 2 | 0 | 5 | 5 | 3 | 4 | No | 4 |
| 10 | 2 | 1 | No | – | – | 10 | 11 | 4 | 2 | 4 | 2 | 5 | 5 | 4 | 4 | No | 8 |
BA: balance articular (nótese que rodilla y tobillo se reflejan en negativo respecto valor normal y cadera en grados de recorrido pasivo alcanzado para la abducción); BM: balance muscular (corresponde a la suma aritmética de los músculos implicados en los patrones de espasticidad); EMHS: escala de marcha del Hospital de Sagunto; FAC: Functional Ambulation Categories; frec. espas.: frecuencia de espasmos; fcos.: consumo de fármacos que producen disminución del tono muscular; N: número de orden; satisf.: grado satisfacción según escala de FACES modificada; tono ad.: escala de tono de aductores.
En 5 pacientes la articulación limitada en el recorrido articular pasivo debido a la espasticidad fue el tobillo, en 2 pacientes la articulación principal limitada fue la rodilla y en 1 paciente la cadera. En 2 pacientes no se encontró limitación de la movilidad pasiva de las extremidades inferiores. El valor medio de restricción articular fue de 14,63° (0°-38°) antes de la infiltración y de 9,09° tras la misma (0°-42°). Ello supuso la mejora de la limitación del balance articular pasivo en 6 casos; en 5 no se modificó el rango articular (incluidas las articulaciones sin restricción previa).
La puntuación del balance muscular reflejado en la tabla 3 corresponde a la suma aritmética de los músculos implicados en los patrones de espasticidad (0-5); antes de la infiltración, la puntuación motora media de la muestra estudiada fue 8,9 y tras esta fue 9,5. En cuanto la frecuencia de espasmos, antes de la infiltración, 6 pacientes los sufrían, mientras que a las 3 semanas de la misma, sólo 2 pacientes seguían presentado espasmos pero en menor frecuencia e intensidad (grado 2 en la escala de espasmos).
En todas las extremidades en las que se valoró la existencia de hipertonía de la musculatura aductora de la cadera (7 casos), tras la infiltración se constató una disminución de esta hasta la normalización en 5 casos. En los 2 casos en los que predominaba dicho patrón de espasticidad (correspondiente a la LM), tras la infiltración también mejoró el tono, aunque no se normalizó.
Variables funcionalesLas puntuaciones medias de las escalas que valoran la habilidad para la marcha muestran pocas diferencias antes y después de la infiltración de toxina: FAC pre-TBA: 3,6; post-TBA: 3,8. EMHS pre-TBA: 2,9; post-TBA: 3,1.
Información adicionalTres pacientes consumían fármacos que reducen el tono muscular: medicación anticomicial en 2 casos y baclofeno oral en un caso. La puntuación media del grado de satisfacción de los pacientes medido con la escala FACES modificada fue de 7,2 (0-10).
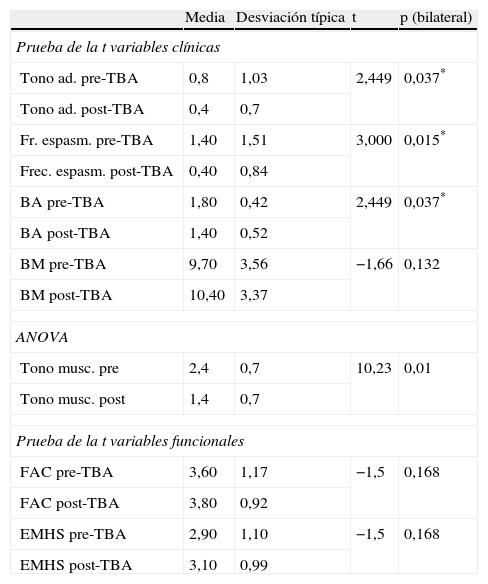
Prueba de la tAnálisis estadístico de la influencia de la toxina botulínica en las variables clínicas (tabla 4)Se ha realizado un estudio comparativo de las variables: tono musculatura aductora, frecuencia de espasmos, balance articular y balance muscular preinfiltración y post-infiltración) en las fases pre y postratamiento mediante toxina botulínica. Para ello, se ha utilizado la prueba de la t para muestras relacionadas. En el caso de la variable tono muscular pre y post, no se ha podido determinar la prueba de la t para muestras relacionadas, por ser un caso muy particular en el que la desviación típica de las diferencias es cero. Para solventar este problema matemático, se ha realizado, en este caso, un estudio de la varianza ANOVA.
Prueba de la t para muestras relacionadas de las variables clínicas y funcionales. Prueba ANOVA con el factor tratamiento
| Media | Desviación típica | t | p (bilateral) | |
| Prueba de la t variables clínicas | ||||
| Tono ad. pre-TBA | 0,8 | 1,03 | 2,449 | 0,037* |
| Tono ad. post-TBA | 0,4 | 0,7 | ||
| Fr. espasm. pre-TBA | 1,40 | 1,51 | 3,000 | 0,015* |
| Frec. espasm. post-TBA | 0,40 | 0,84 | ||
| BA pre-TBA | 1,80 | 0,42 | 2,449 | 0,037* |
| BA post-TBA | 1,40 | 0,52 | ||
| BM pre-TBA | 9,70 | 3,56 | −1,66 | 0,132 |
| BM post-TBA | 10,40 | 3,37 | ||
| ANOVA | ||||
| Tono musc. pre | 2,4 | 0,7 | 10,23 | 0,01 |
| Tono musc. post | 1,4 | 0,7 | ||
| Prueba de la t variables funcionales | ||||
| FAC pre-TBA | 3,60 | 1,17 | −1,5 | 0,168 |
| FAC post-TBA | 3,80 | 0,92 | ||
| EMHS pre-TBA | 2,90 | 1,10 | −1,5 | 0,168 |
| EMHS post-TBA | 3,10 | 0,99 | ||
BA: balance articular (nótese que rodilla y tobillo se reflejan en negativo respecto valor normal y cadera en grados de recorrido pasivo alcanzado para la abducción); EMHS: escala de marcha del Hospital de Sagunto; FAC: Functional Ambulation Categories; frec. espas.: frecuencia de espasmos; tono ad.: escala de tono de aductores; tono musc.: tono muscular.
*p < 0,05.
Los resultados muestran la existencia de diferencias significativas entre los valores medios de todas las variables excepto balance muscular (p = 0,132). El nivel de significación es < 0,01 en la variable disminución del tono muscular. La significación es < 0,05 para las variables: tono de la musculatura aductora (p = 0,037), frecuencia de espasmos (p = 0,015) y balance articular pasivo (p = 0,037).
Análisis estadístico de la influencia de la toxina botullínica en las variables funcionales (tabla 4)En el caso de las variables funcionales (FAC, EMHS), la prueba de la t para muestras relacionadas no muestra diferencias significativas antes y después de la toxina. Curiosamente, los resultados obtenidos son los mismos con ambas escales FAC y EMHS (p = 0,168).
Análisis estadístico de la influencia de la toxina botulínicaTBA en las variables biomecánicas (tabla 5)Variables espaciotemporales: tiempo de apoyo y cadenciaComo cabría esperarse, existe una asimetría entre el pie sano y afectado de manera que el tiempo de apoyo sobre la extremidad sana es superior al de la afectada. Después de la infiltración con toxina disminuye ligeramente el tiempo de apoyo sobre la extremidad sana y aumenta ligeramente el tiempo de apoyo sobre la extremidad afectada (fig. 3), si bien estas diferencias no son significativas y se mantiene la asimetría de paso entre ambos pies (p = 0,993 para el pie sano; p = 0,223 para el pie afectado). El registro de la cadencia también muestra asimetría entre ambas extremidades inferiores en la muestra estudiada. Antes de aplicar toxina, el pie sano muestra un ciclo de marcha más rápido (63,84 pps) que el afectado (59,04 pps) (tabla 5) y a las 3 semanas de la infiltración es el pie afectado el que muestra un ciclo de marcha más rápido (61,47 pps frente 59,61 pps).
Representación gráfica de las variables biomecánicas espaciotemporales: tiempo de apoyo y cadencia para los pies sano y afectado antes y después de la infiltración con TBA (derecha), comparados con la población sana (izquierda). Arbitrariamente, se compara el pie derecho de la población sana con el pie sano del paciente (cilindros azules) y el pie izquierdo de la población sana con el pie afectado del paciente (cilindros negros).
Prueba de la t para muestras relacionadas de las variables biomecánicas
| Prueba de la t | Media | Desviación típica | T | p (bilateral) |
| CAD SAN PRE | 63,84 | 16,17 | 0,987 | 0,362 |
| CAD SAN POST | 59,61 | 21,64 | ||
| CAD AF PRE | 59,04 | 24,61 | −0,886 | 0,399 |
| CAD AF POST | 61,47 | 25,02 | ||
| Tap SAN PRE | 1,66 | 0,77 | 0,009 | 0,993 |
| Tap SAN POST | 1,58 | 0,87 | ||
| Tap AF PRE | 1,10 | 0,27 | −1,308 | 0,223 |
| Tap AF POST | 1,17 | 0,32 | ||
| Pmáx Antep SAN PRE | 610,85 | 235,23 | −0,287 | 0,781 |
| Pmáx Antep SAN POST | 670,76 | 274,47 | ||
| Pmáx Antep AF PRE | 679,82 | 524,40 | −0,525 | 0,612 |
| Pmáx Antep AF POST | 798,60 | 745,67 | ||
| Pmáx Mediop SAN PRE | 158,03 | 75,78 | −0,647 | 0,536 |
| Pmáx Mediop SAN POST | 186,54 | 128,27 | ||
| Pmáx Mediop AF PRE | 174,31 | 101,03 | −0,049 | 0,962 |
| Pmáx Mediop AF POST | 175,87 | 100,44 | ||
| Pmáx Retrop SAN PRE | 480,92 | 118,40 | −0,866 | 0,412 |
| Pmáx Retrop SAN POST | 469,55 | 211,48 | ||
| Pmáx Retrop AF PRE | 512,39 | 660,67 | 1,709 | 0,122 |
| Pmáx Retrop AF POST | 446,77 | 650,49 | ||
| MPM Antep SAN PRE | 128,96 | 60,67 | −0,882 | 0,404 |
| MPM Antep SAN POST | 131,69 | 61,74 | ||
| MPM Antep AF PRE | 126,79 | 65,09 | −1,440 | 0,184 |
| MPM Antep AF POST | 136,66 | 68,21 | ||
| MPM Mediop SAN PRE | 43,08 | 20,15 | −0,505 | 0,627 |
| MPM Mediop SAN POST | 50,63 | 36,29 | ||
| MPM Mediop AF PRE | 53,12 | 31,05 | −0,152 | 0,882 |
| MPM Mediop AF POST | 54,03 | 25,67 | ||
| MPM Retro SAN PRE | 227,69 | 69,52 | 0,443 | 0,670 |
| MPM Retrop SAN POST | 225,89 | 94,36 | ||
| MPM Retrop AF PRE | 182,26 | 130,18 | 0,229 | 0,824 |
| MPM Retrop AF POST | 178,88 | 156,07 |
CAD AF POST: cadencia lado afectado tras toxina; CAD AF PRE: cadencia lado afectado pretoxina; CAD SAN POST: cadencia lado sano tras toxina; CAD SAN PRE: cadencia lado sano pretoxina; Tap AF POST: tiempo apoyo pie afectado tras toxina; Tap AF PRE: tiempo apoyo lado afectado pretoxina; Tap SAN POST: tiempo apoyo pie sano tras toxina; Tap SAN PRE: tiempo apoyo pie sano pretoxina; Pmáx Antep AF POST: presión máxima antepié lado afectado tras toxina; Pmáx Antep AF PRE: presión máxima antepié lado afectado pretoxina; Pmáx Antep SAN POST: presión máxima antepié lado sano tras toxina; Pmáx Antep SAN PRE: presión máxima antepié lado sano pretoxina; Pmáx Mediop AF POST: presión máxima mediopié lado afectado tras toxina; Pmáx Mediop SAN POST: presión máxima mediopié lado sano tras toxina; Pmáx Mediop AF PRE: presión máxima mediopié lado afectado pretoxina; Pmáx Mediop SAN PRE: presión máxima mediopié lado sano pretoxina; Pmáx Retrop AF POST: presión máxima retropié lado afectado tras toxina; Pmáx Retrop AF PRE: presión máxima retropié lado afectado pretoxina; Pmáx Retrop SAN POST: presión máxima retropié lado sano tras toxina; Pmáx Retrop SAN PRE: presión máxima retropié lado sano pretoxina; MPM Antep AF POST: media presión máxima antepié lado afectado tras toxina; MPM Antep AF PRE: media presión máxima antepié lado afectado pretoxina; MPM Antep SAN POST: media presión máxima antepié lado sano tras toxina; MPM Antep SAN PRE: media presión máxima antepié lado sano pretoxina; MPM Mediop AF POST: media presión máxima mediopié lado afectado tras toxina; MPM Mediop AF PRE: media presión máxima mediopié lado afectado pretoxina; MPM Mediop SAN POST: media presión máxima mediopié lado tras toxina; MPM Mediop SAN PRE: media presión máxima mediopié lado sano pretoxina; MPM Retrop AF POST: media presión máxima retropié lado afectado tras toxina; MPM Retrop AF PRE: media presión máxima retropié lado afectado pretoxina; MPM Retrop SAN POST: media presión máxima retropié lado sano tras toxina; MPM Retro SAN PRE: media presión máxima retropié lado sano pretoxina.
La PM se localiza en el antepié, seguido del retropié y, por último, del mediopié, tanto en el lado sano como en el afectado, antes de la aplicación de toxina (fig. 4A). A las 3 semanas de la infiltración en el caso del pie sano, el registro de PM sigue este patrón con aumento del valor medio registrado en antepié y mediopié, y disminución de la PM en retropié. Las diferencias no tienen significación estadística (antepié: p = 0,781; retropié: p = 0,412; mediopié: p = 0,536). En el caso del pie afectado, también las PM se localizan siguiendo esta misma distribución tras la infiltración: antepié (aumenta), retropié (disminuye), mediopié (aumenta) si bien las diferencias son mayores en el antepié y el retropié, mientras que en mediopié no hay grandes variaciones. La prueba de la t muestra que las diferencias de las medias de PM antes y tras la aplicación de toxina en el pie afectado no son estadísticamente significativas (antepié: p = 0,612; mediopié: p = 0,962). Sin embargo, cabe destacar que la comparación de PM en retropié de la pierna afectada se aproxima a 0,1 (p = 0,122) (tabla 5).
Representación gráfica del registro de medias de presiones antes y después del tratamiento. A) Presión máxima. B) Media del pico de presión. La columna a la izquierda de la gráfica representa el pie sano y la columna de la derecha el pie afectado. Unidades de medida: KPa. La dirección de cada segmento (ascendente o descendente) representa el aumento o la disminución de presión en cada zona del pie (antepié, mediopié, retropié) tras la infiltración de TBA.
La distribución de presiones de la variable MPM sigue el siguiente orden: retropié, antepié y mediopié en ambas extremidades. Antes de la aplicación de toxina, la media de MPM en el antepié y el mediopié es similar en los pies sano y afectado (tabla 5; fig. 4B). En cambio, la MPM registrada en el retropié del pie sano es muy superior a la soportada por el pie afecto (227,69 KPa y 182,26 KPa, respectivamente). Tras la infiltración de toxina, la distribución de MPM en las tres zonas del pie, sano y afectado, mantienen el mismo orden (retropié, antepié y mediopié). Los valores medios sufren pocas variaciones, por lo que las diferencias no son significativas (tabla 5) aunque, al igual que los valores de PM, las diferencias son mayores en el pie afectado que en el sano tras la BTX (tabla 5, fig. 4B). Los valores medios tienen tendencia descendente en el retropié y ascendente en el antepié, y mediopié tanto en el pie sano como en el afectado.
DiscusiónLa hipótesis planteada al inicio del trabajo consistía en comprobar la influencia en los patrones clínicos, funcionales y biomecánicos de la marcha en pacientes con espasticidad de miembros inferiores tras una lesión encefálica o medular, a los que se ha infiltrado toxina botulínica. Como cabía esperar, el empleo de TBA ha generado cambios detectables en el examen clínico y biomecánico, aunque con diferente inferencia estadística que debe valorarse teniendo en cuenta el tamaño muestral.
Variables clínicas y funcionalesEl beneficio del empleo de la toxina botulínica para el tratamiento de la espasticidad focal ha sido ampliamente estudiado en la literatura y no hay duda de su efectividad en la disminución del tono muscular de músculos espásticos, del consiguiente aumento del arco articular pasivo y mejora en la habilidad para la marcha6-8,11,12. Metaanálisis de estudios aleatorizados, doble ciego, que comparan placebo y TBA concluyen que esta técnica es adecuada para el control de la espasticidad tras el ictus13. La TBA igualmente es útil para mejorar el dolor y la discapacidad debida a espasticidad de miembros inferiores en pacientes afectados de LM14.
Nuestros resultados no difieren de los datos recogidos en la literatura y, habiendo estudiado solo a 10 pacientes (11 extremidades inferiores), se han constatado deferencias estadísticas significativas en el balance articular, el tono muscular, la frecuencia de espasmos y el tono musculatura aductora. Como era presumible, no se han encontrado diferencias significativas en el balance muscular de las extremidades estudiadas, por el mecanismo de acción de la toxina y la debilidad de los músculos paréticos.
El concepto habilidad para la marcha incluye diversos aspectos según distintos autores, tales como velocidad de marcha11,12, gasto energético12, empleo de ayudas técnicas13 o valoración subjetiva del paciente. Hemos optado por elegir escalas de marcha validadas como método objetivo de evaluación de la habilidad para la marcha tras la infiltración con TBA: escala FAC y escala EMHS. Los datos obtenidos en nuestro estudio no muestran cambios en dichas escalas, quizás porque el tamaño de la muestra es reducido y el patrón de marcha está muy consolidado, dada la cronicidad del proceso en la mayoría de los pacientes. Estos resultados son concordantes con algunos estudios previos en los que no observan modificaciones en escalas ordinales de marcha estandarizadas15.
Para valorar los beneficios clínicos y funcionales derivados de la aplicación de toxina, hay acuerdo general en que debe individualizarse el objetivo que se debe conseguir y debe realizarse de forma conjunta entre los facultativos, los pacientes y los cuidadores13,16. En este sentido, y aun no siendo objetivo del trabajo, se optó arbitrariamente por el empleo de una escala cualitativa para poder valorar la opinión de los pacientes como información complementaria. La escala FACES fue diseñada para la valoración del dolor de manera intuitiva pero aplicable a nuestros objetivos, incluidos aquellos pacientes con déficits graves del lenguaje. Con su uso hemos comprobado los buenos resultados del empleo de TBA en términos de satisfacción subjetiva, que en el presente trabajo agrupa al 90% de los pacientes (escala FACES ≥ 6). Asumiendo la arbitrariedad de esta elección, hemos obviado la realización de correlaciones estadísticas.
Si bien se han empleado dos tipos de toxina, con difusibilidad diferente, consideramos que este no es un factor de sesgo ya que la dilución ha sido la máxima posible según el continente donde están contenidas las toxinas, solo se ha empleado el mismo tipo de toxina en un mismo paciente y la segunda medición con las plantillas ha tenido lugar con el lapso suficiente para objetivar el beneficio de la toxina. Por otro lado, al efectuar la infiltración guiada por control EMG, la técnica asegura con mayor fiabilidad la proximidad a la placa motora que si se hace exclusivamente mediante referencias anatómicas, compensando estas posibles diferencias entre ambas toxinas17.
Variables biomecánicasEn el análisis biomecánico de la marcha se diferencian los estudios cinemáticos (relacionadas con valores angulares) y los cinéticos (relacionadas con las fuerzas de reacción del suelo). Las variables: tiempo de apoyo y cadencia son características espaciotemporales del ciclo de marcha18. Existen estudios recientes en los que se constata la mejoría de las variables cinemáticas con la aplicación de toxina que no son objeto de nuestro estudio19,20.
Es aceptado el empleo de plantillas instrumentadas como herramienta fiable y reproducible para la valoración de las presiones plantares en población normal21. En población hemipléjica existen escasos estudios con este sistema de medición y suelen realizarse con otros métodos (plataformas dinamométricas)4. No hemos encontrado ninguno donde se estudie con esta metodología las variaciones en las presiones plantares que la infiltración de toxina botulínica podría condicionar. De los parámetros biomecánicos ofrecidos por las plantillas instrumentadas, hemos elegido aquellos sobre los que la literatura hace mayor referencia.
Variables espacio-temporales del ciclo de marcha (tabla 5; fig. 3)El tiempo de apoyo del pie sano del paciente hemipléjico es el doble y la cadencia próxima a la mitad (tabla 5) en relación con los valores de la población sana, cuyo valor es de 115 ppm22 y existe una asimetría entre ambos pies, sano y afectado. En diversos estudios se observa aumento de la velocidad de marcha tras la aplicación de TBA en diversas patologías11,19,23. Sin embargo, en nuestra muestra la diferencia no resulta significativa.
Variables cinéticasEn el estudio de las variables cinéticas no podemos establecer comparaciones con trabajos anteriores porque se han efectuado con sistemas diferentes de medida (plataformas dinamométricas). Por ello, analizaremos nuestros datos a partir de la diferencia de valores antes y después de la aplicación de toxina y en relación con los datos de la población normal, estos últimos valorados de manera cualitativa. Así, en el estudio de las PM comprobamos que el patrón de distribución de presiones coincide con la población sana aunque, como es de esperar, con valores medios diferentes (tabla 5, fig. 4A)21,24,25. Las diferencias de los valores de PM entre ambos pies, sano y afectado, aumentan en el antepié como en el retropié tras la infiltración, pero dada la ausencia de significación estadística no pueden extrapolarse conclusiones. Queremos resaltar que la diferencia de PM en retropié de la pierna afectada ha obtenido una significación cercana a 0,1 (p = 0,122), por lo que probablemente con muestras de mayor tamaño sí aparecerían diferencias significativas.
En lo relativo a la MPM, en la distribución por zonas del pie tras la infiltración de toxina los valores medios de MPM sufren pocas variaciones (tabla 5, fig. 4B), por lo que podríamos decir que la TBA apenas modifica las PM soportadas por la extremidades inferiores de la población tratada y las diferencias encontradas en cada región de ambos pies no permiten extrapolar conclusiones. Si comparamos con los datos de población sana aportados por Martínez Nova et al.21, observamos que dichos valores tienden a la normalización a nivel del antepié y el mediopié, pero se alejan a nivel del retropié. Nuevamente, estas valoraciones han de tomarse con cautela dadas la dispersión y la escasez de datos aportados por la bibliografía, así como el reducido tamaño muestral de nuestro trabajo.
Conclusiones- –
Los resultados del presente estudio avalan la utilidad de la toxina botulínica en la disminución del tono muscular de los músculos tratados, la mejora del arco articular pasivo y la disminución de la frecuencia de espasmos en los pacientes espásticos de distinta etiología.
- –
No hay cambios en términos de habilidad para la marcha tras la infiltración medida mediante escalas (funcionales) de marcha en nuestra muestra.
- –
No hay cambios estadísticamente significativos tras la infiltración en las variables espaciotemporales ni cinéticas, aunque la PM en el retropié de la extremidad afectada muestra tendencia a la significación.
Los resultados obtenidos apuntan a la necesidad de profundizar en el estudio de la marcha tras el empleo de toxina botulínica con métodos cinéticos como las plantillas instrumentadas, por su portabilidad y facilidad de manejo incluso en población con alteración severa del tono muscular debido a lesión del sistema nervioso central.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la ortopedia ORTOPRONO, por su amable colaboración para el desarrollo técnico del presente trabajo.