Actualmente no existe una herramienta que permita cuantificar la apraxia bucofonatoria para estratificar, comparar y monitorizar longitudinalmente a los pacientes de manera objetiva. Nuestro objetivo en el presente trabajo es crear una escala cuantitativa para la apraxia bucofonatoria y evaluarla en pacientes con la variante no fluente/agramatical de la afasia progresiva primaria (vnfAPP) y otras enfermedades neurodegenerativas que cursan con problemas del habla y/o lenguaje.
MétodosSe diseñó una escala a partir de elementos útiles en la exploración de la apraxia bucofonatoria y se cuantificó el total en segundos. Se administró la escala a 64 participantes con diagnósticos de vnfAPP, variante semántica de la afasia progresiva primaria (vsAPP), variante logopénica de la afasia progresiva primaria (vlAPP), enfermedad de Huntington, enfermedad de Parkinson, así como a un grupo de controles sanos.
ResultadosLos pacientes mostraron una puntuación significativamente mayor respecto a los controles. El grupo de vnfAPP presentó la puntuación media más alta en la escala (429±278segundos). La escala resultó útil para diferenciar la vnfAPP de la vsAPP y de la enfermedad de Parkinson (área bajo la curva [AUC] de 0,956 y 0,989 respectivamente), pero menos para diferenciarla de la enfermedad de Huntington (AUC=0,67) y de la vlAPP (AUC=0,772). Existió una relación estadísticamente significativa entre la puntuación total y la gravedad de la enfermedad en la vnfAPP (p<0,029).
ConclusionesLa escala Barcelona para la apraxia bucofonatoria podría ser útil para evaluar cuantitativamente la apraxia bucofonatoria en diferentes enfermedades neurodegenerativas, y comparar pacientes, en especial en la vnfAPP.
Currently there is no tool to quantify buccophonatory apraxia to stratify, compare and monitor patients longitudinally in an objective manner. Our aim in this study is to create a quantitative scale for buccophonatory apraxia and evaluate it in patients with the non-fluent/grammatical variant of Primary Progressive Aphasia (nfvPPA) and other neurodegenerative diseases that occur with speech and/or language problems.
MethodsThe scale was designed based on useful elements in the assessment of buccophonatory apraxia and the total was quantified in seconds. The scale was administered to 64 participants with diagnoses of: nfvPPA, semantic variant of Primary Progressive Aphasia (svPPA), logopenic variant of Primary Progressive Aphasia (lvPPA), Huntington's disease, Parkinson's disease, as well as a group of healthy controls.
ResultsPatients showed a significantly higher score compared to controls. The group nfvPPA had the highest mean score on the scale (429seconds±278). The scale was useful to differentiate vnfPPA from svPPA and Parkinson's disease (area under curve [AUC] of 0.956 and 0.989 respectively), but less to differentiate it from Huntington's disease (AUC=0.67) and lvPPA. There was a statistically significant relationship between total score and disease severity in nfvPPA (p<0.029).
ConclusionsThe Barcelona scale for buccophonatory apraxia could be useful to quantitatively evaluate buccophonatory apraxia in different neurodegenerative diseases, and compare patients, especially in nfvPPA.
La afasia progresiva primaria (APP) es un conjunto de trastornos neurodegenerativos que se caracterizan por un deterioro progresivo del lenguaje1. En función de las características del lenguaje afectadas se clasifican en tres variantes clínicas2: la variante semántica (vsAPP), que se caracteriza por la pérdida progresiva del conocimiento semántico que conduce a problemas para la denominación y comprensión de palabras aisladas, la variante logopénica (vlAPP) caracterizada por las dificultades para la búsqueda de palabras, ya sea en pruebas de denominación como en habla espontánea, y dificultades en la repetición de frases, y la variante no fluente/agramatical de la APP (vnfAPP) que se caracteriza por la presencia de agramatismo en la producción del lenguaje y/o apraxia verbal con un habla enlentecida y con esfuerzo. Estos últimos pacientes presentan frecuentemente errores en los sonidos y distorsiones del habla como consecuencia de la apraxia verbal (AV). Finalmente, también existen casos de APP que no pueden ser clasificadas en estas variantes (indeterminadas) o que presentan características mixtas.
La AV, también denominada apraxia del habla, es un trastorno de la programación motora del habla ocasionada por lesiones neurológicas. Se afecta la capacidad para planificar o programar espacial y temporalmente los movimientos de los órganos fonoarticulatorios necesarios para producir los sonidos del habla3. Así mismo, se producen errores articulatorios inconsistentes, disprosodia y una disminución en la velocidad del habla4. Habla enlentecida, alargamiento de palabras o segmentos y una articulación distorsionada son algunas de las principales características clínicas descritas5.
Por otro lado, en los pacientes con la vnfAPP también pueden aparecer dificultades a la imitación o realización de movimientos sin sonido. En este caso se le denomina apraxia no verbal (ANV) o bucofacial, definido como la incapacidad de producir de forma eficiente movimientos orales (con la cara, lengua, boca, mandíbula y paladar) en respuesta a una orden verbal o a la imitación. Se afectan los movimientos de las estructuras respiratorias y bucales con relativa preservación de la capacidad para producir acciones semiautomáticas y movimientos reflejos6. Frecuentemente, la AV y la ANV coocurren en los pacientes con la vnfAPP.
En la práctica clínica, existen algunos instrumentos de evaluación de la AV con el objetivo de contribuir a su diagnóstico diferencial con otras alteraciones de la comunicación como la afasia o la disartria. Una búsqueda bibliográfica dirigida permite poner en conocimiento que no hay versiones en español publicadas y validadas. La mayoría de las herramientas de valoración clínica son para la población de habla inglesa. Entre ellas, el Motor Speech Evaluation, en el cual se evalúa diferentes tareas del habla tales como la prolongación de vocales, repetición de sílabas, palabras y frases, lectura de texto y descripción de lámina7. El Apraxia Battery for Adults – 2 (ABA-2) es un instrumento estandarizado que consiste en 6 subtest donde se evalúa la tasa diadococinética, repeticiones de diferentes longitudes de palabras y movimientos orales, entre otros8. La Apraxia of Speech Rating Scale (ASRS) fue diseñada para cuantificar la presencia o ausencia, la frecuencia relativa y la gravedad de las características asociadas con la apraxia del habla9. La mayoría de estas escalas fueron creadas como herramientas de diagnóstico. No obstante, todas ellas se basan en el criterio subjetivo del evaluador. Es por ello por lo que resultan menos útiles como herramienta de estudio de la progresión de la enfermedad o para medir la respuesta a intervenciones terapéuticas. Otras herramientas, como la ratio de articulación, requieren de análisis sofisticados de grabaciones de la voz10–12. En cuanto a la evaluación de la ANV, en el subtest de agilidad no verbal (de la prueba agilidad oral del test de Boston para el diagnóstico de la afasia) se cuantifica la agilidad no verbal sólo de la lengua y los labios, puntuando el número de repeticiones que se realizan en 5 segundos13. El Apraxia Battery for Adults – 2 (ABA-2) mencionado anteriormente también contiene un subtest para la ANV con una puntuación de 0 a 5, siendo 0 incapacidad para realizar el movimiento y 5 realización de forma correcta. Otros estudios reportan la evaluación de la ANV a través de la creación de su propio protocolo14.
A pesar de todas estas herramientas mencionadas, a día de hoy, no existe una escala práctica, sencilla, objetiva y cuantitativa para la evaluación de la AV y la ANV, especialmente necesaria en la vnfAPP. Por este motivo, nos planteamos la creación de una escala en lengua castellana (con una versión en catalán) para cuantificar globalmente y monitorizar las características de la apraxia bucofonatoria. Dado que la existencia de otras alteraciones del habla y lenguaje, como la disartria y la afasia, es frecuente en otras enfermedades neurodegenerativas, comparamos nuestra escala con pacientes con alteración en la comunicación causada por otras enfermedades neurodegenerativas.
Material y métodosParticipantesEl estudio fue aprobado por el comité de Ética del Hospital Clínic de Barcelona. Todos los pacientes fueron reclutados en el Hospital de Día de Enfermedades Neurodegenerativas del Hospital Clínic de Barcelona.
Los participantes debían tener un diagnóstico de APP, enfermedad de Huntington o enfermedad de Parkinson, realizado por un neurólogo experto según los actuales criterios diagnósticos2,15,16. Con vistas a la aplicabilidad clínica de la escala en pacientes con alteraciones del habla y lenguaje se decidió incluir en cada grupo diagnóstico sólo sujetos con alteraciones del habla y lenguaje. Los diagnósticos de estas alteraciones fueron confirmados por un logopeda o un neuropsicólogo a través del BDAE y del Frenchay Dysarthria Assessment (FDA)13,17. Se excluyó a los pacientes con resultados dentro de la normalidad en la puntuación descriptiva del FDA. Para evitar incluir sujetos en fase de demencia avanzada se decidió reclutar sujetos con una puntuación en el Mini-Mental State Examination (MMSE) mayor de 15. El estadio de la enfermedad se determinó del siguiente modo: para las APP se utilizó la escala BDAE para la gravedad del lenguaje (BDAE 4=leve; BDAE 3 o 2=moderado; BDAE 1=grave)13. Para los pacientes de enfermedad de Parkinson se utilizó los estadios de Hoehn y Yarh (una puntuación de 1 o 2 se consideró leve; 3 se consideró moderado y 4 o 5 grave)18. Para la enfermedad de Huntington se usó la escala funcional de Myers considerando una puntuación ≥80 como leve, entre 80 y 50 como moderada y ≤50 como grave19. Un neurólogo y neuropsicólogo experto en demencias evaluó a los pacientes con APP en tareas de lenguaje y habla (habla espontánea, descripción de lámina y repetición de frases)13 para obtener el perfil de características del habla y lenguaje.
Los controles incluidos se reclutaron específicamente para este estudio. Todos ellos eran voluntarios sanos sin quejas cognitivas o del lenguaje y sin antecedentes de enfermedades psiquiátricas o neurológicas con una valoración del lenguaje espontáneo dentro de la normalidad.
Escala de evaluaciónLa escala Barcelona se diseñó considerando los ítems existentes en diversas herramientas para la evaluación de la AV y ANV. Particularmente, se tomó información del Motor Speech Evaluation7, adaptación en español no validada, FDA17, subtest de agilidad no verbal del test de Boston para el diagnóstico de la afasia13, Examen complementario de apraxia bucofacial del test Ducarne20 y el subtest de Afasia, exploración, diagnóstico y tratamiento21. Se revisaron los diferentes ítems, teniendo en cuenta tanto las tareas de articulación como los movimientos bucofaciales. Así mismo, se revisó la forma de puntuación de cada uno de ellos. Se tuvieron en cuenta los principios básicos en la construcción de ítems: representatividad, relevancia, diversidad, claridad, sencillez y comprensibilidad. Para seleccionar mejor los ítems se tuvo en cuenta el índice de dificultad (no verbal y verbal), el índice de discriminación y el funcionamiento diferencial de los ítems. Se hizo un análisis de los valores de la escala COSP (Crosslinguistic Overlap Scale for Phonology)22 de las palabras para observar la similitud fonológica entre ambas lenguas. La escala Barcelona para la apraxia bucofonatoria fue administrada por un logopeda experto en patologías neurodegenerativas (N.M). Dicha escala proporciona una puntuación total (en segundos) y está compuesta por 2 subescalas (una para la ANV y otra para AV). Para la ANV, el test evalúa el tiempo que tarda el participante en realizar 5 repeticiones en diferentes movimientos con la cara, lengua, labios y sonidos orales (13 ítems). La subescala de la AV contiene 14 ítems divididos en 5 apartados: 1 ítem de fonación, 3 de diadococinesias simples, 3 de diadococinesias alternas, 5 de repetición de palabras multisilábicas y 2 de lectura de frases. Se facilitaron las instrucciones de forma clara y concisa, con instrucción verbal o proporcionando el modelo a repetir. Todos los participantes comprendieron las consignas. El tiempo de realización se midió con un cronómetro empezando a contabilizar en el momento que el participante empezaba a realizar el primer movimiento y se detenía al finalizar la última repetición. Se anotaron los segundos empleados durante las 5 o 10 repeticiones de cada ítem, según se indica en la escala (Anexo 1).
Se hicieron 2 versiones de la escala, una en castellano y otra en catalán. La escala se administró en la lengua nativa o predominante de cada participante (36 pacientes y 15 controles en catalán y 28 pacientes y 4 controles en castellano).
Puntuación de la escalaSe obtuvo una puntuación total de la escala en segundos, sumando todos los subapartados. Esta puntuación indica cuántos segundos ha tardado el participante en realizar todas las tareas, por lo que una puntuación más alta significa un peor rendimiento. Los valores de las mediciones de tiempo en cada ítem se obtuvieron en el cronómetro con una precisión de décimas de segundo y se redondearon al número entero en segundos. A cada uno de los 64 participantes se les realizaron los 30 ítems de la escala, lo que supone un total de 1920 ítems; 4 de los pacientes (3 vnfAPP y 1 vlAPP) fallaron 1 de los ítems, lo que supone un 6,25% de los pacientes y un 0,21% de los ítems, por lo que el porcentaje de ítems no ejecutados fue muy bajo. En estos casos se le asignó una puntuación de 50, siendo esta puntuación el doble de la peor puntuación entre los sujetos que sí consiguieron realizar la tarea. De esta forma es poco probable que un paciente que realice la tarea obtenga una puntuación superior a 50 y por lo tanto que pueda puntuar más alto que uno que no la realice. Se estableció este criterio dado que si a los pacientes que no podían realizar alguna de las tareas no se les asignaba un número, no podrían ser comparables con el resto.
Evaluación estadísticaLos análisis se realizaron mediante RStudio versión 4.0.2. La comparación de la puntuación entre grupos se realizó mediante test no paramétricos. Se consideraron diferencias significativas los resultados de p<0,05 para todos los análisis. Las variables cualitativas entre grupos se analizaron mediante el test de Fisher. Se utilizó el test de Kruskal-Wallis para la comparación de los valores cuantitativos entre más de dos grupos. Las comparaciones entre pares de grupos se realizaron mediante la prueba de Wilcoxon, ajustando el valor de p significativo por múltiples comparaciones según el test de Bonferroni. Se realizaron curvas ROC y se calcularon las áreas bajo la curva para las diferentes comparaciones entre grupos. Se correlacionó las puntuaciones de los subapartados de AV y ANV mediante el test no paramétrico de Spearman. Finalmente, con el objetivo de controlar los resultados de la escala con vistas a otras variables, se realizó un análisis multivariante en el que se incluyó la puntuación de la escala como variable dependiente y las variables grupo, edad, sexo y gravedad de la enfermedad como variables independientes.
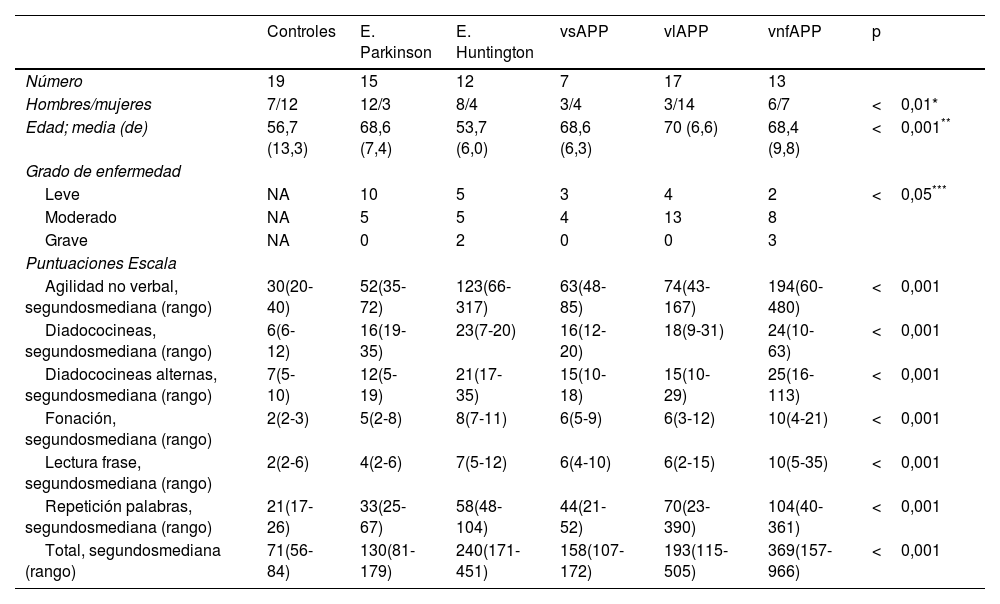
ResultadosSujetos incluidos en el estudioUn total de 64 individuos participaron en el estudio distribuidos en los siguientes diagnósticos: 7 vsAPP, 17 vlAPP y 13 vnfAPP, 12 con enfermedad de Huntington y 15 con enfermedad de Parkinson. Así mismo, un total de 19 controles neurológicamente sanos fueron evaluados. En la tabla 1 se resumen las características demográficas y clínicas de la muestra.
Información demográfica y clínica de la muestra
| Controles | E. Parkinson | E. Huntington | vsAPP | vlAPP | vnfAPP | p | |
|---|---|---|---|---|---|---|---|
| Número | 19 | 15 | 12 | 7 | 17 | 13 | |
| Hombres/mujeres | 7/12 | 12/3 | 8/4 | 3/4 | 3/14 | 6/7 | <0,01* |
| Edad; media (de) | 56,7 (13,3) | 68,6 (7,4) | 53,7 (6,0) | 68,6 (6,3) | 70 (6,6) | 68,4 (9,8) | <0,001** |
| Grado de enfermedad | |||||||
| Leve | NA | 10 | 5 | 3 | 4 | 2 | <0,05*** |
| Moderado | NA | 5 | 5 | 4 | 13 | 8 | |
| Grave | NA | 0 | 2 | 0 | 0 | 3 | |
| Puntuaciones Escala | |||||||
| Agilidad no verbal, segundosmediana (rango) | 30(20-40) | 52(35-72) | 123(66-317) | 63(48-85) | 74(43-167) | 194(60-480) | <0,001 |
| Diadococineas, segundosmediana (rango) | 6(6-12) | 16(19-35) | 23(7-20) | 16(12-20) | 18(9-31) | 24(10-63) | <0,001 |
| Diadococineas alternas, segundosmediana (rango) | 7(5-10) | 12(5-19) | 21(17-35) | 15(10-18) | 15(10-29) | 25(16-113) | <0,001 |
| Fonación, segundosmediana (rango) | 2(2-3) | 5(2-8) | 8(7-11) | 6(5-9) | 6(3-12) | 10(4-21) | <0,001 |
| Lectura frase, segundosmediana (rango) | 2(2-6) | 4(2-6) | 7(5-12) | 6(4-10) | 6(2-15) | 10(5-35) | <0,001 |
| Repetición palabras, segundosmediana (rango) | 21(17-26) | 33(25-67) | 58(48-104) | 44(21-52) | 70(23-390) | 104(40-361) | <0,001 |
| Total, segundosmediana (rango) | 71(56-84) | 130(81-179) | 240(171-451) | 158(107-172) | 193(115-505) | 369(157-966) | <0,001 |
vsAPP: variante semántica de la afasia progresiva primaria; vlAPP: variante logopénica de la afasia progresiva primaria; vnfAPP: variante no fluente de la afasia progresiva primaria; p: valor p (corresponde a test de Fisher en variables cualitativas y Kruskal-Wallis en variables cuantitativas); de: desviación estándar; NA: no aplica.
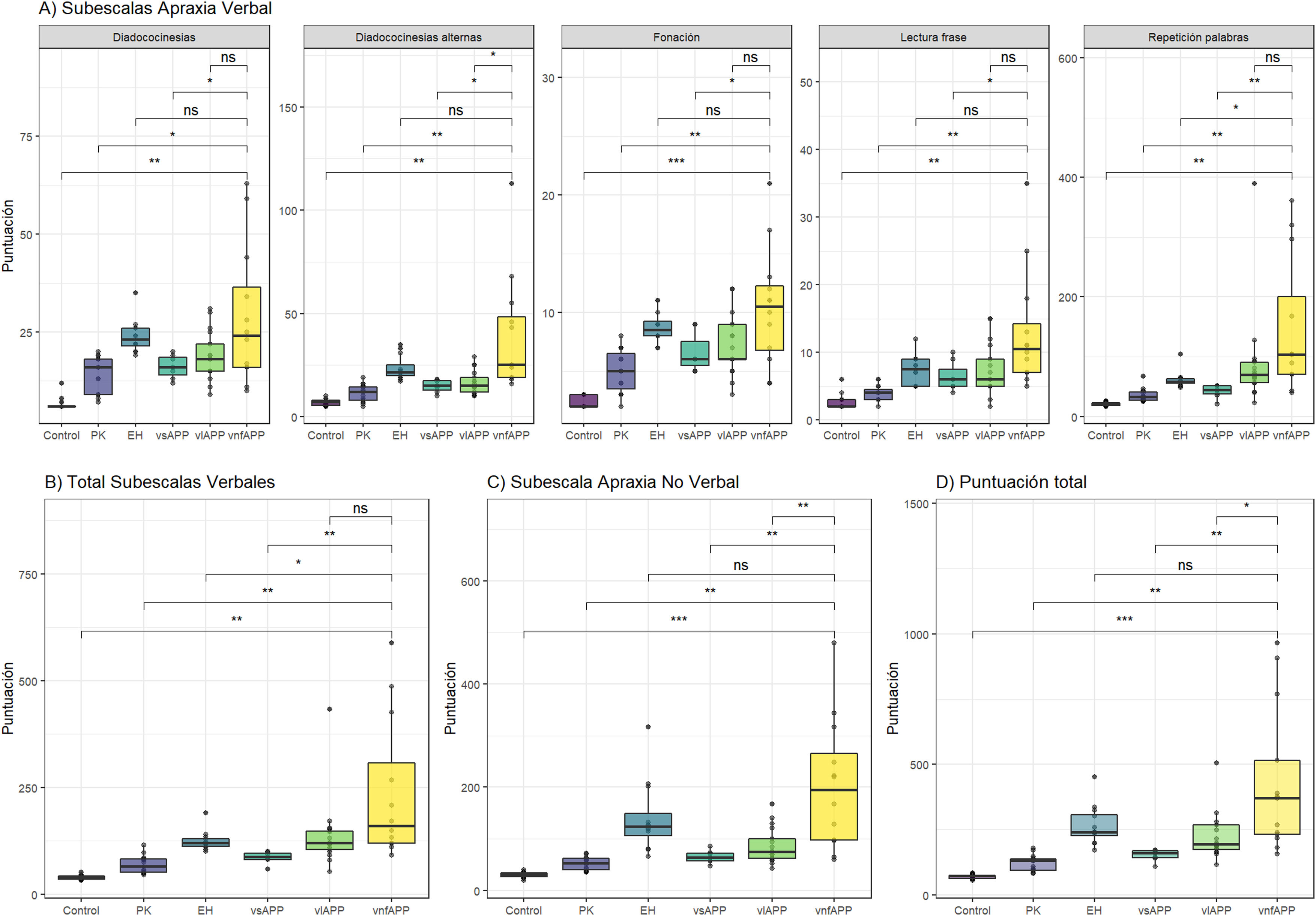
En la figura 1 y la tabla 1 se resumen los resultados de todas las subpruebas, el total del apartado de AV, ANV y la puntuación total de la escala para cada uno de los grupos. La puntuación total media en el grupo de controles fue de 69 segundos (desviación estándar [de]=8). Los pacientes, en conjunto, mostraron una puntuación significativamente mayor respecto a los controles tanto en la puntuación total del test (media de 242 segundos; de=173) como en cada uno de los subtest por separado (p<0,01 en todas las comparaciones).
Resultados de la escala según grupos y subtest. A) Subtest de apraxia verbal; B) Suma del total de subtest de apraxia verbal; A) Subtest de apraxia no verbal y D) Puntuación total de la escala.
EH: enfermedad de Huntington; PK: enfermedad de Parkinson; vlAPP: variante logopénica de la afasia progresiva primaria; vnfAPP: variante no fluente de la afasia progresiva primaria; vsAPP: variante semántica de la afasia progresiva.
Valores de significación: *p<0,05; **p<0,01; ***p<0,001; ****p<0,0001.
Entre las diferentes patologías, la vnfAPP fue el grupo que presentó unas puntuaciones más elevadas (media de 429 segundos, de=278), presentando diferencias significativas en la puntuación global de la prueba con todos los restantes grupos excepto con el grupo de enfermedad de Huntington. Sí se encontraron diferencias significativas entre los grupos de vnfAPP y de Huntington para el global de las puntuaciones verbales agrupadas (p<0,05). La escala también detectó diferencias significativas entre los tres subtipos de APP, siendo el grupo de vnfAPP el más afectado y el grupo de vsAPP el menos afectado (p<0,001 en todas las comparaciones).
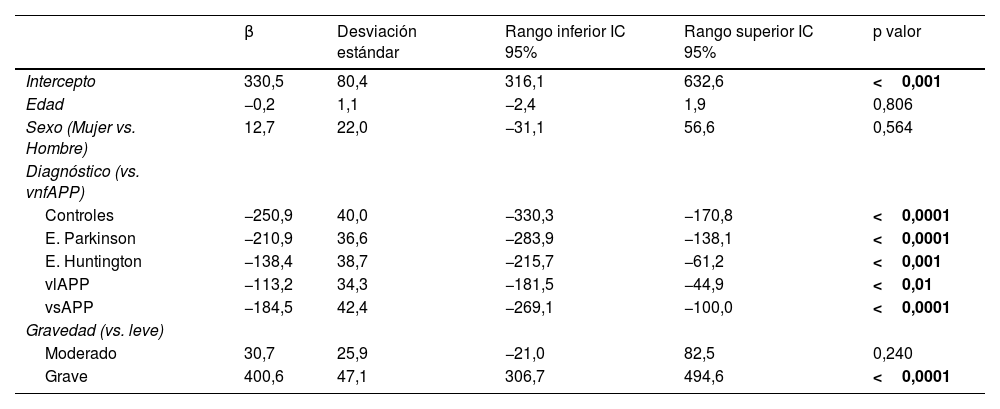
El análisis multivariante controlado por las variables edad, sexo y gravedad también mostró diferencias significativas de la puntuación total de la escala entre el grupo de pacientes de vnfAPP y los restantes grupos (tabla 2).
Regresión lineal multivariante
| β | Desviación estándar | Rango inferior IC 95% | Rango superior IC 95% | p valor | |
|---|---|---|---|---|---|
| Intercepto | 330,5 | 80,4 | 316,1 | 632,6 | <0,001 |
| Edad | −0,2 | 1,1 | −2,4 | 1,9 | 0,806 |
| Sexo (Mujer vs. Hombre) | 12,7 | 22,0 | −31,1 | 56,6 | 0,564 |
| Diagnóstico (vs. vnfAPP) | |||||
| Controles | −250,9 | 40,0 | −330,3 | −170,8 | <0,0001 |
| E. Parkinson | −210,9 | 36,6 | −283,9 | −138,1 | <0,0001 |
| E. Huntington | −138,4 | 38,7 | −215,7 | −61,2 | <0,001 |
| vlAPP | −113,2 | 34,3 | −181,5 | −44,9 | <0,01 |
| vsAPP | −184,5 | 42,4 | −269,1 | −100,0 | <0,0001 |
| Gravedad (vs. leve) | |||||
| Moderado | 30,7 | 25,9 | −21,0 | 82,5 | 0,240 |
| Grave | 400,6 | 47,1 | 306,7 | 494,6 | <0,0001 |
IC: intervalo de confianza; vsAPP: variante semántica de la afasia progresiva primaria; vlAPP: variante logopénica de la afasia progresiva primaria; vnfAPP: variante no fluente de la afasia progresiva primaria.
Los valores en negrita indican resultados estadísticamente significativos.
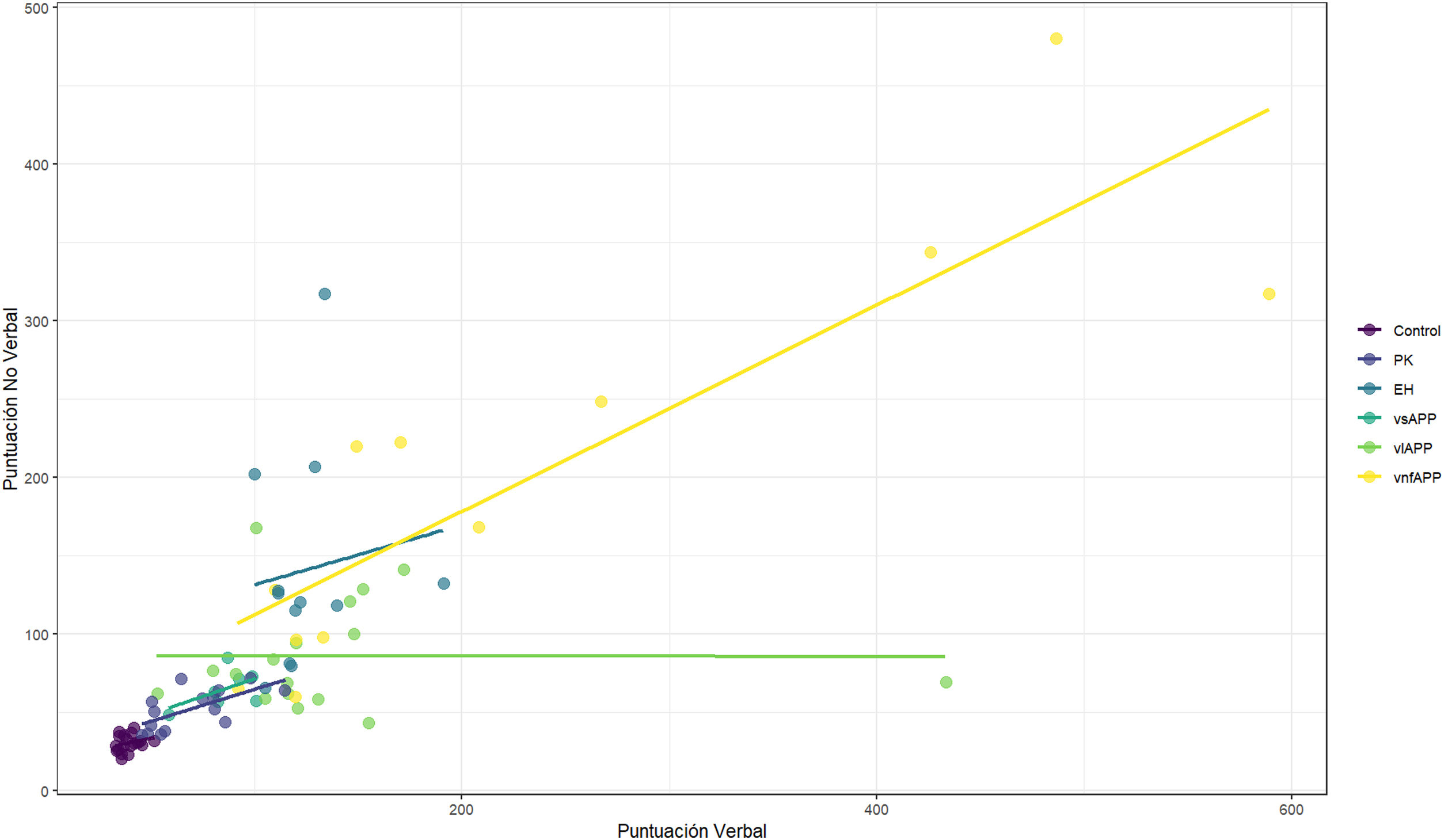
Se observó una correlación entre las puntuaciones de los subtest de AV y el subtest de ANV (rho de Spearman=0,86, p<0,0001) (fig. 2).
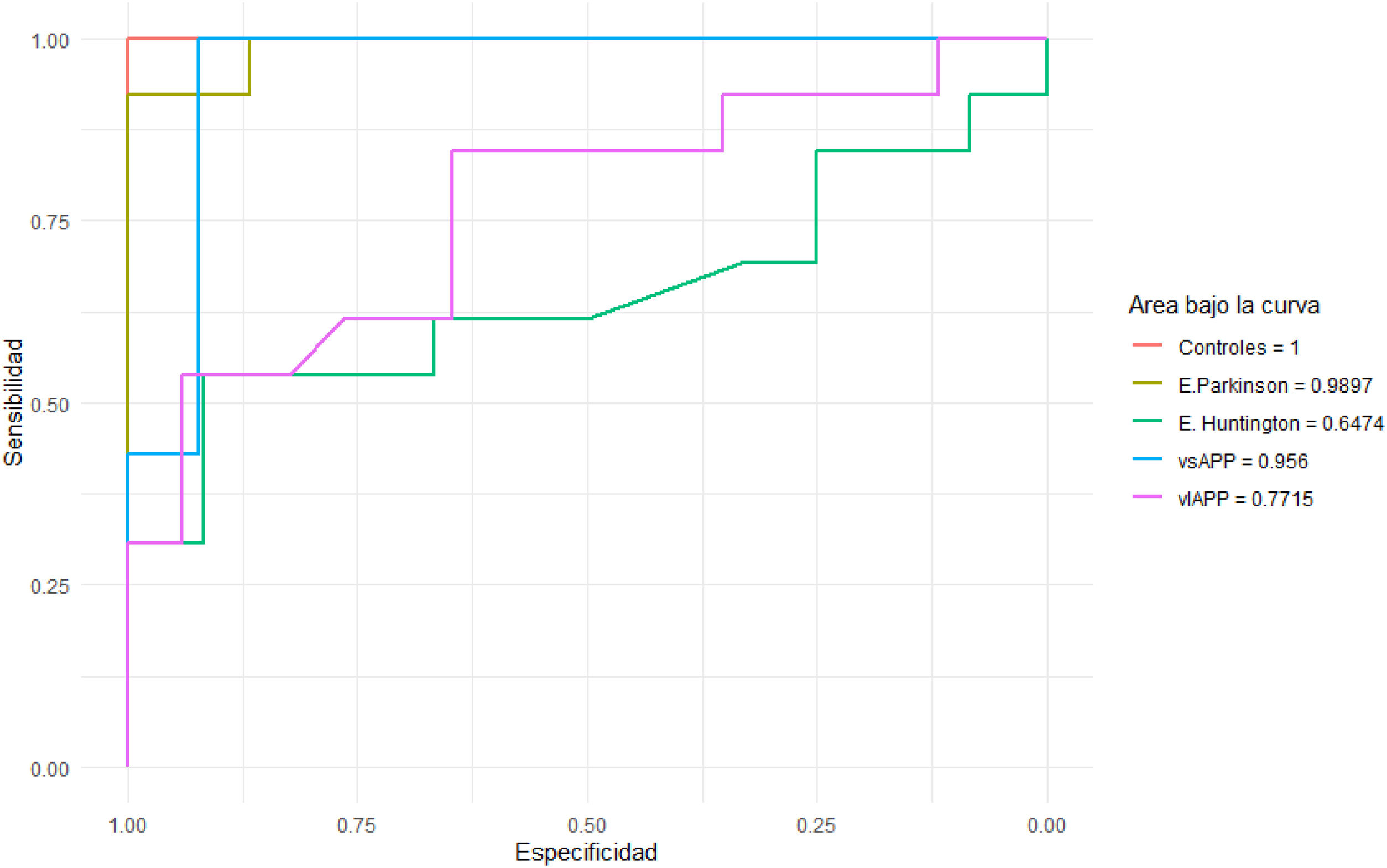
Curvas ROC para diferenciar entre patologíasSe evaluó la capacidad del test de distinguir la vnfAPP, el grupo con las puntuaciones más elevadas, del resto de patologías (fig. 3). En este sentido, las curvas ROC entre el grupo de vnfAPP y los grupos de vsAPP y enfermedad de Parkinson fueron muy buenas (área bajo la curva [AUC] de 0,956 y 0,989, respectivamente). La escala resultó menos sensible para diferenciar vnfPPA de los pacientes con enfermedad de Huntington y vlAPP (AUC de 0,647 y 0,771, respectivamente).
Curvas ROC entre vnfAPP y el resto de enfermedades neurodegenerativas y controles.
EH: enfermedad de Huntington; PK: enfermedad de Parkinson; vlAPP: variante logopénica de la afasia progresiva primaria; vnfAPP: variante no fluente de la afasia progresiva primaria; vsAPP: variante semántica de la afasia progresiva primaria.
El mejor punto de corte de la escala para diferenciar las características del habla de vnfAPP del resto de grupos se estableció en 215 segundos. Este punto de corte mostró una sensibilidad del 84% y una especificidad del 78% para la cuantificación de la apraxia bucofonatoria en la vnfAPP.
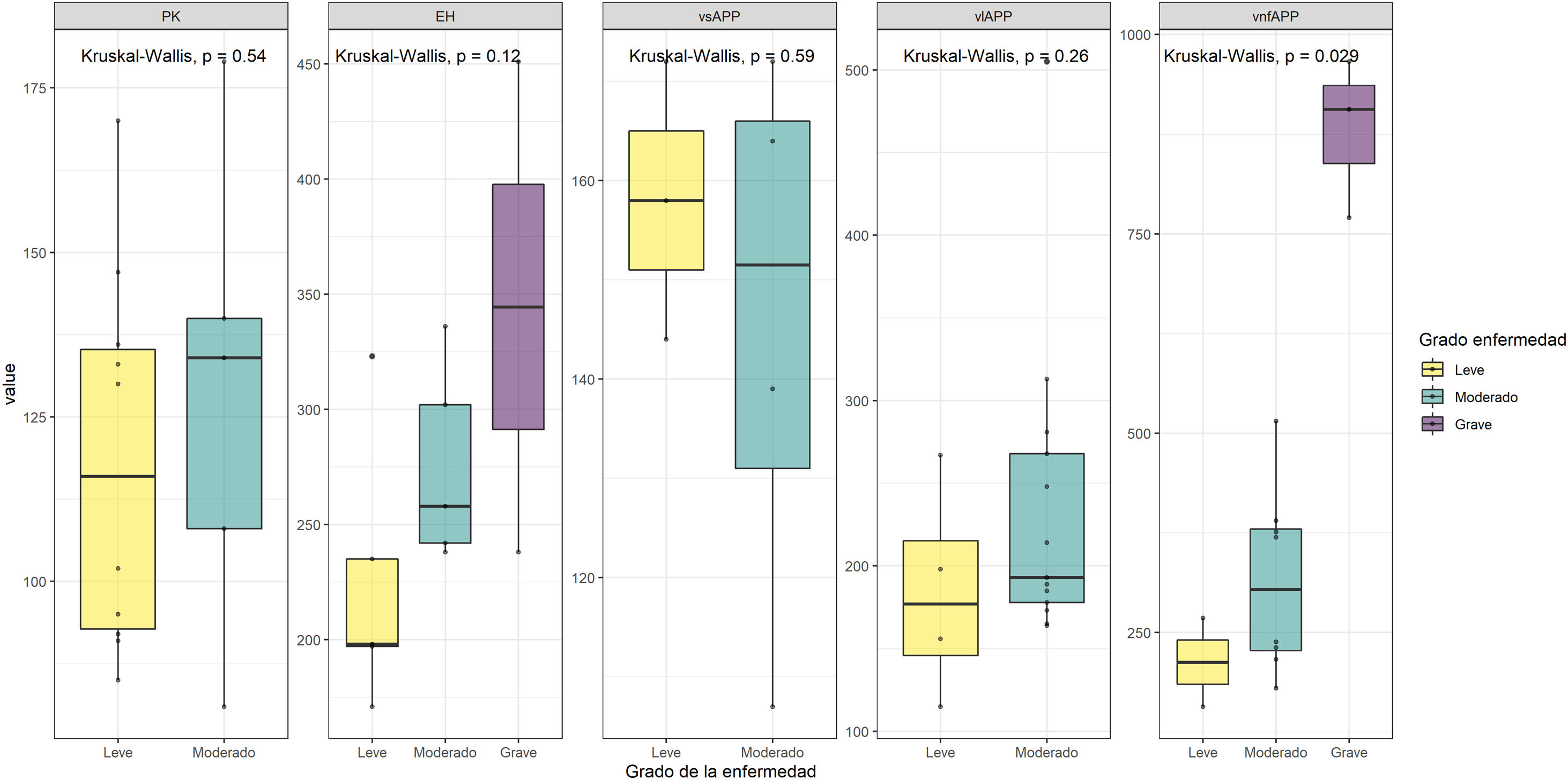
Resultados según la gravedad de la enfermedadLa figura 4 indica los resultados de cada patología según la gravedad. Se observa una tendencia entre la gravedad de la enfermedad y un incremento en las puntuaciones de la escala en todos los grupos salvo en el de vsAPP. Esta relación es estadísticamente significativa en los casos de vnfAPP (p<0,029).
DiscusiónEn nuestro estudio, diseñamos un instrumento de evaluación para la apraxia bucofonatoria como herramienta para cuantificar estas alteraciones de manera objetiva y poder establecer comparaciones entre diferentes tipos de pacientes.
La gran mayoría de las escalas para el diagnóstico y evaluación de la AV, como la escala ASRS o la Motor Speech Evaluation, se basan en puntuaciones cualitativas o semicuantitativas que dependen, en parte, de la valoración subjetiva del evaluador7,9. Por el contrario, nuestra escala obtiene como resultado una medida cuantitativa, el tiempo que el sujeto tarda en completar una serie de tareas, evitando la subjetividad del evaluador. Con un estudio posterior se podría observar la utilidad de la herramienta para facilitar la validez interevaluador y la monitorización de la progresión de la apraxia. En relación con la ANV, el subtest del BDAE sí que cuantifica la agilidad no verbal con el número de repeticiones producidas durante 5 segundos (p. ej., contraer y relajar los labios, abrir y cerrar la boca, sacar y esconder la lengua…)13. No obstante, este no evalúa la parte verbal y únicamente examina los movimientos de la lengua y los labios.
La escala Barcelona para la apraxia bucofonatoria mostró ser útil para poder diferenciar el grupo de pacientes de vnfAPP con el grupo de pacientes con enfermedad de Parkinson (AUC de 0,989) ya que, aunque estos últimos también presentan alteraciones en el habla, como la disartria, los movimientos práxicos bucofaciales y verbales tienden a estar más preservados. También resultó apropiada para diferenciar entre vnfAPP y vsAPP (AUC 0,956) debido a su preservación del acto motor, mostrando más alteraciones en el lenguaje que en el habla. Por otro lado, la escala es menos beneficiosa para diferenciar entre la vnfAPP y la enfermedad de Huntington (AUC 0,647) debido a las mayores dificultades oromotoras y enlentecimiento en el habla que presentan estos pacientes. También resulta menos favorable para diferenciar la vnfAPP de la vlAPP (AUC 0,771), probablemente por las múltiples repeticiones que realizan al incrementarse la longitud y complejidad fonética, especialmente en el ítem de repetición de palabras. En estos casos las puntuaciones de la escala son más elevadas con una tendencia más cercana a las de la vnfAPP.
Nuestro estudio también muestra que los pacientes con estadios más avanzados de la enfermedad presentan peores resultados, observándose una tendencia entre la gravedad y mayor puntuación en todas las patologías estudiadas, excepto en la vsAPP, tendencia que en el grupo de nfvPPA resulta estadísticamente significativa (p<0,029). Esto sugiere la posible utilidad de esta herramienta como medida de progresión clínica y para su uso como medida de respuesta a las intervenciones terapéuticas.
La limitación principal de nuestro estudio es el tamaño de la muestra, consecuencia de la baja prevalencia de algunas de las enfermedades estudiadas. Aunque el tamaño muestral permite encontrar diferencias significativas entre los grupos estudiados, la comparación entre subgrupos (como por ejemplo entre la gravedad de la misma enfermedad) está ciertamente limitada. Otra limitación importante es que, aunque la escala fue diseñada para la cuantificación de la AV y la ANV, la puntuación de la misma parece verse afectada por alteraciones del habla y lenguaje distintas a la apraxia, puesto que sujetos sin apraxia (como pacientes con la vlAPP o con enfermedad de Parkinson) presentan puntuaciones más altas que los controles. Así mismo, el presente trabajo no presenta una comparación interevaluador. Finalmente, aunque nuestros datos sugieren que la puntuación de la escala aumenta a medida que progresan las enfermedades estudiadas, no se dispone de datos longitudinales de la misma.
En conclusión, nuestro estudio sugiere que esta nueva escala podría ser una herramienta útil para evaluar cuantitativamente la apraxia bucofonatoria en diferentes enfermedades neurodegenerativas y diferenciarlas entre sí, en especial en la vnfAPP. La obtención de resultados cuantitativos podría ayudar a medir los cambios longitudinales en el tiempo y la respuesta a potenciales intervenciones terapéuticas. Estos hallazgos han de ser validados en muestras de mayor tamaño, e idealmente en estudios longitudinales.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación BBVA Juan Rodés – Josep Baselga otorgado a SBE y por el Hospital Clínic de Barcelona por otorgar la beca de permiso sabático en el extranjero a NM.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses relacionado con esta publicación.
Los autores agradecen a todos los voluntarios su participación en este estudio.