Analizar el patrón geográfico de la mortalidad por cáncer de pulmón según sexo en España (nivel provincial) y Andalucía (nivel municipal) durante el periodo 2013-2017.
Sujetos y métodoPara analizar los patrones espaciales se usaron 3 estimadores de riesgo: la razón de mortalidad estandarizada, el riesgo relativo suavizado (RRs) y la probabilidad posterior (PP) de que el RRs sea mayor que 1. Realizamos un análisis de conglomerados utilizando el índice global de Moran y el índice local de Moran (LISA). Los resultados fueron mapeados.
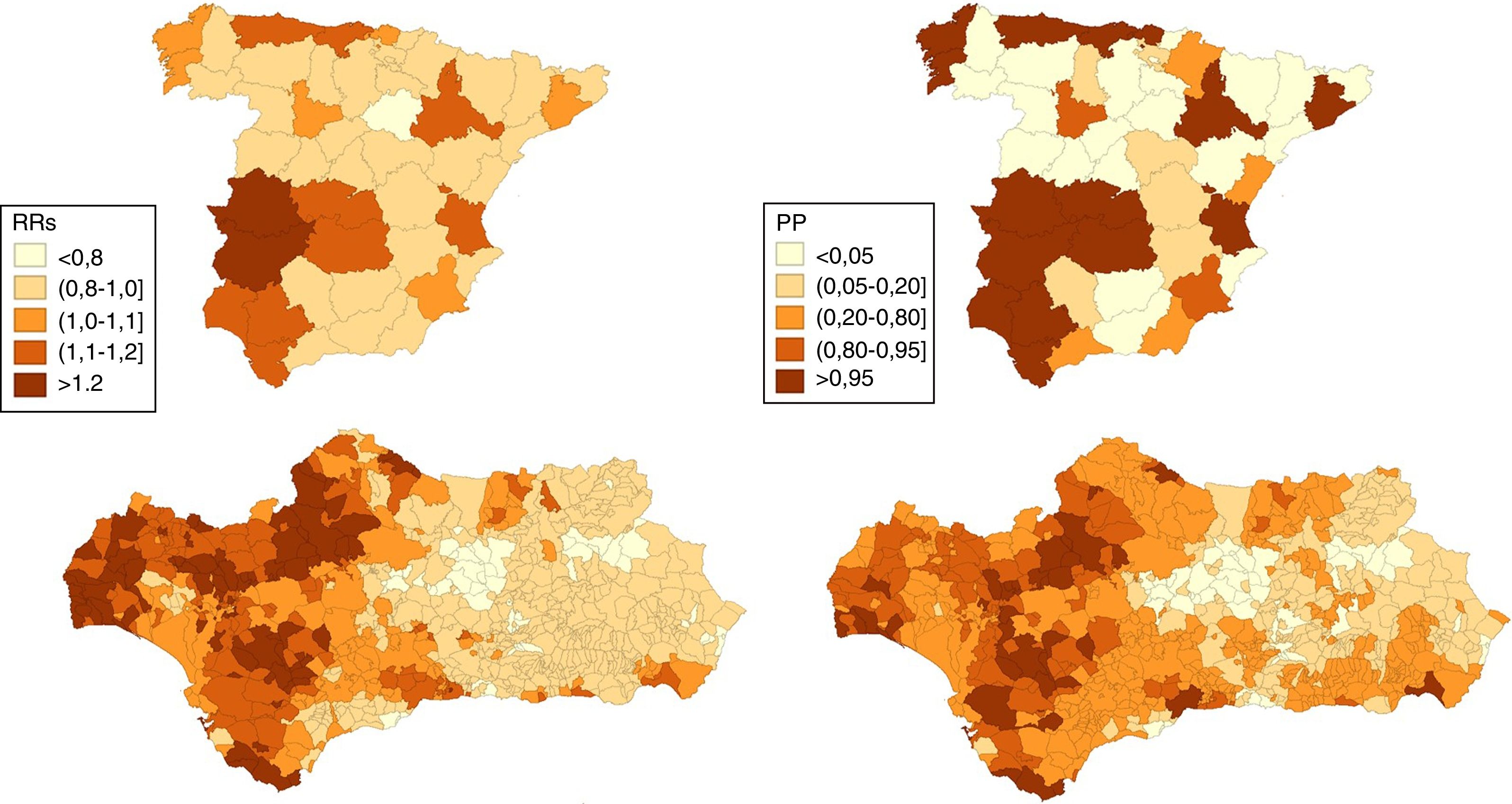
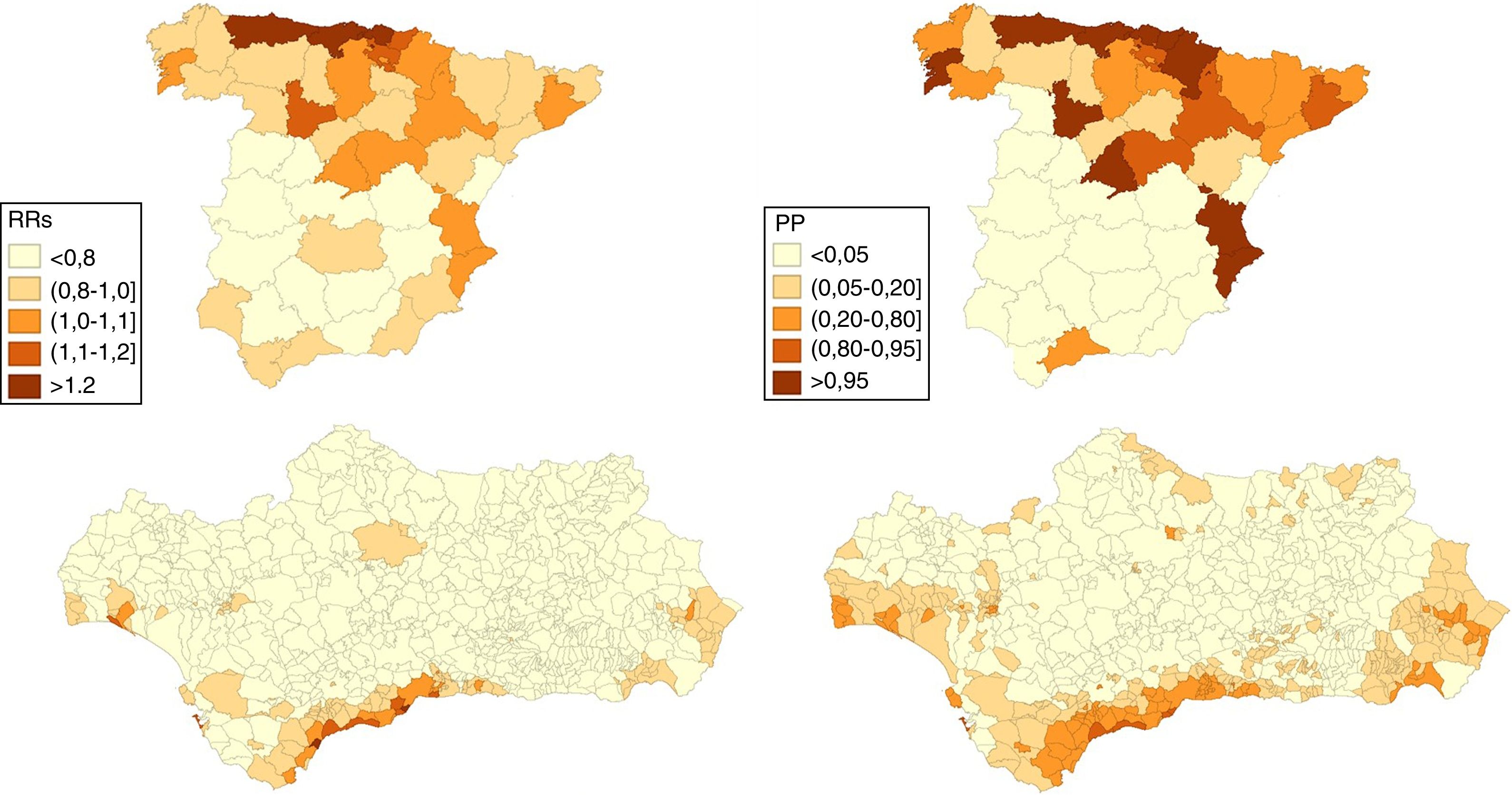
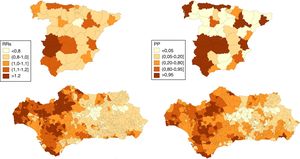
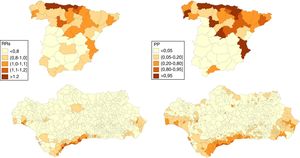
ResultadosEn los hombres, 17 provincias tienen un RRs>1 de las que 15 presentan una PP>0,95, entre ellas Huelva, Sevilla, Cádiz y algunas provincias del norte peninsular (Asturias y Cantabria). En las mujeres son 10 las que presentan un RRs>1 y PP>0,95: 6 situadas en el norte peninsular, Valladolid, Madrid, Valencia y Alicante. En Andalucía, en los hombres, 332 municipios muestran un RRs>1 de los que 39 muestran una PP>0,95, la mayoría de los cuales se encuentran en las provincias de Huelva, Cádiz y Sevilla y que incluye a 5 capitales de provincia (Huelva, Sevilla, Cádiz, Málaga y Almería). En las mujeres solo 22 municipios muestran un RRs superior a 1 aunque solo 5 muestran una PP>=0,80 (uno en Cádiz y 4 en Málaga) y ninguno una PP>0,95.
ConclusionesNuestros hallazgos ayudan a identificar áreas de alto riesgo para guiar los esfuerzos de control de la mortalidad por cáncer de pulmón.
To analyze the geographical pattern of lung cancer mortality according to sex in Spain (by provinces) and Andalusia (by municipalities) during the period 2013-2017.
Subjects and methodThree risk estimators were used to analyze spatial patterns: standardized mortality ratio, relative risk smoothing (RRS), and posterior probability (PP) that RRS is greater than 1. We conducted a cluster analysis using global Moran's index and local Moran's index (LISA). The results were mapped.
ResultsIn men, 17 provinces have an RRS greater than 1, 15 of which have a PP>0.95, including Huelva, Seville, Cadiz and some provinces in northern Spain (Asturias and Cantabria). In women, 10 provinces have an RRS>1 and PP>0.95, 6 located in northern Spain, Valladolid, Madrid, Valencia, and Alicante. In Andalusia, 332 municipalities in an area that includes 5 provincial capitals (Huelva, Seville, Cadiz, Malaga, and Almeria) show an RRS>1 among men. Thirty nine of these, mostly in the provinces of Huelva, Cadiz and Seville, have a PP>0.95. In women, only 22 municipalities have an RRS>1, although only 5 have a PP≥0.80 (one in Cadiz and 4 in Malaga) and none have PP>0.95.
ConclusionsOur findings help identify high-risk areas to guide lung cancer mortality control efforts.
A nivel mundial, el cáncer de pulmón (CP) sigue siendo la principal causa de incidencia y mortalidad por cáncer, con 2,1 millones de nuevos casos (11,6%) y 1,8 millones de muertes (18,4%) en 2018. Entre las mujeres, el CP es la principal causa de muerte por cáncer en 28 países1.
En España (2018) fallecieron 22.153 personas por CP (17.194 hombres y 4.959 mujeres), siendo la primera causa de muerte por cáncer en hombres y la segunda en mujeres tras el cáncer de mama. En el año 2019 se estima que hubo 27.939 nuevos casos de CP, 4.635 de ellos en Andalucía2.
Desde comienzos de la década de los 90 las tasas de mortalidad por CP en mujeres aumentaron en España3 en contraste con las tasas decrecientes observadas entre los hombres. Algo similar se observa en la mayoría de las comunidades autónomas4,5.
En Andalucía las tasas de mortalidad por CP en mujeres (35-64 años) se muestran más bajas que a nivel nacional, pero se estima que estas seguirán creciendo6, sobre todo en la provincia de Málaga7.
Los estudios que muestran la distribución espacial (geográfica) de la mortalidad por CP en España han usado generalmente grandes áreas, provincias o comunidades autónomas, como unidad básica de estudio8. El avance de las técnicas de mapeo en áreas pequeñas ha proporcionado un enfoque más preciso para describir los patrones espaciales de las causas de muerte y sus determinantes, y así poder establecer prioridades y planificar políticas sanitarias dirigidas a las áreas de alto riesgo identificadas9. En España, los escasos estudios a nivel de agregados municipales10 o de municipios11 han mostrado una clara agregación de áreas con mayor mortalidad por CP en hombres de Extremadura y el suroeste de Andalucía (Huelva, Sevilla y Cádiz).
Teniendo en cuenta todo lo anterior nos planteamos actualizar la información sobre el patrón espacial de la mortalidad por CP a nivel provincial (España continental) y a nivel municipal en Andalucía durante el periodo 2013-2017.
MétodosSe realizó un estudio ecológico exploratorio12 a nivel provincial (España) o municipal (Andalucía) de los casos de mortalidad por CP durante el periodo 2013-2017.
El Instituto Nacional de Estadística proporcionó los datos de mortalidad por CP (Clasificación Internacional de Enfermedades, 10.a revisión: C33-C34) y de población necesarios para los cálculos a nivel provincial y nacional. El Instituto de Estadística de Andalucía proporcionó los datos de mortalidad por CP desglosados por municipios y sexo, y las poblaciones municipales según sexo y 18 grupos de edad en el periodo de estudio.
Se calcularon las tasas brutas, específicas por grupos de edad, ajustadas por el método directo usando como población estándar la europea (TEe) y sexo a nivel de España y de Andalucía en su conjunto.
Para analizar el patrón espacial de la mortalidad por CP a nivel provincial (España) y a nivel de los municipios de Andalucía se usaron 3 estimadores de riesgo: la razón de mortalidad estandarizada, el riesgo relativo suavizado (RRs) y la probabilidad posterior (PP) de que el RRs sea mayor que 1.
Para el cálculo de las defunciones esperadas en cada área (provincia o municipio) se multiplicaron las tasas de mortalidad por grupos de edad a nivel nacional (2013-2017) por las personas-año de cada grupo de edad según los padrones provinciales y municipales disponibles en el Instituto Nacional de Estadística y el Instituto de Estadística de Andalucía. Una vez obtenidos los casos esperados se computó la razón de mortalidad estandarizada que mide el riesgo relativo de un área respecto a la región de referencia, en este caso España, para cada área, teniendo como numerador el número de casos observados y como denominador el número de casos esperados para cada área.
Para cada área se efectuó una estimación de los RRs municipales mediante el ajuste del modelo de Besag-York y Mollié13. Estos RRs y sus PP14 de que los RRs fueran mayores de 1 se estimaron mediante métodos bayesianos empleando «integrated nested Laplace approximation» utilizando (R-INLA)15 con el programa R16.
Para decidir qué áreas tienen un exceso de mortalidad, aplicamos una regla de decisión basada en calcular la probabilidad de que el RRs específico sea mayor que 1 con los siguientes puntos de corte17: 0,05; 0,20; 0,80 y 0,95. Las áreas con valores superiores a 0,80 son áreas en riesgo. El exceso de mortalidad se consideró significativo cuando la probabilidad fue mayor a 0,95. Las probabilidades entre 0,2 y 0,8 muestran poca evidencia de que la relación de tasas es superior a 1, por lo que la tasa de mortalidad específica de estas áreas es similar a la tasa de mortalidad de referencia. Las áreas con valores inferiores a 0,20 son áreas de bajo riesgo y las áreas con probabilidad inferior a 0,05 se consideran áreas con una tasa de mortalidad específica significativamente menor que la tasa nacional española.
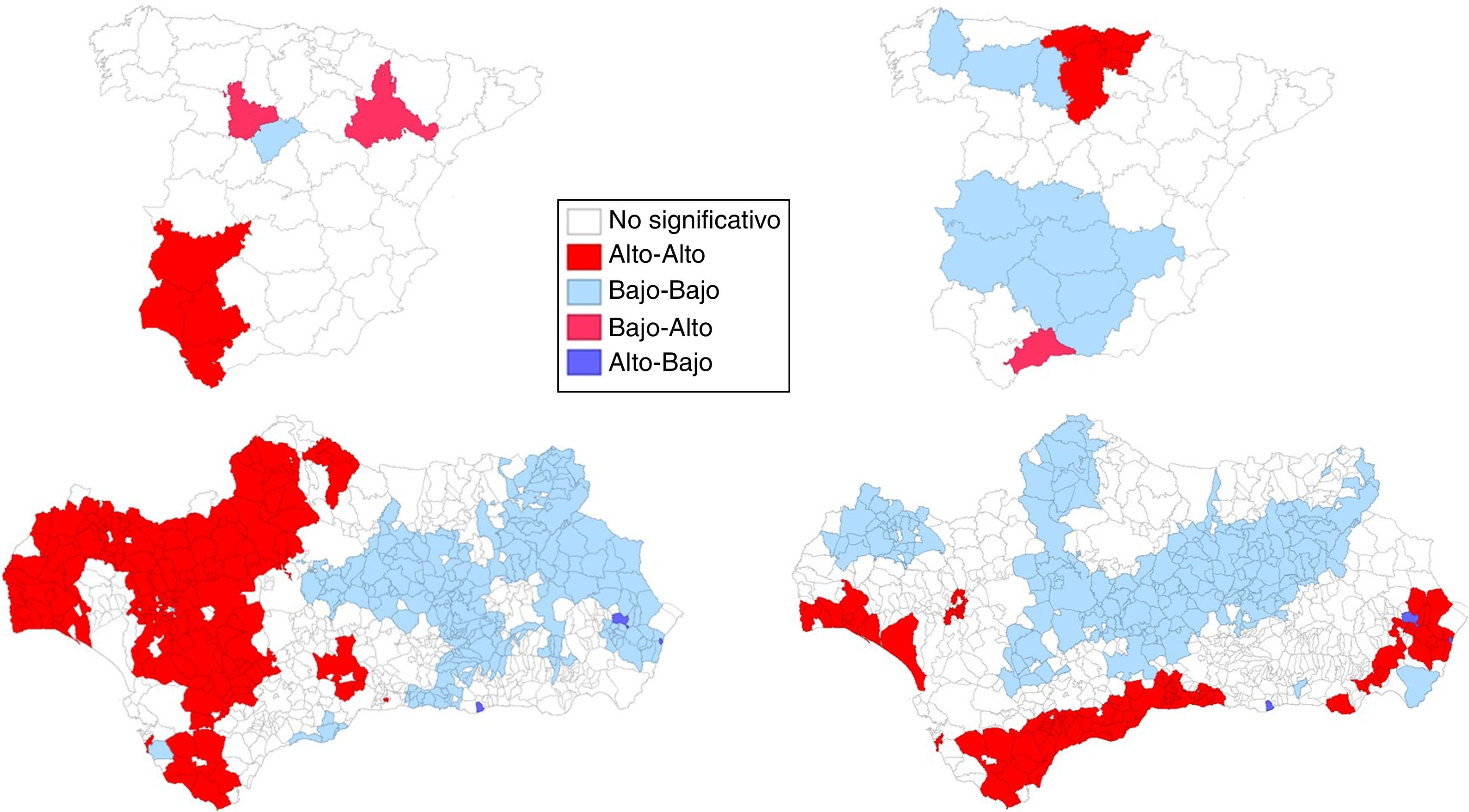
El análisis espacial se realizó mediante el software GeoDa18. Calculamos el índice global de Moran, una estadística inferencial que estima la autocorrelación espacial que oscila entre −1 y +1. Los valores más positivos o negativos corresponden a una mayor agrupación espacial o dispersión competitiva, respectivamente. Para el estudio local de estas agrupaciones se aplicó el Índice Local de Autocorrelación Espacial (LISA)19 que indica la presencia de dependencia espacial en algunas áreas e identifica 4 tipos de agrupaciones espaciales en relación con las áreas vecinas:
- ∘
alto-alto: áreas con una tasa alta rodeadas de otras áreas con tasas altas,
- ∘
bajo-bajo: áreas con una tasa baja rodeadas de otras áreas con tasas bajas,
- ∘
bajo-alto: áreas con una tasa baja rodeadas de zonas con tasas altas y
- ∘
alto-bajo: áreas con una tasa alta rodeadas de zonas con tasas bajas
Durante el periodo de estudio (2013-2017) fallecieron en España 108.892 personas por CP de los que 17.319 residían en Andalucía.
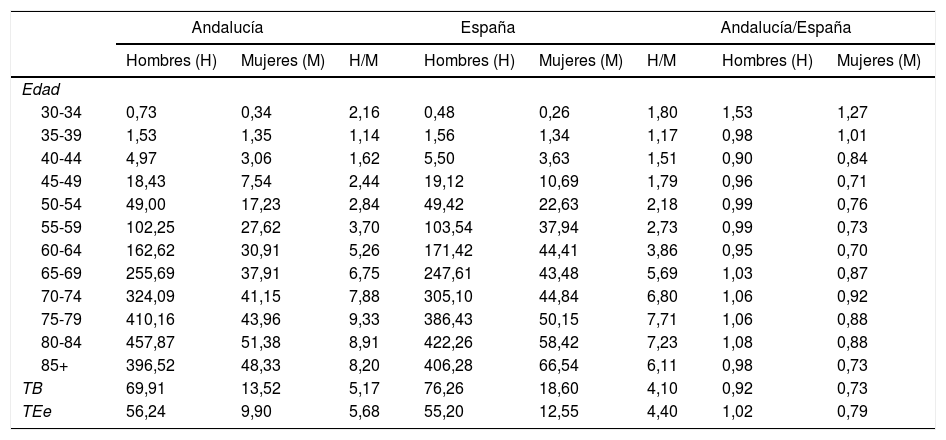
En la tabla 1 se muestran las tasas de mortalidad por CP por 100.000 personas-año (brutas, estandarizadas y específicas por grupos de edad), en hombres y mujeres en Andalucía y España (2013-2017), así como la razón de tasas hombre/mujer y Andalucía/España. En los hombres de Andalucía las tasas son ligeramente superiores a las de España en los grupos de edad entre 65-84 años y en el grupo de 30-34 años. En las mujeres andaluzas las tasas se muestran por debajo de las de España en todos los grupos de edad por encima de los 40 años. Las tasas brutas de mortalidad por CP en Andalucía son inferiores, tanto en hombres (69,9 por 100.000 personas-año) como en mujeres (13,5 por 100.000 personas-año), a las de España (76,3 y 18,6 por 100.000 personas-año en hombres y mujeres respectivamente). Al ajustar por edad se observa que las TEe en hombres son ligeramente superiores en Andalucía (56,2 vs. 55,2 por 100.000) mientras que en las mujeres siguen siendo inferiores (9,9 vs. 12,5 por 100.000). La razón de tasas hombre/mujer en Andalucía es superior a la observada a nivel nacional tanto a nivel de grupos de edad como en las tasas brutas (5,2 vs. 4,1) y estandarizadas (5,7 vs. 4,4).
Tasas de mortalidad por cáncer de pulmón por grupos de edad, tasas brutas y estandarizadas según sexo. Andalucía y España (2013-2017)
| Andalucía | España | Andalucía/España | ||||||
|---|---|---|---|---|---|---|---|---|
| Hombres (H) | Mujeres (M) | H/M | Hombres (H) | Mujeres (M) | H/M | Hombres (H) | Mujeres (M) | |
| Edad | ||||||||
| 30-34 | 0,73 | 0,34 | 2,16 | 0,48 | 0,26 | 1,80 | 1,53 | 1,27 |
| 35-39 | 1,53 | 1,35 | 1,14 | 1,56 | 1,34 | 1,17 | 0,98 | 1,01 |
| 40-44 | 4,97 | 3,06 | 1,62 | 5,50 | 3,63 | 1,51 | 0,90 | 0,84 |
| 45-49 | 18,43 | 7,54 | 2,44 | 19,12 | 10,69 | 1,79 | 0,96 | 0,71 |
| 50-54 | 49,00 | 17,23 | 2,84 | 49,42 | 22,63 | 2,18 | 0,99 | 0,76 |
| 55-59 | 102,25 | 27,62 | 3,70 | 103,54 | 37,94 | 2,73 | 0,99 | 0,73 |
| 60-64 | 162,62 | 30,91 | 5,26 | 171,42 | 44,41 | 3,86 | 0,95 | 0,70 |
| 65-69 | 255,69 | 37,91 | 6,75 | 247,61 | 43,48 | 5,69 | 1,03 | 0,87 |
| 70-74 | 324,09 | 41,15 | 7,88 | 305,10 | 44,84 | 6,80 | 1,06 | 0,92 |
| 75-79 | 410,16 | 43,96 | 9,33 | 386,43 | 50,15 | 7,71 | 1,06 | 0,88 |
| 80-84 | 457,87 | 51,38 | 8,91 | 422,26 | 58,42 | 7,23 | 1,08 | 0,88 |
| 85+ | 396,52 | 48,33 | 8,20 | 406,28 | 66,54 | 6,11 | 0,98 | 0,73 |
| TB | 69,91 | 13,52 | 5,17 | 76,26 | 18,60 | 4,10 | 0,92 | 0,73 |
| TEe | 56,24 | 9,90 | 5,68 | 55,20 | 12,55 | 4,40 | 1,02 | 0,79 |
TB: tasas brutas; TEe: estandarizadas.
En las figuras 1 y 2 se muestran las distribuciones de los RRs y PP de tener un riesgo relativo mayor que 1 en la mortalidad por CP a nivel provincial (España) y municipal (Andalucía) en hombres y mujeres respectivamente durante el periodo 2013-2017.
A nivel nacional, en los hombres, 17 provincias tienen un RRs superior a 1 de las que 15 presentan una PP>0,95, entre ellas Huelva, Sevilla, Cádiz y algunas provincias del norte peninsular (Asturias y Cantabria). En las mujeres son 10 las que presentan un RRs>1 y PP>0,95: 6 situadas en el norte peninsular (Pontevedra, Asturias, Cantabria, Guipúzcoa, Vizcaya y Navarra), Valladolid, Madrid, Valencia y Alicante.
En Andalucía, en los hombres, 332 municipios muestran un RRs>1 de los que 39 muestran una PP>0,95, la mayoría de los cuales se encuentran en las provincias de Huelva, Cádiz y Sevilla y que incluye 5 capitales de provincia: Huelva, Sevilla, Cádiz, Málaga y Almería. En las mujeres solo 22 municipios muestran un RRs>1 aunque solo 5 (uno en Cádiz y 4 en Málaga) muestran una PP≥0,80 y ninguno una PP>0,95.
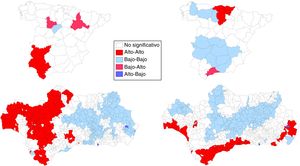
Los mapas de significación de los indicadores locales de asociación espacial (LISA) para los riesgos de mortalidad por CP se muestran en la figura 3. La asociación espacial negativa significativa se muestra en azul (gris claro en versión impresa) mientras que la asociación positiva significativa está en rojo (gris oscuro en versión impresa). Las áreas con valores LISA no significativos están en blanco (sin sombreado de color). En el suroeste peninsular, en los hombres, se observa una agrupación (alto-alto) de 4 provincias (Badajoz, Huelva, Sevilla y Cádiz). Valladolid y Zaragoza surgen como provincias de alto riesgo rodeadas de provincias de bajo riesgo. En las mujeres, se observa una agrupación de 5 provincias (alto-alto) en el norte peninsular (las 3 provincias vascas, Cantabria y Burgos) y la provincia de Málaga surge como una provincia de riesgo alto rodeado de provincias de bajo riesgo. En Andalucía, los mapas revelaron 2 patrones diferenciados según sexo, en los hombres se observa un patrón occidental (alto-alto)/oriental (bajo-bajo) (177/227 municipios) mientras que en las mujeres se observan agrupaciones alto-alto de predominio en los municipios próximos a la costa y el área metropolitana de Sevilla.
DiscusiónEste estudio muestra marcadas diferencias en la distribución de la mortalidad por CP (2013-2017) tanto en España, a nivel provincial, como en Andalucía a nivel municipal, y revela similitudes y diferencias en los patrones geográficos para hombres y mujeres.
Nuestros resultados confirman la existencia de algunos patrones de riesgo geográfico resaltados en estudios previos10,11, y muestran la existencia de diferencias geográficas importantes en los factores que influyen sobre la mortalidad por CP y que representan un amplio espectro de factores: edad, sexo, antecedentes familiares y personales, exposición a factores de riesgo, tipo histológico, lugar de residencia20, y el acceso a intervenciones preventivas, diagnósticas y terapéuticas21. Además, el hecho de que el análisis LISA muestre agrupaciones de municipios con tasas altas en la costa occidental de Huelva, sur de Cádiz y el área metropolitana de Sevilla en ambos sexos sugiere la implicación de ciertos factores ambientales o socioculturales locales.
A pesar de las mejoras en el diagnóstico y tratamiento en las últimas décadas, el CP todavía tiene una de las tasas de supervivencia más bajas del mundo22. En España (2008-2013) la supervivencia neta a los 5 años fue del 12,7% en hombres y del 17,6% en mujeres23.
La supervivencia neta a un año fue del 35% en Granada frente al 26% en Huelva, y la supervivencia neta a 2 años fue del 21% y del 17% respectivamente24. Pese a las posibles diferencias geográficas en la supervivencia del CP25, dada su baja supervivencia, podemos pensar que los patrones geográficos observados en la mortalidad por CP reflejarían, en gran medida, la distribución de la incidencia del CP.
En Andalucía (2009-2014) vemos que en los hombres las tasas de incidencia de CP son mayores en las provincias de Sevilla (74,5) y Huelva (72,3) y más bajas en Almería y Jaén (con 43,6 y 51,9 respectivamente) y en las mujeres las provincias con tasas estandarizadas más elevadas son Málaga (12,79) y Huelva (11,68)26. Asimismo, un reciente trabajo muestra en los hombres de Huelva (2007-2011) una zona con riesgo más alto en la incidencia de CP en los municipios de la costa occidental y la zona limítrofe con Portugal27, similar a lo observado por nosotros.
La exposición al tabaco, tanto de forma activa como pasiva, representa entre el 80-95% de los CP28 por lo que podemos pensar que los patrones geográficos observados (figuras 1-3) reflejarían en gran medida el consumo de tabaco acumulado durante décadas anteriores29 (así, por ejemplo, el aumento de la mortalidad por CP en las mujeres andaluzas desde la década de los 90s se ha asociado a una mayor prevalencia de fumadoras en las cohortes nacidas desde 1940)30. Pese a ello, existen evidencias de que otros factores como exposiciones ambientales y ocupacionales, y la variación genética, contribuyen directamente al riesgo de CP, y que algunos de estos factores pueden modificar el efecto del tabaco sobre sus resultados en salud31.
La identificación de Málaga como provincia alto-bajo en el análisis LISA podría reflejar, en parte, el fuerte incremento (5,2% anual)7 observado en la mortalidad por CP en las mujeres (35-64 años) de Málaga, una de las provincias donde antes se comienza a fumar32.
El nivel socioeconómico se considera un marcador de otros factores que pueden contribuir a las disparidades del CP. Así, el riesgo de CP aumenta con la disminución del nivel socioeconómico y la prevalencia de tabaquismo es mayor entre las personas de clase social más desfavorecida33,34. En Andalucía (2015-2016) los fumadores diarios pertenecían a la clase social más desfavorecida (33,3%), frente al 18,3% en las clases sociales superiores que mostraban además el porcentaje mayor de personas que intentó dejar de fumar32.
Nosotros no hemos investigado los determinantes de las diferencias geográficas identificadas en la mortalidad por CP. Por lo tanto, se necesita más investigación para comprender mejor las variaciones regionales en los factores que conducen a las muertes por CP en nuestro contexto.
Nuestro estudio tiene ciertas fortalezas y limitaciones. Debido a la escasa disponibilidad de datos sobre morbilidad a nivel municipal en Andalucía, hemos tenido que usar los datos de mortalidad ya que son la única fuente de datos disponible que satisface los criterios de continuidad y globalidad35 a nivel municipal y provincial. Una posible limitación de los estudios basados en certificados de defunción es que dependen de la calidad de estos. Afortunadamente, en nuestro país la calidad de los certificados es aceptable36 y, en Andalucía, la posible variabilidad en la certificación de la causa de muerte entre áreas se vería atenuada por el papel de control de calidad efectuado por el Registro de Mortalidad de Andalucía. Pese a ello, los datos de mortalidad disponibles no permiten estudiar la distribución de los principales tipos histológicos en Andalucía.
En Granada (1985-2012) las tasas de incidencia por CP en hombres, tras un periodo (1985-1994) de incremento (2,5% anual), comenzaron a disminuir (−1,4% anual) esencialmente en el grupo de edad de 65-74 años y por la mayor incidencia de carcinomas de células escamosas. En las mujeres, sin embargo, se observó un incremento significativo durante todo el periodo (4,2% anual) debido fundamentalmente al grupo de 55-64 años y la incidencia de adenocarcinomas37.
A pesar de su popularidad, los estudios ecológicos presentan algunas limitaciones que deben ser tenidas en cuenta para interpretar correctamente los resultados. Por un lado, las técnicas estadísticas utilizadas permiten describir la distribución geográfica de la mortalidad, pero no explicar las diferencias observadas entre áreas. Al tratarse de datos agregados, el nivel de exposición a cualquier factor de riesgo de las personas fallecidas y no fallecidas es desconocido. Además, dado que las muertes en España se registran de acuerdo con la última dirección conocida donde vivía la persona sin especificar el tiempo que la persona había vivido allí, no es posible conocer si los individuos que residen actualmente en un municipio han vivido en él la mayor parte de la vida expuestos a factores de riesgo del entorno, por lo que toda hipótesis que sugiera una relación entre el exceso de mortalidad observado en algunas áreas y las desigualdades sociales, uso de servicios de salud o exposiciones medioambientales de los individuos podría incurrir en la conocida falacia ecológica38. Además, en los estudios epidemiológicos en áreas pequeñas es común encontrar un sesgo de información relacionado con migraciones no registradas ya que algunas de las muertes registradas en los municipios fueron por individuos que no se registraron en el censo local. Además, la inclusión de personas institucionalizadas en los datos de mortalidad afecta la variación en la mortalidad de áreas pequeñas39.
Nuestros modelos permiten controlar la variabilidad de las tasas que muestran inestabilidad al ser calculada para áreas muy pequeñas. Los mapas de los RRs mediante el método propuesto tienden a eliminar parte de esta variabilidad aleatoria. Pese a ello, este método tiene la limitación de que en zonas donde se concentra el riesgo podría considerarse que el exceso es debido a valores elevados en los municipios colindantes y viceversa. Esto podría dar lugar a falsos positivos, aumentando el riesgo de algunas zonas o falsos negativos atenuando el riesgo de otras40.
Pese a dichas limitaciones, este tipo de estudio sirve para identificar áreas de mayor riesgo y generar hipótesis basadas en el conocimiento actual sobre la epidemiología del CP y sus factores de riesgo.
ConclusionesNuestros hallazgos refuerzan la importancia de este tipo de análisis en el abordaje de los problemas de salud pública al permitir identificar áreas donde dirigir programas o estrategias para disminuir o eliminar el impacto de las enfermedades analizadas41. Asimismo, sería necesario continuar con iniciativas como la del Registro de Tumores Torácicos para mejorar el conocimiento epidemiológico del CP en España, más allá de la información sobre mortalidad aportada por el Instituto Nacional de Estadística, a través de la recogida de datos relacionados con factores de riesgo, presentación clínica o pruebas moleculares42.
FinanciaciónEste trabajo no se ha presentado en ninguna reunión o congreso y no ha recibido financiación (ni pública ni privada).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.