Las bronquiectasias son una entidad heterogénea, compleja y con múltiples etiologías, caracterizada por un estado inflamatorio persistente, predominantemente de tipo neutrofílico. Diversos estudios han abordado la identificación de biomarcadores de utilidad para el manejo de pacientes con bronquiectasias, algunos de los cuales han demostrado resultados prometedores. Biomarcadores en esputo como la elastasa neutrofílica, las metaloproteinasas de la matriz, las proteínas del moco, la carga bacteriana de la vía aérea, los péptidos antimicrobianos y la proteína de la zona del embarazo, han probado correlacionarse con la gravedad de la enfermedad, la función pulmonar, extensión radiológica, e incluso con la presencia de Pseudomonas aeruginosa en la vía aérea. Es por lo que potencialmente pueden ser de gran utilidad para el manejo de estos pacientes.
Los biomarcadores sistémicos, por su parte, son más heterogéneos; aunque algunas proteínas como el fibrinógeno o el factor de necrosis tumoral alfa en plasma también han demostrado su potencial utilidad al asociarse con la gravedad de las bronquiectasias.
A pesar de los resultados prometedores, aún son necesarios más estudios para establecer la función de estos biomarcadores en el manejo clínico de los pacientes con bronquiectasias.
Bronchiectasis is a heterogeneous, complex disease with multiple etiologies. It is characterized by a persistent, predominantly neutrophilic, inflammatory state. Several studies have attempted to identify useful biomarkers for the management of patients with bronchiectasis, some of which have shown promising results. Biomarkers in sputum, including neutrophilic elastase, matrix metalloproteinases, mucus proteins, bacterial load in the airway, antimicrobial peptides, and pregnancy zone protein have been shown to correlate with disease severity, lung function, radiologic extension, and even with the presence of Pseudomonas aeruginosa in the airway. As such, they are potentially of great use in the management of these patients.
Systemic biomarkers, on the other hand, are more heterogeneous, although some proteins such as fibrinogen or tumor necrosis factor alpha in plasma have also shown their potential utility by correlating with the severity of bronchiectasis.
Despite promising results, further studies are still needed to establish the role these biomarkers can play in the clinical management of patients with bronchiectasis.
Las bronquiectasias son una entidad heterogénea con mecanismos fisiopatológicos diferentes y complejos que aún no se conocen por completo1. Una de las hipótesis más conocidas sobre fisiopatogenia de las bronquiectasias, es la del círculo vicioso de Cole2. En ella se plantea que la alteración del aclaramiento mucociliar conlleva un aumento en las secreciones bronquiales, lo cual a su vez disminuye su capacidad de barrera inmunológica, facilitando así el desarrollo de una infección crónica. Esta imposibilidad para eliminar microorganismos patógenos produce una respuesta inflamatoria sostenida que resulta en lesión del epitelio bronquial e induce una remodelación patológica, conduciendo así a la aparición de bronquiectasias, perpetuando el ciclo. No obstante, se ha observado que tratar de romper este círculo vicioso en un único punto no evita eficazmente su perpetuidad. Es por lo que se plantea la hipótesis del vórtice vicioso, donde todos los componentes patogénicos están conectados entre sí, haciendo necesario tratar varios aspectos de la enfermedad y no solo la infección3. Para ello es fundamental realizar un enfoque personalizado en el manejo de cada paciente.
En esta línea, se propuso el concepto de «rasgos tratables» de las enfermedades respiratorias crónicas4, posteriormente adaptado para las bronquiectasias5. Este concepto propone un manejo basado en la identificación de fenotipos clínicos y endotipos y guiado por biomarcadores, en lugar de usar las etiquetas diagnósticas imprecisas que existen actualmente, con la intención de realizar un tratamiento personalizado que dé lugar a mejores resultados. Por su parte, Martínez-García et al.1,6 proponen abordar la complejidad de las bronquiectasias mediante el estudio de dimensiones clave de la patología, como lo son: la gravedad, mediante sistemas de puntuación validados; el impacto sobre el paciente, a través de cuestionarios de síntomas y calidad de vida; y la actividad biológica de la enfermedad. En ambas propuestas queda en evidencia la necesidad de identificar endotipos de la enfermedad y de estudiar biomarcadores que permitan individualizar el manejo de estos pacientes.
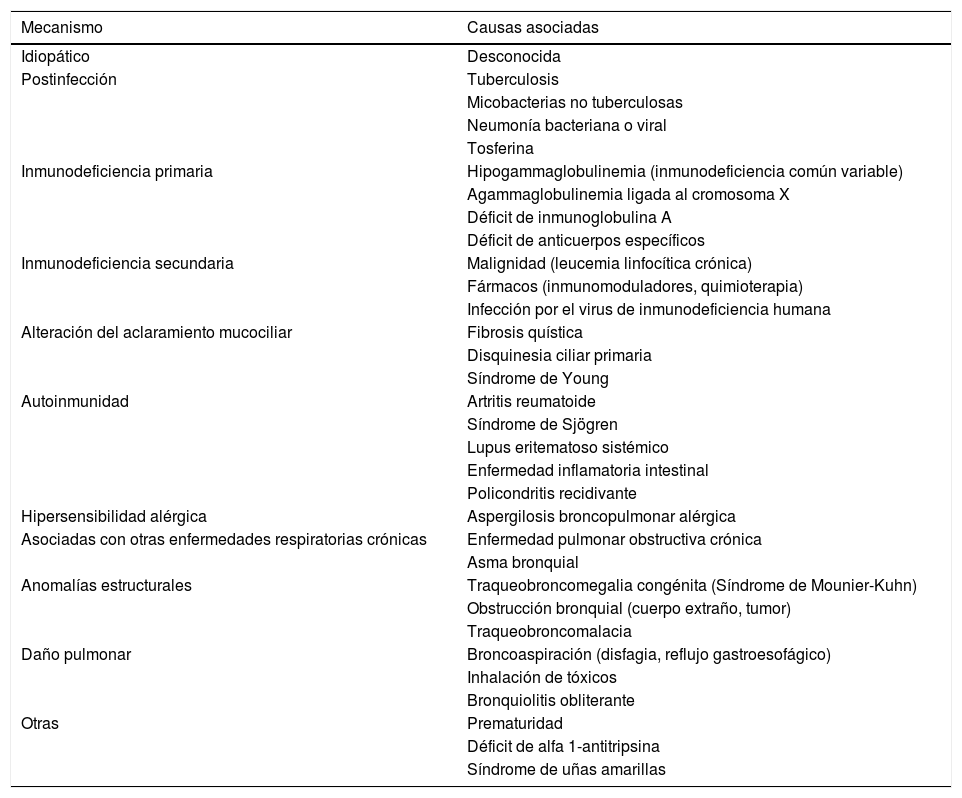
EndotiposExisten múltiples entidades relacionadas con la aparición de bronquiectasias7. Las normativas actuales para el diagnóstico y tratamiento de las bronquiectasias recomiendan realizar un estudio etiológico inicial y de acuerdo con las características clínicas del paciente, ya que la identificación de la causa podría implicar un manejo específico del caso8-10. Con base en los mecanismos etiológicos subyacentes pueden identificarse posibles endotipos como: inmunodeficiencia, alteración del aclaramiento mucociliar, hipersensibilidad a hongos y autoinmunidad; siendo algunos de ellos potencialmente abordables desde un punto de vista terapéutico11. En la tabla 1 se resumen los principales endotipos de pacientes con bronquiectasias según el mecanismo fisiopatológico.
Principales endotipos de bronquiectasias según el mecanismo fisiopatológico
| Mecanismo | Causas asociadas |
|---|---|
| Idiopático | Desconocida |
| Postinfección | Tuberculosis |
| Micobacterias no tuberculosas | |
| Neumonía bacteriana o viral | |
| Tosferina | |
| Inmunodeficiencia primaria | Hipogammaglobulinemia (inmunodeficiencia común variable) |
| Agammaglobulinemia ligada al cromosoma X | |
| Déficit de inmunoglobulina A | |
| Déficit de anticuerpos específicos | |
| Inmunodeficiencia secundaria | Malignidad (leucemia linfocítica crónica) |
| Fármacos (inmunomoduladores, quimioterapia) | |
| Infección por el virus de inmunodeficiencia humana | |
| Alteración del aclaramiento mucociliar | Fibrosis quística |
| Disquinesia ciliar primaria | |
| Síndrome de Young | |
| Autoinmunidad | Artritis reumatoide |
| Síndrome de Sjögren | |
| Lupus eritematoso sistémico | |
| Enfermedad inflamatoria intestinal | |
| Policondritis recidivante | |
| Hipersensibilidad alérgica | Aspergilosis broncopulmonar alérgica |
| Asociadas con otras enfermedades respiratorias crónicas | Enfermedad pulmonar obstructiva crónica |
| Asma bronquial | |
| Anomalías estructurales | Traqueobroncomegalia congénita (Síndrome de Mounier-Kuhn) |
| Obstrucción bronquial (cuerpo extraño, tumor) | |
| Traqueobroncomalacia | |
| Daño pulmonar | Broncoaspiración (disfagia, reflujo gastroesofágico) |
| Inhalación de tóxicos | |
| Bronquiolitis obliterante | |
| Otras | Prematuridad |
| Déficit de alfa 1-antitripsina | |
| Síndrome de uñas amarillas |
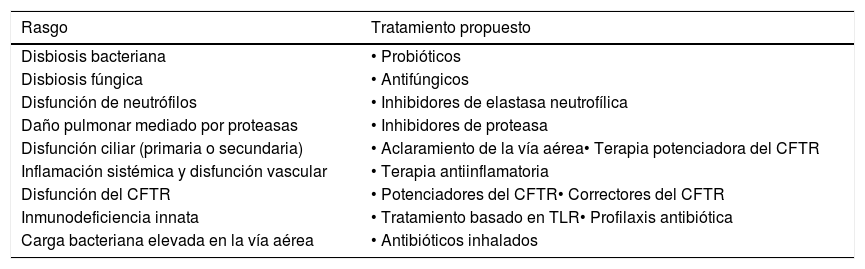
Por otra parte, Chalmers et al.11 proponen una clasificación de rasgos endofenotípicos tratables mediante la identificación de aspectos de la biología de las bronquiectasias susceptibles de intervención terapéutica utilizando fármacos existentes. Un ejemplo son pacientes con concentraciones elevadas de elastasa neutrofílica en el esputo, quienes presentan un declive rápido de la función pulmonar, peores resultados clínicos y podrían ser tributarios de tratamiento mediante inhibición de la elastasa12; pacientes con carga bacteriana elevada en la vía aérea, con posible mejor respuesta al tratamiento antibiótico inhalado13; o sujetos con elevación de eosinófilos en sangre periférica, que pueden ser más propensos a responder a los corticosteroides inhalados14,15. No obstante, la utilidad de los endotipos en el manejo de pacientes con bronquiectasias aún necesita ser validada mediante estudios prospectivos. Los rasgos endofenotípicos tratables propuestos, se encuentran en la tabla 2.
Principales rasgos endofenotípicos tratables propuestos
| Rasgo | Tratamiento propuesto |
|---|---|
| Disbiosis bacteriana | • Probióticos |
| Disbiosis fúngica | • Antifúngicos |
| Disfunción de neutrófilos | • Inhibidores de elastasa neutrofílica |
| Daño pulmonar mediado por proteasas | • Inhibidores de proteasa |
| Disfunción ciliar (primaria o secundaria) | • Aclaramiento de la vía aérea• Terapia potenciadora del CFTR |
| Inflamación sistémica y disfunción vascular | • Terapia antiinflamatoria |
| Disfunción del CFTR | • Potenciadores del CFTR• Correctores del CFTR |
| Inmunodeficiencia innata | • Tratamiento basado en TLR• Profilaxis antibiótica |
| Carga bacteriana elevada en la vía aérea | • Antibióticos inhalados |
CFTR: Regulador de conductibilidad transmembrana de fibrosis quística; TLR: Receptores de tipo Toll.
Uno de los elementos clave de la patogenia de las bronquiectasias es la inflamación neutrofílica crónica en las vías aéreas16. La respuesta inflamatoria neutrofílica se lleva a cabo a través de la liberación de mediadores inflamatorios como la elastasa neutrofílica (EN), la catepsina G y la proteinasa 3 de los gránulos citoplasmáticos y mediante el sistema de especies reactivas del oxígeno. La EN es una proteasa que tiene actividad proinflamatoria, disminuye la frecuencia del latido ciliar y estimula la secreción de moco17,18, siendo su función principalmente antimicrobiana; sin embargo, su desregulación puede ser nociva para el tejido circundante19-21.
Se han encontrado elevadas concentraciones de esta enzima en el esputo de pacientes con bronquiectasias en fase estable, en comparación con sujetos sanos22,23, por lo que se asume, que la EN tiene un papel importante en el desarrollo y progresión de la inflamación presente en esta patología24. Es posible que el mecanismo por el que se perpetúa esta inflamación es debido a que la sobreexpresión de EN sobrepasa la actividad de sus inhibidores y antiproteasas como la alfa-1 antitripsina18,25.
Si bien no existe un biomarcador ampliamente aceptado para medir la inflamación y gravedad de las bronquiectasias, múltiples estudios han demostrado la gran utilidad que tiene la EN. Las concentraciones de EN se han relacionado con la purulencia del esputo, lo cual puede actuar como un marcador de inflamación y gravedad en las bronquiectasias26,27. Se ha demostrado también que la actividad de la EN está relacionada con el volumen del esputo expectorado, la extensión radiológica de las bronquiectasias y el volumen espiratorio forzado en un segundo (VEF1)28. Además, en un estudio por Chalmers et al.12 que incluyó prospectivamente a 433 pacientes con bronquiectasias seguidos durante tres años, se observó que la actividad de la EN se asoció con la puntuación de gravedad del Bronchiectasis Severity Index (BSI) y la gravedad de la disnea, la extensión radiológica y el VEF1. Tras el seguimiento de los pacientes incluidos, se determinó que la EN se relacionaba también con una mayor frecuencia de exacerbaciones, con el declive del VEF1 y con la mortalidad12. Finalmente, se ha identificado un aumento en las concentraciones de EN durante las exacerbaciones, presentando buena respuesta al tratamiento antibiótico12,29, así como de forma persistente en pacientes con infección crónica por Pseudomonas aeruginosa30.
Es posible medir la EN mediante métodos cuantitativos como ELISA31, o cualitativos como la fluorimetría o la espectrofotometría32,33, para lo que están disponibles algunos kits comerciales. Recientemente, un estudio realizado por Shoemark34 et al. evaluó la utilidad de un simple ensayo semicuantitativo de EN (neutrophil elastase airway test stick - NEATstik®) para identificar pacientes con bronquiectasias con alto riesgo de infección bronquial y de futuras exacerbaciones en los siguientes 12 meses, en tan solo pocos minutos. Los resultados de esta prueba presentaron una buena correlación con aquellos obtenidos mediante la técnica de ELISA, por lo que podría ser de gran utilidad en la práctica clínica para mejorar la estratificación del riesgo o la toma de decisiones terapéuticas.
A pesar de estos prometedores resultados, aún se necesitan ensayos clínicos que permitan validar el punto de corte de la actividad de la EN de cara a optimizar el manejo de los pacientes con bronquiectasias.
Metaloproteinasas de la matrizLas metaloproteinasas de la matriz (MMP) son endopeptidasas capaces de degradar el tejido conectivo35,36. La MMP-8 (colagenasa-2) y la MMP-9 (gelatinasa B) son producidas por neutrófilos, aunque pueden producirse también, entre otras, por las células epiteliales de la vía aérea (MMP-8) y por los macrófagos35-37. Estudios previos han detectado concentraciones elevadas de MMP-8 y MMP-9 (y en menor medida de las MMP-1, -3 y -7) en las vías respiratorias de pacientes con bronquiectasias, lo cual ha sido asociado con el proceso de inflamación y destrucción epitelial característico de esta enfermedad38-40.
La utilidad de estas proteínas como biomarcadores fue evaluada en un estudio realizado por Guan et al.41 que incluyó 102 pacientes con bronquiectasias y 22 controles sanos. Observaron que los enfermos tenían concentraciones significativamente más elevadas de MMP-8 y MMP-9 en esputo respecto a los sujetos sanos. Además, estas concentraciones elevadas de MMP-8, MMP-9 y la relación MMP-9/inhibidor tisular de la metaloproteinasa-1 (TIMP-1) se asociaron con una mayor extensión radiológica y carga bacteriana en esputo, peor VEF1, mayor gravedad de las bronquiectasias, aumento en la purulencia del esputo y con la presencia de P. aeruginosa en las muestras respiratorias41. Encontraron también que la concentración basal en esputo de MMP-9 puede ser un buen predictor del tiempo hasta la primera exacerbación y de la frecuencia de exacerbaciones, presentando además un aumento significativo en sus concentraciones (al igual que MMP-8) durante las mismas41.
Gran parte de los resultados mencionados son coherentes con los hallazgos de otros estudios, donde las concentraciones elevadas de MMP-8 y 9, así como las ratios MMP-8/TIMP-1 y MMP-9/TIMP-1 se correlacionaron inversamente con el VEF1 y podían variar según las composiciones de la microbiota respiratoria27,40. En esta línea, el estudio de Taylor et al.40 encontraron que las concentraciones de MMP-8, MMP-9 y TIMP-2 fueron significativamente más bajas en pacientes con infecciones dominadas por especies bacterianas distintas de P. aeruginosa o H. influenzae. Además, los mencionados estudios también observaron correlaciones positivas entre MMP-8 y MMP-9 en esputo y otros marcadores inflamatorios como la interleucina (IL)-6, IL-8, IL-1β y el factor de necrosis tumoral alfa (TNF-α)40,41. Esto sugiere que las concentraciones de MMP pueden estar influenciados por la presencia de infección o inflamación bronquial.
MucinasEl moco de la vía aérea es una de las principales barreras del sistema inmunológico, y se compone principalmente de agua, sal y proteínas. El balance adecuado de estos componentes es esencial para el cumplimiento de su función protectora42. Las mucinas son glucoproteínas que forman el principal componente macromolecular del moco, siendo la MUC5AC y MUC5AB las más frecuentemente aisladas en la vía aérea43,44. Múltiples estudios han confirmado la función fundamental de las mucinas en la defensa de la vía aérea45, y su desregulación se ha asociado con enfermedades inflamatorias crónicas como la enfermedad pulmonar obstructiva crónica (EPOC) y la fibrosis quística46,47. Sin embargo, el papel de las mucinas en las bronquiectasias no está aún del todo claro.
Recientemente, Ramsey et al.48 observaron que la concentración de mucinas era significativamente mayor en pacientes con bronquiectasias que en sujetos sanos. Específicamente, en el grupo de enfermos las concentraciones de MUC5B eran seis veces mayores, y las de MUC5AC eran 17 veces mayores que en los controles sanos, seguidas de la MUC2 en mucha menor cantidad. El esputo de estos pacientes presentó también una mayor presión osmótica, mayor viscosidad y elasticidad, explicado principalmente por la gran concentración de MUC5B. Además, al estudiar biopsias transbronquiales realizadas a ambos grupos, la proporción de células epiteliales de superficie que expresan MUC5AC fue significativamente mayor en los individuos con bronquiectasias48.
Al evaluar las variables clínicas, objetivaron una correlación inversa entre la concentración del moco y el VEF1, y una correlación positiva con la extensión radiológica de las bronquiectasias. Por otra parte, en sujetos con bronquiectasias, la actividad de la IL-8 e IL-1β y la de la MMP y la EN se asoció con el porcentaje de sólidos en el esputo, la concentración total de mucinas, el ratio MUC5AC/MUC5B, el volumen y viscosidad del esputo, el VEF1 y la extensión radiológica de las bronquiectasias48. Todos estos cambios contribuyen a lentificar el transporte del moco y con ello a la patogenia de la enfermedad.
En esta línea, en un estudio piloto previo que incluyó a 50 pacientes con bronquiectasias clínicamente estables, se observó que las concentraciones de MUC2 se correlacionaron positivamente con la presencia de P. aeruginosa en el esputo, la gravedad de las bronquiectasias y la actividad de la EN49. De esta forma, la concentración de las mucinas en el esputo y la hiperconcentración de las secreciones respiratorias, pueden ser una diana terapéutica de utilidad en el manejo de pacientes con bronquiectasias.
Péptidos antimicrobianosLos péptidos antimicrobianos (PAM) son un grupo variado de moléculas presentes en múltiples seres vivos y que forman parte de la inmunidad innata contra las infecciones50. Algunos PAM provienen de la activación de neutrófilos, macrófagos y epitelio bronquial y tienen función proinflamatoria, como la lisozima, lactoferrina y la catelicidina LL-37; mientras que otros, como el inhibidor de proteasas secretado por leucocitos (SLPI), tienen acción antiinflamatoria51,52. La participación de los PAM en la patogenia de las bronquiectasias no está claramente demostrada, pero es posible que la presencia crónica de bacterias con múltiples mecanismos de adaptación como P. aeruginosa lleve a una respuesta desregulada de estos péptidos, perpetuando así el proceso inflamatorio53.
Un trabajo reciente por Sibila et al.54 en 135 pacientes con bronquiectasias en situación de estabilidad clínica, demostró que existe poca correlación entre las concentraciones de PAM en esputo y suero, con concentraciones más elevadas en esputo. Esto sugiere que la liberación de estos péptidos se produce localmente. Se observó, además, que concentraciones más elevadas de LL-37 y más bajas de SLPI en esputo se correlacionaban significativamente con la gravedad de las bronquiectasias. Específicamente, encontraron que existía una relación inversa entre las concentraciones locales de LL-37, lisozima y lactoferrina con el VEF1, mientras que sucedía lo contrario con las concentraciones de SLPI54. Por otra parte, se identificó una correlación significativa entre LL-37, lactoferrina y lisozima en esputo con la actividad de la EN. Asimismo, los pacientes infectados por P. aeruginosa presentaron concentraciones locales significativamente más elevadas de LL-37 y lactoferrina, y más bajas de SLPI54. Finalmente, tras un seguimiento de los pacientes a lo largo de 12 meses, observaron que aquellos con concentraciones elevadas en esputo de LL-37, disminuidas de SLPI, o ambas, tuvieron una mayor frecuencia de exacerbaciones y un menor tiempo hasta la primera exacerbación54. En vista de esto, los PAM como LL-37 y SLPI podrían ser potencialmente buenos biomarcadores de gravedad de las bronquiectasias y de identificación de pacientes exacerbadores frecuentes.
Proteína de la zona de embarazoLa proteína de la zona de embarazo (PZP) es una glucoproteína con actividad inmunosupresora y antiproteinasa, que se había estudiado únicamente en el suero de mujeres embarazadas55. Su papel en el embarazo es prevenir el rechazo al feto mediante la supresión de la inmunoreactividad mediada por linfocitos T y del reclutamiento, migración y proliferación de células T, así como de la producción de IL-256. En un estudio reciente de Finch et al.57 se observó que la PZP es liberada por los neutrófilos ante estímulos inflamatorios como las infecciones, y que los pacientes con bronquiectasias infectados por P. aeruginosa presentaban concentraciones significativas de esta proteína en esputo. Se incluyeron 124 pacientes con bronquiectasias e identificaron que las concentraciones de PZP en esputo se asociaban con una mayor gravedad de la enfermedad, a exacerbaciones frecuentes (≥ 3/año), peor calidad de vida, peores valores de VEF1 y mayor volumen de esputo diario57. De la misma forma, las concentraciones en esputo de la PZP se asociaron con la infección respiratoria crónica por Haemophilus influenzae y P. aeruginosa, y a mayores cargas bacterianas en la vía aérea57. El estudio de la PZP ha demostrado resultados favorables y con gran potencial para las patologías respiratorias que cursan con inflamación neutrofílica.
Carga bacterianaLa presencia de infección crónica y la carga bacteriana presente en la vía aérea son parte de los componentes clave de la patogenia de las bronquiectasias, al perpetuar la inflamación y por ende, también el daño tisular2,3,58. Diversos estudios han demostrado que la carga bacteriana en la vía aérea se correlaciona de forma directa con los marcadores de inflamación tanto local como sistémicamente, lo cual apoya la hipótesis mencionada con anterioridad59,60.
Un trabajo realizado por Sibila et al.13 demostró que los pacientes con una elevada carga bacteriana (≥ 107 ufc/g) presentaban peor calidad de vida y mayor puntuación en el BSI, además de mayores concentraciones de neutrófilos y actividad de la mieloperoxidasa en esputo. En este mismo estudio se observó que los pacientes con alta carga bacteriana presentaban una reducción importante al recibir tratamiento antibiótico sistémico por una exacerbación, pero volvían a presentar altas cargas bacterianas durante el seguimiento posterior. Esto llevó a los autores a reanalizar los ensayos clínicos de aztreonam nebulizado para pacientes con bronquiectasias, que presentaron resultados negativos para su objetivo principal61. El resultado principal de este nuevo análisis fue la identificación de un fenotipo de pacientes con buena respuesta a los antibióticos inhalados, al observar que presentar una carga bacteriana elevada se asociaba con una mejoría significativa en la calidad de vida, mayor reducción de carga bacteriana y aumento en la distancia caminada en el test de la marcha de seis minutos13. Estos resultados son consistentes con los obtenidos en otros ensayos clínicos de antibióticos inhalados en pacientes con bronquiectasias, donde los pacientes incluidos tenían una elevada carga bacteriana y presentaron una respuesta favorable en cuanto a la mejoría de la calidad de vida y reducción en la frecuencia de exacerbaciones62,63. De esta forma, es posible plantear que la carga bacteriana de la vía aérea de pacientes con bronquiectasias puede ser un buen biomarcador de gravedad de la enfermedad y de predicción de respuesta al tratamiento.
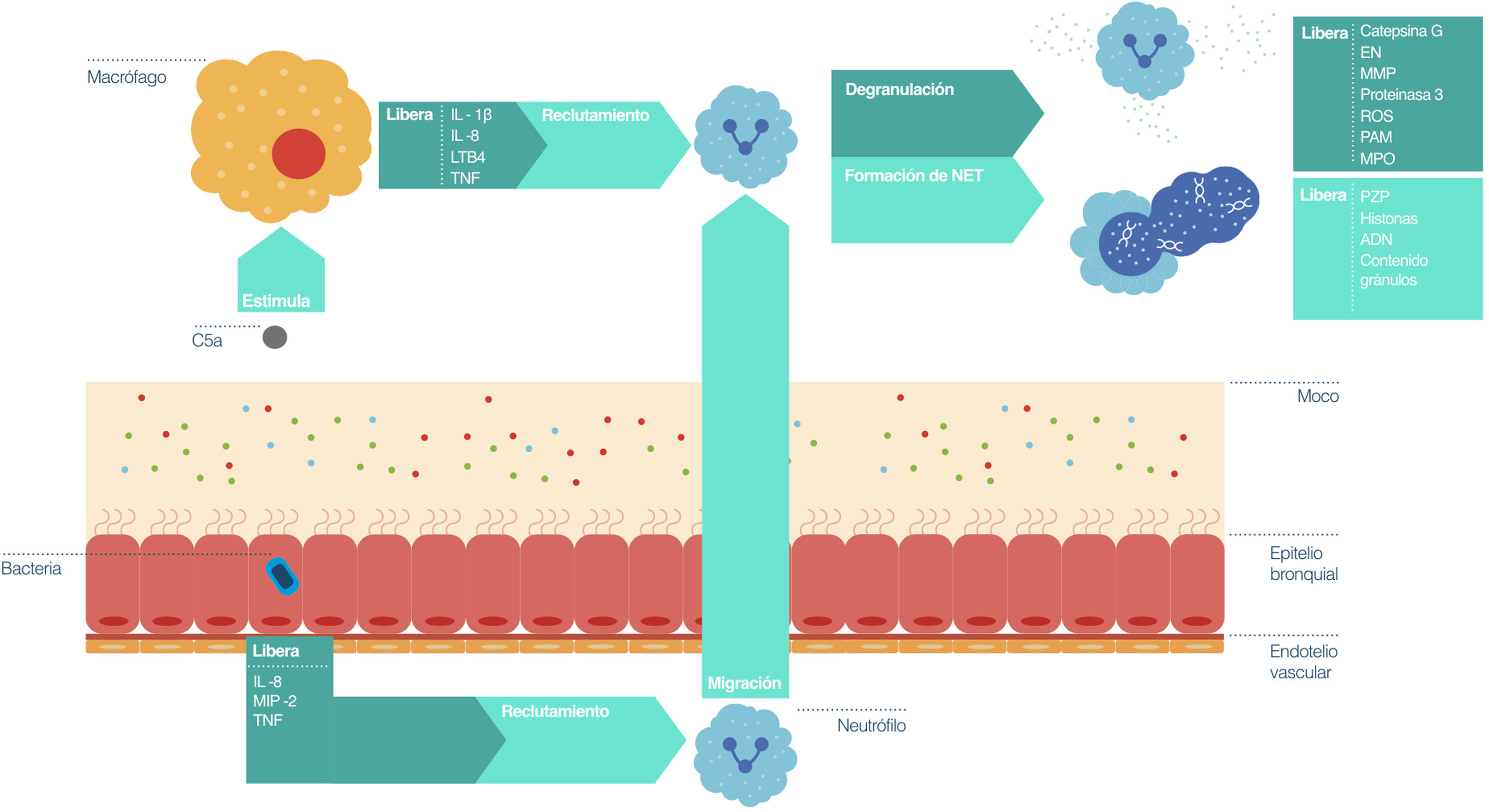
En la figura 1 se representa de forma simplificada el proceso de inflamación neutrofílica en pacientes con bronquiectasias, y el lugar de acción de los principales biomarcadores. En la tabla 3 se recogen las principales correlaciones encontradas en el estudio de los biomarcadores en el esputo de pacientes con bronquiectasias.
Proceso (simplificado) de inflamación neutrofílica en la vía aérea de pacientes con bronquiectasias.
Ante la presencia de una bacteria que no es eliminada por las barreras naturales (moco), el epitelio bronquial libera señales proinflamatorias para reclutar neutrófilos. Por su parte, la activación del complemento circulante estimula a los macrófagos, que a su vez promueven el reclutamiento y activación de los neutrófilos. Estos, una vez activados, pueden liberar el contenido de sus gránulos y formar trampas extracelulares de neutrófilos. La desregulación de este proceso impide la opsonización, y, por ende, la fagocitosis por parte de los neutrófilos, así como la eliminación de estas células por parte de los macrófagos. La eliminación bacteriana ineficaz, la infección e inflamación persistente, la hipersecreción y alteración del aclaramiento del moco, así como el daño epitelial de las vías aéreas, promueven el desarrollo de las bronquiectasias. IL: Interleucina; MIP-2: Proteína inflamatoria de macrófagos 2; TNF: Factor de necrosis tumoral; C5a: Componente del complemento 5 activado; LTB4: Leucotrieno B4; MUC: Mucina; EN: Elastasa neutrofílica; MMP: Metaloproteinasa de la matriz; ROS: Especies reactivas de oxígeno; PAM: Péptidos antimicrobianos; MPO: Mieloperoxidasa; NET: Trampa extracelular de neutrófilos; PZP: Proteína de la zona del embarazo; ADN: Ácido desoxirribonucleico.
Principales correlaciones encontradas en el estudio de los biomarcadores en el esputo de pacientes con bronquiectasias
| Biomarcador | Gravedad | VEF1 | Extensión radiológica | Exacerbaciones | Presencia de Pseudomonas aeruginosa | Mortalidad | Volumen/ purulencia del esputo | Respuesta al tratamiento |
|---|---|---|---|---|---|---|---|---|
| Elastasa neutrofílica | + | + | + | + | + | + | + | + |
| Metaloproteinasas de la matriz | + | + | + | + | + | + | ||
| Mucinas | + | + | + | + | + | |||
| Péptidos antimicrobianos | + | + | + | + | ||||
| Proteína de la zona de embarazo | + | + | + | + | + | + | ||
| Carga bacteriana de la vía aérea | + | + |
VEF1: Volumen espiratorio forzado en el primer segundo.
La respuesta inflamatoria presente en los pacientes con bronquiectasias tiene un claro predominio pulmonar, pero algunos estudios han encontrado concentraciones significativamente elevadas de marcadores inflamatorios sistémicos en situación de estabilidad clínica59,64. Algunos marcadores como el recuento total de glóbulos blancos, el recuento de neutrófilos y la velocidad de sedimentación globular (VSG) se han correlacionado con la extensión radiológica de la enfermedad y con la función pulmonar64. Martínez-García et al.65 observaron también que las concentraciones plasmáticas de TNF-α eran mayores en los pacientes con bronquiectasias que en los sujetos sanos. Estas concentraciones se correlacionaron a su vez con la VSG, la proteína C reactiva (PCR) y el porcentaje de neutrófilos periféricos. De la misma manera, se encontró que los pacientes con concentraciones plasmáticas de TNF-α mayores a 8,1 pg/dL presentaban mayor extensión radiológica de la enfermedad y un mayor porcentaje de colonización por P. aeruginosa65.
Por otra parte, otro estudio demostró que existe una marcada heterogeneidad en las concentraciones de marcadores inflamatorios sistémicos en los pacientes con bronquiectasias. Saleh et al.66 identificaron en dos cohortes de pacientes diferentes que las concentraciones de fibrinógeno se correlacionaron positivamente con una mayor gravedad de las bronquiectasias, peor función pulmonar y con la colonización bronquial por P. aeruginosa. Asimismo, se observó que los pacientes con inmunodeficiencias primarias presentaban respuestas exageradas de IL-17, en comparación con los pacientes con bronquiectasias debidas a otras etiologías66.
Finalmente, un reciente estudio del Registro Español de Bronquiectasias (RIBRON) ha demostrado que las concentraciones de PCR sérica de pacientes en fase de estabilidad clínica se relacionan con la presencia futura de agudizaciones graves, aunque no con agudizaciones leves o moderadas67. No obstante, estos biomarcadores son menos específicos que los estudiados localmente, por lo que su utilidad en la práctica clínica habitual aún no se ha definido con claridad.
Biomarcadores como posibles dianas terapéuticasEn los últimos años se han desarrollado diversas moléculas dirigidas a interrumpir el ciclo de inflamación e infección presente en pacientes con bronquiectasias. Una de las principales dianas terapéuticas ha sido la actividad de la EN. Dos moléculas inhibidoras de la EN, AZD966 y BAY 85-850, demostraron ser seguras y bien toleradas; sin embargo, no lograron reducir significativamente la densidad de neutrófilos en el esputo o el volumen de 24 horas68,69. No obstante, es posible que en el futuro una mejor estratificación de los pacientes según la actividad de la EN pueda ser de ayuda en la identificación de aquellos sujetos que puedan beneficiarse de esta terapia70.
En esta línea, un nuevo ensayo clínico fue llevado a cabo con la molécula INS1007, que inhibe la dipeptidil peptidasa 1 (DPP-1), también conocida como catepsina C, encargada de activar diversas serina proteasas producidas por los neutrófilos71. Los resultados de este estudio recientemente finalizado (NCT03218917/EudraCT 2017-002533-32) podrían potencialmente impactar en el manejo de los pacientes con esta enfermedad72.
Por último, en un estudio piloto realizado por De Soyza et al.73 con un antagonista del receptor de IL-8 (CXCR2), se observó una reducción significativa en el recuento absoluto de neutrófilos en el esputo de pacientes con bronquiectasias, aunque esto no se asoció con mejoras clínicas relevantes.
ConclusionesLa heterogeneidad de las bronquiectasias ha dificultado la identificación de biomarcadores específicos de la enfermedad. Hasta la fecha, se han estudiado tanto localmente (en pulmón) como sistémicamente (en suero), siendo los hallazgos mucho más contundentes en el primer caso, sobre todo en aquellos biomarcadores que se han estudiado en esputo. Entre ellos, la EN del esputo es uno de los marcadores con mayor potencial para predecir la gravedad, frecuencia de exacerbaciones y colonización bronquial por P. aeruginosa en pacientes con bronquiectasias. Otros trabajos han demostrado que, proteínas de defensa de la vía aérea como las mucinas y los péptidos antimicrobianos, las metaloproteinasas de la matriz o la proteína de la zona de embarazo en esputo, pueden ser biomarcadores útiles que se relacionan con la gravedad de la enfermedad, y que la carga bacteriana puede ser un indicador para valorar la respuesta al tratamiento antibiótico inhalado. Sistémicamente, los estudios son menos concluyentes, y algunos trabajos han relacionado las concentraciones de TNF-alfa y proteína C reactiva con presencia de infección bronquial y riesgo de agudizaciones.
Sin embargo, a pesar de los resultados prometedores, aún son necesarios más estudios para establecer la función de estos biomarcadores locales y sistémicos en la estratificación de distintos endotipos para el manejo clínico de los pacientes con bronquiectasias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.