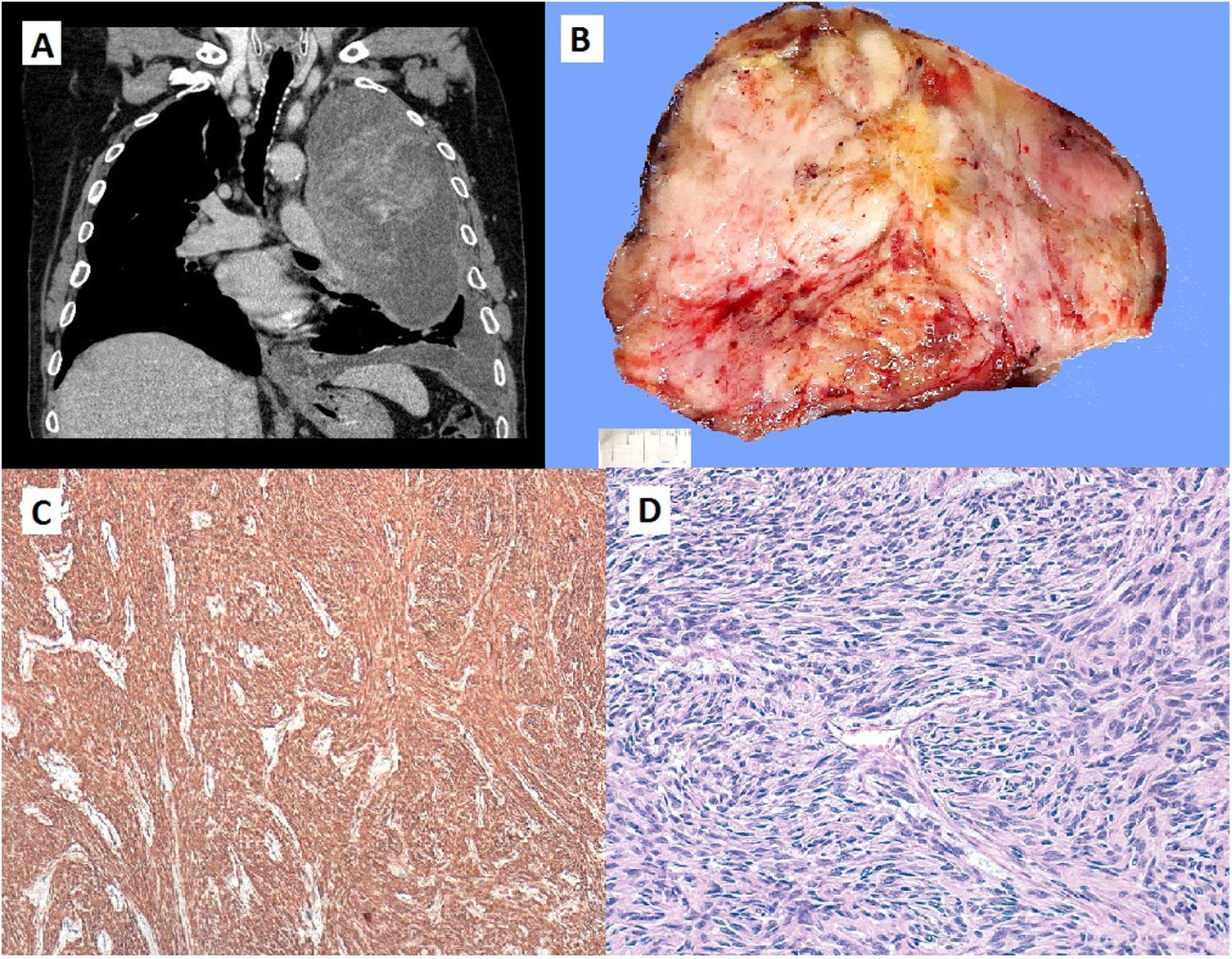
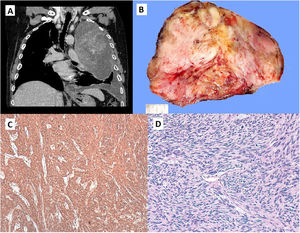
Presentamos el caso de un paciente de 72 años derivado a urgencias por debilidad muscular, somnolencia y sudoración profusa, en el contexto de un cuadro de astenia, anorexia y pérdida ponderal de 5kg en los últimos dos meses, al que se le añade una hipoglucemia refractaria a tratamiento médico. Tras reposición de la glucemia se realizó una radiografía de tórax donde se observó una ocupación pleural de la práctica totalidad del hemitórax izquierdo con desviación contralateral del mediastino. Tras este hallazgo, se realizó una tomografía computarizada donde se evidenció una masa de 20 x 16 x 11cm en el hemitórax izquierdo heterogénea y con neovascularización, de probable origen extrapleural (fig. 1A). Se completó el estudio con una resonancia magnética que confirmó la presencia de una tumoración gigante en el hemitórax izquierdo, altamente sugestiva de tumor fibroso solitario pleural (TFSP).
A) Corte coronal de TC torácica con masa que ocupa la práctica totalidad del hemitórax izquierdo. B) Masa neoplásica de 20 x 16 x 11cm de dimensiones máximas. La tumoración está constituida por un tejido blanquecino de consistencia firme con áreas de aspecto mixoide y una cierta configuración nodular. C) Área de proliferación fusocelular con un patrón de crecimiento estoriforme. Se observan varias figuras de mitosis. (HE, x400). D) Tinción inmunohistoquímica para CD34 con positividad citoplásmica difusa. (CD34, X40).
Tras descartar otras causas de hipoglucemia y en el contexto de un TFSP, se interpretó el caso como un síndrome de Doege-Potter, y se decidió tratamiento quirúrgico mediante toracotomía anterolateral izquierda. Se encontró una tumoración que ocupaba la totalidad del hemitórax izquierdo, dependiente de la pleura visceral, sésil provocando la compresión de todo el parénquima pulmonar. Se llevó a cabo la exéresis en bloque del tumor, que requirió una resección pulmonar sublobar adyacente a la tumoración. El diagnóstico anatomopatológico correspondió con un TFSP con expresión en la inmunohistoquímica positiva a STAT6 (transductor de señal y activador de la transcripción 6), alto índice mitótico (entre 20% y 25%) y ausencia de expresión de CD 34, ambos factores de mal pronóstico para esta tumoración.
El TFSP es una rara neoplasia primaria de la pleura1–3, que se origina en su inmensa mayoría en el tejido conectivo submesotelial de la pleura visceral. Son tumores de crecimiento lento, que producen pocos síntomas y que pueden alcanzar un gran tamaño. La mayor parte se comportan de un modo benigno, aunque actualmente se prefiere considerarlos de comportamiento clínico incierto, ya que un porcentaje variable (entre 13 y 23%) han demostrado un comportamiento agresivo. Por otro lado, en pacientes con TFSP benignos con resección R0, se han detectado recidivas incluso pasados 10-20 años de la resección inicial. Por lo que se hace obligatorio un seguimiento4,5.
El 5% de los casos se asocia con un síndrome paraneoplásico (síndrome de Doege-Potter) caracterizado por hipoglucemia recurrente refractaria a tratamiento médico, debida a secreción excesiva de factor de crecimiento similar a la insulina (IGF-II). Los TFSP pueden asociarse en un 20% con osteoartropatía pulmonar hipertrófica. Descrito originalmente en 1935 por Bamberger y Pierre Marie y en ocasiones denominado síndrome de Pierre-Marie-Bamberger. Este síndrome se caracteriza por dedos en palillo de tambor, periostitis y derrames sinoviales. Aunque el mecanismo exacto subyacente a la osteoartropatía pulmonar hipertrófica no está claro, se han propuesto como efectores la hipoxia crónica y la secreción tumoral de ácido hialurónico o citocinas6,7.
Su diagnóstico se basa en las imágenes radiológicas y en la clínica. No existe una imagen patognomónica o específica de este tumor, pero suele aparecer como áreas bien circunscritas, dependientes de la pleura visceral. Normalmente presenta un contenido homogéneo, aunque pueden aparecer áreas quísticas, calcificaciones, degeneración mixoide, o hemorragia, especialmente en los tumores de gran tamaño como en nuestro caso (fig. 1B).
El diagnóstico definitivo requiere confirmación histopatológica (fig. 1C). La inmunohistoquímica (fig. 1D) es muy útil para diferenciar el TFSP de otros tumores como los mesoteliomas o sarcomas8. Los marcadores convencionales son el CD34, Bcl2 y vimentina. Recientemente se ha demostrado que la expresión nuclear de STAT6 es un marcador altamente sensible y específico para TFSP, con una sensibilidad del 98% y una especificidad mayor del 85%9–13.
La mayoría de los TFSP se comportan de manera indolente y sin recurrencias, pero hay criterios histopatológicos de mal pronóstico asociados a alto riesgo de recidiva, como actividad mitótica elevada, presencia de necrosis o hemorragia, gran tamaño del tumor, su morfología sésil, intensa celularidad, pleomorfismo nuclear o invasión vascular. En nuestro caso, la anatomía patológica definía la masa como un TFSP con áreas lipomatosas, en el que se observan frecuentes figuras de mitosis y también áreas de necrosis, por ello fue categorizada de alto riesgo maligno.
El tratamiento de los TFSP de gran tamaño, por su potencial riesgo de malignidad, debe discutirse en una sesión multidisciplinar. En este tipo de tumor pleural la cirugía es el único tratamiento efectivo14, debiendo llevarse a cabo una cirugía en bloque y con márgenes oncológicos. Aunque los cirujanos torácicos realizamos la mayor parte de las intervenciones por cirugía mínimamente invasiva (VATS uni- o multiportal), en el caso que nos ocupa, el abordaje por videotoracoscopia es técnicamente imposible y, lógicamente, no se aplica en nuestro caso. Dadas las gigantescas dimensiones del tumor, se requirió la realización de una toracotomía para conseguir una resección quirúrgica completa.
Posteriormente presentó un postoperatorio libre de complicaciones, y fue dado de alta al 4.° día, con glucemias en rango de la normalidad.
Como conclusión y pese a la excepcionalidad de este caso, valga esta carta científica para recordar la importancia del despistaje del TFSP ante la presencia de hipoglucemias recurrentes sin causa médica aparente y sin resolución definitiva tras un tratamiento médico óptimo. El tratamiento de este tumor pleural será la resección quirúrgica completa, consiguiendo la resolución inmediata del cuadro paraneoplásico de hipoglucemia15.