El síndrome de vena cava superior (SVCS) se define por un conjunto de signos y síntomas resultantes de la obstrucción de la vena cava superior (VCS). Se considera una urgencia vital, aunque la calidad de vida y supervivencia han mejorado notablemente en los últimos años. Si bien, es cierto que suele estar asociado a procesos malignos de orígenes múltiples, también puede ser provocado por patología benigna, procedimientos invasivos, etc1. La obstrucción de la VCS cursa con la aparición de circulación colateral en la cabeza, las extremidades superiores y la región superior del torso. Por otra parte, los pacientes pueden presentar disnea, disfagia, estridor, tos, disfonía, etc1,2. Los hallazgos más típicos en la exploración física son: edema en esclavina, circulación colateral y, más raramente, cianosis y plétora.
Este caso clínico aporta a la literatura una etiología inusual del SVCS en una paciente con fibrosis quística (FQ). Describe la neumonectomía como posible etiología de dicho síndrome y el implante de un dispositivo intravascular como tratamiento.
Nuestra paciente es una mujer de 25 años diagnosticada de FQ al año de vida, con mutación 508del/R334W. En su primera valoración por la unidad de adultos de FQ, presentaba afectación pulmonar severa (volumen espirado forzado en el 1 segundo del 48%) con al menos tres exacerbaciones graves anuales. Se constató colonización por Staphylococo aureus, Pseudomonas aeruginosa, Achromobacter xylosoxidans y Aspergillus. La paciente desarrolló un cuadro de aspergilosis invasiva con destrucción completa del parénquima del pulmón derecho, infecciones respiratorias reiteradas e importante repercusión funcional. La posibilidad del trasplante pulmonar quedó descartada al presentar un carcinoma de tiroides dos años antes de esta situación. Ante la desfavorable evolución clínico-radiológica, se efectuó una neumonectomía derecha a la edad de 21 años. Tras su realización, se redujo el número de ingresos, la necesidad de terapia antibiótica intravenosa y se estabilizó clínica y funcionalmente.
Tras cuatro años de la intervención, acudió a consulta, refiriendo aparición progresiva en el último año de edema palpebral y lesiones cutáneas en forma de redes venosas en miembros superiores y región torácica. Estas eran especialmente llamativas por las mañanas y tras el decúbito. La paciente negaba tos, disfagia, disfonía, estridor o disnea. En la exploración física, mostraba tensión arterial 107/55 mmHg, frecuencia cardiaca de 97 latidos por minuto, saturación basal de oxígeno del 100%, leve estridor, edema en esclavina y circulación colateral en hemitórax superior.
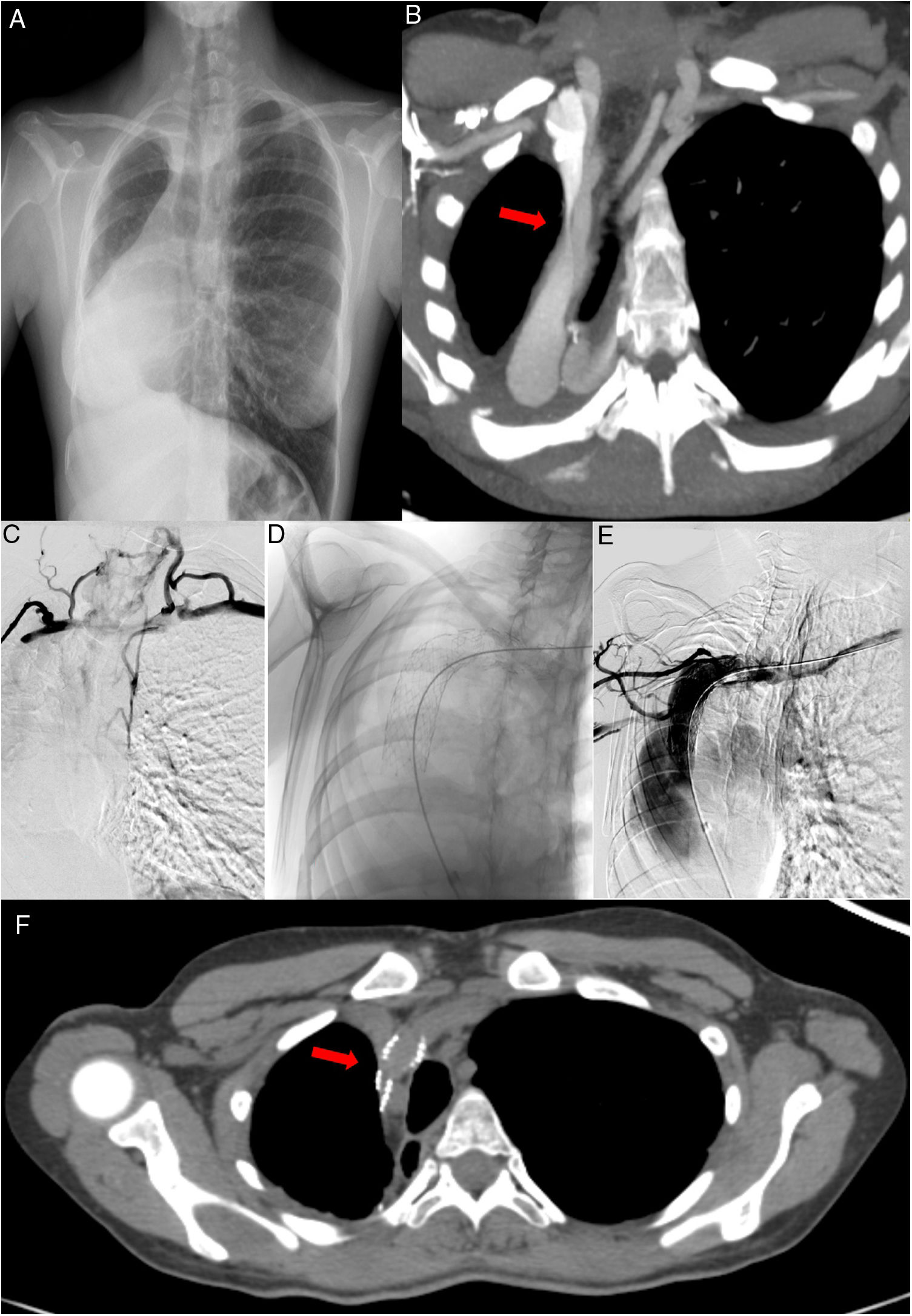
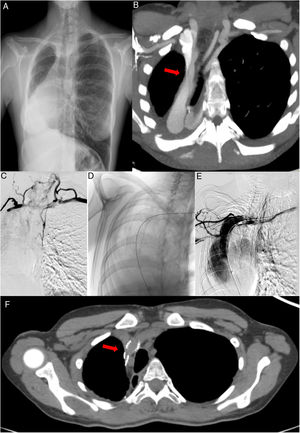
Ante la elevada sospecha clínica de SVCS, se realizaron las siguientes pruebas complementarias durante ingreso hospitalario. En la radiografía de tórax (fig. 1A), se observan cambios postquirúrgicos secundarios a neumonectomía derecha, con herniación transmediastínica e hiperinsuflación pulmonar compensatoria contralateral, sin cambios con respecto a radiografías previas. Las pruebas de laboratorio realizadas, incluido el recuento celular sanguíneo y el panel bioquímico se encontraban dentro de la normalidad. La tomografía computarizada (TC) torácica mostró (fig. 1B) una vena cava superior de morfología filiforme en su región proximal, inmediatamente posterior a la confluencia del tronco braquiocefálico derecho y la vena innominada, secundario al marcado desplazamiento mediastínico derecho y posterior. También se visualizó circulación colateral en hemitórax anterior. Estos hallazgos los confirmó el eco doppler, que mostró disminución de calibre en vena cava superior de no más del 50% morfológicamente, aunque dicha estenosis aumentaba con el decúbito.
A) Radiografía de tórax PA. Neumonectomía derecha, herniación transmediastínica e hiperinsuflación pulmonar compensatoria contralateral. B) TC con CIV. Reconstrucción MIP. Estenosis a nivel proximal de la VCS. C) Flebografía. Estenosis objetivada mediante instilación de contraste intravenoso a nivel proximal de la VCS y circulación colateral. D) Imagen obtenida por radioscopia. Prótesis normoposicionada a nivel proximal de la VCS, inmediatamente posterior a la confluencia del tronco braquiocefálico derecho y la vena innominada. E) Flebografía. Reperfusión de la región estenótica de la VCS. F) TC con CIV. Reconstrucción MIP. Reperfusión de la VCS tras el implante de la prótesis vascular.
CIV: contraste intravenoso; MIP: máxima proyección de intensidades; PA: posteroanterior; TC: tomografía computarizada; VCS: vena cava superior.
Tras valorar el caso en sesión multidisciplinar (incluyendo cirujanos torácicos, unidad de broncoscopia, unidad de FQ, radiología vascular, oncología radioterápica, etc.) se decidió implantar una prótesis vascular de forma percutánea. Se realizó una flebografía selectiva de ambos miembros superiores que demostró importante estenosis de la vena cava superior inmediatamente distal a la confluencia de los troncos innominados con abundante circulación colateral (fig. 1C) y se procedió a la colocación de una prótesis auto expandible híbrida, tipo sinus-venous de 18 mm de diámetro con buenos resultados en el control inmediato (fig. 1D). Tras la intervención, la circulación colateral fue disminuyendo hasta casi resolverse al momento del alta, así como el edema en la región facial y extremidades superiores. Requirió de doble antiagregación durante seis meses para prevenir la re-estenosis de la prótesis, manteniendo posteriormente de forma indefinida ácido acetilsalicílico. En el control radiológico, mediante TC torácica con contraste intravenoso (CIV) a los dos meses del procedimiento vascular, se comprobó normoposicionamiento de la prótesis y permeabilidad de esta (fig. 1E). En el seguimiento, que alcanza la actualidad, la paciente no ha presentado ninguna complicación hemorrágica ni existe compromiso de la permeabilidad de la prótesis.
El SVCS está causado, en la mayoría de los casos, por lesiones tumorales y compresión extrínseca, siendo el cáncer de pulmón la etiología más frecuente1. En el caso de los pacientes con FQ, algunos requieren de múltiples catéteres intravasculares para la administración de antibiótico intravenoso lo que parece ser una causa relevante en el desarrollo de SVCS a la vista de los casos publicados en la literatura3,4. Sin embargo, hasta donde nosotros conocemos, no hemos encontrado, ninguna publicación que asocie la realización de neumonectomía y el desarrollo de SVCS y mucho menos de forma específica en pacientes con FQ. Sí se conoce el síndrome posneumonectomía que consiste en la obstrucción de la vía aérea por la rotación del corazón, los grandes vasos y la herniación del pulmón restante. Sin embargo, en ninguna de las revisiones consultadas, los pacientes presentaban de forma asociada SVCS ni circulación colateral5,6.
Desde el punto de vista terapéutico, existen varias opciones en el manejo del SVCS de origen maligno7. En cuanto al origen benigno, el manejo endovascular es de primera opción8. Específicamente en pacientes con FQ, Otani et al.3 describen una serie de ocho pacientes con FQ y SVCS. Cinco de ellos fueron tratados mediante stent vascular, resolviéndose su clínica y permitiendo la realización posterior de trasplante pulmonar. ÓMahony et al.4 comunicaron un paciente con FQ de 23 años con SVCS secundario al implante de un catéter intravascular yugular que fue tratado también con éxito mediante la inserción de un stent.
Como conclusión, reportamos la neumonectomía como una causa inusual del SVCS. El tratamiento con prótesis intravasculares en el SVCS benigno está descrito en la literatura como seguro y efectivo, y también específicamente en los pacientes con SVCS y FQ.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.