La linfangioleiomiomatosis (LAM) es una enfermedad pulmonar infrecuente, quística, que puede progresar causando fracaso respiratorio. Se puede considerar una neoplasia de tejidos blandos, por la proliferación de células parecidas a las del músculo liso en las vías aéreas, paredes de vasos linfáticos pulmonares o vénulas. Podemos distinguir 2 formas de presentación: asociada a esclerosis tuberosa (TSC-LAM) las células LAM presentan mutaciones de pérdida de función de los genes supresores tumorales tuberous sclerosis complex1,2 (TSC1/2), mostrando una activación anómala de la vía de señalización mediada por mechanistic target of rapamycin (mTOR); o esporádica (S-LAM), donde solo se presenta en mujeres1,2. Existen casos en los que se acompaña de afectación extrapulmonar, por ejemplo, en forma de angiomiolipomas o linfangioleiomiomas a nivel abdominal. En los últimos años se ha empezado a utilizar un tratamiento con un inhibidor de mTOR, como es el sirolimus, comprobándose su eficacia y seguridad a largo plazo3.
Presentamos el caso de una mujer de 37 años no fumadora, diagnosticada de atresia esofágica y fístula traqueoesofágica intervenida en su infancia y reintervenida a los 19 años, asma bronquial alérgica, deficiencia de alfa-1 antitripsina genotipo Pi*SS y bronquiectasias en lóbulo medio e inferior izquierdo, con episodios de bronconeumonías de repetición aspirativas. A la exploración física se aprecia una auscultación respiratoria con hipofonesis y crepitantes finos en base izquierda, siendo el resto normal. Entre las pruebas complementarias destaca un moderado descenso de la alfa-1 antitripsina (88mg/dl; 116-232mg/dl), con el resto de parámetros analíticos, incluyendo inmunoglobulinas séricas y sus subclases, normales.
Tras la visualización de la tomografía computarizada de tórax de alta resolución, dada la sospecha diagnóstica, se solicitaron niveles plasmáticos de factor de crecimiento vascular endotelial (VEGF), que fue de 27,4 (normal<128,9pg/ml), sin volver a repetirse su determinación durante el seguimiento debido a la normalidad en el parámetro; también se realizó un estudio genético con secuenciación de los genes TSC1 y TSC2, resultando negativo. Se le realizó endoscopia respiratoria para revisar la fístula y un lavado broncoalveolar, sin mostrar aislamientos microbiológicos. En el estudio funcional respiratorio se aprecia una obstrucción leve al flujo aéreo, sin respuesta a prueba broncodilatadora, y moderada afectación de la difusión, siendo normales los volúmenes pulmonares. Sus valores prebroncodilatación absolutos y porcentajes con respecto a sus teóricos son: capacidad vital forzada (FVC)=3.100ml-98%; volumen espirado máximo en el primer segundo de la espiración forzada (FEV1)=2.140ml-79%; FEV1/FVC=0,69; flujo espiratorio forzado entre el 25-75% de la capacidad vital forzada =1.270ml/s-35%; capacidad pulmonar total (TLC)=4.930ml-106%; volumen de gas intratorácico=3.070ml-119%; volumen residual=1.810ml-124%; volumen residual/TLC=0,37-116%; capacidad de difusión de monóxido de carbono=56%; volumen alveolar=101%; capacidad de difusión de monóxido de carbono por unidad de volumen alveolar=57%.;;
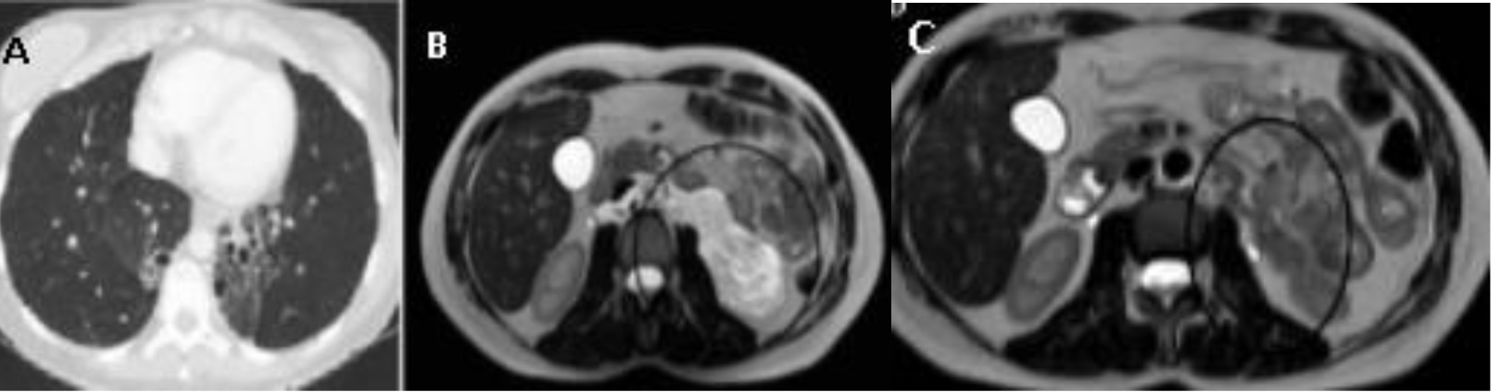
En la tomografía computarizada toracoabdominal se evidenciaba una estenosis de esófago y bronquiectasias de aspecto quístico de predominio en los lóbulos inferiores (LLII), así como una masa retroperitoneal (figs. 1A y B) que se extiende entre las estructuras normales retroperitoneales sin comprimirlas, vasos a su través y adyacentemente adenopatías retrocrurales y retroperitoneales, similar a la masa, recomendándose una resonancia magnética (fig. 1C). Tras presentar el caso en el comité con oncología y cirugía general se decide tratamiento con Rapamune® (sirolimus) 2mg en el desayuno, con excelente tolerancia, y se instaura tratamiento inhalado con vilanterol/furoato de fluticasona 92/22mcg.
A: TC torácica. Bronquiectasias centrales y lobares de predominio en ambos LLII de aspecto quístico en LII con pérdida de volumen asociado. B: RMN de abdomen. Lesión retroperitoneal de al menos 80×95mm (T×L), hiperintensa en pT2 con presencia de tabiques en su interior y zonas con restricción de difusión y captación de contraste que sugieren componente sólido. C: RMN de abdomen. Práctica resolución de la masa quística retroperitoneal, con tamaño actual de unos 12×35×34mm.
A los 6 meses en la resonancia magnética de control se aprecia una mejoría con práctica resolución de la masa quística retroperitoneal, sin cambios significativos a nivel pulmonar (fig. 1D). El estudio de función respiratoria de control muestra mejoría con respecto al previo en cuanto al FEV1 (2.310ml-86%) y de la relación FEV1/FVC (0,74), no observando cambios en el resto de las variables.
La evolución clínica de los pacientes con LAM y su pronóstico antes del tratamiento con un inhibidor mTOR era incierto y poco esperanzador, debido a que las terapias usadas hasta el momento eran poco efectivas. Se conoce que la LAM es una enfermedad multisistémica rara, con una prevalencia de 1-9/1.000.000 de habitantes, afectando principalmente a mujeres, caracterizándose por la difusión de células LAM anormales. En los últimos años se ha visto que sirolimus reduce estas células circulantes bloqueando la progresión de la enfermedad4.
Uno de los objetivos con este tratamiento es conseguir la estabilización de la función pulmonar. Además, es importante tener en cuenta que el fármaco no provoca efectos adversos significativos5. En el estudio MILES, promovido por The LAM Foundation, el tratamiento durante un año con sirolimus reduce los niveles de VEGF-D y estabiliza la función pulmonar, demostrando una pequeña significativa mejoría en el FEV1. En el grupo de MILES con placebo las pacientes premenopáusicas mostraron una caída del FEV1 5 veces más rápido que las posmenopáusicas. Tras el tratamiento tanto las pacientes premenopáusicas como las posmenopáusicas mostraron una menor caída del FEV1 en comparación con el grupo placebo6.
Existen, por tanto, una serie de biomarcadores, como el VEGF-D, que son útiles para el diagnóstico y pronóstico. Recientemente se ha publicado en European Respiratory Journal un artículo sobre el uso de los inhibidores de la COX2 en pacientes con LAM con resultados prometedores, sobre todo en el subgrupo con VEGF-D elevado7. Además, es importante realizar el estudio genético, ya que se cree que las pacientes con TSC-LAM tienen una enfermedad más leve y menos progresiva que las S-LAM6.
Por otro lado, destacar que solo hay 2 casos descritos en la literatura de asociación entre LAM y déficit de alfa-1 antitripsina8 diagnosticados en la tercera década de la vida, al igual que en nuestro caso, aunque presentaban un genotipo PiSZ. LAM y enfisema tienen un mecanismo patogénico similar y se podría explicar por la degradación de fibras elásticas debido a un desequilibrio del sistema elastasa/antielastasa9,10.
ConclusiónLa instauración de tratamiento con un inhibidor de mTOR, ya sea everolimus o sirolimus11,12, ha cambiado el curso evolutivo de esta enfermedad. En este caso podemos observar que, a pesar de no haberse detectado mutación asociada y presentar unos niveles de VEGF-D normales, la respuesta y la tolerancia al fármaco han sido muy buenas.
Se han descrito casos de LAM y déficit de alfa-1 antitripsina que podrían guardar relación, ya que las lesiones que se producen en la LAM tienen un mecanismo patogénico similar al del enfisema. Sin embargo, no hemos encontrado publicaciones que asocien la presencia de atresia y fístula traqueoesofágica con esta enfermedad.