INTRODUCCION
El cáncer epitelial deovario es el causante de un mayor número de muertes en elámbito de la ginecologíaoncológica(1). No conocemos posibles causas que nos puedan ayudar aprevenir el mismo ni tampoco podemos realizar un diagnósticoprecoz correcto en la mayoría de los casos. Por tanto, todoel éxito del tratamiento recae en el manejo inicial deltumor y en la quimiosensibilidad del mismo. A pesar de que hahabido importantes avances terapéuticos tanto encirugía citorreductora como en quimioterapia, la realidad esque la mortalidad del tumor sigue básicamenteinalterada(2). Las estrategiasterapéuticas se han modificado sustancialmente en los 30últimos años, pero la supervivencia no ha mejorado.Esto es debido a varias razones, destacando sobre todo laquimiorresistencia parcial de los tumores avanzados junto con laausencia de drogas de segunda línea moderadamente eficaces.Además todavía no conocemos realmente los factorespronósticos biológicos que modificarán lasupervivencia en la enfermedad avanzada. Con frecuencia creemos quelos tumores no son citorreducibles porque existe una imposibilidadtécnica para realizar una exéresis completa; sinembargo, muchos expertos(3-5) opinan que los tumores en los que nos se puede hacer unaexéresis óptima son aquellos que presentan una mayoragresividad y que tienen mal pronóstico independientementede la extensión de la enfermedad. El estudio de los factorespronósticos en cáncer de ovario ha suscitado siempreun gran interés. Su conocimiento nos permite englobarpacientes dentro de grupos de supervivencia y localizar a su vezgrupos de gran riesgo de recidiva o fracaso terapéutico aquien ofrecer alternativas de terapias más novedosas dentrode ensayos clínicos. El objetivo primero de este trabajo esevaluar los factores pronósticos clínicos en nuestromedio de trabajo (Hospital General Universitario GregorioMarañón) e intentar conocer cual son las variablesque han modificado la supervivencia de nuestras pacientes en losúltimos años. El segundo objetivo del trabajo eraintentar elaborar un índice de riesgo usando las variablesindependientes del análisis multivariante.
MATERIAL YMÉTODOS
Selección de laspacientes
El grupo de pacientes que sonobjeto de estudio de este trabajo está formado por mujerescon los siguientes criterios de inclusión:
-- Pacientes con historia decáncer epitelial de ovario.
-- Diagnosticadas en el HospitalGeneral Universitario Gregorio Marañón y conhistológica primaria en nuestros archivos del Servicio deAnatomía Patológica.
-- Que el diagnósticohubiera sido realizado entre 1985 y 1995.
Se han excluido, por tanto, lasdemás pacientes y se consideran como criterios deexclusión los siguientes:
-- Pacientes diagnosticadasprimariamente en otros centros y de las que no existe evidenciahistológica del tumor primario en nuestrosarchivos.
-- Aquellos tumoresováricos en los que coexiste otra neoplasia de distintoorigen que el ovárico (por ejemplo, adenocarcinoma deendometrio) y que no es posible filiar con certeza si son primarioso metastásicos.
-- Los tumores ováricos deorigen metastásico.
-- Cualquier tumor queinfiltrando el ovario hace dudar al patólogo de suorigen.
-- Los tumores de ovarios noinfiltrantes (border- line o tumoresde bajo potencial de malignidad).
Se seleccionaron en el archivo deAnatomía Patológica todos los casos catalogadosde cáncer epitelial de ovario entre los años 1985 y 1995, ambos exclusive. Sereunieron un total 288 casos. De entre éstos fueronseleccionados las pacientes que cumplían los criterios deinclusión y exclusión. En el archivo deAnatomía Patológica encontramos un total de 259preparaciones, que fueron revisadas en colaboración con unanatomopatólogo experto en el estudio de neoplasiasováricas. Se repasaron los tipos histológicos y serealizó una nueva clasificación, valorando el gradoarquitectural y nuclear de cada uno de los tumores. Para el estudiode supervivencia global por el método de Kaplan y Meiercontábamos finalmente con 217 pacientes.
Edad de laspacientes
La edad media de las pacientesfue de 55,9 ± 13,6 años, con una edad mínimade 18 y una máxima de 84 años. La mediana de la edadfue de 56 años y la moda de 51.
Tipohistológico
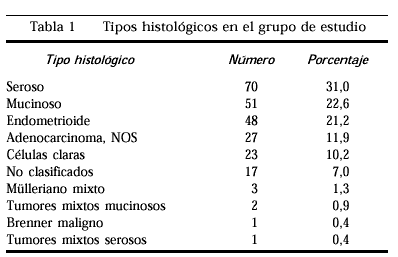
Tras revisar cada uno de loscristales, las pacientes fueron de nuevo clasificadas en un tipohistólogico concreto por un anatomopatólogo experto(tabla 1). Como se aprecia en nuestraserie, el tipo histológico más frecuente fue eladenocarcinoma seroso seguido del adenocarcinomamucinoso.
Gradoarquitectural
Tras revisar todas laspreparaciones disponibles se procede a la gradaciónarquitectural del tumor utilizando los mismos criterios que la FIGOrecomienda para la clasificación en grados en el carcinomade endometrio.
Grado nuclear
Para clasificar el grado nuclearde los tumores hemos seguido la clasificación deShimizu(18) tal como se demuestra a continuación:
-- Grado nuclear I.Núcleos uniformes con una variación de losdiámetros no mayor de 2:1, cociente núcleo:citoplasmabajo, ausencia de nucléolo prominente y ausencia de grumoscromatina.
-- Grado nuclear II.Diversidad moderada en la forma y tamaño nuclear (entre 2:1y 4:1); los nucléolos son reconocibles, peropequeños; se aprecian algunos grumos decromatina.
-- Grado nuclear III. Granvariación en los tamaños nucleares (mayor de 4:1) yde las formas; cociente núcleo-citoplasma muy elevado;membranas nucleares gruesas; grumos densos de cromatina; grandesnucléolos eosinófilos.
Estadio FIGO deltumor
Las pacientes se ordenaronsegún la última clasificación recomendada porla FIGO (1988) modificada por nosotros en los casos de estadios ICy IIIC con fines investigacionales tal como se muestra en la tabla 2. Se repasó laclasificación previa de cada paciente y se modificóla estadificación en los casos que se consideróincorrecta una vez estudiado de nuevo el informe de AnatomíaPatológica y la descripción de hallazgosquirúrgicos de la historia clínica. En los casos enque las maniobras quirúrgicas no fueron suficientes paraclasificar correctamente a la paciente se respetó laestadificación, consignándose en una variable aparteque la estadificación adolecía de algún gestoquirúrgico necesario. De este modo clasificamos elnúmero de estadificaciones correctas e incorrectas. Esto secuidó especialmente en los estadios precoces donde unacorrecta clasificación modifica el estadio, el tratamiento ypor supuesto el pronóstico.
Métodosestadísticos
Para los cálculosestadísticos se utilizó el paquete informáticoSPSS+ para Windows (standard versión 6.1). Las diferenciasentre frecuencias y medias se estudiaron mediante x2, «t» de Studenty análisis de la varianza. Para el análisis desupervivencia actuarial se empleó el cálculo de lasupervivencia acumulativa según el método de Kaplan yMeier. Las diferencias entre curvas de supervivencia se hallaroncon los métodos delog-rank, Breslow y Tarone. Finalmente, el análisismultivariante se desarrolló mediante el método deregresión múltiple de Cox, en el que se usaron lasvariables que resultaron positivas en el análisisunivariante (p < 0,05).
RESULTADOS
Supervivencia global ysupervivencia libre de enfermedad
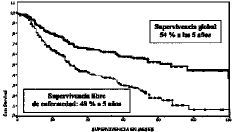
La supervivencia actuarial globala los 5 años de nuestras pacientes fue del 54% y lasupervivencia actuarial a los 10 años fue del 36% para unseguimiento medio de 81 meses, con un error estándar del 5%y con un intervalo de confianza entre 71 y 90 meses. La mediana desupervivencia, que valora el tiempo en que nuestra poblaciónse reduce a la mitad, es de 87 meses. Después de los 5años de seguimiento se aprecia una caída importante,pero menos mantenida de la supervivencia.
La mediana de supervivencia librede enfermedad fue de 58 meses. La supervivencia actuarial libre deenfermedad fue del 48% y a los 10 años ha sido del 26,96%;quiere decir que en nuestro medio sólo una de cada cuatromujeres están libres de enfermedad a los 10 años dehaberles sido diagnosticado el cáncer de ovario. Estos datosquedan reflejados en la figura1.
Figura1. Curvas desupervivencia global y libre de enfermedad en el grupo deestudio.
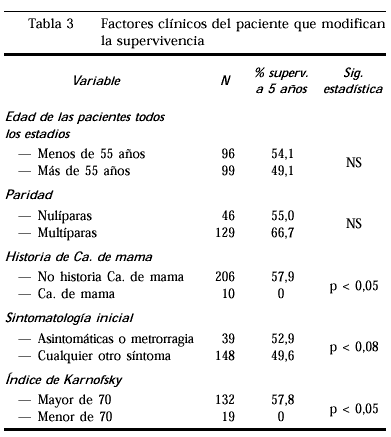
Factores clínicosdel paciente que modifican la supervivencia (tabla 3)
Edad de laspacientes
La supervivencia por edades nodemostró la existencia de diferencias significativas entrelos grupos de edad de más y menos de 55 años alvalorar todos los estadios. Tampoco se encuentran diferencias alcomparar otros grupos de edad ni al seleccionar estadiosconcretos.
Situaciónhormonal en el momento del diagnóstico de laenfermedad
Cuando se consideró lasituación hormonal en el momento del diagnóstico paratodos los estadios no se encontraron diferencias significativas enla supervivencia a 5 años. Sin embargo, al considerar losestadios IIIC o superiores se observaron diferencias del orden de pmenor de 0,08.
Edad de lamenarquía
Hay una mejoría en lasobrevida que no es significativa en las pacientes conmenarquía más temprana.
Historia previa decáncer de mama
La supervivencia de las pacientescon antecedentes de cáncer de mama es peor que aquellas queno lo tuvieron. De las 10 pacientes con este antecedente nosobrevivió ninguna tras 5 años deseguimiento.
Antecedentesfamiliares de primer grado de cáncer de mama uovario
La existencia de antecedentes detumores de mama u ovario entre los familiares de primer grado denuestras pacientes no empeora su pronóstico. Existendiferencias que no fueron significativas entre los grupos deestudio.
Tipo desintomatología inicial
Cuando analizamos lasupervivencia según la sintomatología inicialobservamos que las pacientes cuyo diagnóstico fue casual,estando asintomáticas o bien que presentaron metrorragiacomo síntoma inicial, presentan una ligera ventaja en lasupervivencia que no fue significativaestadísticamente.
Situaciónvital. Índice de Karnofsky
Las pacientes con uníndice de Karnofsky menor de 70 (paciente que cuida desí misma, pero necesita ayuda para desarrollar una actividadnormal) tienen una desventaja objetiva en su supervivencia respectode aquellas con índices mejores.
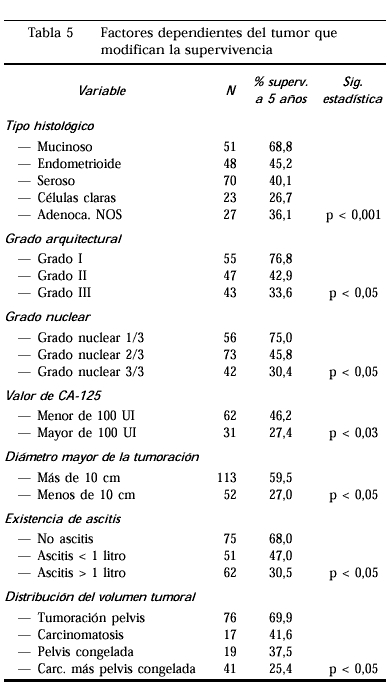
Factores dependientes deltumor que modifican la supervivencia (tablas 4 y 5)
EstadioFIGO
El análisisestadístico aplicado al estudio de la supervivencia global ylibre de enfermedad a los 5 y 10 años por estadios demuestralos resultados que se analizan en la tabla 4. Es interesanteresaltar que no existen prácticamente pacientes libres deenfermedad a 10 años a partir del estadio II.
Tipohistológico
Después de descartar lostipos histológicos poco frecuentes se estudió ycomparó la supervivencia global entre los tiposhistológicos que encontramos más veces en lapráctica clínica. La tabla 5 nos muestra lasupervivencia a 5 años según los diversos tiposhistológicos; los tumores mucinosos son los menos agresivos.Los tumores de células claras presentan la supervivenciamás baja, siempre considerando todos losestadios.
Gradoarquitectural
Tras revisar todas laspreparaciones disponibles se ha procedido a la gradaciónarquitectural del tumor utilizando los mismos criterios que la FIGOrecomienda para la clasificación en grados en el carcinomade endometrio. De este modo la supervivencia de las pacientes concáncer de ovario atendiendo al grado arquitectural semuestra en la tabla 5.
Gradonuclear
Se han revisado las preparacionesvalorando también las aberraciones nucleares, elnúmero de mitosis, así como la relaciónnúcleo-citoplásmática de los tumores deovario, de este modo se estima el grado nuclear por un únicoobservador que ha repasado cada una de la preparaciones. La tabla 5nos muestra la supervivencia por grupos de gradonuclear.
Valoracióndel CA-125 preoperatorio
La cuantificación delantígeno CA-125 preoperatorio demostró ser de granutilidad a la hora de predecir la supervivencia de las pacientes.Se encontraron diferencias significativas entre las pacientes cuyoCA-125 era mayor y menor de 100 UI/ml. Las pacientes con un CA-125menor de 100 unidades tuvieron una supervivencia media casi eldoble de aquellas con un CA-125 mayor de 100 UI.
Diámetromayor de la tumoración
A diferencia de lo que se hapublicado en diversas ocasiones, en nuestra poblaciónencontramos que los tumores de más tamaño se hanasociado globalmente a una supervivencia mejor. Se demuestra quelos tumores de más de 10 cm se asocian másfrecuentemente a mayor sobrevida. La razón de esta realidadse debe a que la mayoría de los tumores que alcanzan grandesdiámetros tiene una menor agresividad y frecuentementetienen una histología de tipo adenocarcinoma mucinoso. Lostumores más agresivos invaden rápidamente lacápsula y vierte su contenido al peritoneo. Cuandoanalizamos por estadios la relación que existe entre eltamaño tumoral y la supervivencia se confirma estarelación, tanto en los estadios precoces como en lostardíos. De tal modo que para cualquier estadio I eltamaño mayor de 10 cm se asocia a un tumor menosagresivo. En los estadios avanzados los tumores condiámetros mayores también presentan una supervivenciamayor que los tumores de menor tamaño.
Existencia deascitis
La existencia de ascitisproducida por el tumor ha demostrado ser un factor discriminante dela supervivencia global. Cuando estudiamos la influencia de estavariable por estadios nos percatamos que tiene un especialinterés dentro del estadio I donde discrimina muy claramenteel pronóstico (tabla 5).
Distribucióndel volumen tumoral en el abdomen
La supervivencia de nuestraspacientes se modifica según la distribución del tumordentro del abdomen. La tumoración aislada en pelvis suponeestadísticamente un mejor pronóstico. Losdemás hallazgos supusieron un peor pronóstico. Entreellos la carcinomatosis sin tumor pélvico importante tuvomejor pronóstico que la pelvis bloqueada por tumor, yésta, mejor pronóstico que la asociación deambos hallazgos, aunque no se encontró diferencias entreellos (tabla 5).
Factores dependientes deltratamiento del tumor que modifican la supervivencia (tabla 6)
Tipo decirugía primaria
La obtención de unacitorreducción óptima en la cirugía primariamejora la supervivencia de un modo muy significativo al considerartodos los estadios. Sin embargo, no se encontraron diferenciassignificativas entre el grupo de citorreducciónsubóptima y el grupo de cirugía diagnóstica enel que sólo se tomaron biopsias. Es decir, entre nuestrospacientes un esfuerzo citorreductor con enfermedad residual mayorde 2 cm equivale a tomar biopsias para el diagnóstico. Lasupervivencia en las pacientes con citorreducción optima estres veces mayor que la apreciada en las pacientes con enfermedadresidual importante en la primera cirugía. La ventajapronóstica de la citorreducción óptima semanifiesta especialmente en el estadio IIIC, donde es un factor quetiene una gran discriminación estadística. En esteestadio la citorreducción óptima eleva lasupervivencia a porcentajes parecidos al estadio II. Es decir, quea los 5 años sobreviven hasta una de cada dos pacientesdespués de ser sometidas a quimioterapia adyuvante (tabla6).
Realizaciónde una estadificación completa en los estadiosprecoces
La realización de lasmaniobras quirúrgicas adecuadas para la clasificaciónquirúrgica de los estadios precoces permite un correctoconocimiento del pronóstico de tumor. Se encuentrandiferencias muy cercanas a la significaciónestadística (menor de 0,08) entre las pacientes con estadiosprecoces bien estadificadas (supervivencia de l00% a 5 años)y aquellas que en las que no se realizaron todas las maniobrasquirúrgicas que están indicadas en estos casos(supervivencia de 77,7 a 5 años). Las pacientes con tumoresprecoces que no han sido completamente estadificadas se clasificana veces en un estadio que no les corresponde. En algunos casosincluso una incorrecta clasificación les impide una adecuadaterapia adyuvante (tabla 6).
Respuesta del tumora la quimioterapia
Entre las pacientes susceptiblesde terapia adyuvante con quimioterapia, aquellas sin enfermedadclínicamente medible al acabar la misma muestran una granventaja en el porcentaje de sobrevida. Se considera tumorclínico aquel que podemos medir mediante exploraciónclínica, exploración radiológica o medianteevaluación del marcador CA-125. La diferencia es tandiscriminante que las pacientes sin tumor tras quimioterapiaalcanzan una supervivencia a 5 años más de 10 vecesmayor. La importancia de esta variable se demuestra tanto en laspacientes en las que se ha realizado una citorreducciónóptima, donde la existencia de tumor tras la quimioterapiasupone que el mismo había crecido durante suadministración, como en los casos donde se ha realizado unaresección primaria subóptima del tumor y por tantoqueda tumor residual. En ambos casos las diferencias sonestadísticamente significativas. Hay que subrayar queindependientemente del tipo de citorreducción, cuando existetumor residual tras quimioterapia, las pacientes tienen unaevolución muy similar con porcentajes de supervivencia a 5años desde el diagnóstico que rondan el27%.
Tipo derégimen quimioterápico administrado
El 76% de las pacientes hanecesitado tratamiento adyuvante con quimioterapia. Lascombinaciones de drogas utilizadas varían durante elperíodo de estudio. La asociaciónplatino-ciclofosfamida ha sido la asociación másutilizada en primera línea. Las pacientes que incluimos ennuestro trabajo no se han beneficiado de placlitaxel por serpacientes diagnosticadas antes de presentarse los resultados deensayos del GOG. Se estudia de modo global la supervivencia entrelos diferentes grupos de tratamiento. No se han encontradodiferencias significativas. Tampoco se encuentran diferencias alestudiar los grupos de tratamiento por estadios y por tipo decirugía primaria (citorreducción óptimavs subóptima). No se aprecia, por tanto, un beneficiosegún el régimen que se ha administrado. Estudiamossi la administración de adriamicina a los esquemas deplatino tienen un impacto en la supervivencia. De este mododividimos las pacientes según hayan sido o no tratadas conuna combinación que incluya adriamicina. Al analizar lasupervivencia cuando se incluyen todos los estadios se encuentraque las pacientes que fueron tratadas con adriamicina tuvieron unporcentaje de supervivencia mejor con diferencias cercanas a lasignificación estadística (p menor de 0,08). Estasdiferencias se acrecientan cuando comparamos la distintautilización de combinaciones con y sin adriamicina en laspacientes con enfermedad avanzada, tanto en el grupo decitorreducción óptima con el grupo decitorreducción subóptima (tabla 6).
Hallazgos en lacirugía de segunda mirada (second-look)
Se han realizado un total de 34cirugías de segunda mirada (second-look) entre nuestras pacientes. La existencia deenfermedad al realizar la exploración quirúrgicacondiciona el pronóstico. Las pacientes con ausencia deenfermedad en la cirugía de segunda mirada tienen unasupervivencia mayor del 50% a los 5 años tal como nosmuestra la tabla 6.
Papel de lacitorreducción secundaria en la supervivencia
De todas las pacientes sometidasa quimioterapia, 43 presentan enfermedad medible tras eltratamiento. De este grupo de mujeres, 22 fueron sometidas a unalaparotomía de citorreducción secundaria y en 21 nose realizó cirugía. El grupo en el que se hizo elesfuerzo quirúrgico tuvo una supervivencia en meses mejor demodo estadísticamente significativo (tabla 6).
Recidiva tumoraltras un período libre de enfermedad
En 54 casos se demuestra laexistencia de una recidiva tras un período libre deenfermedad. Las recurrencias se producen con más frecuenciaen la pelvis y en el abdomen superior. El tiempo medio derecurrencia tras el diagnóstico de la enfermedad ha sido de25 ± 18,5 meses. Una vez diagnosticada la recurrencia, lasupervivencia media es de 22,63 meses. A los 3 años deldiagnóstico de la recurrencia sólo sobreviven el22,3% y sólo el 14,4% está libre de enfermedad. Seestudian las variables que pueden modificar la supervivenciadespués de la recurrencia. No se encuentra ninguna variableque modificando la sobrevida en el tumor primario modifique lasupervivencia tras la recaída. Sólo laadministración de un tratamiento activo versus laactitud expectante modifica el pronóstico. De las 54pacientes que recurren tras estar libre de enfermedad sólocinco están libres de enfermedad en la últimarevisión, con una media de seguimiento entre 5 y 55 mesesdespués de la recurrencia. De las cinco pacientes, cuatrohabían recurrido en la pelvis y una en el abdomen superior.El CA-125 medio en la recurrencia ha sido de 309,923 UI/ml(17-1.644).
Análisisunivariante y multivariante de los factores pronósticosevaluados
Los factores pronósticosque mejoraron la supervivencia en el análisis univariantepara todos los estadios fueron los siguientes:
-- Historia previa decáncer de mama.
-- Índice de Karnofskymenor de 70.
-- Estadio FIGO.
-- Tipohistológico.
-- Grado nuclear.
-- Gradoarquitectural.
-- Grado de agresividadbiológica.
-- CA-125 preoperatorio mayor de100 UI.
-- Diámetro de latumoración menor de 10 cm.
-- Existencia deascitis.
-- Tipo de citorreducciónprimaria.
-- Tipo de respuesta aquimioterapia.
-- Hallazgos en el secondlook.
-- Sobreexpresión de laproteína p53.
Tras el análisisunivariante 102 pacientes pudieron ser sometidas al análisismultivariante mediante el sistema de regresiónmúltiple de Cox. Se obtuvieron las siguientes variablesindependientes al considerar todos los estadios (tabla 7):
-- Enfermedad post-QMT.RR: 8,06; IC95%: 2,37-27,32.
-- Grado nuclear. RR:3,69; IC95%: 1,22-11,10.
Al estudiar el estadio I, lasvariables que demostraron una influencia en la supervivencia demodo independiente fueron:
-- Grado nuclear. RR:27,02; IC95%: 1,17-62,80.
-- Ascitis. RR: 8,70;IC95%: 1,54-48,26.
-- Tamaño tumoral.RR: 0,07; IC95%: 0,005-1,03.
Finalmente se evaluaron losfactores pronósticos que modificaron la supervivencia en losestadios avanzados (II-IV). Las variables independientes quemodificaron el pronósticos en los estadios avanzadosfueron:
-- Enfermedad trasquimioterapia. RR: 6,97; IC95%: 1,75-27,7.
-- Grado nuclear. RR:4,05; IC95%: 1,12-14,6.
DISCUSIÓN
De todos los factores que hansido estadísticamente significativos en el análisisunivariante destacamos aquellos que son independientes tras elestudio multivariante. Al aplicar el método deregresión múltiple de Cox sobre las variables quemodificaron la sobrevida en todas nuestras pacientes, dos fueronlas variables que resultaron seleccionadas: grado nuclear y existencia de enfermedad clínica trasquimioterapia. A primeravista podría llamar la atención que estas dosvariables tuvieran mayor fuerza predictiva que otras másconocidas como el estadio o el grado de citorreducción. Sinembargo, hay que tener en cuenta que el grado nuclear es unavariable que no ha sido evaluada prácticamente enningún estudio retrospectivo y que, por otro lado, laexistencia de enfermedad clínica tras quimioterapia englobaotros factores como son el estadio y la cantidad de enfermedadresidual tras la primera cirugía. Son muy numerosas lasreferencias bibliográficas que incluyen un análisismultivariante de los factores pronósticos en cáncerde ovario(6-17). En nuestra serie el grado nuclear ha sido un factor de supervivenciaaltamente predictivo. Es notable la dificultad con que elpatólogo se encuentra a la hora de determinar el grado delos tumores ováricos(18). No existe en laactualidad un criterio único para determinar el grado en losdistintos tipos histológicos, lo que hace que lasdiferencias inter e intraobservador sean importantes. Cuandopreparamos el protocolo de recogida de datos decidimos que serevisaran cada una de las preparaciones y que se gradara de mododiferente los tumores según el grado arquitectural y elgrado nuclear. Con frecuencia los tumores ováricos seclasifican siguiendo las indicaciones de la FIGO para el carcinomade endometrio. Para algunos anatomopatólogos expertos encáncer ginecológico este criterio sólo esválido en cáncer de ovario cuando valoramos el gradode tumores endometrioides(19). Laexperiencia de este trabajo ha demostrado que la revisión detodas las preparaciones por un mismo patólogo que confieraun grado con un tumor con un criterio uniforme y que valore lamorfología nuclear es altamente útil para indicar elfuturo y la sobrevida de estas pacientes tanto en estadios precocescomo en estadios avanzados.
La otra variable predictivaindependiente ha sido la existencia o no de enfermedad clínica trasquimioterapia. Esta variablepretende explorar el valor de la reevaluación clínicamediante exploración física, analítica opruebas radiológicas de la existencia de enfermedad medibleal acabar el tratamiento complementario. Este concepto tiene unafuerza predictiva mayor que el estadio FIGO y el de la enfermedadresidual tras la primera cirugía porque en realidadcomprende a estas dos variables. Con estas dos variables y laclasificación FIGO hemos creado un índice de riesgode enfermedad precoz y avanzada que pensamos pueda ser de utilidadpara clasificar a nuestras pacientes según el riesgo derecurrencia.
En definitiva tras elanálisis de los factores pronósticos de nuestrapoblación podemos clasificar los grupos de cáncerepitelial de ovario en grupos de riesgo que nos permitan catalogarel riesgo recurrencia y por tanto el tratamiento. Los factoresclásicos que se valoran en la enfermedad precoz (estadio I)son los que se exponen en la clasificación FIGO: uni obilateralidad del tumor, existencia de tumor en cápsula,ascitis positiva y/o rotura capsular. De este modo son subsidiariosde tratamiento adyuvante los tumores estadio IC de laclasificación FIGO. También son candidatos aquimioterapia adyuvante los tumores que histológicamente sonindiferenciados. Sin embargo, cuando se planea se estudia untratamiento complementario no se valora la existencia de ascitis nitampoco el grado nuclear, ya que no existe acuerdo sobre suimportancia. Nuestra sugerencia tras este estudio es que en la enfermedadprecoz y avanzada el grado nuclear es discriminante y por tanto debe ser uno de los pilaresdonde se apoye la terapéutica complementaria. En muchosestudios de factores pronósticos, el gradohistológico del tumor emerge como un factorpronóstico, junto con otros factores como enfermedadresidual o estadio. El grado histológico definitivodebería estar compuesto por el grado nuclear y el gradoarquitectural. Desgraciadamente es muy difícil, si no imposible,entender el método empleado en las diversas publicacionespara clasificar un tumor, pareciendo en mucho casos que se haclasificado el tumor según un procedimiento subjetivomás que por un sistema reproducible universal. Comodecíamos antes, varios sistemas se han propuesto paraclasificar los tumores epiteliales de ovario, aunque no ha tenidoéxito y no se han extendido(18-20). Probablemente estehecho se deba a que el cáncer epitelial de ovario no es unaenfermedad homogénea, sino que cada tipo histológicosea una enfermedad diferente. Es decir, que cada tipohistológico probablemente tenga un desarrollobiológico diferente, de tal modo que no sólo suapariencia y su desarrollo, sino también suquimiosensibilidad sea diferente. Por ejemplo, la aparienciamacroscópica de un tumor ovárico puede serquística con un nódulo en pared, de aspecto papilartapizando la superficie interna, de aspecto papilar en lasuperficie o completamente sólido. Los tumoresendometrioides y los de célula claras se asocian conmás frecuencia a endometriosis. Los tumores serosos nose encuentran asociados aendometriosis y, sin embargo, se diagnostican másfrecuentemente estadios avanzados. Los tumores mucinosos son degran tamaño y aparecen en estadios muy precoces, pero cuandose encuentran en estadios avanzados el tumor tiene unpronóstico infausto. Los tumores de células clarastienen peor pronóstico que otros tipos en estadios precocesy los tumores endometrioides tienen una supervivencia mayor que losserosos. Por tanto, el cáncer epitelial de ovario no es unaenfermedad homogénea. Por eso el encontrar un métodoreproducible que sirviera para todos los tipos histológicosha de ser una tarea de los próximos años entre losprofesionales que quieren avanzar en el conocimiento de labiología de esta enfermedad. Recientemente,Shimizu(18) publicaba un sistema de gradación histológica universal con estascaracterísticas que resultaba además factorpronóstico independiente en el análisismultivariante.
Por otro lado, aunque de un modoclásico se ha sugerido que todos los tumores epitelialesprovienen de una misma célula del epitelio de superficie,este planteamiento empieza a ser controvertido(21). Louis Dubeau propone enun reciente artículo otras estructuras müllerianassecundarias como posible origen de los tumores epiteliales deovario, como son el tejido paraovárico, los quistesparatubáricos, la rete ovarii, la endosalpingiosis, la endometriosismicroscópica y la endomucinosis(22).
¿Existe entoncesalgún sistema que pudiera servirnos para gradar los tumoresde ovario? Por el momento la gradación arquitectural parecemás consensuada, y puede decirse que el porcentaje de tumorsólido o indiferenciado podría ser el patrónde medida, tal como se hace en la clasificación FIGO paracarcinoma de endometrio. Respecto de la clasificaciónsegún el grado nuclear son varios los intentos deestandarización, pero queremos subrayar el deShimuzu(18),que es bastante reproducible y que recientemente ha demostrado susignificación estadística como factor desupervivencia independiente en un estudio con 456 casos decáncer epitelial de ovario y que es la que hemos seguido ennuestro estudio.
Siguiendo estos criterios nuestropatólogo clasificó cada uno de los tumores tras unarevisión exhaustiva siguiendo un criterio de un únicoobservador y sin conocer otras características de laspacientes. Pues bien, esta variable fue la que mejordiscriminó la supervivencia, tanto al considerar todanuestra población de estudio como un todo como cuandoanalizamos por separado la enfermedad precoz o la enfermedadavanzada. A pesar de la gran cantidad de literaturacientífica que apunta que el grado histopatológico esuna variable que modifica la supervivencia, es tambiéncierto que no se considera factor pronóstico en laactualidad por la FIGO(23)ni por la OMS(24).Las razones de esta situación podrían ser lassiguientes: primero, la gradación del tumor puede adolecerde un criterio subjetivo con una inadecuada capacidad de serreproducido. Segundo, todavía no se ha aceptado un sistemade gradación universal para los tumores de ovario. Tercero,el grado histopatológico tiene una especialeficacia predictiva en aquelloscasos en los que el tumor no va a ser sometido inicialmente aquimioterapia, es decir, la quimiosensibilidad del tumor noestá asociada al grado histopatológico y de este modopuede ocurrir que tumores con un grado nuclear muy agresivo seanmuy quimiosensibles(25). Es decir, el gradonuclear no es un índice de quimiosensibilidad. En nuestroíndice de riesgo la variable que resultó elegida enel análisis multivariante fue la existencia de enfermedadtras quimioterapia que en realidad nos habla de quimiosensibilidady nos complementa perfectamente al grado nuclear a la hora depredecir supervivencia.
La segunda variable que seconsideró en el análisis multivariante como variableindependiente fue la existencia de enfermedadpostquimioterapia. Este concepto incluye la existencia o no deenfermedad mensurable tras quimioterapia medianteexploración física, técnicas de imagen omarcadores tumorales calificados de útiles en cáncerde ovario, como el CA-125 y el CA-19-9. Es una variable fuertementepredictiva y complementaria del grado nuclear. Esta variableengloba otros factores muy reconocidos como son: estadios,enfermedad residual tras primera cirugía y respuesta aquimioterapia. Se puede considerar como un second-look clínico. En la actualidad lalaparotomía de segunda mirada o second-look está en continuo debate. Existe unatendencia a indicarla solamente en casos de ensayos clínicosde tercera fase de drogas antineoplásicas. Es cierto quehasta un 50% de las pacientes con ausencia de enfermedadclínica tras quimioterapia tiene enfermedad(26-3) enel second-look y queaproximadamente la mitad de las laparotomíassecond-look negativas estarán seguidas de unarecaída de la enfermedad(31-36). Toda estainformación ha hecho que este procedimientodiagnóstico sea controvertido. Ozols (comunicaciónpersonal al autor) en el protocolo prospectivo de GOG 152,presentado en 1999 en la reunión American Society ofClinical Oncology, presentó datos inéditos porprimera vez que demuestra la ineficacia del second-look para mejorar la supervivencia a pesar de que existeliteratura abundante que afirma lo contrario(34-36). En resumen,existe una tendencia importante a evaluar la respuesta aquimioterapia de las pacientes con cáncer de ovario mediantepruebas no invasivas fuera de ensayoclínico(36).Hasta hace muy poco tiempo las pacientes conenfermedad mensurable tras quimioterapia, sobre todo siprimariamente habían sido dejadas con enfermedad residualvoluminosa, eran sometidas a una segunda línea dequimioterapia o sometidas a cuidados paliativos. En un recientetrabajo de la Sección de GinecologíaOncológica de la SEGO demostrábamos que aquellaspacientes que eran diagnosticadas clínicamente de existenciade enfermedad tras quimioterapia y que habían tenido unacitorreducción subóptima en la primera cirugíapodían beneficiarse de una citorreducción secundariacon una clara mejoría de la supervivencia, que eraestadísticamente significativa(37).
En resumen, queremos afirmar quedestacar la importancia de la valoración meticulosa de gradonuclear de los tumores ováricos como elemento altamentepredictivo de supervivencia, este dato junto a laquimiosensibilidad del tumor valorada mediante la existencia o node tumor tras quimioterapia, nos orienta perfectamente sobre elporvenir de nuestras pacientes.