Evaluar el porcentaje de detección del ganglio centinela en el cáncer de vulva, su sensibilidad y su valor predictivo negativo. Determinar las complicaciones de la técnica y las recidivas a largo plazo.
Material y métodosRevisión sistemática de la literatura con posterior extracción de datos y síntesis de la evidencia.
ResultadosSe incluyeron 19 estudios de carácter observacional. El Tc99-coloide asociado o no al colorante detectó el 98% de los ganglios centinelas. Los falsos negativos fueron menores del 2%, la sensibilidad y el valor predictivo negativo superiores al 95% y las recidivas ganglionares del 3%.
ConclusionesLa técnica de ganglio centinela parece una alternativa razonable a la linfadenectomía inguinal en pacientes con cáncer de vulva de estadios iniciales. A la hora de su implementación, se deberían tener en cuenta factores relativos al equipo de trabajo, la selección de pacientes, la técnica de detección, la técnica quirúrgica y anatomopatológica y la curva de aprendizaje.
To assess the percentage detection of sentinel-lymph-node in vulval cancer, its sensitivity and negative predictive value (NPV). To ascertain the adverse effects of this technology and long term relapses of tumour.
Material and methodsSystematic review of literature and subsequent critical appraisal of the evidence.
ResultsA total of 29 studies were selected, all of which were observational in nature. The sentinel lymph node was detected by Tc99-colloid and combined technique in 98% of patients. The percentage of false negatives observed was less than 2%, the sensitivity values and NPV were over 95% and the lymph node relapse rate around 3%.
ConclusionsSentinel-lymph-node technique would seem to be a reasonable alternative to inguinal lymphadenectomy in patients with early stages of vulval cancer. When it comes to implementing the technique, a series of factors must be borne in mind with respect to the work team, patient selection, detection technique, surgical and anatomopathological techniques and learning curve.
El cáncer de vulva representa entre el 3 y el 5% de todos los cánceres del tracto genital femenino e incide fundamentalmente en mujeres de edad avanzada, con un pico entre la séptima y octava décadas de la vida. En EE. UU., la tasa de incidencia ajustada por edad es de 2,2 por 100.000 mujeres/año y la media de edad al diagnóstico, de 68 años (en el período 2002-2006)1. En el Reino Unido, la tasa de incidencia ajustada por edad ronda también el 2 por 100.000 mujeres/año2, mientras que en España la tasa estandarizada por edad es de 1,1 por 100.000 mujeres3.
El ganglio centinela (GC) se define como el primer ganglio que recibe el drenaje linfático de una determinada región anatómica. En la detección mediante un trazador isotópico se considera aquel que presenta una actividad representativa, esto es, cuyo recuento supera un valor umbral, y que está ubicado en el área de drenaje visualizada en la gammagrafía previa; en la detección con colorante, todo ganglio que aparece teñido de azul o al que fluye un conducto linfático azulado.
El fundamento de la técnica de detección y biopsia del GC radica en que, al ser el primero en recibir la linfa, sería también el primero en riesgo de metástasis linfáticas, y es además testigo del estado del resto de ganglios de la región. De esta manera, el estudio histológico intraoperatorio del GC podría establecer la existencia de metástasis y en caso negativo, predecir la ausencia de afectación tumoral de los ganglios no centinelas, evitando una linfadenectomía completa, con el consiguiente beneficio en términos de menor morbilidad.
El objetivo de esta revisión sistemática es evaluar el porcentaje de detección del GC en el cáncer de vulva y la precisión diagnóstica de la prueba, mediante la determinación de su sensibilidad y del valor predictivo negativo. Por último, determinar el porcentaje de complicaciones de dicha tecnología y la aparición de recidivas a largo plazo cuando se omite la linfadenectomía en las pacientes en las que el GC es negativo.
Material y métodosSe realizó una revisión sistemática de la literatura científica con la siguiente metodología:
- 1.
Estrategia de búsqueda: la búsqueda bibliográfica se realizó sin límite temporal y hasta septiembre de 2009; las bases de datos utilizadas fueron las siguientes:
- –
Especializadas en revisiones sistemáticas: Cochrane Library Plus y Base de datos del NHS Centre for Reviews and Dissemination (HTA, DARE y NHSEED).
- –
Bases de datos generales: Medline, Embase y Web of Science (Web of Knowledge).
- –
Bases de datos y repositorios de proyectos de investigación en curso: Clinical Trials Registry (US. National Institutes of Health) y HSPROJ (Health Services Research Projects in Progress).
- –
Buscadores generales: Google académico.
- –
- 2.
Selección y análisis de estudios: el resultado de las búsquedas fue volcado en un gestor de referencias bibliográficas (EndNote X.0.2), con el fin de eliminar los duplicados y facilitar la gestión documental. Tras la lectura de los resúmenes de los artículos, se realizó una selección de estudios mediante una serie de criterios de inclusión previamente establecidos y relativos al diseño del estudio (se incluyeron todo tipo de estudios, excepto editoriales, artículos de opinión, cartas al director y comunicaciones a congresos), tamaño muestral (únicamente se incluyeron los estudios con más de 20 pacientes), intervención (realización de la técnica de detección y biopsia del ganglio centinela), población a estudio (pacientes con cáncer de vulva), idioma (se incluyeron todos aquellos estudios publicados en español, inglés, francés, portugués e italiano) y variables de resultado (datos relativos al porcentaje de identificación del ganglio centinela, sensibilidad y valor predictivo negativo [VPN] de la prueba, problemas técnicos, complicaciones asociadas al procedimiento y resultados de seguimiento).
Se procedió a la lectura crítica de los estudios, a la extracción y síntesis de los resultados y a su posterior evaluación. También se realizó una revisión de la bibliografía citada en los artículos. La extracción de datos se realizó siguiendo una metodología sistemática, en hojas de extracción diseñadas específicamente para esta revisión. Los datos de los estudios incluidos se presentaron en forma de tablas de evidencia, prestando especial interés a las variables de eficacia y seguridad. La calidad de la evidencia científica de los estudios fue valorada según el diseño de los mismos, siguiendo una jerarquía de mayor a menor importancia de acuerdo con la escala de Jovell y Navarro-Rubio4.
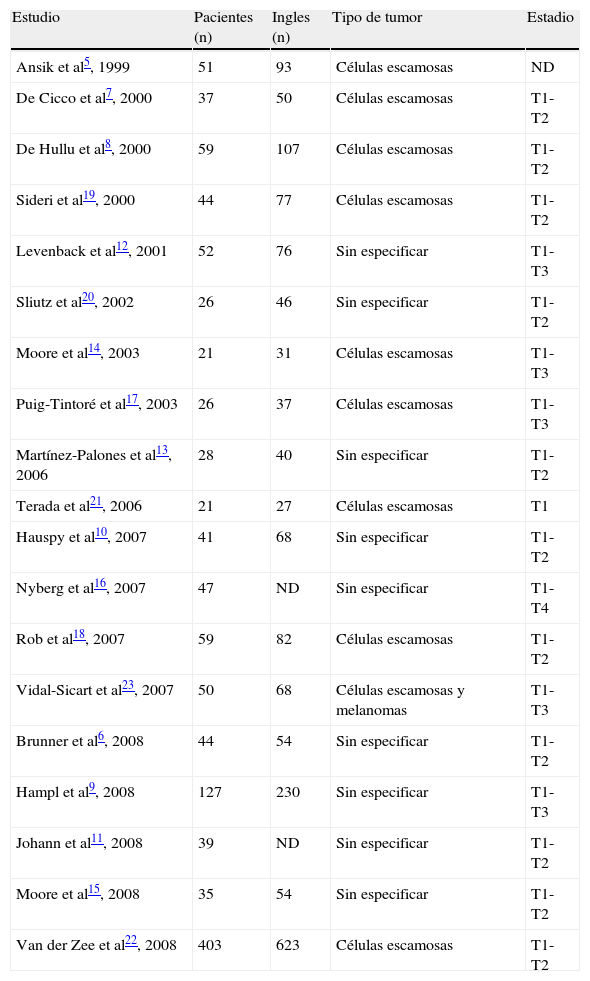
ResultadosEstudios clínicos incluidosSe seleccionaron 29 estudios para su lectura a texto completo, de los que 19 cumplieron los criterios de inclusión establecidos previamente. Todos ellos fueron de tipo observacional5–23; en la tabla 1 se presentan las principales características de éstos.
Número de pacientes, de ingles diseccionadas y características de los tumores en los estudios seleccionados.
| Estudio | Pacientes (n) | Ingles (n) | Tipo de tumor | Estadio |
| Ansik et al5, 1999 | 51 | 93 | Células escamosas | ND |
| De Cicco et al7, 2000 | 37 | 50 | Células escamosas | T1-T2 |
| De Hullu et al8, 2000 | 59 | 107 | Células escamosas | T1-T2 |
| Sideri et al19, 2000 | 44 | 77 | Células escamosas | T1-T2 |
| Levenback et al12, 2001 | 52 | 76 | Sin especificar | T1-T3 |
| Sliutz et al20, 2002 | 26 | 46 | Sin especificar | T1-T2 |
| Moore et al14, 2003 | 21 | 31 | Células escamosas | T1-T3 |
| Puig-Tintoré et al17, 2003 | 26 | 37 | Células escamosas | T1-T3 |
| Martínez-Palones et al13, 2006 | 28 | 40 | Sin especificar | T1-T2 |
| Terada et al21, 2006 | 21 | 27 | Células escamosas | T1 |
| Hauspy et al10, 2007 | 41 | 68 | Sin especificar | T1-T2 |
| Nyberg et al16, 2007 | 47 | ND | Sin especificar | T1-T4 |
| Rob et al18, 2007 | 59 | 82 | Células escamosas | T1-T2 |
| Vidal-Sicart et al23, 2007 | 50 | 68 | Células escamosas y melanomas | T1-T3 |
| Brunner et al6, 2008 | 44 | 54 | Sin especificar | T1-T2 |
| Hampl et al9, 2008 | 127 | 230 | Sin especificar | T1-T3 |
| Johann et al11, 2008 | 39 | ND | Sin especificar | T1-T2 |
| Moore et al15, 2008 | 35 | 54 | Sin especificar | T1-T2 |
| Van der Zee et al22, 2008 | 403 | 623 | Células escamosas | T1-T2 |
ND: no disponible.
Fuente: elaboración propia.
Quince estudios tuvieron como objetivo estudiar la aplicabilidad y validar la técnica de GC en el carcinoma de vulva, evaluando el porcentaje de identificación y la correlación entre los hallazgos histológicos del GC y el resto de ganglios extraídos de la linfadenectomía. De ellos, 2 estudios11,23 constituyeron un primer grupo de validación, al que se realizó sistemáticamente la técnica de GC y linfadenectomía, y un segundo grupo de aplicación en el que se biopsió el GC, realizándose la linfadenectomía dependiendo del resultado. Por último, 4 estudios13,15,21,22 evaluaron las recidivas existentes en pacientes con GC negativo no sometidas a linfadenectomía.
Únicamente se incluyeron los estudios con más de 20 pacientes, por lo que el tamaño muestral osciló entre 21 y 403, siendo 1.210 el número total de mujeres tratadas (tabla 1). En los estudios de validación, con independencia del éxito en la localización y estado histológico del GC, cada paciente fue sometida a linfadenectomía uni o bilateral, dependiendo del tipo y la localización del tumor (lateral, medial); el número total de ingles diseccionadas fue de 1.763.
Once estudios incluyeron tumores de estadio T1-T2 de la clasificación TNM, 5 de estadios T1-T3 y el resto, de estadios T1 y T1-T4 (en un estudio no se facilitó la estadificación). Los problemas técnicos y las complicaciones asociadas al procedimiento se recogieron en escasas ocasiones.
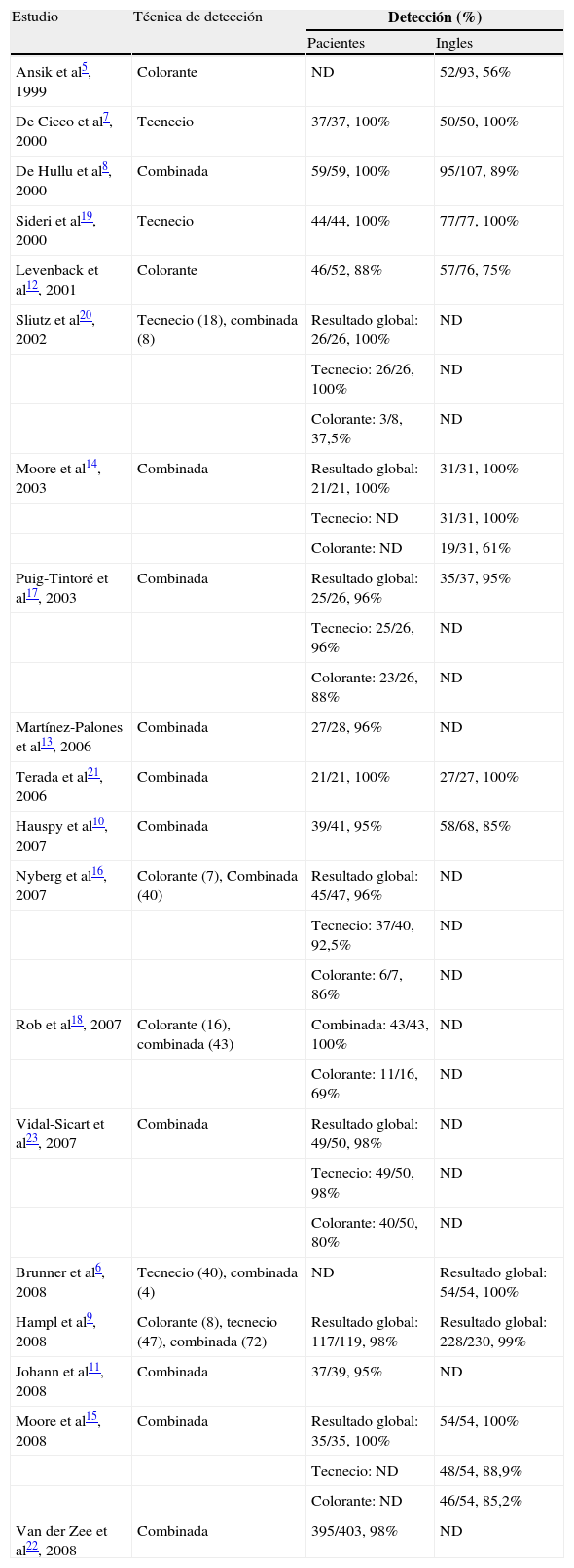
Método y porcentaje de detección del ganglio centinelaComo se observa en la tabla 2, el medio de detección del GC más utilizado fue el combinado, utilizando colorante y coloides marcados con tecnecio. En los estudios de validación, el protocolo de realización de la linfadenectomía fue similar en todos los estudios, de manera que cuando la lesión era lateral se realizaba una linfadenectomía unilateral y cuando la lesión era medial o cerca de la línea media, se realizaba una linfadenectomía bilateral. En los casos de disección bilateral reglada y detección unilateral, salvo evidencia de compromiso histológico en la ingle donde no se identificó GC, no fue posible determinar cuántos correspondieron a fallo técnico o a verdadero drenaje único.
Técnica de detección del ganglio centinela y porcentajes de detección (por pacientes e ingles) en los estudios seleccionados.
| Estudio | Técnica de detección | Detección (%) | |
| Pacientes | Ingles | ||
| Ansik et al5, 1999 | Colorante | ND | 52/93, 56% |
| De Cicco et al7, 2000 | Tecnecio | 37/37, 100% | 50/50, 100% |
| De Hullu et al8, 2000 | Combinada | 59/59, 100% | 95/107, 89% |
| Sideri et al19, 2000 | Tecnecio | 44/44, 100% | 77/77, 100% |
| Levenback et al12, 2001 | Colorante | 46/52, 88% | 57/76, 75% |
| Sliutz et al20, 2002 | Tecnecio (18), combinada (8) | Resultado global: 26/26, 100% | ND |
| Tecnecio: 26/26, 100% | ND | ||
| Colorante: 3/8, 37,5% | ND | ||
| Moore et al14, 2003 | Combinada | Resultado global: 21/21, 100% | 31/31, 100% |
| Tecnecio: ND | 31/31, 100% | ||
| Colorante: ND | 19/31, 61% | ||
| Puig-Tintoré et al17, 2003 | Combinada | Resultado global: 25/26, 96% | 35/37, 95% |
| Tecnecio: 25/26, 96% | ND | ||
| Colorante: 23/26, 88% | ND | ||
| Martínez-Palones et al13, 2006 | Combinada | 27/28, 96% | ND |
| Terada et al21, 2006 | Combinada | 21/21, 100% | 27/27, 100% |
| Hauspy et al10, 2007 | Combinada | 39/41, 95% | 58/68, 85% |
| Nyberg et al16, 2007 | Colorante (7), Combinada (40) | Resultado global: 45/47, 96% | ND |
| Tecnecio: 37/40, 92,5% | ND | ||
| Colorante: 6/7, 86% | ND | ||
| Rob et al18, 2007 | Colorante (16), combinada (43) | Combinada: 43/43, 100% | ND |
| Colorante: 11/16, 69% | ND | ||
| Vidal-Sicart et al23, 2007 | Combinada | Resultado global: 49/50, 98% | ND |
| Tecnecio: 49/50, 98% | ND | ||
| Colorante: 40/50, 80% | ND | ||
| Brunner et al6, 2008 | Tecnecio (40), combinada (4) | ND | Resultado global: 54/54, 100% |
| Hampl et al9, 2008 | Colorante (8), tecnecio (47), combinada (72) | Resultado global: 117/119, 98% | Resultado global: 228/230, 99% |
| Johann et al11, 2008 | Combinada | 37/39, 95% | ND |
| Moore et al15, 2008 | Combinada | Resultado global: 35/35, 100% | 54/54, 100% |
| Tecnecio: ND | 48/54, 88,9% | ||
| Colorante: ND | 46/54, 85,2% | ||
| Van der Zee et al22, 2008 | Combinada | 395/403, 98% | ND |
ND: no disponible.
Fuente: elaboración propia.
Los resultados del porcentaje de detección del GC fueron expresados respecto al número de pacientes o al de inglés diseccionadas profilácticamente/en riesgo (tabla 2). En algunos estudios en los que se aplicó la técnica combinada se facilitaron también los resultados correspondientes al tecnecio y al colorante de forma individualizada, mientras que en otros, los resultados comunicados fueron globales.
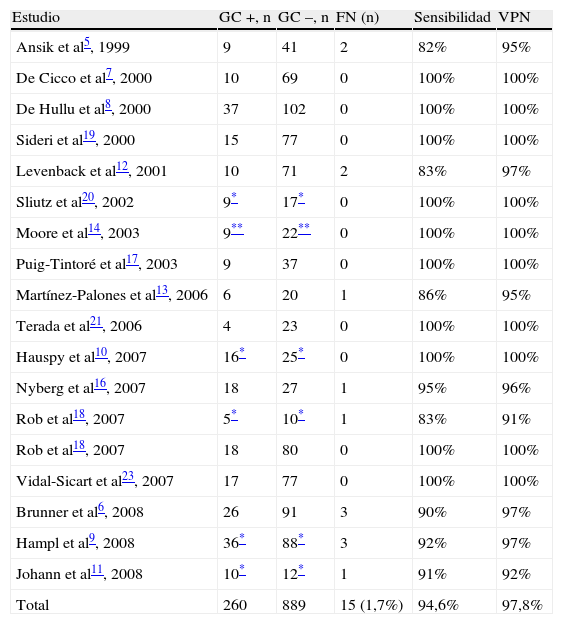
En la tabla 3 se muestra el número de GC positivos (con afectación metastásica) y negativos, si bien en algún caso el resultado expresado fue de número de pacientes o de inglés con GC positivos. En la misma tabla se muestra también el número de falsos negativos (casos con GC normal pero con afectación metastásica de algún ganglio no centinela), la sensibilidad y el VPN de la prueba obtenidos en los estudios de validación. El total de falsos negativos en los 19 estudios fue de 15 (1,7%), la sensibilidad media del 95% y el VPN del 98%.
Número de ganglios centinela con y sin metástasis, número de falsos negativos, sensibilidad y valor predictivo negativo de la prueba diagnóstica.
| Estudio | GC +, n | GC –, n | FN (n) | Sensibilidad | VPN |
| Ansik et al5, 1999 | 9 | 41 | 2 | 82% | 95% |
| De Cicco et al7, 2000 | 10 | 69 | 0 | 100% | 100% |
| De Hullu et al8, 2000 | 37 | 102 | 0 | 100% | 100% |
| Sideri et al19, 2000 | 15 | 77 | 0 | 100% | 100% |
| Levenback et al12, 2001 | 10 | 71 | 2 | 83% | 97% |
| Sliutz et al20, 2002 | 9* | 17* | 0 | 100% | 100% |
| Moore et al14, 2003 | 9** | 22** | 0 | 100% | 100% |
| Puig-Tintoré et al17, 2003 | 9 | 37 | 0 | 100% | 100% |
| Martínez-Palones et al13, 2006 | 6 | 20 | 1 | 86% | 95% |
| Terada et al21, 2006 | 4 | 23 | 0 | 100% | 100% |
| Hauspy et al10, 2007 | 16* | 25* | 0 | 100% | 100% |
| Nyberg et al16, 2007 | 18 | 27 | 1 | 95% | 96% |
| Rob et al18, 2007 | 5* | 10* | 1 | 83% | 91% |
| Rob et al18, 2007 | 18 | 80 | 0 | 100% | 100% |
| Vidal-Sicart et al23, 2007 | 17 | 77 | 0 | 100% | 100% |
| Brunner et al6, 2008 | 26 | 91 | 3 | 90% | 97% |
| Hampl et al9, 2008 | 36* | 88* | 3 | 92% | 97% |
| Johann et al11, 2008 | 10* | 12* | 1 | 91% | 92% |
| Total | 260 | 889 | 15 (1,7%) | 94,6% | 97,8% |
GC: ganglio centinela; FN: falso negativo; VPN: valor predictivo negativo.
Fuente: elaboración propia.
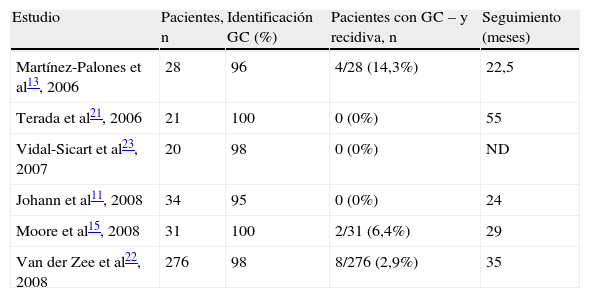
Martínez-Palones et al13 compararon 2 series de casos de pacientes con tumores de vulva de estadios T1-T2 (tabla 4). La primera fue una serie prospectiva de 28 pacientes para validación de la técnica y la segunda, una serie retrospectiva de 27 pacientes sometidas al mismo procedimiento, aunque sin identificación del GC. Tras un seguimiento de 22,5 meses en el primer grupo y de 60 meses en el segundo, encontraron 8 y 6 recidivas, respectivamente (el 26,9 frente al 28,6%; p=0,89). Vidal-Sicart et al23 constituyeron un grupo de aplicación con 20 pacientes, detectando GC positivos en 7 pacientes. En el seguimiento, sólo una paciente con GC positivo presentó diseminación metastásica a los 12 meses del diagnóstico, sin que aparecieran recidivas en las pacientes con GC negativo. De igual forma, Johann et al11 tras 24 meses de seguimiento medio, no observaron recidivas inguinales en 34 pacientes con tumores T1-T2 y ganglios centinela negativos; la supervivencia libre de recidiva fue de 29 meses en las pacientes sometidas únicamente a la técnica del GC. Terada et al21 no encontraron recidivas tras un seguimiento de 4,6 años en un grupo de 21 pacientes y Moore et al15 observaron una tasa de recidiva inguinal a los 12 meses del 6,4% de las pacientes (2/31) o del 4,3% de las ingles (2/46). Por último, Van der Zee et al22, tras un seguimiento medio fue de 35 meses en 276 mujeres, observaron 8 recidivas inguinales; la tasa de recidiva a los 2 años fue del 3% en el total de pacientes y del 2,3% en aquellas con enfermedad unifocal.
Tasa de recidivas en pacientes con ganglio centinela negativo a las que no se realiza linfadenectomía.
| Estudio | Pacientes, n | Identificación GC (%) | Pacientes con GC – y recidiva, n | Seguimiento (meses) |
| Martínez-Palones et al13, 2006 | 28 | 96 | 4/28 (14,3%) | 22,5 |
| Terada et al21, 2006 | 21 | 100 | 0 (0%) | 55 |
| Vidal-Sicart et al23, 2007 | 20 | 98 | 0 (0%) | ND |
| Johann et al11, 2008 | 34 | 95 | 0 (0%) | 24 |
| Moore et al15, 2008 | 31 | 100 | 2/31 (6,4%) | 29 |
| Van der Zee et al22, 2008 | 276 | 98 | 8/276 (2,9%) | 35 |
GC: ganglio centinela.
Fuente: elaboración propia.
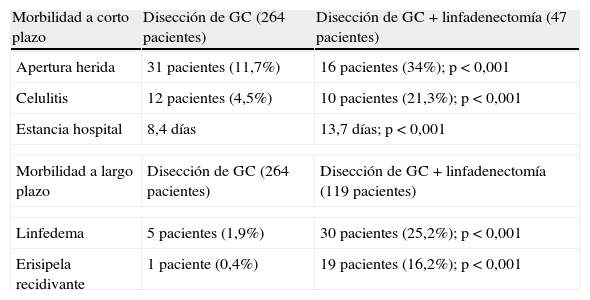
De los 19 artículos incluidos, en 13 no se registraron las complicaciones de la técnica y en dos no se observaron. El estudio que mejor recoge la aparición de efectos secundarios es el de Van der Zee et al22(tabla 5); observa que las pacientes no sometidas a linfadenectomía presentaron a corto plazo un menor y significativo porcentaje de apertura de la herida y de celulitis y una menor estancia media. A largo plazo, los porcentajes de linfedema y de erisipela recidivante también fueron menores.
Morbilidad a corto y largo plazo.
| Morbilidad a corto plazo | Disección de GC (264 pacientes) | Disección de GC + linfadenectomía (47 pacientes) |
| Apertura herida | 31 pacientes (11,7%) | 16 pacientes (34%); p<0,001 |
| Celulitis | 12 pacientes (4,5%) | 10 pacientes (21,3%); p<0,001 |
| Estancia hospital | 8,4 días | 13,7 días; p<0,001 |
| Morbilidad a largo plazo | Disección de GC (264 pacientes) | Disección de GC + linfadenectomía (119 pacientes) |
| Linfedema | 5 pacientes (1,9%) | 30 pacientes (25,2%); p<0,001 |
| Erisipela recidivante | 1 paciente (0,4%) | 19 pacientes (16,2%); p<0,001 |
GC: ganglio centinela.
Fuente: Van der Zee c, 2008.
Todos los estudios incluidos en esta revisión son de carácter observacional y algunos de ellos presentan limitaciones metodológicas, como carecer de una adecuada descripción de los criterios de selección de pacientes, omitir resultados o no incorporar la definición de las variables estudiadas. Esta falta de homogeneidad observada en los estudios limita poder emitir conclusiones definitivas acerca de los diferentes aspectos evaluados en esta revisión. Los ensayos clínicos en marcha, con casi 1.000 pacientes incluidos, serán sin duda muy esclarecedores y ayudarán a profundizar en el conocimiento de la efectividad y seguridad de esta técnica.
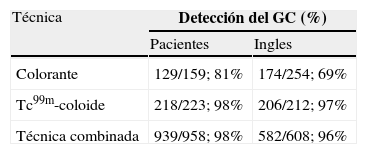
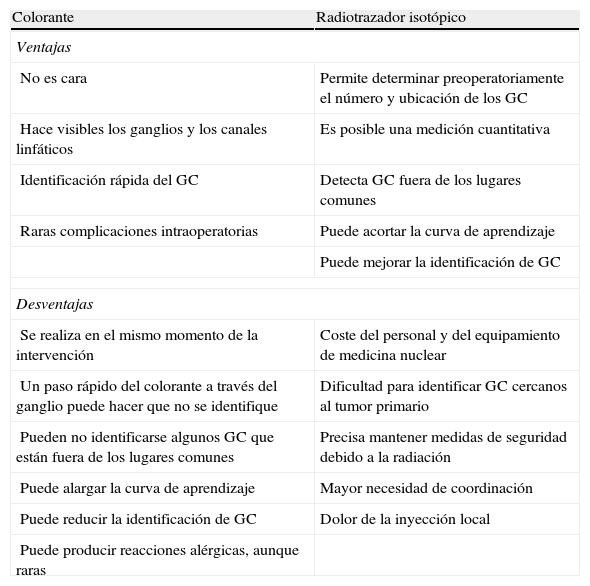
Efectividad de la técnicaLos resultados de esta revisión sistemática nos muestran que la identificación del GC utilizando Tc99m–coloide es la técnica de mayor precisión en el cáncer de células escamosas de vulva (tabla 6). La técnica mixta (trazador isotópico más colorante) podría ser útil en los períodos de aprendizaje de los profesionales y cuando la linfogammagrafía preoperatoria no fuese esclarecedora o anticipara una detección dificultosa. Otra opción sería utilizar el trazador isotópico y agregar el colorante cuando no se detecta ningún GC, lo que evitaría los efectos adversos que, aunque infrecuentes, se asocian con el colorante. Con los datos actuales, la utilización exclusiva del colorante en la identificación del GC no es aconsejable. En la tabla 7 se muestran las ventajas y desventajas de ambas técnicas.
Ventajas y desventajas de las técnicas de identificación del ganglio centinela.
| Colorante | Radiotrazador isotópico |
| Ventajas | |
| No es cara | Permite determinar preoperatoriamente el número y ubicación de los GC |
| Hace visibles los ganglios y los canales linfáticos | Es posible una medición cuantitativa |
| Identificación rápida del GC | Detecta GC fuera de los lugares comunes |
| Raras complicaciones intraoperatorias | Puede acortar la curva de aprendizaje |
| Puede mejorar la identificación de GC | |
| Desventajas | |
| Se realiza en el mismo momento de la intervención | Coste del personal y del equipamiento de medicina nuclear |
| Un paso rápido del colorante a través del ganglio puede hacer que no se identifique | Dificultad para identificar GC cercanos al tumor primario |
| Pueden no identificarse algunos GC que están fuera de los lugares comunes | Precisa mantener medidas de seguridad debido a la radiación |
| Puede alargar la curva de aprendizaje | Mayor necesidad de coordinación |
| Puede reducir la identificación de GC | Dolor de la inyección local |
| Puede producir reacciones alérgicas, aunque raras | |
GC: ganglio centinela.
Fuente: adaptación de Levenback et al12, 2001.
Los factores más importantes a la hora de evaluar la técnica de detección del GC son el porcentaje de identificación de éste y el porcentaje de falsos negativos que, a su vez, determinarán los valores de la sensibilidad y del VPN de la prueba. La identificación de pacientes con posibles metástasis es muy importante debido a que su tasa de supervivencia disminuye drásticamente con el número de ganglios linfáticos afectados y permite seleccionar a las pacientes que se beneficiarán de radioterapia. Sin embargo, sólo entre el 10 y el 15% de las pacientes con lesiones T1 o T2 desarrollarán enfermedad metastásica inguinal, por lo que entre el 85 y el 90% de las pacientes sometidas a linfadenectomía reglada o sistemática estarán expuestas a corto y largo plazo a las comorbilidades asociadas con este procedimiento, sin recibir ningún beneficio clínico15.
Aunque los falsos negativos se han observado más frecuentemente en pacientes en las que se utiliza colorante5,12, también se han observado en estudios en los que se utilizó tecnecio radiactivo6,9,11,13,16,18. De todas formas, el porcentaje de falsos negativos es bajo, representando el 1,7% de todos los GC negativos evaluados, con una sensibilidad del 94,6% y un VPN del 97,8% (el 96 y el 98%, respectivamente, eliminando aquellos estudios en los que se utilizó únicamente colorante). Todo ello hace esta técnica comparable con la del GC en el cáncer de mama, ampliamente aceptada por la comunidad científica13.
De Hullu et al8 señalan la ubicación del tumor primario como un importante factor asociado con el fallo en la detección del GC y Levenback et al12 informan de un mayor porcentaje de identificación en los tumores laterales que en los mediales (el 90 frente al 69%). Por este motivo, las disecciones de GC en las lesiones de la línea media deberían abordarse con cautela y considerar que todas las lesiones de clítoris, perineo o con un borde medial a menos de 1cm de la línea media pueden tener un drenaje linfático bilateral15.
Otro factor que podría estar implicado en la no identificación del GC, y que ha sido documentado en el cáncer de mama, es un bloqueo de los canales linfáticos debido a metástasis del GC. Así, en el caso que éste estuviese completamente ocupado por células cancerosas, podría puentearse debido a su propia estasis13. Por ello, al igual que en el cáncer de mama, la identificación por parte del cirujano de ganglios de características sospechosas durante el acto quirúrgico obligaría a su estudio histológico, con independencia de cumplir o no los criterios de GC e incluso a la linfadenectomía profiláctica en caso de sospecha.
Recidiva de la enfermedadLa tasa de recidiva inguinal en estudios retrospectivos varía entre el 0 y el 5,8% en pacientes con ganglios linfáticos negativos24–26 y hasta el momento existen pocos estudios prospectivos en los que la linfadenectomía inguinal sea selectiva. En la revisión actual, 3 estudios de seguimiento de pacientes con GC negativo, a las que no se les realizó linfadenectomía, no observaron recidivas11,21,23, mientras que en otros 2 casos, los porcentajes fueron del 14,3 y el 6,4%13,15. Debemos destacar que el tamaño de la lesión vulvar primaria se ha relacionado con el riesgo de metástasis ganglionar; no se observaron recidivas en aquellas pacientes con lesiones < 20mm15.
La baja tasa de recidiva ganglionar de la enfermedad observada por Van der Zee et al22 (3% en el caso de enfermedad vulvar multifocal y 2,3% en el de unifocal), comparable con la descrita con la linfadenectomía clásica, y la excelente tasa de supervivencia específica a 3 años (97%) en las pacientes con GC negativo les hace sugerir que esta técnica es una alternativa segura a la linfadenectomía inguinofemoral electiva para pacientes seleccionadas y que debería formar parte del estándar asistencial del tratamiento del cáncer de vulva. En este mismo sentido, un panel de expertos de la International Sentinel Node Society27 consideró que la técnica de biopsia de GC es una alternativa razonable a la linfadenectomía inguinal completa en las pacientes con cáncer vulvar de estadios I-II, cuando la técnica es realizada por un equipo multidisciplinar experimentado y en pacientes correctamente seleccionadas.
Aspectos de seguridadComo ya se ha comentado en el apartado anterior, las pacientes sometidas a la técnica de GC presentan, a corto y largo plazo, menores porcentajes de apertura de la herida, celulitis, estancia hospitalaria, linfedema y erisipela recidivante que el grupo que recibió también una linfadenectomía22,28. Otros posibles efectos secundarios que pueden aparecer al realizar la técnica de GC son aquellos relacionados con la administración del colorante, si bien parece que son infrecuentes29.
Factores críticos de la técnicaExisten una serie de factores que se consideran críticos a la hora de implementar la técnica de detección del ganglio centinela: el equipo, la selección de las pacientes, la técnica anatomopatológica utilizada y la curva de aprendizaje22,30.
EquipoLa detección del ganglio centinela es una técnica multidisciplinar que requiere la colaboración de cirujanos, anatomopatólogos y especialistas en medicina nuclear. Para prevenir la aparición de falsos negativos, es necesario diseñar un correcto protocolo de trabajo y conseguir la estricta adhesión a éste de todo el equipo. Se requiere, además, un control de calidad de cada etapa del procedimiento, incluidas la administración del trazador radioactivo por el especialista en medicina nuclear, una cuidadosa interpretación de la linfogammagrafía, un cirujano con experiencia contrastada y un servicio de anatomía patológica con experiencia en la ultraestadificación del GC.
Selección de las pacientesLa técnica de GC únicamente estaría indicada en aquellos cánceres de vulva de estadios iniciales, existiendo autores que recomiendan limitar la técnica a aquellas pacientes con tumores T121.
En general, la presencia de ganglios linfáticos aumentados de tamaño es una contraindicación para realizar el procedimiento15 o al menos deberían ser resecados para detectar posibles metástasis13. También todas las situaciones en las que se produce una interrupción del drenaje linfático, como la cirugía y la biopsia excisional previas o la infección, ya que pueden comprometer el drenaje linfático normal12.
Técnica anatomopatológicaUno de los aspectos más importantes en la aparición de falsos negativos es la técnica de anatomía patológica utilizada20. Un examen más profundo de los GC mediante ultraestadificación, que implica la realización de cortes seriados del ganglio y la aplicación de técnicas inmunohistoquímicas, incrementa la capacidad de detectar micrometástasis que podrían pasar inadvertidas con las técnicas rutinarias15. La realización de la técnica de GC, al seleccionar uno o pocos ganglios, permite esta ultraestadificación y la identificación de un subgrupo de pacientes con focos micrometastásicos, y por tanto, con mayor riesgo de metástasis17,31.
Curva de aprendizajeEl rendimiento de la técnica del GC está fuertemente asociado con la experiencia del cirujano. En el cáncer de mama se suelen recomendar al menos 40 procedimientos con éxito de detección del GC seguidos de una linfadenectomía axilar completa32 y en el caso del melanoma cutáneo, una fase de aprendizaje de al menos 30 casos consecutivos33. Sin embargo, en el cáncer de vulva estas cifras no son realistas debido a la rareza de la enfermedad. Además, la ubicación más superficial de la región inguinofemoral en comparación con la zona axilar y la mínima variación en la anatomía de los canales linfáticos desde la vulva a los ganglios facilitarían una detección más exacta, por lo que la curva de aprendizaje en el cáncer de vulva podría ser menor. Así, se considera que la curva de aprendizaje sería de al menos 10 pacientes (con detección del GC en 15-20 ingles) y la realización entre 5 y 10 procedimientos al año para mantener esta experiencia8,22. Dada la baja frecuencia del cáncer de vulva, en muchas ocasiones se requerirá centralizar el tratamiento quirúrgico de éste22. Tradicionalmente, la técnica de GC precisa de una validación individual de cada uno de los especialistas implicados en la técnica. Sin embargo, dado su carácter multidisciplinar, esta validación podría ser sustituida progresivamente por un proceso de aprendizaje supervisado en el contexto de un grupo con experiencia34.
ConclusionesLa importancia de la detección y biopsia del GC en el tratamiento del cáncer de vulva radica en la posibilidad de evitar la linfadenectomía inguinofemoral completa, con el consiguiente beneficio en términos de menor morbilidad. Esta técnica parece una alternativa razonable en aquellas pacientes con cáncer de vulva de estadios I-II y cuando la técnica es realizada por un equipo multidisciplinar experimentado y en pacientes correctamente seleccionadas.
Conflicto de interesesEl autor declara no tener conflicto de intereses en la elaboración de este manuscrito.
A D. Iñigo Montesino Semper, del Servicio de Ginecología del Hospital Virxe da Xunqueira (Cee, A Coruña), a Eloy Moral Santamarina, del Servicio de Obstetricia y Ginecología del Complexo Hospitalario de Pontevedra, y D. Andrés Serena Puig, del Servicio de Medicina Nuclear del Hospital do Meixoeiro de Vigo (Pontevedra), por su colaboración desinteresada en la revisión de este manuscrito y por los comentarios aportados.