PROGRESOS DE OBSTETRICIA Y GINECOLOGÍA
Volumen 41 Número 4 Mayo 1998
Hiperplasia pseudoangiomatosa del estroma mamarioPseudoangiomatous hyperplasia of mammary stroma
J. A. Ortiz-Rey
S. de Andrés 1
M. I. Rivas 1
L. Cerrada 2
M. Hortas 3
I. Antón
F. Sacristán
A. de la Fuente
Servicios de Anatomía Patológica, 1Ginecología, 2Cirugía General y 3Radiología
Centro Médico POVISA
Vigo (Pontevedra)
Correspondencia:
José Antonio Ortiz Rey
Servicio de Anatomía Patológica
Centro Médico POVISA
C/ Salamanca, 5
36211 Vigo (Pontevedra)
Aceptado para publicación 23/12/97
Ortiz-Rey JA, De Andrés S, Rivas MI, Cerrada L, Hortas M, Antón I, Sacristán, De la Fuente A. F. Hiperplasia pseudoangiomatosa del estroma mamario. Prog Obstet Ginecol 1998;41:247-253
INTRODUCCIÓN
La hiperplasia pseudoangiomatosa del estroma mamario (HPEM) es una lesión descrita por primera vez en 1986 (1), que se puede observar como hallazgo incidental en biopsias rutinarias de mama (2) o produciendo un nódulo palpable.
Esta entidad, que con cierta frecuencia pasa desapercibida al anatomopatólogo, puede sin embargo plantear el diagnóstico diferencial histológico con un angiosarcoma de bajo grado. Su conocimiento resulta, pues, de gran importancia por las diferencias que existen en cuanto a tratamiento y pronóstico entre ambas entidades.
Presentamos nuestra serie de tres casos de HPEM y revisamos toda la literatura sobre esta entidad.
Este trabajo describe los hallazgos clínicos, radiológicos y anatomopatológicos de tres pacientes exploradas y tratadas en el Centro Médico POVISA de Vigo (Pontevedra).
Las piezas quirúrgicas fueron fijadas en formol al 10%, incluyéndose muestras en parafina y se obtuvieron secciones de 3 micras de grosor, que se tiñeron con hematoxilina-eosina (H-E), tinciones de PAS, orceína y de Gomori, según técnicas habituales. En uno de los casos (número 1) se realizaron tinciones de inmunohistoquímica mediante el método avidina-biotina-complejo de peroxidasa («ABC») con los siguientes anticuerpos monoclonales: AE3 (Signet); CAM 5.2, CD 34 (Becton and Dickinson); CK 903, actina muscular común (Enzo); vimentina, desmina (Dako) ; receptores de estrógenos, receptores de progesterona (Abbott); y proteína relacionada con estrógenos (ps2) (Biogenex); y con el anticuerpo policlonal antígeno asociado al Factor VIII (Dako).
CASOS CLÍNICOS
Caso 1
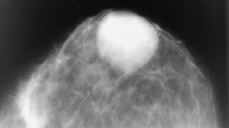
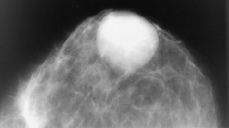
Mujer de 39 años, nuligesta, usuaria de anticonceptivos orales hasta ocho meses antes de la consulta. Acudió a nuestro hospital en octubre de 1995 por bultoma mamario de varios meses de evolución. En la exploración física se evidenció un área de aumento de consistencia en unión de cuadrantes superiores de mama izquierda, sin nódulo definido que, reexplorada tres meses después se delimitaba mejor. La mamografía (Fig. 1) mostró una masa ovalada de 6 cm de diámetro, de contorno nítido, sin calcificaciones, y por neumooncografía (inyección de 5 cc de aire) se observaron conductos galactóforos intratumorales.No se produjeron complicaciones post-neumooncografía, tales como hematoma post-punción. En la ecografía se detectó un tumor sólido, bien definido y de ecogenicidad ligeramente heterogénea. El diagnóstico clínico-radiológico fue probable fibroadenoma. Se practicó tumorectomía en febrero de 1996.
Caso 2
Mujer de 45 años, gesta 4 para 4, en la que, en revisión rutinaria, en abril de 1995, se detectó nódulo no palpable en mama derecha, mamográficamente dudoso de benignidad. Se realizó exéresis-biopsia, previa localización ecográfica, en la que se diagnosticaron cambios fibroquísticos de la mama con epiteliosis atípica. Diez meses después, en una nueva revisión, se observó nuevo nódulo dominante en dicha mama, bien delimitado, hipoecoico pero de ecogenicidad homogénea. Con el diagnóstico de fibroadenoma, se realizó excisión de la masa en mayo de 1996.
Caso 3
Mujer de 28 años, nuligesta, con antecedente de exéresis en otro hospital de una tumoración de cuadrante superoexterno de mama izquierda en 1991, que se diagnosticó de fibroadenoma (no hemos tenido posibilidad de revisar las preparaciones histológicas de aquella lesión). En marzo de 1994 consultó en nuestro hospital por nódulo en la misma localización. A la exploración física, se evidenció una tumoración situada por debajo de la cicatriz de exéresis previa, de consistencia firme y no adherida a planos profundos ni a piel. En la ecografía se observó una lesión sólida hipoecoica, de bordes bien definidos y ecoestructura homogénea, de 2,6 cm de diámetro. Se realizó PAAF que fue negativa para células malignas. El diagnóstico clínico-radiológico fue fibroadenoma. En dos ecografías posteriores (diciembre 1994 y agosto 1995) se apreció crecimiento progresivo de la lesión (3,5 cm y 4,1 cm de diámetro, respectivamente) manteniendo su hipogenicidad, bordes bien definidos y ecoestructura homogénea. Se decidió resección de la misma en mayo de 1996.
ANATOMIA PATOLOGICA
Hallazgos macroscópicos
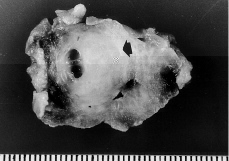
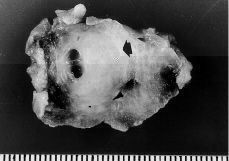
Los tres tumores extirpados eran de forma ovoidea, bien circunscritos y presentaban consistencia elástica-firme. El diámetro máximo fue de 6 cm (caso 1), 1,8 cm (caso 2) y 4,5 cm (caso 3). Al corte (Fig. 2) mostraban coloración blanquecina, superficie rugosa, un patrón vagamente fascicular (caso 1) o nodular (caso 3), y, en dos de los casos (números 2 y 3), se observaban áreas quísticas de 0,5 cm de diámetro máximo, de contenido líquido seroso. Ninguna de las lesiones presentaba necrosis ni hemorragia.
Histología
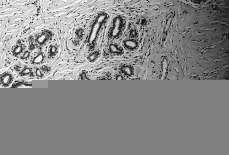
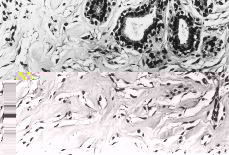
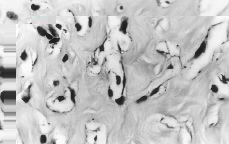
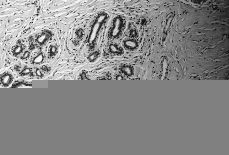
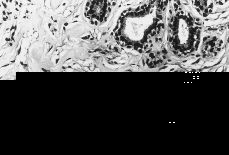
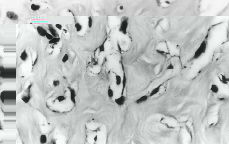
En las tres tumoraciones se observó una proliferación estromal, con áreas de colagenización densa, destacando la presencia de numerosas hendiduras irregulares, aisladas o interconectadas entre sí en pequeñas redes, afectando al estroma inter e intralobular (Fig. 3). Estos espacios carecían de contenido y estaban limitados por células aplanadas, de núcleo alargado, sin atipia destacable ni mitosis (Figs. 4 y 5). No se demostró presencia de membrana basal, fibras elásticas o de reticulina subyacentemente a dichas células, al ser negativas, respectivamente, las tinciones de PAS, orceína y Gomori.
En cuanto al epitelio glandular, aparecía conservado en todos los casos, existiendo en los tres discreta hiperplasia lobulillar, metaplasia apocrina focal y presencia de algunos quistes. En el caso 2 se observó leve epiteliosis y, en la mama adyacente a la tumoración cambios fibroquísticos floridos.
Se realizó estudio inmunohistoquímico en el caso 1. Las células que limitaban las hendiduras mostraron reactividad únicamente para vimentina, siendo negativas las citoqueratinas de peso molecular alto, intermedio y bajo (respectivamente, CK 903, AE3, CAM 5.2), antígeno asociado al Factor VIII, actina músculo específica y CD 34. No se observó en estas células expresión de receptores de estrógenos, ps2 (proteína relacionada con estrógenos) ni de receptores de progesterona.
Evolución
Tras un tiempo de seguimiento de 12 meses (caso 1) y nueve meses (casos 2 y 3), no se ha detectado recidiva de las lesiones.
Figura 1.La mamografía muestra una tumoración bien delimitada, de 6 cm de diámetro, sin calcificaciones (caso 1).
Figura 2.En la pieza de resección se observa, al corte, una tumoración (flecha) ovoidea, de 1,8 cm, blanquecina y con áreas quísticas (caso 2).
Figura 3.Red de hendiduras irregulares anastomosadas entre sí en el estroma inter (derecha) e intralobular (izquierda) (H-E, 40x).
Figura 4.Estroma colagenizado que muestra numerosas hendiduras vacías de contenido y limitadas por células fusiformes (H-E, 200x).
Figura 5.Las células que revisten los espacios pseudovasculares muestran núcleo alargado y monótono, sin rasgos de atipia (H-E, 400x).
DISCUSIÓN
La HPEM fue descrita por primera vez en 1986 por Vuitch y cols. (1) en nueve pacientes premenopáusicas, como una proliferación benigna del estroma de la mama con una morfología microscópica peculiar: un patrón complejo de hendiduras «pseudovasculares» anastomosadas entre sí, que planteaba el diagnóstico diferencial con un angiosarcoma de bajo grado (de hecho, éste había sido el diagnóstico inicial en cuatro de los nueve casos de la serie comunicada por dichos autores).
En un principio se consideró una lesión infrecuente(1), pero en los últimos años se han ido aportando nuevas series (2-6), y es muy probable que en la práctica diaria los cambios histológicos sean pasados por alto por el patólogo en gran parte de los casos, por lo que la incidencia real de la entidad se encontraría subestimada.
Los casos comunicados en la literatura ocurrieron en mujeres pre y postmenopáusicas, con una edad comprendida entre 14 y 67 años (1-6), siendo la edad media de 37 años en la serie más amplia, de 40 casos, de Powell y cols.(5).
En general, la presentación clínica fue como una masa palpable, bien delimitada, unilateral y no dolorosa, con un diámetro máximo comprendido entre 1 y 12 cm (1-6), con una media de 6 cm en la mencionada serie de Powell(5).
En cuanto a la radiología de la HPEM, se trata habitualmente de una masa parcial o totalmente circunscrita y sin calcificaciones en la mamografía, que es hipoecoica y ligeramente heterogénea en el estudio ecográfico(6,7). Estas características son inespecíficas y no permiten un diagnóstico radiológico de certeza, pero pueden ser de utilidad al patólogo en biopsias de pequeño tamaño de la lesión, como las obtenidas por aguja.
Los hallazgos clínicos y radiológicos conducen generalmente a un diagnóstico preoperatorio de fibroadenoma (1-6).
Macroscópicamente (1-6), la lesión aparece generalmente bien delimitada, aunque no encapsulada, y es de consistencia firme y coloración que se describe como blanquecina, rosada o amarillenta. Al corte, presenta una textura rugosa y se puede observar en algunos casos un patrón nodular o fasciculado. No son propios de esta lesión cambios de necrosis o hemorragia. En ocasiones se evidencian áreas quísticas.
El aspecto microscópico de la HPEM resulta muy característico (1-6): el estroma mamario presenta una red compleja de numerosas hendiduras irregulares, anastomosadas entre sí, «revestidas» por células fusiformes que simulan un endotelio vascular, sin presencia de células sanguíneas dentro de las pseudoluces. Estos cambios afectan al estroma intra e interlobular y se acompañan de hialinización del colágeno. Las células que limitan las hendiduras no muestran mitosis ni signos de atipia severa, y sólo en algunos casos se describe leve atipia o multinucleación (2,4,8).
Este cuadro histológico es idéntico en tejido fijado en formol y en material congelado (1,4), y no es, por tanto, un artefacto producto del medio de fijación.
El epitelio de ductos y dúctulo-acinos incluidos en la lesión es respetado y aparece normal o con discretos cambios de hiperplasia, metaplasia apocrina, formación de quistes y proliferación mioepitelial (2). En alguna ocasión se han observado ductos comprimidos por el estroma similares a los típicos de los fibroadenomas (1). No se ha encontrado atipia epitelial en ninguno de los casos comunicados (1-6).
Con respecto a la inmunohistoquímica, las células que limitan las hendiduras estromales son negativas para Factor VIII, Ulex Europaeus, citoqueratinas y
S-100, mostrando positividad únicamente para vimentina (1). Recientemente se han comunicado casos con reactividad para CD 34, actina musculoespecífica y, menos frecuentemente, para desmina (5).
El estudio de microscopía electrónica demuestra un citoplasma con abundante retículo endoplásmico rugoso y aparato de Golgi prominente. No se observan cuerpos de Weibel-Palade, vesículas pinocitóticas u otros rasgos propios de células endoteliales. Tampoco se evidencian uniones intercelulares, filamentos finos intracitoplasmáticos o membrana basal (1,2,4).
En definitiva, los hallazgos inmunohistoquímicos y ultraestructurales indican que las células que limitan las hendiduras no son endoteliales, sino que corresponden a fibroblastos (miofibroblastos).
Recientemente se ha descrito una variante histológica de HPEM, «proliferativa» o «celular», caracteriza-da por una mayor celularidad estromal, incluso con
áreas en las que las células se disponen en un patrón fascicular desapareciendo las pseudoluces (5). En estas lesiones coexisten otras zonas donde se reconocen los cambios propios de HPEM «clásica».
Cabe destacar que cambios microscópicos focales de HPEM se pueden observar incidentalmente en cualquier biopsia de mama. En la serie de Ibrahim et al se describen en el 23% de los casos en una serie correlativa de 200 mamas biopsiadas por diferentes causas (2). Estos autores consideran la HPEM como un espectro clinicopatológico que se extendería desde cambios microscópicos insignificantes y sin repercusión clínica alguna hasta aquellos casos en que se produce masa tumoral (2).
Se han observado asimismo cambios de HPEM en el varón, prácticamente todos en casos de ginecomastia (2,4,8,9). Badve y Sloane los encontraron en 44 casos (47,4%) de una serie de 93 mamas masculinas, correspondiendo todos ellos excepto uno a ginecomastias, siempre en estadio histológico de evolución precoz o intermedio (8). Por otra parte, se ha comunicado un caso de crecimiento rápido de una lesión axilar de HPEM en un varón inmunodeprimido que presentaba ginecomastia(9).
El aspecto microscópico de la HPEM puede llevar a un diagnóstico erróneo de angiosarcoma (1). La distinción entre ambas entidades es de gran trascendencia por las diferencias que existen en cuanto al manejo terapéutico. Se han señalado diferentes datos anatomopatológicos útiles para dicho diagnóstico diferencial. Macroscópicamente, la HPEM recuerda a un fibroadenoma y no presenta hemorragia o necrosis (1,2,4). En cuanto a la histología (1,2,4,5), en la HPEM la proliferación pseudovascular se dispone con una peculiar distribución lobulocéntrica, no se acompaña de atrofia o destrucción acinar, ni invade el tejido adiposo adyacente. No se observa crecimiento micropapilar dentro de las hendiduras y estas pseudoluces no contienen células sanguíneas. Por otra parte las células que limitan los espacios no muestran pleomorfismo o hipercromasia nuclear destacables y no se observan mitosis. Estas características sí se producen, en cambio, en el angiosarcoma, en el que además pueden coexistir áreas sólidas de aspecto francamente sarcomatoso (10,11).
La variante celular de HPEM plantea el diagnóstico diferencial con lesiones mamarias caracterizadas por una celularidad incrementada en el estroma, como tumor filodes o miofibroblastoma. Con respecto al primero, diferencia a la HPEM el patrón fascicular de crecimiento, la ausencia de pleomorfismo o mitosis en las células estromales, y la inexistencia de componente epitelial con patrón característico del tumor filodes (5). La coexistencia de focos de HPEM «clásica» ayuda asimismo al diagnóstico. Aunque áreas celulares de HPEM pueden simular un miofibroblastoma, no se observará el patrón típico de esta lesión, de celularidad fusiforme densa dispuesta en fascículos que se entremezclan con gruesas bandas de colágeno (5,12).
Con respecto a la posible aportación de la PAAF (punción aspiración con aguja fina) al diagnóstico de la HPEM, no existe gran experiencia y en la literatura no hemos encontrado ningún caso con descripción del cuadro citológico (1-6). Sólo uno de nuestros casos fue puncionado, pero la celularidad obtenida fue muy escasa como para considerarla absolutamente representativa de la lesión, y correspondió a aisladas células epiteliales y del estroma.
La naturaleza exacta de la HPEM es discutida y se la ha caracterizado como hamartoma o hiperplasia, y recientemente, como un tumor benigno del estroma de la mama con diferenciación miofibroblástica (5).
La etiopatogenia de esta entidad es desconocida. Como ya hemos señalado, los hallazgos de inmunohistoquímica y microscopía electrónica indican que el miofibroblasto juega un papel esencial en la misma: la lesión consistiría en una proliferación estromal con aumento de miofibroblastos y disrupción y separación del colágeno, originándose, como artefacto, las hendiduras «pseudovasculares» (1,5).
Existen numerosos datos que sustentan la hipótesis de un mecanismo hormonal en el desarrollo de la HPEM. La lesión es mucho más frecuente antes de la menopausia [100% de los nueve casos de Vuitch y cols. (1) y 90% de las 40 pacientes de Powell y cols. (5)] y algunas de las pacientes postmenopáusicas estaban recibiendo tratamiento hormonal sustitutivo (5). Por otra parte la elevada incidencia de HPEM en casos de ginecomastia (9) sugiere también que la lesión se produciría como respuesta a una situación de estimulación hormonal.
Tradicionalmente se ha dividido el estroma de la mama en un componente intralobular, hormonalmente sensible, y una porción interlobular, que sería relativamente refractaria al estímulo hormonal (1,5,13,14). El estroma lobular y el epitelio muestran variaciones histológicas a lo largo del ciclo menstrual. La similitud microscópica del estroma en la HPEM con los cambios fisiológicos observados en el estroma mamario normal durante la fase luteínica del ciclo (13,14), sugiere que la HPEM se puede originar como una respuesta exagerada a la progesterona por parte de un tejido previamente sometido a la acción estrogénica (1). Esta hipótesis se vio apoyada por el hallazgo de una intensa inmunorreactividad para anticuerpos anti-receptores de progesterona en células estromales en casos de HPEM(3).
En definitiva, es posible que la HPEM comience como una exageración focal de los cambios lobulillares asociados con el ciclo menstrual, la cual es observable al microscopio de forma incidental en un cierto número de mamas. En ocasiones alguno de esos focos se «escapa» al control fisiológico y no sigue el ciclo con el resto de la mama, sino que adquiere la capacidad de proliferación miofibroblástica independiente dando lugar a un tumor palpable (5).
El tratamiento recomendado para esta lesión es
la excisión quirúrgica simple. En la serie de 40 ca-
sos de Powell et al, con un tiempo de seguimiento de 0,6-11 años (media= 4,5 años), se produjeron seis recurrencias (cinco homolaterales, dos contralatera-
les) (5). En general la recidiva se relaciona con una resección incompleta de la masa (1). En nuestra serie no se han producido recidivas, aunque cabe señalar la posibilidad de que uno de nuestros casos (n.° 3) constituya ya una recurrencia de una lesión extirpada en otro centro en la misma localización anatómica tres años antes, que se diagnosticó de fibroadenoma, cuya histología no hemos podido revisar retrospectivamente.
Cuando la lesión es difusa, si se han producido múltiples recurrencias o en tumoraciones de gran celularidad y/o difícil diagnóstico anatomopatológico, puede ser necesario un tratamiento más agresivo, como una mastectomía (5).
BIBLIOGRAFÍA
1 Vuitch MF, Rosen PP, Erlandson RA. Pseudoangiomatous hyperplasia of mammary stroma. Hum Pathol 1986;17:185-91.
2 Ibrahim RE, Sciotto CG, Weidner N. Pseudoangiomatous hyperplasia of mammary stroma: some observations regarding its clinicopathologic spectrum. Cancer 1989;63:1154-60.
3 Anderson C, Ricci A, Pedersen CA, Cartun RW. Immunocytochemical analysis of estrogen and progesterone receptors in benign stromal lesions of the breast: evidence for hormonal etiology in pseudoangiomatous hyperplasia of mammary stroma. Am J Surg Pathol 1991;15:145-9.
4 Ortiz-Rey JA, Alvarez A, Valbuena L, Arnal FM. Pseudoangiomatous hyperplasia of mammary stroma. Breast Dis 1995;8:295-9.
5 Powell CM, Cranor ML, Rosen PP. Pseudoangiomatous stromal hyperplasia (PASH). A mammary stromal tumor with myofibroblastic differentiation. Am J Surg Pathol 1995;19:270-7.
6 Polger MR, Denison CM, Lester S, Meyer JE. Pseudoangiomatous stromal hyperplasia: mamographic and sonographic appearances. AJR 1996;166:349-52.
7 Cohen MA, Morris EA, Rosen PP, Dershaw DD, Libermam L, Abramson AF. Pseudoangiomatous stromal hyperplasia: mammographic, sonographic, and clinical patterns. Radiology 1996; 198:117-20.
8 Badve S, Sloane JP. Pseudoangiomatous hyperplasia of male breast. Histopathology 1995;26:463-6.
9 Seidman JD, Borkowski A, Aisner SC, Sun CC. Rapid growth of pseudoangiomatous hyperplasia of mammary stroma in axillary gynecomastia in an immunosuppressed patient. Arch Pathol Lab Med 1993;117:736-8.
10 Donnell RM, Rosen PP, Lieberman PH y cols. Angiosarcoma and other vascular tumors of the breast: pathologic analysis as a guide to prognosis. Am J Surg Pathol 1981;5:629-42.
11 Hunter TB, Martin PM, Dietzen CD y cols. Angiosarcoma of the breast. Two case reports and review of literature. Cancer 1985; 56:2099-106.
12 Wargotz ES, Weiss SW, Norris HJ. Myofibroblastoma of the
breast. Sixteen cases of a distinctive benign mesenchymal tumor. Am J Surg Pathol 1987;11:493-502.
13 Vogel PM, Georgiade NG, Fetter BF y cols. The correlation of histologic changes in the human breast with the menstrual cycle. Am J Pathol 1981;104:23-34.
14 Longacre TA, Bartow SA. A correlative morphologic study of human breast and endometrium in the menstrual cycle. Am J Surg Pathol 1986;10:382-93.