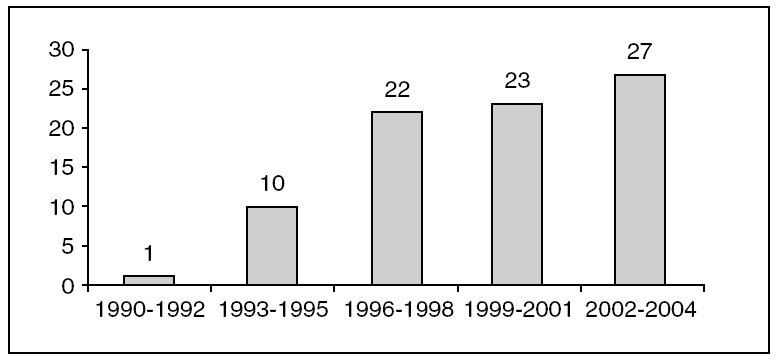INTRODUCCION
El interés por el estudio del carcinoma intraductal de mama ha aumentado considerablemente, debido al incremento en su detección como consecuencia del cribado poblacional realizado mediante mamografía.
El carcinoma intraductal se caracteriza por la proliferación de células epiteliales malignas en la unidad terminal ductoalveolar, que permanecen confinadas en su interior sin que haya evidencia de invasión microscópica del estroma por fuera de la membrana basal. Por tanto, al ser lesiones no infiltrantes, no presentan capacidad metastásica. Esta característica plantea que la exéresis quirúrgica de la lesión pueda tener, en teoría, un carácter curativo, lo que abre un amplio debate sobre el manejo y el tratamiento quirúrgico y complementario más adecuado.
En este artículo mostraremos la experiencia clínica y patológica de los carcinomas intraductales recogidos en nuestro hospital durante los últimos 15 años. Analizaremos la incidencia y las formas de presentación clínica, así como el manejo terapéutico y la evolución de la enfermedad.
SUJETOS Y MÉTODO
Se revisaron más de doscientas historias clínicas de pacientes que estaban codificadas con el diagnóstico de carcinoma ductal in situ (CDIS) entre el 1 de enero de 1990 y el 31 de diciembre de 2004 en el Hospital Universitario Son Dureta. Sin embargo, sólo 83 casos fueron finalmente seleccionados. En la mayoría de los casos rechazados, la anatomía patológica reveló la presencia de focos de microinvasión estromal. En otros casos, las pacientes no completaron el tratamiento en nuestro servicio, o bien el diagnóstico se había realizado en otro centro y no pudimos acceder al informe histológico.
Se recogieron para su estudio los datos demográficos (edad y antecedentes), clínicos (sintomatología, método diagnóstico y tratamiento) y de seguimiento (recidivas y fecha y estado de la paciente en el último control).
Se realizó un estudio descriptivo retrospectivo mediante la revisión de las historias clínicas, y para el manejo de los datos se introdujo la información en el programa Filemaker Pro 5.5.
Se describieron los casos resumiendo las variables cualitativas con porcentajes, y la variable cuantitativa «meses de seguimiento» con la media y la desviación estándar.
RESULTADOS
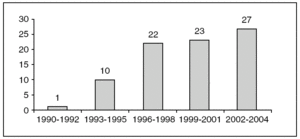
La incidencia del carcinoma intraductal corresponde en nuestra serie al 3,5% (83 de 2.365) del total de los cánceres de mama diagnosticados en nuestro hospital. En la figura 1 se representa la distribución de los casos según los años en el momento del diagnóstico.
Figura 1. Distribución de casos según los años del diagnóstico.
La edad mínima al diagnóstico fue de 30 años y la máxima de 77. El 57% (47 de 83) de las pacientes tenían edades comprendidas entre 50 y 64 años, que coincide con la franja de edad en la que se realiza el cribado poblacional (Programa de Detección Precoz de Cáncer de Mama [PDPCM]).
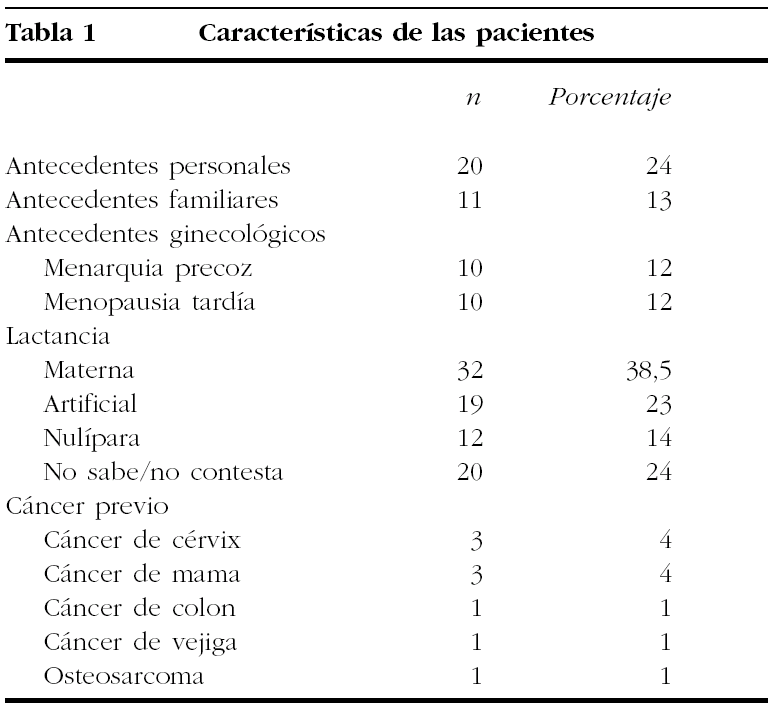
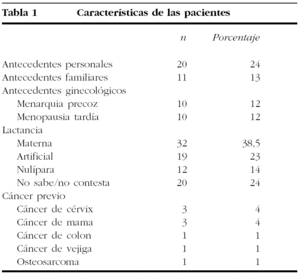
En este estudio consideramos como antecedentes personales relevantes la cirugía mamaria previa, y como antecedentes familiares de interés la existencia de un familiar de primer grado (madre, hermana o hija) con carcinoma de mama o de ovario. Recogimos, además, el diagnóstico previo de cualquier tipo de cáncer en la paciente, y si dieron o no lactancia materna al menos durante 4 meses. En cuanto a los antecedentes ginecológicos, consideramos que una menarquia es precoz cuando aparece a los 10 años o antes, y menopausia tardía a partir de los 53 años. Los resultados se presentan en la tabla 1.
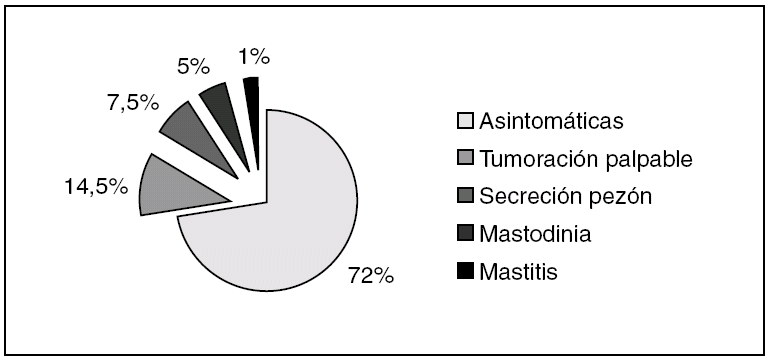
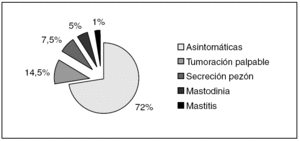
En cuanto a la forma de presentación clínica, en 60 casos (72%) las pacientes estaban asintomáticas y presentaron alguna imagen sospechosa en la mamografía, más frecuentemente microcalcificaciones. El resto (23 de 83) presentó lesiones sintomáticas (fig. 2).
Figura 2.Formas de presentación clínica del carcinoma ductal in situ.
Se realizaron para el diagnóstico un total de 62 biopsias con arpón (75%), aunque en muchos casos estas intervenciones fueron también terapéuticas, ya que en la mayoría de los casos, al estar las pacientes asintomáticas, las lesiones no eran palpables. En las lesiones palpables se realizaron 16 tumorectomías (19%) y 5 biopsias (6%), de las que 4 fueron intraoperatorias y en un caso biopsia Trucut®.
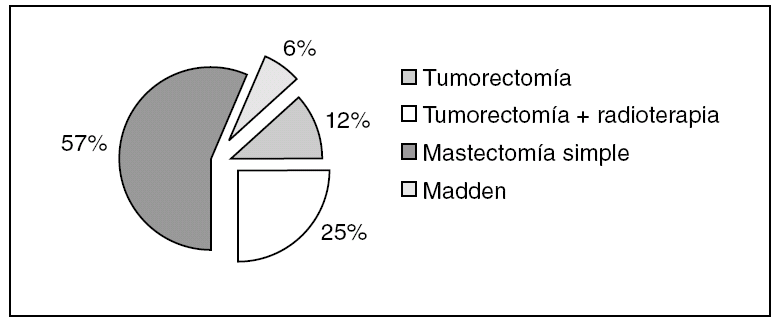
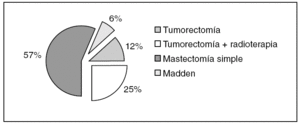
El tratamiento quirúrgico definitivo se realizó en una sola intervención en el 22% (18 de 83) de los casos. En el resto, el 78% (65 de 83) de los casos, se realizaron al menos 2 intervenciones quirúrgicas. En muchos de estos casos la afección de los márgenes obligó a realizar la nueva cirugía, pero en muchos otros, a pesar de tener márgenes libres, fue la paciente quien decidió someterse a una cirugía más radical, por miedo o por evitar la radioterapia. En definitiva, se realizó cirugía conservadora en 31 casos (37%), y de éstos, 21 pacientes recibieron radioterapia adicional. En el 57% de los casos (n = 47) se hicieron mastectomías simples, y en 5 casos (6%) se realizó un vaciamiento axilar, sin evidencia de metástasis en ninguno de ellos (fig. 3).
Figura 3. Distribución de casos según el tratamiento realizado.
Los márgenes de resección estaban afectados en 42 casos de 80 (52,5%) en la primera intervención quirúrgica, lo que obligó a realizar una nueva intervención. En 31 de los 42 casos se realizó como segunda intervención una mastectomía, y el resto optó por la ampliación de la tumorectomía previa. Para la valoración de los márgenes excluimos a 3 pacientes, en las que se realizó como primera intervención una mastectomía tras el diagnóstico por biopsia intraoperatoria o Trucut®, por lo que no pudo realizarse dicha valoración.
El grado histológico más frecuente fue el G3, con ausencia de diferenciación celular o presencia de focos de necrosis, hallado en 48 de los 83 casos (58%). Dieciséis casos presentaron grado nuclear 2 (19%) y 19 casos un grado nuclear 1 (23%). En cuanto al tamaño tumoral, 64 tumores medían 2,5 cm o menos, y 19 más de 2,5 cm.
El seguimiento medio de las pacientes (media ± desviación estándar) fue de 85 ± 48 meses.
Se detectó un total de 3 recidivas en los 83 casos (4%): una recidiva local, una regional y una a distancia.
La paciente con recidiva local presentó una imagen estrellada en una mamografía de control 4 años después de la cirugía conservadora sin radioterapia, correspondiente a un carcinoma intraductal de gran tamaño tumoral, aunque de bajo grado nuclear, y con márgenes de resección libres. La reextirpación evidenció un carcinoma intraductal, y la paciente ha presentado normalidad mamográfica 2 años después.
La recidiva regional apareció en una paciente mastectomizada 3 años antes por un carcinoma intraductal de alto grado nuclear. Tras la autoexploración de una adenopatía axilar en el mismo lado, la biopsia confirmó la infiltración por carcinoma de alto grado nuclear. Se realizó un vaciamiento axilar y se obtuvieron 3 ganglios afectados de los 5 aislados. El estudio de extensión fue negativo y la paciente está libre de enfermedad 2 años después.
El último caso es el de una paciente con cáncer de cérvix, diagnosticada de carcinoma intraductal de alto grado nuclear 5 años después del primer diagnóstico. Se realizó una tumorectomía, cuyos márgenes de resección estaban parcialmente afectados, y recibió radioterapia adicional. Tres años después, aparecieron metástasis en el hilio pulmonar, y el análisis con citoqueratinas reveló que eran positivas para mama. La paciente inició tratamiento quimioterápico, que redujo las adenopatías hiliares, y sigue los controles de su enfermedad desde hace 4 años.
Consideramos una supervivencia a día de hoy del 100%, puesto que hemos registrado solamente una muerte por una enfermedad intercurrente.
DISCUSION
La incidencia del carcinoma intraductal de mama ha ido en progresivo aumento como consecuencia del cribado poblacional realizado mediante mamografía1. En nuestra serie, la aparición de casos aumenta a partir del año 1999, coincidiendo con la puesta en marcha en Mallorca del PDPCM.
La mamografía de cribado diagnostica tumores con tamaños muy reducidos2, que pasan inadvertidos a la palpación mamaria, y el diagnóstico de estas lesiones no palpables es el que plantea una mayor complejidad. En estos casos, la localización de la lesión requiere un marcado preoperatorio mediante control mamográfico, y la confirmación de la extirpación de la lesión mediante radiografía de la pieza quirúrgica3. Aun así, será sólo el estudio final de todos los márgenes de la pieza en el material fijado y parafinado el que nos establecerá el diagnóstico definitivo del estado de los márgenes de resección. En nuestro estudio, para el diagnóstico de dichas lesiones, hemos realizado en todos los casos una biopsia guiada con arpón. Conseguir que la biopsia sea a la vez diagnóstica y terapéutica depende fundamentalmente de realizar una amplia resección de la zona para obtener márgenes libres y, a ser posible, en una sola pieza, puesto que la valoración de los márgenes es muy dificultosa cuando la pieza quirúrgica está fragmentada.
En cuanto al tratamiento, podemos decir que en nuestra serie fue a partir del año 1995 cuando se comenzaron a protocolizar los tratamientos quirúrgicos, tras las recomendaciones dadas en la 2.a Reunión de Consenso de la European Organisation for Research and Treatment of Cancer (EORTC), celebrada en septiembre de 19914.
El vaciamiento axilar sistemático no está indicado en el tratamiento del carcinoma intraductal, ya que la incidencia de metástasis axilares publicada en distintas series es prácticamente nula5,6. En 5 de nuestros casos se realizó un vaciamiento axilar. Cuatro de ellos se realizaron antes de 1995. En el único caso registrado después de ese año la indicación fue la correcta, pero en la hoja operatoria consta que en la exploración axilar se palparon varias adenopatías y se decidió realizarlo. En todos estos casos, la anatomía patológica confirmó la ausencia de metástasis en los ganglios.
La radioterapia es imprescindible como tratamiento complementario a la cirugía conservadora, ya que disminuye el riesgo de recidiva en un 50% o más7. Diversos ensayos clínicos aleatorizados han demostrado que la irradiación de la mama tras la escisión con márgenes libres de un CDIS disminuye los índices de recurrencia sin afectar la supervivencia global8. En nuestra serie, sólo en 21 casos de los 31 a los que se les realizó tratamiento conservador, se aplicó radioterapia adyuvante. En los 10 casos restantes, la paciente optó por el seguimiento clínico, a pesar de contar en varios casos con márgenes libres pero inadecuados.
Un ensayo publicado por el Nacional Surgical Adjuvant Breast Projet B-24 (NSABP B-24), demostró además los beneficios del tamoxifeno en mujeres con CDIS tras cirugía conservadora y radioterapia9. El análisis retrospectivo de la expresión de receptores estrogénicos demostró que el tamoxifeno es beneficioso, en términos de reducción de riesgo tanto de cáncer de mama ipsolateral como contralateral, en las pacientes con receptores hormonales positivos10.
En la actualidad, el índice pronóstico más aceptado en relación con las recidivas es el denominado «índice de Van Nuys», diseñado por Silverstein et al11,12, el cual conlleva también la toma de decisiones terapéuticas. Este índice se obtiene valorando el tamaño tumoral, el grado histológico de la lesión y el estado de los márgenes de resección. En los casos de buen pronóstico se propone la tumorectomía, en los de pronóstico intermedio se añade a la exéresis la radioterapia, y en los casos de mal pronóstico se propone la mastectomía simple.
La mayoría de las recidivas del carcinoma intraductal de mama se produce después de la cirugía conservadora, y los márgenes de resección escasos son la principal causa de recidiva en la mayoría de los estudios publicados13. Aproximadamente, el 50% de las recidivas ocurre durante los primeros 5 años, la mayoría de ellas como carcinomas intraductales de alto grado, y las restantes entre los 5 y los 10 años de seguimiento14. En las lesiones tratadas con cirugía y radioterapia, el índice de recidiva a los 10 años oscila entre el 4 y el 7% si los márgenes son negativos, mientras que alcanza el 29% cuando los márgenes son positivos15. Sin embargo, la definición de un margen negativo no está claramente establecida en estos casos. Hay un consenso global de que los márgenes superiores a 10 mm son claramente negativos, y que los menores de 1 mm son inadecuados, pero no así para los márgenes intermedios. Como ya se ha descrito en el apartado de resultados, en 2 casos de nuestra serie observamos recidiva del CDIS tras cirugía conservadora. Uno de los casos era un tumor de bajo grado nuclear con márgenes libres tras la tumorectomía, que no recibió radioterapia adicional. En el otro caso, el tumor era de alto grado nuclear con márgenes de resección focalmente afectados, que recibió radioterapia adicional. En ambos casos la recidiva apareció en los primeros 5 años.
La incidencia de recidivas del carcinoma intraductal después de la mastectomía oscila en la literatura médica entre el 3 y el 7% a los 5 años13. Estas recidivas pueden ser locales, regionales o a distancia, y deberse a la presencia de tejido mamario residual posmastectomía, a partir del cual puede originarse un carcinoma, o a la presencia de focos de microinvasión que no han sido detectados en el momento del diagnóstico en carcinomas intraductales de gran tamaño16. En nuestra serie, tal como hemos descrito en el apartado de resultados, sólo en un caso se observó una infiltración por carcinoma en una adenopatía axilar 3 años después de la mastectomía. El tumor primario medía más de 2,5 cm.
La incidencia de carcinoma contralateral en pacientes con CDIS oscila entre el 0,6 y el 6%17. Un estudio indica un riesgo relativo de cáncer contralateral 3 veces mayor en pacientes con carcinoma intraductal, que es del 60% durante el primer año de seguimiento17. Nosotros hemos registrado la aparición de carcinoma contralateral en 5 casos (6%), 2 de los cuales fueron carcinomas intraductales, y 3 carcinomas ductales infiltrantes. Sólo un caso se diagnosticó durante el primer año de seguimiento, el resto fue diagnosticado más de 3 años después del primer diagnóstico.
Por último, cabe concluir que el manejo de esta enfermedad hace recomendable un trabajo multidisciplinario bien coordinado, que pasará idealmente por la creación de unidades de patología mamaria. Además, puesto que las opciones de tratamiento disponibles son complejas y variadas, la elección final debe ser el resultado de un consenso entre el médico y su paciente.
Correspondencia:
Dra. M. Febles Borges.
Capitán Salom, 2, Esc. E, 2.o A. 07004 Palma de Mallorca.
Islas Baleares. España.
Correo electrónico: mfeblesb@hotmail.com
Fecha de recepción: 22/8/2006.
Aceptado para su publicación: 12/12/2006.