Comparar las concentraciones de interleucina-17 en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó a un total de 100 pacientes. Se incluyó a 50 pacientes preeclámpticas como grupo de estudio (grupo A) y un grupo control seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio, que consistió en 50 embarazadas normotensas sanas (grupo B). Las muestras de sangre se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo A para determinar las concentraciones de interleucina-17.
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, la edad gestacional y el índice de masa corporal al momento de la toma de la muestra (p = NS). Se encontraron diferencias estadísticamente significativa en las concentraciones de interleucina-17 entre las pacientes en el grupo de estudio (grupo A; 6,0±0,9 pg/ml) y las pacientes del grupo control (grupo B; 3,9±1,0 pg/ml; p<0,05). Se observó una correlación significativa con los valores de presión arterial sistólica (r=0,232; p<0,05) y con los valores de presión arterial diastólica (r=0,181; p<0,05) en las pacientes del grupo A.
ConclusionesLas pacientes preeclámpticas presentaron concentraciones significativamente más altas de interleucina-17 al compararlas con embarazadas normotensas sanas.
To compare concentrations of interleukin-17 in preeclamptic and healthy normotensive pregnant women.
MethodA total of 100 patients were selected. Fifty preeclamptic patients were selected as the study group (group A) and 50 healthy normotensive pregnant women, with a similar age and body mass index as the study group, were selected as controls (group B). To determine interleukin-17 concentrations, blood samples were collected in all patients before labor and immediately after diagnosis in group A.
ResultsThere were no significant differences in relation to maternal age, gestational age or body mass index at sample extraction (p=ns). Statistically significant differences were found in interleukin-17 concentrations between patients in the study group (group A; 6.0 +/- 0.9 pg/ml) and patients in the control group (group B; 3.9 +/- 1.0 pg/ml; p<0.05). There was a significant correlation with values of systolic blood pressure (r=0.232; p < 0.05) and diastolic blood pressure (r=0.181; p<0.05) in group A.
ConclusionsInterleukin-17 values were significantly higher in preeclamptic patients than in healthy normotensive pregnant women.
La preeclampsia es un síndrome relativamente común e impredecible en su aparición y progresión. No existe tratamiento excepto la culminación del embarazo y es una causa importante de morbilidad y mortalidad materna y fetal1. Se ha estimado que afecta del 3 al 8% de todas las nulíparas2. A pesar de las mejoras en el cuidado prenatal y los grandes esfuerzos para identificar los mecanismos y las moléculas que inducen la aparición del síndrome, no se ha identificado algún factor etiológico específico. Se considera que es el resultado de la combinación de factores inmunológicos, ambientales y genéticos que llevan a la alteración de la invasión trofoblástica normal y de la remodelación de las arterias espirales3,4.
Los diferentes hallazgos epidemiológicos apuntan hacia la etiología inmunitaria de la preeclampsia. Existe una creciente evidencia que el embarazo es un estado proinflamatorio y que la preeclampsia es una exageración de esta respuesta1,5. Los resultados de investigaciones clínicas y experimentales han demostrado que el aumento en la respuesta inflamatoria relacionada a la inmunidad Th1 y la disminución en la respuesta antiinflamatoria de las citocinas Th2 están asociados a la aparición de enfermedades cardiovasculares y la preeclampsia6-8.
La interleucina (IL)-17, el miembro prototipo de una emergente familia de citocinas, es una citocina proinflamatoria, producida por un subtipo de células T efectoras, denominadas Th179. Recientemente se ha descubierto que también es producida por monocitos, neutrófilos, basófilos y mastocitos10,11. Esta IL regula la producción de varias citocinas proinflamatorias, como el factor de necrosis tumoral alfa y la IL-1 beta por las células estromales-macrófagos y la producción del factor estimulante de colonias granulocitos-macrófagos12. Se ha reportado en diferentes estudios el papel de la IL-17 en las enfermedades autoinmunitarias e inflamatorias13; sin embargo, su participación en la patogénesis de la preeclampsia aún no ha sido adecuadamente investigada.
El objetivo de la investigación fue comparar las concentraciones de IL-17 en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó a un total de 100 pacientes. Se incluyó a 50 pacientes preeclámpticas como grupo de estudio (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio, que consistió en 50 embarazadas normotensas sanas sin factores de riesgo para el desarrollo de hipertensión durante el embarazo (grupo B). Todas las pacientes eran primigestas. El comité de ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente (antes de las 20 semanas), enfermedad cardiaca o renal, diabetes mellitus, hábito tabáquico, embarazo múltiple y tratamiento con medicamentos que puedan alterar las concentraciones de IL-17.
Las muestras de sangre (10ml) se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo A de la vena antecubital y se las dejó coagular a temperatura ambiente. Posteriormente, fueron centrifugadas a 1.000g por 15 min a los 60 min de tomada la muestra y almacenadas con posterioridad a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de la IL-17 en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 mediciones fue el resultado final. La sensibilidad fue de 2 pg/ml. El coeficiente de variación intra e interensayo fue menor del 6%.
Los valores obtenidos se presentaron como promedio ± desviación estándar. La prueba de la t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y para comparar las variables continuas. Los coeficientes de correlación entre la IL-17 y la presión arterial sistólica y diastólica en el grupo de pacientes preeclámpticas se evaluaron usando la prueba de Pearson. La precisión de la IL-17 para el diagnóstico de preeclampsia se presenta en función de la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
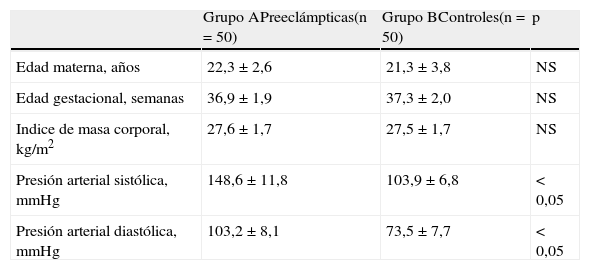
ResultadosLas características generales de los dos grupos de pacientes se muestran en la tabla 1. De las 50 pacientes del grupo A, 39 de ellas (78,0%) fueron catalogadas como preeclámpticas leves y 11 como preeclámpticas graves (22,0%). No se encontraron diferencias significativas con relación con la edad materna, la edad gestacional y el índice de masa corporal al momento de la toma de la muestra (p=NS). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Características generales
| Grupo APreeclámpticas(n=50) | Grupo BControles(n=50) | p | |
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | NS |
| Edad gestacional, semanas | 36,9±1,9 | 37,3±2,0 | NS |
| Indice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,7 | NS |
| Presión arterial sistólica, mmHg | 148,6±11,8 | 103,9±6,8 | < 0,05 |
| Presión arterial diastólica, mmHg | 103,2±8,1 | 73,5±7,7 | < 0,05 |
Valores promedio de IL-17: se encontraron diferencias estadísticamente significativas entre las pacientes en el grupo A (6,0 ± 0,9 pg/ml) y las pacientes del grupo B (3,9 ± 1,0 pg/ml; p<0,05). Al realizar la correlación entre las concentraciones de IL-17 y los valores de presión arterial en las pacientes preeclámpticas, se observó una correlación significativa con los valores de presión arterial sistólica (r=0,232; p<0,05) y con los valores de presión arterial diastólica (r=0,181; p<0,05).
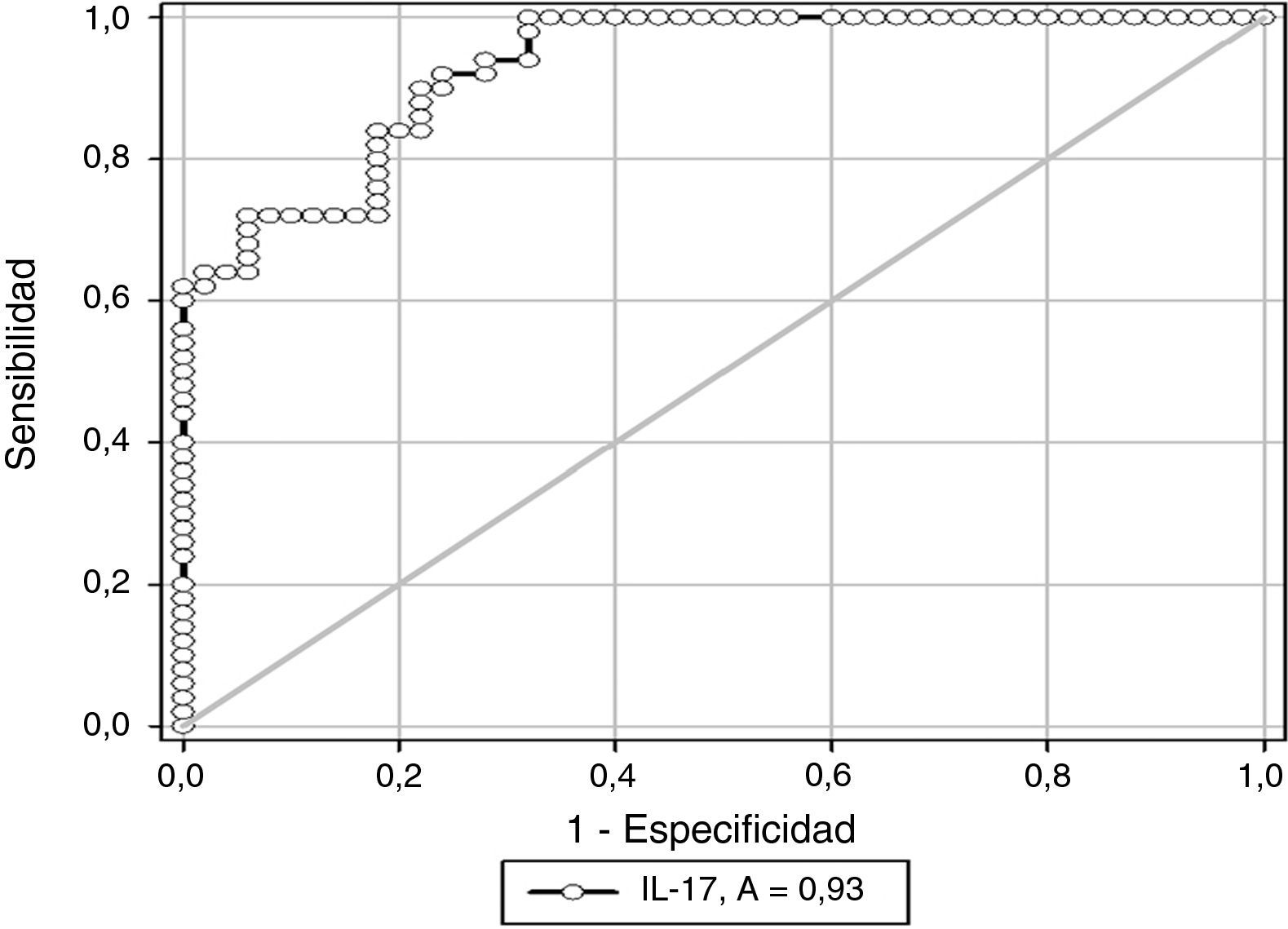
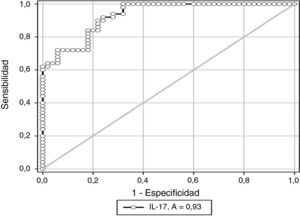
En la figura 1 se muestra la curva operador-receptor para la precisión de la IL-17 para el diagnóstico de preeclampsia. Un valor de corte de 5 pg/ml presentó un valor por debajo de la curva de 0,93 y tiene una sensibilidad del 80,0% (intervalo de confianza [IC] del 95%, 69,9-91,1), especificidad del 82,0% (IC del 95%, 71,4-92,7), valor predictivo positivo del 81,6% (IC del 95%, 70,7-92,4) y valor predictivo negativo del 80,3% (IC del 95%, 69,5-91,2) con una exactitud diagnóstica del 81,0%.
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente más altas de IL-17 en comparación con embarazadas normotensas sanas. Los hallazgos de esta investigación aportan evidencia de que esta IL está asociada con la preeclampsia. Estudios previos han enfatizado la importancia de la producción de IL-17 en la inducción de inflamación14.
Saito et al.15 han propuesto que la teoría de inflamación crónica, disfunción endotelial, alteración de la angiogénesis y alteraciones de la inmunomodulación en la fisiopatología de la preeclampsia pueden estar relacionadas con alteraciones en la diferenciación de las células T reguladoras y las células Th17. En la preeclampsia, diferentes moléculas producidas por las células endoteliales y el sinciciotrofoblasto pueden alterar la diferenciación de las células T reguladoras y la angiogénesis. Más aún, la producción de IL-1 beta e IL-6 por las células dendríticas y los monocitos puede promover la diferenciación de células T en células Th17 y aún la conversión de células T reguladoras en células Th17. El incremento de las células Th17 induciría la inflamación crónica que posteriormente produciría la disfunción endotelial15.
Las células Th17 producen la IL-17, que actúa como un mediador proinflamatorio a través de una variedad de mecanismos que incluyen: producción de factor de necrosis tumoral alfa, IL-1 e IL-6, al igual que las quimocinas CXCL1 y CXCL2, inducción de moléculas de adhesión como la molécula 1 de adhesión intercelular, estimulación de la producción de proteína C reactiva y óxido nítrico16,17. La IL-17 también media la quimiotaxis de neutrófilos y monocitos a los sitios de inflamación mediante la inducción de mediadores como la IL-8, molécula 1 quimioatrayente de los monocitos y proteína alfa relacionada al crecimiento9,16. Todos estos eventos también son observados en la preeclampsia1,8.
El papel preciso de la IL-17 en el desarrollo placentario no esta claro. Diferentes investigaciones han demostrado una expresión diferencial de IL-17 en subpoblaciones celulares de la placenta humana, sugiriendo que esta citocina podría desempeñar un papel regulador en el embarazo en humanos. Es conocido que esta citocina es un miembro de la familia de las citocinas proinflamatorias, las cuales están asociadas con la pérdida embrionaria o fetal18. Sin embargo, se han detectado patrones de producción idénticos en embarazos normales a término, abortos espontáneos y tejido placentario de embarazo molar19. Estudios previos han demostrado que se observa una elevación de las concentraciones de IL-17 en pacientes con rechazo agudo de transplante renales20, lo que sugiere que el incremento de las células Th17 en la decidua podría ser desventajoso para el mantenimiento del embarazo. Es improbable que esta citocina ejerza un efecto negativo en el desarrollo placentario aunque puede regular la producción de otras citocinas normalmente presentes en la interfase materno-fetal.
Honorati et al.21 demostraron que los fibroblastos tratados con IL-17 pueden aumentar la producción de factores angiogénicos. Debido a que el trofoblasto puede producir grandes cantidades de estas sustancias22,23, la producción de IL-17 puede tener un papel crucial en la regulación de moléculas activas producidas por el tejido uteroplacentario y, por lo tanto, controlar los procesos de angiogénesis asociados a la formación placentaria19. También se ha demostrado que incrementa la producción de la metaloproteinasa de la matriz 9 biológicamente activa, que es importante en la invasión del trofoblasto24,25.
Este es el primer informe sobre las concentraciones de IL-17 en el suero de preeclámpticas. La importancia de las citocinas proinflamatorias en la patogénesis de la preeclampsia se vuelve cada vez más evidente y los resultados de esta investigación demuestran los posibles efectos de esta IL, pero aún se deben realizar más investigaciones para aclarar el efecto de estas altas concentraciones sobre la inmunología de la preeclampsia.
Se concluye que las pacientes preeclámpticas presentaron concentraciones significativamente más altas de IL-17 al compararlas con embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.