Determinar si la HAM y el RFA pueden emplearse para predecir reserva ovárica.
Sujetos y métodosSe compara el RFA y los valores de la HAM en FIV/ICSI: bajas, normo y altas respondedoras, las primeras con fallos de TRA previos (un FIV/ICSI).
El RFA se llevó a cabo con US 3D con modos superficie, inverso y AVC.
ResultadosExistió correlación entre HAM y RFA. Ambos reflejan la reserva ovárica. Las diferencias entre normo y bajas respondedoras fueron significativas. RFA, HAM y edad mostraron ser los mejores parámetros.
Las diferencias entre normo y altas respondedoras fueron igualmente significativas, mostrando ser predictivos de hiperestimulación.
El grupo de número de ovocitos recuperados (≤5 vs >5) mostró ser predictivo de maduración, no de calidad embrionaria ni de pronóstico reproductivo.
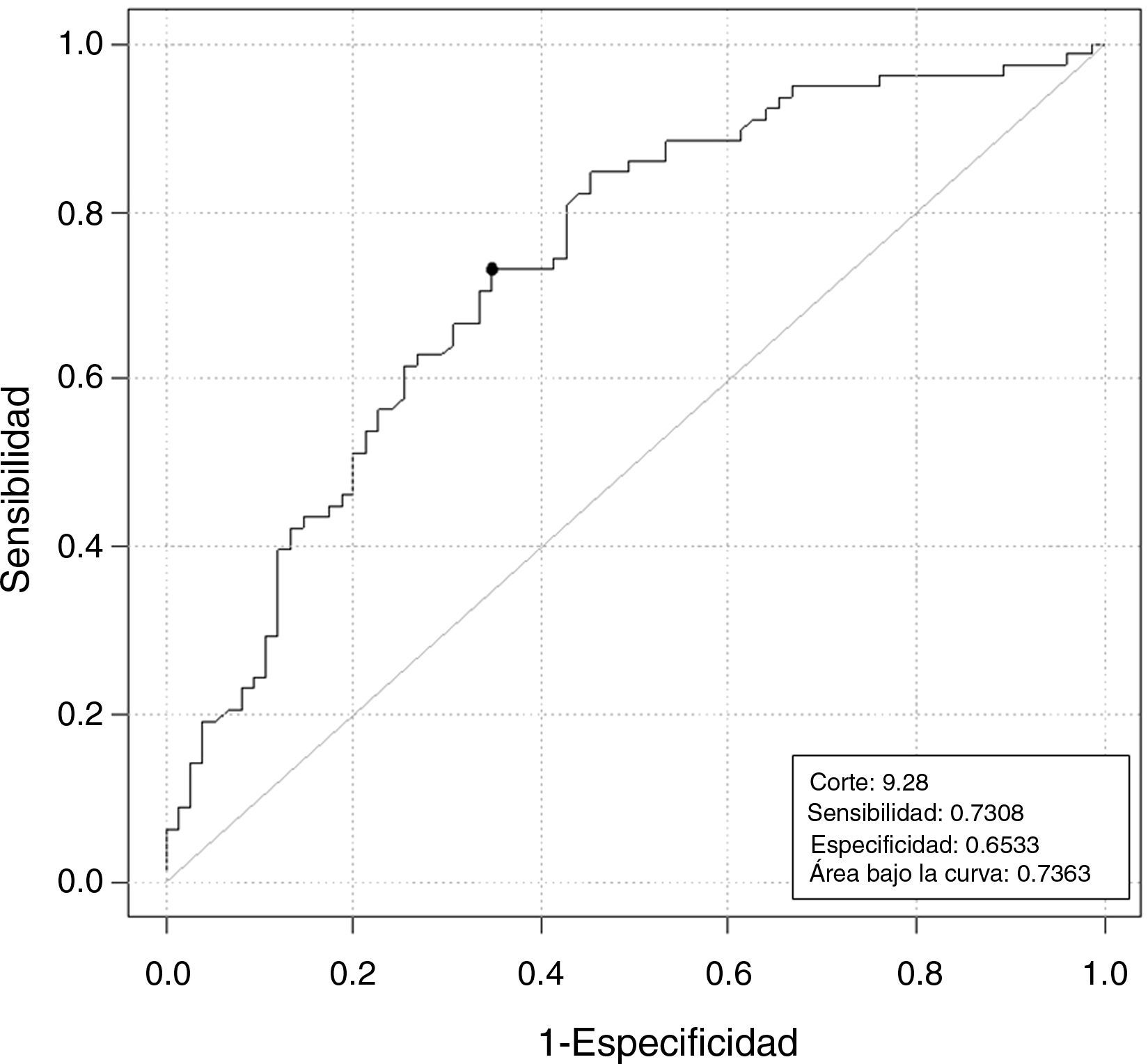
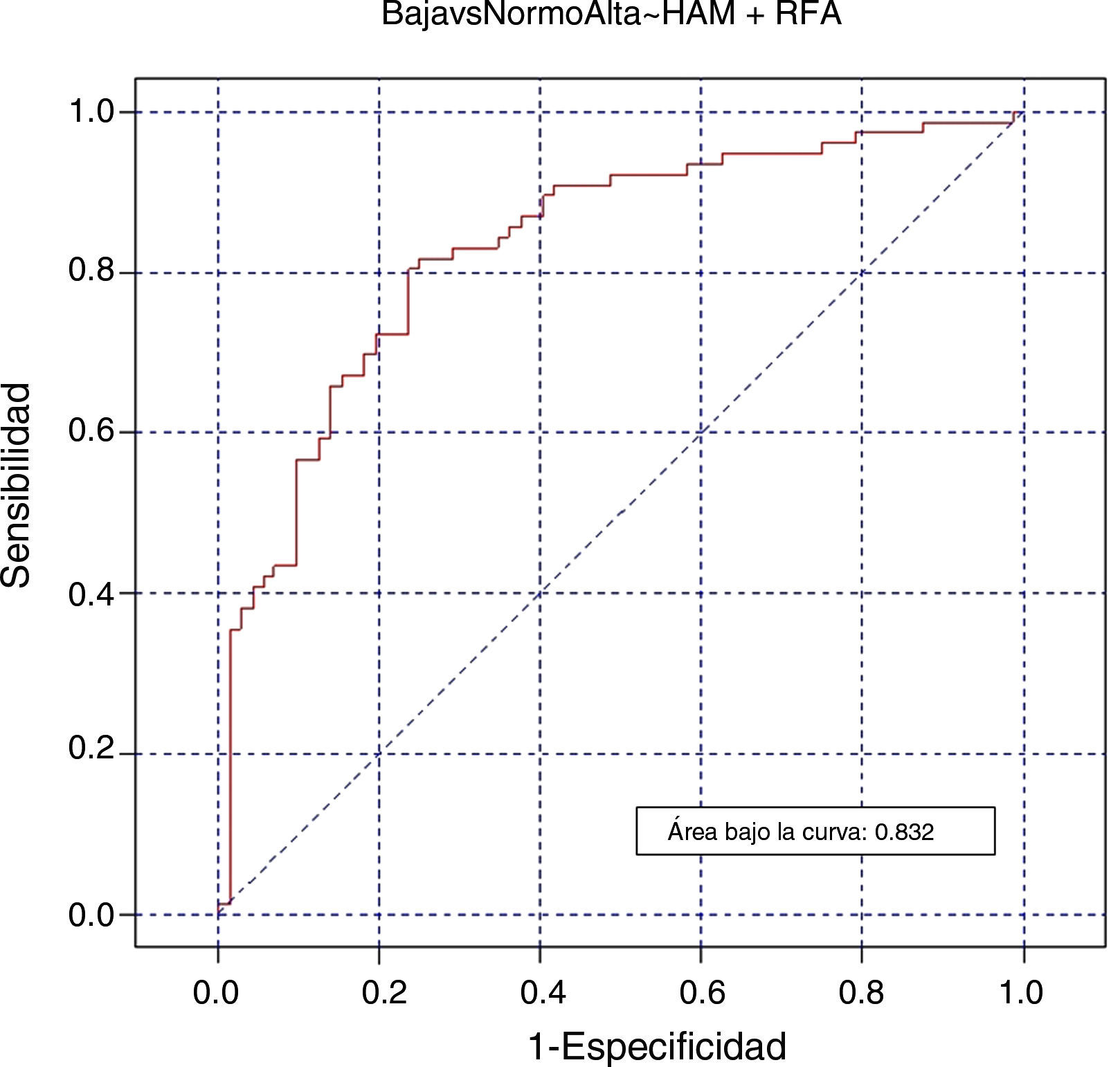
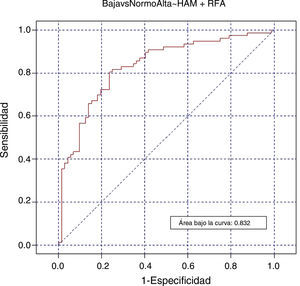
ConclusionesValores bajos de HAM (<9,28pmol/L) predicen mal pronóstico con un 72,7 y 64,5% de sensibilidad y especificidad. La mejor aproximación predictiva es la combinación HAM más RFA, con un área bajo la curva de 82%.
Valores de HAM y RFA superiores a 27,21pmol/L y 15 folículos son riesgo de hiperestimulación.
El pronóstico reproductivo muestra alto índice de cancelaciones (22% de ciclos iniciados) muy bajo de gestaciones (16,7%), con solo un 6,2% de embarazos evolutivos.
La determinación de HAM y RFA no permite negar un nuevo intento FIV, pero obligan a informar a la pareja de las bajas probabilidades de éxito.
To determine whether anti-Müllerian hormone (AMH) and antral follicle count (AFC) could be used as predictors of ovarian reserve.
Subjects and methodsWe compared AFC and AMH values in IVF/ICSI in low, normal and high responders. Low responders had undergone previous assisted reproduction technologies (ART) and had experienced at least one IVF failure.AFC was carried out with US 3D surface, inverse mode, and automatic volume calculation.
ResultsAMH and AFC were correlated and reflected the actual ovarian reserve. Differences between normal and low responders were significant. The best predictors of ovarian reserve were AMH, AFC and age. Differences between normal and high responders were also significant and were predictors of hyperstimulation. Grouping patients according to oocyte recovery (≤5 vs. >5) was predictive of maturation but was not predictive of embryo quality or reproductive outcome.
ConclusionsLow AMH values (<9.28pmol/L) predicted poor outcomes with a sensitivity and specificity of 72.7% and 64.5%. The best predictive approach was the combination of AMH plus AFC, resulting in an area under the curve of 82.2%. AMH and AFC above 27.21pmol/L and 15 follicles indicated a high risk of hyperstimulation. The reproductive outcome showed a very high cancelation rate (22% of initiated cycles), very low pregnancy rates (16.7%) and only 6.2% of ongoing pregnancies. Determination of AMH and AFC levels should not be used to reject candidates for IVF treatment but to inform patients with low levels of the very poor probability of success and the use of other alternatives.
La seguridad y la relación coste/beneficio son pilares básicos en las TRA ya que la edad se ha convertido hoy en la primera causa de esterilidad femenina1 y con ella el número de embriones con anomalías genéticas2,3.
Para ello se están empleando la edad, la HAM, y el RFA como parámetros de elección del envejecimiento ovárico, respuesta a la inducción, resultados reproductivos4–9, quizá establecimiento de la menopausia y factor masculino7–11.
Valores disminuidos de HAM y RFA pueden ser nuevas vías para evitar o reducir el número de pacientes con posibilidad de fallos en TRA10,11, minimizando tanto el coste de los tratamientos, la desazón, depresión psíquica de la pareja y complicaciones ante fracasos previsibles.
Igualmente, y al contrario, valores elevados de estos parámetros podrían ser indicativos de riesgo de hiperestimulación7.
A pesar de las publicaciones últimamente aparecidas quedan por establecer valores estándares de referencia.
Material y métodoEl estudio ha consistido en 153 pacientes, todas con antecedentes de fallos de TRA (inducción de la ovulación, IAH, y por lo menos una FIV/ICSI), con menstruaciones normales, ambos ovarios, sin historia previa de endocrinopatías, quimioterapia y/o radioterapia, en las cuales y a pesar de los fracasos previos y conociendo en el presente ciclo los niveles de HAM y otras hormonas, aceptaron la realización de un nuevo ciclo.
Fueron eliminadas las parejas con factor masculino severo (<5 millones espermatozoides/ml).
Una vez dispusimos del resultado de la estimulación del presente ciclo, analizamos los siguientes subgrupos de acuerdo al número de ovocitos recuperados.
Grupo 1. Ciclos cancelados o ≤5 ovocitos recuperados
- A.-
Ciclos cancelados: n=34 (22,2%)
- B.-
Baja respuesta no cancelados: n=44 (28,8%)
Grupo 2. Normo respondedoras>5 y <15 ovocitos recuperados: n=65 (42,5%).
Grupo 3. Altas respondedoras >15 ovocitos recuperados: n=10 (6,5%).
Hemos determinado los niveles de hormonas basales (FSH, LH, HAM y 17 ß-E2), el día 3 del ciclo previo (enzyme-linked immuno-sorbent assay [ELISA] Human Gesselschaft für Biochemica und Diagnostica MbH. Wiesbaden, Alemania- con una sensibilidad analítica de 0,4mIU/ml para FSH, 0,5mIU/ml para LH, 3pg/ml y para 17ß-E2). Para la HAM hemos empleado el HAM/MIS immunoassay (Laboratory Instrument & Beckman-Coulter, Viena, Austria). Con una sensibilidad analítica estimada (ELISA) de 0,1ng/ml (0,7pmol/L).
El RFA se llevó a cabo con ecografía transvaginal 2D/3D (Voluson E8, GE, equipado con un transductor transvaginal RAB 4-8D), al comienzo del ciclo de estimulación13.
La inducción de la ovulación se llevó a cabo empleando 225-300IU de rFSH (Puregon®, MSD, Madrid, España) durante 6 días, continuada según el tamaño folicular y 17β-E2. El día 5 (o folículos de 15mm), fue suministrada 0,25mg de GnRH antagonista (Orgalutran ®, MSD Madrid, España) diariamente hasta la administración de rHCG (Ovitrelle®, Serono, Madrid).
Se tomaron en cuenta los siguientes datos:
- 1.-
Edad, 2.
- 2.-
Coste de las TRA previas, de acuerdo a la Ley (DL 1/2005, DOGV 4971):
- -
Estudio de esterilidad y técnicas de diagnóstico=1.640€
- -
IAH=242€
- -
FIV/ICSI=616€,
- -
- 3.-
Dosis total de gonadotropinas empleadas y días de estimulación.
- 4.-
Total de ovocitos recuperados, porcentaje de ovocitos maduros obtenidos y fertilizados
- 5.-
Número total de embriones calidad GI, GII, obtenidos. Número y calidad de embriones transferidos. Gestaciones obtenidas y evolución clínica (abortos, ectópicos, y gestaciones en evolución).
Todos los datos fueron incluidos en el programa File Maker.
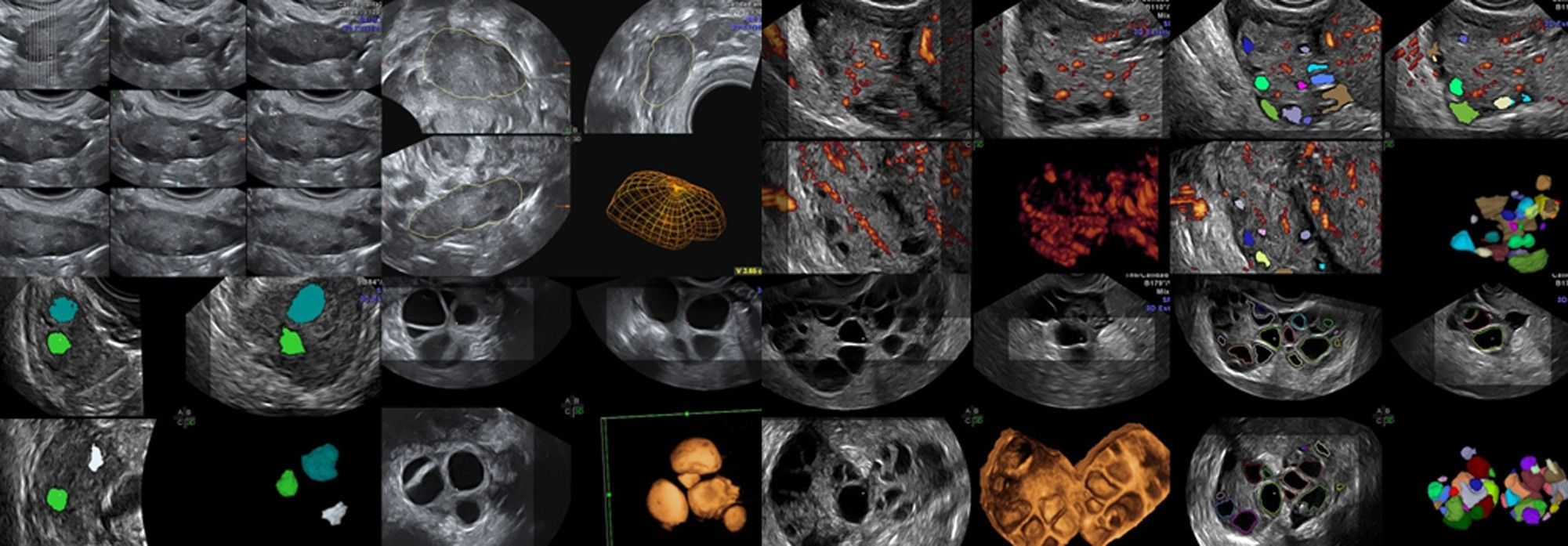
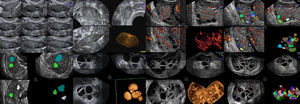
Modos ecográficos empleados para el RFAEL RFA ha sido llevado a cabo empleando 2D y 3D vaginal de superficie1,4,10,18, modo inverso, VOCAL, AVC y de precisarse, el TUI12–15. (fig. 1)
Estudio estadísticoHemos empleado el paquete InfoStat (2008) FCA, Córdoba, Argentina y el ANOVA como test paramétrico. Para verificar su significancia hemos empleado el test no paramétrico de Kruskal-Wallis con un nivel <0,05. Para aceptar la normalidad y determinar el ajuste de compatibilidad entre residuos estandarizados con dos probabilidades de distribución usamos el test de Kolmogorov-Smirnov.
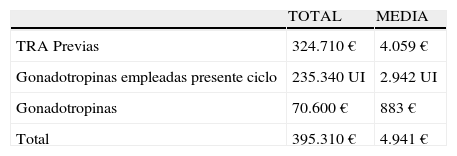
ResultadosCoste económico global y de gonadotropinasSe han calculado tanto los gastos en las TRA previas al ciclo actual como los de gonadotropinas en el presente ciclo, estableciéndose el coste de estas últimas en 0,30€ por UI (datos suministrados por MSD, Madrid). No se han incluido los gastos derivados del control del presente ciclo (hormonas, ecografías, analíticas, etc.) ni el grupo de altas respondedoras por no tener fallos previos de FIV (tabla 1).
Gastos totales
| TOTAL | MEDIA | |
| TRA Previas | 324.710€ | 4.059€ |
| Gonadotropinas empleadas presente ciclo | 235.340UI | 2.942UI |
| Gonadotropinas | 70.600€ | 883€ |
| Total | 395.310€ | 4.941€ |
Gonadotropinas €: coste económico de gonadotropinas; Gonadotropinas UI: gonadotropinas empleadas en el presente ciclo; Total €=total coste económico de las TRA; TRA: técnicas de reproducción asistida previas.
El coste total de los tratamientos a los que previamente habían sido sometidas asciende a 324.710€, parecidos a los ya publicados en la literatura12.
El total de gonadotropinas empleadas fue de 235.340UI, (395.310€) y la media de gasto por paciente uniendo gastos previos de TRA y gonadotropinas del presente ciclo asciende a 4.941€.
Diferencias en el RFA entre 2D y 3D vaginal empleando AVCDesde el comienzo del estudio, se apreció como ya mostraron otros autores13,14,18 claras diferencias en el RFA, ya que la 2D solo muestra 2 planos. Las imágenes observadas con 3D (modos AVC e inverso) fueron superiores (12-13% más folículos encontrados), y la cuantificación de FA más rápida13–16. El empleo de estos modos ahorran tiempo, y, como se ha descrito, eliminan diferencias intra e inter-observador. (fig. 1).
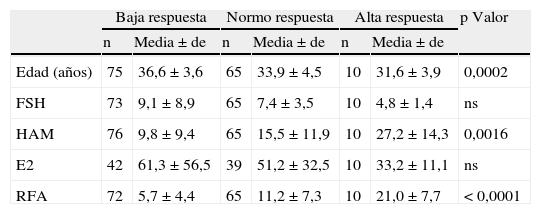
Resultados generales de marcadores de envejecimiento ováricoLa tabla 2 muestra las medias y valores de significación encontrados para edad y hormonas de acuerdo a los tres grupos de casos establecidos.
Valores medios de edad, FSH, HAM, E2 y RFA obtenidos en casos de baja, normo y alta respuesta y resultado de su significación
| Baja respuesta | Normo respuesta | Alta respuesta | p Valor | ||||
| n | Media±de | n | Media±de | n | Media±de | ||
| Edad (años) | 75 | 36,6±3,6 | 65 | 33,9±4,5 | 10 | 31,6±3,9 | 0,0002 |
| FSH | 73 | 9,1±8,9 | 65 | 7,4±3,5 | 10 | 4,8±1,4 | ns |
| HAM | 76 | 9,8±9,4 | 65 | 15,5±11,9 | 10 | 27,2±14,3 | 0,0016 |
| E2 | 42 | 61,3±56,5 | 39 | 51,2±32,5 | 10 | 33,2±11,1 | ns |
| RFA | 72 | 5,7±4,4 | 65 | 11,2±7,3 | 10 | 21,0±7,7 | <0,0001 |
El número de ovocitos recuperados vs FSH, LH, y 17 ß-estradiol basales no fue significativo (tabla 2).
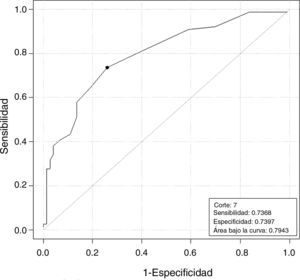
La HAM en bajas vs normo-altas respondedoras muestra una correlación estadísticamente significativa (tabla 2) de enorme interés clínico. Un valor de HAM de 9,28pmol/L predice la baja respuesta con una sensibilidad y especificidad del 73 y 65%, respectivamente (fig. 2).
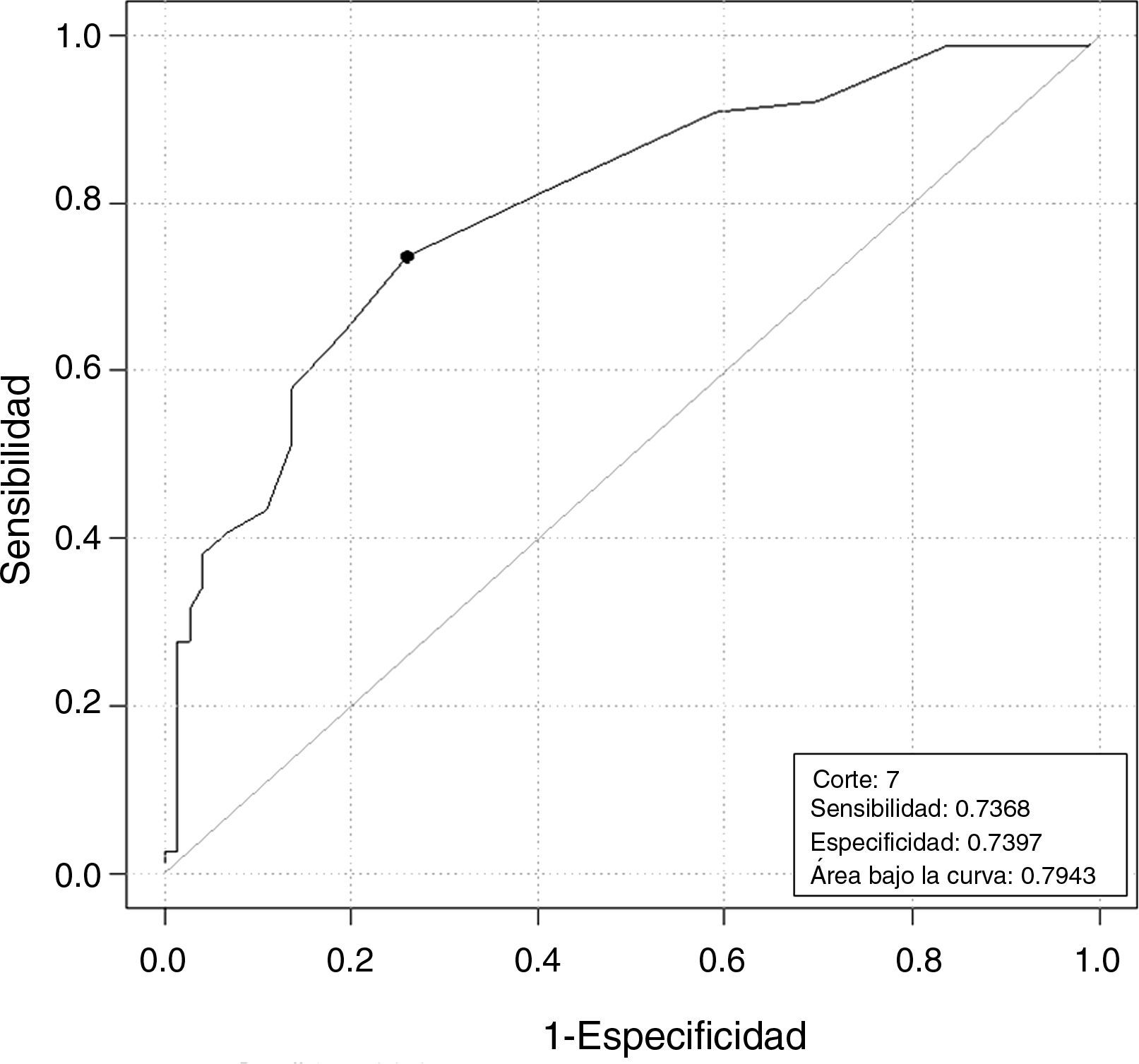
Las diferencias en el RFA de bajas vs normo-altas respondedoras fue estadísticamente significativa (tabla 2), y que con un valor de RFA≤7 predice la baja respuesta con una sensibilidad del 74% y una especificidad del 74%. (fig. 3).
HAM vs madurez ovocitaria. El análisis de la varianza entre los valores medios de HAM y la proporción de ovocitos maduros entre los tres grupos mostró una correlación positiva estadísticamente significativa (p<0,0001).
RFA vs madurez ovocitaria mostró una correlación positiva estadísticamente significativa (p<0,0001).
HAM, RFA y calidad embrionaria G1 y G2. Para ambos marcadores se halló una relación estadísticamente significativa, para HAM p=0,0007 y para RFA p<0,0001.
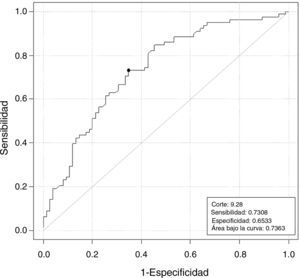
Finalmente, nuestros resultados muestran que la combinación entre HAM y RFA ha sido el mejor parámetro con un área bajo la curva del 83,2% (fig. 4).
Resultados reproductivosNuestros resultados han mostrado un alto índice de cancelaciones por ciclo (22% de ciclos iniciados) y muy bajo de gestaciones (16,7%), con solo un 6,2% de embarazos evolutivos.
DiscusiónLa idea fundamental es lograr identificar dos grupos de pacientes:
- •
Mujeres jóvenes ya con reserva disminuida y mujeres de edad avanzada que aún dispongan de reserva adecuada.
- •
De alcanzarse esta meta podrían optimizarse los resultados identificando pacientes que ya tienen un envejecimiento ovárico evidente. De esta forma podría ofrecérseles TRA apropiadas, como la ovodonación.
Durante la última década se han propuesto numerosos parámetros para conocer la reserva (hormonas basales, test endocrinos, etc.)1. La gran mayoría están hoy considerados obsoletos.
Recientes publicaciones concluyen que los más predictivos y con mayor aplicación clínica serian el RFA, la HAM y el test de estimulación con agonistas (GAST)16,17 este último no lo recomendamos.
La edad está incluida como criterio básico en todos los protocolos y sigue siendo de gran importancia, pero numerosos investigadores afirman que la HAM es más predictiva1,7,16,17.
Las determinaciones basales de FSH y 17 ß-estradiol han generado mucho interés debido a su sencillez y repercusión clínica. Sin duda son importantes en el estudio basal de la mujer estéril y deberán tenerse en cuenta como de mal pronóstico reproductivo valores altos de FSH basales (>10UI) y de estradiol (>75pg), pero nuestros resultados muestran que no hay diferencias significativas entre bajas y normo respondedoras y que tienen un bajo poder predictivo34.
También estos resultados muestran que la HAM y el RFA predicen madurez ovocitaria, algo de interés clínico. Cuanto mayores los niveles de HAM y el RFA mayor el número de ovocitos maduros que se recuperan19.
El presente estudio demuestra que la HAM se correlaciona muy bien con la respuesta ovárica en casos de mal pronóstico reproductivo y representa un avance para conocer el potencial de las bajas respondedoras, ya que aún no existe evidencia suficiente de disponer de un marcador predictivo ideal de reserva y/o respuesta ovárica que pueda ser empleado de forma rutinaria.
Solo recientemente se han publicado valores de corte eficaces para casos de normalidad35–37, pero apenas existen estudios comparativos con FIV/ICSI y en bajas respondedoras. Aun no siendo totalmente comparable, pues solo estudian casos de endometriosis36 los resultados semejan a los aquí mencionados.
Respecto al RFA, es imposible conocer el pool de ovocitos que restan, pero parece ser que el contaje está muy relacionado. Son numerosos los parámetros usados cuya sensibilidad difiere1,2,20–23.
Un volumen ovárico menor<3cm31. Ha mostrado ser un buen predictor de baja respuesta cuando es excesivamente pequeño, pero hay parámetros ecográficos que son mejores1,24.
El RFA con 2D vaginal proporciona excelentes resultados, sin embargo, la 3D US vaginal, especialmente combinada con modos inverso y AVC proporciona aún mejores (13% superior el contaje)13–16,18,24–28). Un número de FA<6 es un índice de pronóstico pobre29,30.
Los resultados del RFA con modos 3D han mostrado ser altamente reproducibles1,13,14,25,26,32 y más precisos que con 2D13,15.
Empleando los modos AVC e inverso pueden calcularse tanto el número como el volumen de cualquier estructura con enorme precisión1,14,25. El TUI permite almacenar los folículos en cualquier plano espacial25,27. En nuestra opinión, estos modos, junto con el AVC son los más promisorios1,13–15,18,26,28.
La angiografía doppler energía cuya eficacia ha quedado demostrada para valorar la vascularización del desarrollo folicular, no predice la reserva ovárica y por ello no debe usarse1,33.
Aunque es importante la edad, todos los autores la consideran, la HAM y el RFA fueron más predictivos. La ventaja de la HAM es su estabilidad a lo largo del ciclo7,17.
Un importante hallazgo, ya documentado31, ha sido que al comparar la madurez ovocitaria con los valores medios de HAM y del RFA en grupos de mujeres con≤5 vs>5 ovocitos recuperados, las diferencias fueron significativas.
Nuestros resultados reproductivos definitivos, así lo demuestran: tasas de cancelaciones elevadas (22%), tasas de embarazos para bajas respondedoras bajísimas (6,7%), y tasas de embarazos en normo respondedoras (9,8%) igualmente muy bajas.
En conclusión, proponemos emplear solo dos parámetros analíticos en la valoración de la reserva. Valores muy bajos de HAM (8,9pmol/L= 1,15ng/ml) junto a RFA ≤ 7, son predictivos de mínimas posibilidades de éxito reproductivo, informando así a las parejas y proponiéndoles técnicas alternativas para el éxito reproductivo.
Lamentablemente, el hecho de que con valores muy bajos de HAM y RFA hayamos tenido algún éxito no permite, como hubiéramos deseado, negar realizar un nuevo intento FIV/ICSI, o simplemente vitrificación seriada de ovocitos.
La relación coste/beneficio ha motivado que la ley española prohíba en instituciones públicas, realizar cualquier TRA superados los 40 años. Esta edad, y aún más, estos valores de HAM y RFA, no justifican, a nuestro entender, los gastos económicos cuando son tan bajas las posibilidades de éxito, existiendo otras alternativas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.