Evaluar el tratamiento de la diabetes pregestacional (DPG) y los resultados metabolicoperinatales en función del mismo.
Marterial y métodosSe analiza a 42 mujeres con DPG en tratamiento insulínico intensivo seguidas desde el primer trimestre de gestación.
ResultadosLa edad media fue de 30±5 años y el tiempo medio±desviación estándar de diabetes fue de 14,2±9,5 años. El índice de masa corporal (IMC) y los requerimientos de insulina pasaron de 26±4,85kg/m2 y 0,56±0,32 U/kg al inicio a 30±4,5kg/m2 y 0,70±0,28 U/kg al final. La hemoglobina glucosilada (HbA1c) previa era de 7,71±1,85% y la media gestacional de 6,81±1,33%. Se aplicaron 4 modalidades de insulina: NPH-lispro 26,2%, mezclas prefijadas 26,2%, glargina-lispro 21,4% e ISCI 26,2%. No hubo diferencias significativas entre el tipo de insulina y las variables analizadas.
ConclusionesEl tipo de insulina no afecta a los resultados perinatales. Las HbA1c elevadas se relacionan con mayor circunferencia abdominal a las 32 semanas y más incidencia de partos pretérmino.
To evaluate the treatment of pregestational diabetes mellitus (PDM) and the metabolicperinatal results according to the treatment used.
Material and methodWe reviewed 42 women with PDM with intensive insulin treatment under clinical supervision from the first three months of their pregnancy.
ResultsThe average age was 30±5 years and the time for the average development of diabetes was14,2±9.5 years. The Body Mass Index and the need for insulin passed from 26±4.85kg/m2 and 0,56±0.32 U/kg at the beginning to 30±4.5kg/m2 and 0.70±0.28 U/kg at the end. Prior HbA1c was 7.71±1.85% and a gestational average HbA1c of 6.81±1.33%. Four types of insulin therapy were used: NPH-lispro 26.2%, pre-programmed mixtures 26.2%, glargina-lispro 21.4% and ISCI 26,2%. Significant differences were not found among the types of insulin and the variables analyzed.
ConclusionsThe type of insulin doesn’t affect perinatal results. High HbA1c are related to greater abdominal circumference at 32 weeks and with a greater.
La diabetes mellitus (DM) es la alteración metabólica más frecuentemente asociada al embarazo. Puede ser pregestacional (DPG) tipo 1 o tipo 2 cuando se diagnostica antes de la gestación, o gestacional (DG) cuando se diagnostica durante el embarazo. Su frecuencia con respecto al total de gestaciones con diabetes es del 4% para DPG tipo 1, del 8% para DPG el tipo 2 y del 88% para DG1.
Antes del descubrimiento de la insulina en 1921, la gestación en mujeres con DM era poco frecuente y resultaba en abortos y complicaciones maternas fatales, con una tasa de mortalidad fetal y neonatal del 60%. La introducción de la insulina como tratamiento de las gestantes, junto a los avances obstétricos y del control metabólico, ha supuesto una mejoría permanente de los resultados maternos y perinatales hasta casi equipararse a la población general, pero aún lejos de lo ideal2. En pleno siglo xxi, la DPG sigue siendo un embarazo de alto riesgo, por lo que requiere de un control estrecho y especializado, tanto de la gestante como del feto3.
La DPG afecta a un 1% de todas las mujeres embarazadas. Las gestantes con DPG presentan peores resultados que las gestantes sin DM, con aumento en el índice de malformaciones congénitas, preeclampsia, parto prematuro, mortalidad perinatal, macrosomía4 y agravamiento de la retinopatía y la nefropatía diabética5. Por ello, resulta imprescindible determinar el riesgo que conlleva una gestación en función de las complicaciones maternas secundarias a la DM, así como prevenir y/o reducir las complicaciones materno-fetales mediante un adecuado control y vigilancia, tanto preconcepcional como durante toda la gestación1,4,5.
El objetivo de nuestro trabajo fue evaluar la efectividad del tratamiento de la DPG en los resultados metabólicos y perinatales en función de la modalidad terapéutica utilizada.
Material y métodosLlevamos a cabo un estudio descriptivo de carácter retrospectivo revisando las historias clínicas de 42 mujeres, todas con DPG, de las cuales 37 presentaban DM tipo 1 y 5 mujeres DM tipo 2. Todas recibieron seguimiento clínico desde el primer trimestre de la gestación en una consulta conjunta de endocrinología y obstetricia desde el inicio de la informatización de dicha consulta, en el año 2003. Todas las gestantes estaban en tratamiento insulínico intensivo, entendiendo como tal 3 o más dosis de insulina diarias o infusión subcutánea continua de insulina (ISCI).
En todos los casos se recogieron diversas variables demográficas, clínicas y analíticas que incluyeron edad, años de evolución de la diabetes, antecedentes de hipertensión arterial (HTA), complicaciones microvasculares de la diabetes (retinopatía, microalbuminuria, nefropatía y neuropatía) y progresión de éstas durante la gestación, tipo de insulinoterapia empleada, valor de hemoglobina glucosilada (HbA1c), índice de masa corporal (IMC) y requerimientos de insulina previos y medios durante el embarazo, programación de la gestación, historia obstétrica —incluido el número de gestaciones, abortos, partos, cesáreas y muertes perinatales, peso del recién nacido, percentil de peso al nacer, Apgar, circunferencia abdominal (CA) en la ecografía de las 32 semanas, semana de fin de gestación— y vía de finalización del embarazo.
La tabulación y el análisis de los datos se realizaron usando el paquete estadístico SPSS versión 15.0 para Windows. Las variables cuantitativas se expresan como media±desviación estándar: Para las comparaciones entre grupos se utilizó la prueba de la t de Student o la ANOVA (análisis de la varianza). Las variables cualitativas se expresaron mediante sus frecuencias (absoluta y relativa); las comparaciones entre grupos se realizaron mediante la prueba de la χ2. La significación estadística se consideró en todos los casos para valores de p<0,05. Para evaluar la relación entre el tipo de insulinoterapia y la HbA1c se realizó un análisis bivariante y posteriormente una prueba post hoc.
ResultadosLa edad media±desviación estándar de las gestantes fue de 30±5 años y la evolución media de la DM fue de 14,2±9,5 años. El 11,9% presentaba HTA, el 54,8% retinopatía diabética, el 19% microalbuminuria, el 11,9% nefropatía diabética y ninguna presentaba neuropatía diabética. Se realizó al menos una retinografía por trimestre a cada gestante. La media de HbA1c previa a la gestación fue de 7,71±1,85%, el IMC previo medio de 26±4,85kg/m2 y los requerimientos medios de insulina al inicio del embarazo de 0,56±0,32 U/kg. Sólo un 14,3% de las gestantes evaluadas programó la gestación.
Había 4 modalidades de insulinoterapia: insulina NPH y lispro, mezclas prefijadas, insulina glargina y lispro, e ISCI; las gestantes presentaron una distribución homogénea en los distintos grupos de tratamiento. De esta manera, un 26,2% seguía tratamiento con insulina NPH y lispro, un 26,2% con mezclas prefijadas, un 21,4% con insulina glargina y lispro, y un 26,2% con ISCI.
La HbA1c media durante la gestación fue del 6,81±1,33%. El IMC y los requerimientos de insulina pasaron de 26±4,85kg/m2 y 0,56±0,32 U/kg previos a la gestación a 30±4,5kg/m2 y 0,70±0,28 U/kg, respectivamente, al final de ésta. La retinopatía diabética progresó en un 7,1% y la nefropatía diabética en un 2,4% de las gestantes.
La gestación finalizó por vía vaginal en un 21,4%, cesárea programada en un 26,2% y cesárea urgente en un 28,6%. Se produjeron 2 (4,8%) abortos en la DM tipo 1 de larga evolución, uno de ellos a las 8 semanas de edad gestacional (EG), en una paciente con 20 años de evolución de DM, HbA1c previa de 12,18% y similar HbA1c media y en tratamiento con insulina NPH y lispro, y el otro se produjo a las 6 semanas de EG, en una paciente con 11 años de evolución de DM, HbA1c previa del 6,11% y HbA1c media del 6,77%, y en tratamiento con insulina glargina y lispro. Asimismo, se produjeron 2 (4,8%) muertes intrauterinas, también en DM tipo 1, una de ellas a las 31 semanas de EG, en una paciente con 20 años de evolución de DM, con HbA1c previa del 10% y media del 8,67%, y en terapia con ISCI; la otra pérdida fetal fue a las 23 semanas de gestación, en una paciente con 2 años de evolución de DM, con HbA1c previa del 8,16% y media del 7,33%, y en terapia con insulina NPH y lispro. No se constató la presencia de malformaciones fetales.
Con respecto a los resultados perinatales, la EG media±desviación estándar de finalización de la gestación fue de 35,2±7,6 semanas, la media de CA en ecografía de las 32 semanas de 295,9±22,3mm, la equivalencia de la EG con la CA en ecografía de las 32 semanas fue de 33,3±2,15 semanas, el Apgar medio de 9,41±1,67 puntos y el peso medio al nacer de 3.315,62±740,35g. Atendiendo a la clasificación de Lubchenco para recién nacidos por peso y EG, encontramos que un 40,5% estaba por encima del P90 (grande para la EG), un 38,1% entre el P10 y P90 (normal para la EG), ninguno por debajo del P10 (pequeño para la EG) y en un 21,4% no disponíamos de datos, ya fuera por abortos, fetos muertos, gestación en curso, etc.
DiscusiónMúltiples estudios han evidenciado que un pobre control metabólico en la gestación temprana, especialmente durante la embriogénesis, proceso que se completa hacia la séptima semana posconcepcional, se relaciona con una alta incidencia de abortos espontáneos y anomalías congénitas fetales4,6.
Además de las complicaciones fetales, los cambios fisiológicos asociados a la gestación pueden tener un impacto negativo en la salud materna. La retinopatía, la nefropatía, la neuropatía, la HTA, la enfermedad cardiovascular y la enfermedad tiroidea pueden afectar y verse afectadas, a su vez, por el embarazo. Por ello, resulta imprescindible conseguir un adecuado control glucémico, cuyo objetivo es alcanzar la normoglucemia tanto antes de la concepción como durante toda la gestación, para lo cual es necesario, además de cumplir adecuados hábitos higienicodietéticos, realizar frecuentes controles glucémicos y una terapia intensiva. Algunos estudios exponen que el control estricto de la glucemia aumenta la incidencia de hipoglucemias severas7,8, hecho no documentado en estudios más recientes. Asimismo, la evaluación y el consejo pregestacional —incluidos la educación de las embarazadas, suplementación con yodo y ácido fólico, el cese de hábitos tóxicos— resultan cruciales, además de controles glucémicos frecuentes, como ya hemos mencionado previamente, y visitas especializadas periódicas6. La atención preconcepcional incluye, además, la programación de la gestación, a pesar de lo cual sólo un 14,3% de las gestantes evaluadas programaron el embarazo, resultados que coinciden con lo publicado en la literatura científica, donde algunas series alcanzan hasta un 75% de gestaciones no programadas9.
Las gestantes con DPG tipo 2 pueden alcanzar un buen control glucémico con dieta y ejercicio exclusivamente; aquellas que no lo consigan, o que estén con agentes orales, y en los casos de gestantes con DPG tipo 1 requerirán terapia insulínica. Durante el primer trimestre de la gestación los requerimientos de insulina son similares en DPG tipo 1 y 2, pero en la segunda mitad del embarazo las necesidades aumentan proporcionalmente más en DPG tipo 2 que en DPG tipo 1. La insulinoterapia recomendada actualmente en la gestación es insulina NPH combinada con lispro o aspart. No existen amplios estudios que evidencien la seguridad del empleo de los análogos de insulina de acción prolongada durante la gestación1. Con respecto a la insulina glargina, es conocido que puede llegar a tener 24h de efecto y que su perfil de acción carece de pico, por lo que proporciona mayor estabilidad glucémica, reduciendo las fluctuaciones diarias de glucosa y el riesgo de hipoglucemias nocturnas, y mejorando el control glucémico global. Sin embargo, su perfil de seguridad en la gestación es incierto. Glargina presenta de 6 a 8 veces más afinidad por el receptor del factor de crecimiento similar a la insulina tipo 1 (IGF-1) y potencia mitogénica comparada con la insulina humana en cultivos celulares, aunque se desconoce si este hecho es similar in vivo5,10,11. Frente a estos resultados, Ciaraldi et al12 encuentran, estudiando células de músculo esquelético humano, que la insulina humana y la insulina glargina son totalmente comparables en la fijación al receptor de insulina e IGF-1, fosforilación en cascadas de señalización celulares, estimulación de la captación de glucosa y mitogénesis. El aumento relativo de potencia mitogénica de la insulina glargina sólo se ha evidenciado en células de osteosarcoma. La controversia en los resultados podría deberse a la variabilidad en la densidad de receptores IGF-1 y/o insulina en los sistemas celulares estudiados. En el músculo esquelético humano, la respuesta mitogénica significativa a insulina humana y glargina ocurre a niveles muy superiores de los alcanzados en la circulación sanguínea12. Existen escasos trabajos sobre el uso de glargina en el embarazo, y con escaso número de pacientes, sin que se hayan evidenciado resultados adversos serios y sin que aporten suficiente evidencia para recomendar o desaconsejar el empleo de glargina en la gestación. Sobre la base de dichos estudios, glargina ha alcanzado un grado de recomendación C de la Food and Drug Administration para gestación1. El estudio más amplio realizado sobre glargina y gestación evaluó los resultados obstétricos y perinatales de 115 mujeres con DPG tipo 1 en tratamiento preconcepcional con dicha insulina comparándolos con los resultados obtenidos con terapia convencional, sin que se encontraran diferencias significativas en cuanto a efectos deletéreos en el feto o en la madre5,10,11. En relación con la insulina detemir, actualmente se está realizando un estudio para evaluar su eficacia y seguridad durante la gestación.
Algunos clínicos recomiendan el empleo de ISCI para alcanzar un óptimo control glucémico durante el embarazo. No existe evidencia para recomendar ISCI en multidosis de insulina (MDI) en gestación. Se recomienda continuar con ISCI si ha existido un uso efectivo preconcepcional de esta terapia. El inicio de ISCI en la gestación se ha relacionado con mayor riesgo de cetosis, dificultad con los catéteres y mayor coste. Se realizó una revisión sistemática que incluía 6 estudios aleatorizados, comparando el uso de MDI e ISCI en mujeres embarazadas, sin que se evidenciaran diferencias significativas entre ambos grupos, tanto en el control glucémico como en los resultados de la gestación. Los resultados evaluados incluían HbA1c del tercer trimestre, frecuencia de hipoglucemias/cetosis maternas y neonatales, y el índice de parto pretérmino, cesárea, aborto y grande para EG. Se han descrito más episodios de cetoacidosis y retinopatía diabética en el grupo de ISCI sin que se alcanzara la significación estadística. El uso de ISCI se asoció con similares resultados maternos, fetales, perinatales y de control metabólico que los obtenidos con MDI, por lo que no hay evidencia para recomendar terapia con ISCI en la gestación1,13,14. En nuestra serie, se indicó tratamiento con ISCI en aquellas mujeres con diabetes inestable e hipoglucemias frecuentes (sobre todo nocturnas) y que no consiguieron buen control glucémico con MDI. En todos los casos mejoraron los controles glucémicos y la tendencia a la hipoglucemia, no se ha presentado ningún episodio de cetosis y se han conseguido resultados metabólicos y obstétricos similares a los obtenidos por el resto de las pacientes evaluadas; si bien nuestro estudio incluía un reducido tamaño muestral.
La HbA1C nos informa sobre el grado de control glucémico crónico y refleja la concentración media de glucosa plasmática durante las 6 a 8 semanas previas en la gestación (menor que en no gestantes por menor vida media de los glóbulos rojos en el embarazo debido a una producción aumentada de éstos de forma fisiológica). Una HbA1c del 6% se correlaciona con una glucemia promedio de 120mg/dl y por cada 1% que se eleve refleja un aumento de glucemia en 20mg/dl. Debe determinarse cada 2 a 4 semanas durante la gestación. El objetivo es alcanzar un valor lo más próximo al rango normal (< 5,1%), sin hipoglucemias. Estudios observacionales muestran que una HbA1c mayor de un 1% del valor normal se asocia a un índice de anomalías congénitas y abortos similares a la población general. Nuestros resultados concuerdan con los estudios publicados hasta el momento en cuanto a HbA1c media1.
Con respecto a los requerimientos de insulina, las gestantes evaluadas presentaban un promedio de 0,56U/kg inferior a los descritos en la literatura científica para DM tipo 1, donde la media de necesidades de insulina en el primer trimestre es de 0,7U/kg y en el tercer trimestre de 1U/kg6.
La retinopatía diabética empeora en algunas mujeres durante la gestación, aunque no suele desarrollarse de novo en mujeres sin retinopatía previa al embarazo. El grado de retinopatía se relaciona con la duración de la diabetes y el grado de control glucémico. El control glucémico estricto se ha asociado con un empeoramiento de la retinopatía con incremento en la formación de exudados algodonosos. El grado en que esto ocurre en la gestación se relaciona con la enfermedad retiniana de base y, en parte, con la reducción aguda de la hiperglucemia crónica. Ninguna de las gestantes evaluadas desarrolló retinopatía diabética, la progresión de ésta se produjo en un 7,1% y fue menor que en los datos encontrados en la literatura científica, que oscilan entre un 20 y 55% de los casos6.
La nefropatía diabética y la microalbuminuria se asocian a un mayor índice de parto pretérmino, sobre todo debido a preeclampsia. La gestación no parece incrementar el riesgo de diálisis ni de nefropatía diabética si no existían antes de la concepción. El efecto del embarazo en el curso de una nefropatía establecida está menos claro. El índice de filtrado glomerular estimado por aclaramiento de creatinina disminuye durante la gestación en un tercio de las mujeres con nefropatía diabética. En nuestro estudio, se identificó una progresión de nefropatía en un 2,4%, sin que se desarrollara ningún caso de novo6.
Dos grandes estudios de mujeres con DM tipo 1, el DCCT (Diabetes Control and Complication Trial) y el PCS (EURODIAB Prospective Complications Trial), concluyeron que la gestación no es un factor de riesgo para el desarrollo de retinopatía, nefropatía o neuropatía temprana tras la corrección de factores de confusión tales como la edad, la duración de la diabetes y la HbA1c6.
Atendiendo a la vía de finalización de la gestación, las embarazadas con DPG presentan mayor incidencia de cesárea que la población general, del 50 y el 14,8%, respectivamente, y alcanza un 25% en gestantes sin DM de características similares9. En general, la alta frecuencia de cesáreas electivas o urgentes se debe a sufrimiento fetal, macrosomía y fracaso en la inducción del parto6. En nuestro análisis encontramos un porcentaje de cesáreas del 54,8%; el 26,2% son cesáreas programadas y el 28,6% de urgencia, lo que se correlaciona con lo publicado hasta la fecha. Se ha descrito una incidencia de hasta un 50% en el DCCT9 y de hasta un 56% según Jovanovic6.
Obtuvimos una tasa de abortos del 4,8%, con una incidencia algo menor que las series publicadas: del 10,1% según Shefali et al15, del 14% en el DCCT9 y aumentando hasta un 32% cuando la HbA1c es superior a 6 puntos sobre la media según Kitzmiller et al16.
Con respecto a muertes fetales, también obtuvimos un 4,8%, resultados que concuerdan con los publicados hasta el momento (3% según Jovanovic6 y 11,1% según Cetkovic et al17).
La macrosomía se define como un peso al nacimiento por encima del P90 para su EG o más de 4.000g. Nosotros encontramos un 40,5% de recién nacidos por encima del P90 para su EG. En las series publicadas los datos varían desde un 19,2% según Shefali et al15 hasta un 63% según Jovanovic6, pasando por un 29,6% descrito por Cetkovic et al17. Los recién nacidos macrosómicos son grandes y de aspecto pletórico, y presentan un crecimiento desproporcionado, con exceso de grasa en las regiones abdominal y escapular, junto con visceromegalias. La macrosomía predispone a un parto complicado con distocia de hombro, lesión del plexo braquial y fracturas claviculares o humerales, lo que desemboca en una mayor tasa de cesáreas18.
No se han descrito diferencias significativas en morbimortalidad perinatal entre DPG tipo 1 y tipo 219. Como factores relacionados con resultados perinatales adversos más influyentes en la DPG tipo 1, se han descrito la duración de la DM y la HTA crónica, y en DPG tipo 2 el pobre control metabólico y la macrosomía20.
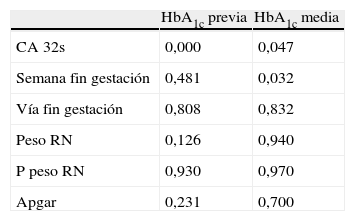
Al analizar la relación existente entre los resultados perinatales y la HbA1c, encontramos que la CA a las 32 semanas se relacionaba de forma significativa y directamente proporcional tanto con la HbA1c previa como media (p=0,000 y 0,047, respectivamente), de manera que a mayor HbA1c mayor es la CA a las 32 semanas y, por tanto, mayor incidencia de macrosomía. Asimismo, al evaluar la relación entre la semana de finalización de la gestación y la HbA1c, encontramos una significación estadística y una relación inversa con respecto a la HbA1c media (p=0,032), pero no con la HbA1c previa (p=0,481), de manera que a mayor HbA1c media, mayor incidencia de parto pretérmino. No se encontró relación estadísticamente significativa con el resto de las variables analizadas (tabla 1).
Significación estadística de los resultados perinatales en función de la HbA1c
| HbA1c previa | HbA1c media | |
| CA 32s | 0,000 | 0,047 |
| Semana fin gestación | 0,481 | 0,032 |
| Vía fin gestación | 0,808 | 0,832 |
| Peso RN | 0,126 | 0,940 |
| P peso RN | 0,930 | 0,970 |
| Apgar | 0,231 | 0,700 |
CA: circunferencia abdominal; HbA1c: hemoglobina glucosilada; RN: recién nacido.
Para analizar si existían diferencias en los resultados perinatales en función de la terapia insulínica empleada, aplicamos una prueba no paramétrica (prueba de Kruskal-Wallis) y no se encontraron diferencias estadísticamente significativas entre los distintos tratamientos (tabla 2).
En la tabla 3 recogemos la media de las cifras de HbA1c previa y media durante la gestación en los distintos grupos de tratamientos de insulina. Para analizar la relación entre el tipo de insulina y la HbA1c llevamos a cabo un estudio bivariante. Con respecto a la HbA1c previa, la prueba de homogeneidad mayor de 0,05 nos permitió realizar un ANOVA que resultó no significativo. En el caso de la HbA1c media, el ANOVA fue de 0,065 que, si bien no es estadísticamente significativo, teniendo en cuenta el pequeño tamaño muestral, podría resultar clínicamente significativo. Por ello, realizamos una prueba post hoc que mostró significación clínica en las cifras de HbA1c media a expensas del grupo de insulinas mezclas sobre el grupo de insulina NPH y regular. Esta relación podría explicarse por el hecho de que las gestantes en tratamiento con mezclas prefijadas de insulina eran aquellas con DPG tipo 2 y aquellas con DPG tipo 1 pertenecientes a la categoría A de la clasificación de Priscilla White, con buen control metabólico, por lo que se mantuvo dicha terapia durante la gestación.
Análisis bivariante: tipo de insulina-HbA1c
| HbA1c previa | HbA1c media | |
| NPH y regular | 8,43 | 7,44 |
| Mezclas prefijadas | 6,58 | 5,94 |
| Glargina | 7,75 | 6,79 |
| ISCI | 8,10 | 7,17 |
| T. homogeneidad | 0,174 | 0,20 |
| ANOVA | 0,097 | 0,065 |
| T. post hoc | – | 0,060 |
HbA1c: hemoglobina glucosilada; ISCI: infusión subcutánea continua de insulina.
Cuando evaluamos la repercusión que tenía la programación de la gestación en los resultados perinatales y obstétricos encontramos significación estadística en la semana de finalización de la gestación (p=0,048) y en el percentil de peso del recién nacido (p=0,000), de manera que la programación de la gestación se asociaba a una incidencia menor de parto pretérmino y de macrosomía.
Como limitaciones de nuestro análisis cabe destacar que se trata de un estudio observacional, retrospectivo y sin controles, que no discriminamos en la evaluación de los resultados obstétricos y perinatales entre DPG tipo 1 y tipo 2, y el pequeño tamaño muestral.
ConclusionesDe todo lo expuesto podemos concluir que:
- –
El modelo de tratamiento insulínico no afecta a los resultados perinatales en pacientes previamente seleccionadas en una consulta especializada conjunta de endocrinología y obstetricia.
- –
Cifras elevadas de HbA1c se relacionan con una mayor circunferencia abdominal a las 32 semanas y con una mayor incidencia de partos pretérmino.
- –
La prematuridad y la macrosomía fetal son menos frecuentes cuando la gestación es programada.
Se requieren más estudios que evalúen los resultados metabólicos, obstétricos y perinatales en función del tipo de tratamiento empleado para el control de la DM en el embarazo, así como definir el perfil de seguridad de los análogos de insulina de acción prolongada y los agentes orales durante la gestación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.