INTRODUCCION
El mioma uterino es una enfermedad dependiente de estrógenos, que aparece durante la edad fértil de la mujer, crece durante la gestación y disminuye su tamaño tras la menopausia.
Aunque el tratamiento definitivo de esta enfermedad sigue siendo la cirugía, se han propuesto diversas opciones de tratamiento médico, que resultan útiles como medidas adyuvantes y previas a la cirugía, como alternativa a ésta en pacientes cuyos síntomas no son tan intensos como para requerir un tratamiento más agresivo, o en las que rechazan la intervención quirúrgica.
Una de estas opciones de tratamiento médico son los análogos agonistas de la hormona liberadora de gonadotropinas (aGnRH), cuya administración prolongada induce un hipogonadismo hipogonadotropo entre 1 y 3 semanas después de haber iniciado el tratamiento, lo cual, al igual que los estados hipoestrogénicos naturales, favorece la regresión del tamaño de los miomas1.
Sin embargo, la administración de análogos de GnRH provoca efectos vasomotores y menopáusicos hipoestrogénicos, en ocasiones poco tolerados por las pacientes, y una desmineralización ósea que puede comprometer la calidad de vida futura2.
Con el fin de minimizar estos efectos colaterales hipoestrogénicos sin alterar su efecto sobre las enfermedades dependientes de estrógenos, se introduce el concepto de terapia add-back, basada en la teoría del umbral estrogénico3,4, que postula la existencia de una respuesta jerárquica de diferentes tejidos y lesiones dependientes de hormonas al estradiol y, por tanto, la posibilidad de una ventana terapéutica para esta hormona.
Aunque clásicamente se han empleado estrógenos conjugados equinos (ECE) combinados con gestágenos como terapia hormonal complementaria a la administración de análogos de GnRH3,5-8, tibolona, una molécula sintética de acción hormonal, con acción específica de tejido, se ha introducido dentro del arsenal terapéutico de la terapia add-back9-15.
Tibolona es una molécula derivada de la 19-nortestosterona que presenta una actividad débil estrogénica, progestágena y androgénica16,17. Esta molécula se ha mostrado eficaz como tratamiento hormonal sustitutivo en la menopausia, reduciendo los síntomas climatéricos y protegiendo el hueso9,10,18.
El presente trabajo trata de estudiar si la disminución del tamaño del útero miomatoso que se consigue con los análogos de GnRH se mantiene con diferentes regímenes de tratamiento con tibolona como terapia add-back, o con ECE.
MATERIAL Y MÉTODOS
Se diseñó un estudio prospectivo y aleatorizado que incluía a 125 pacientes no menopáusicas, con ciclos menstruales regulares y diagnóstico de miomatosis uterina susceptible de tratamiento quirúrgico.
El diagnóstico se estableció mediante estudio ecográfico y la indicación quirúrgica por presentar clínica asociada (hipermenorrea, menorragia, metrorragia, signos o síntomas derivados de la compresión de órganos vecinos) o un diámetro uterino superior a 12 cm.
Ninguna paciente presentaba enfermedades que contraindicaran la administración de esteroides.
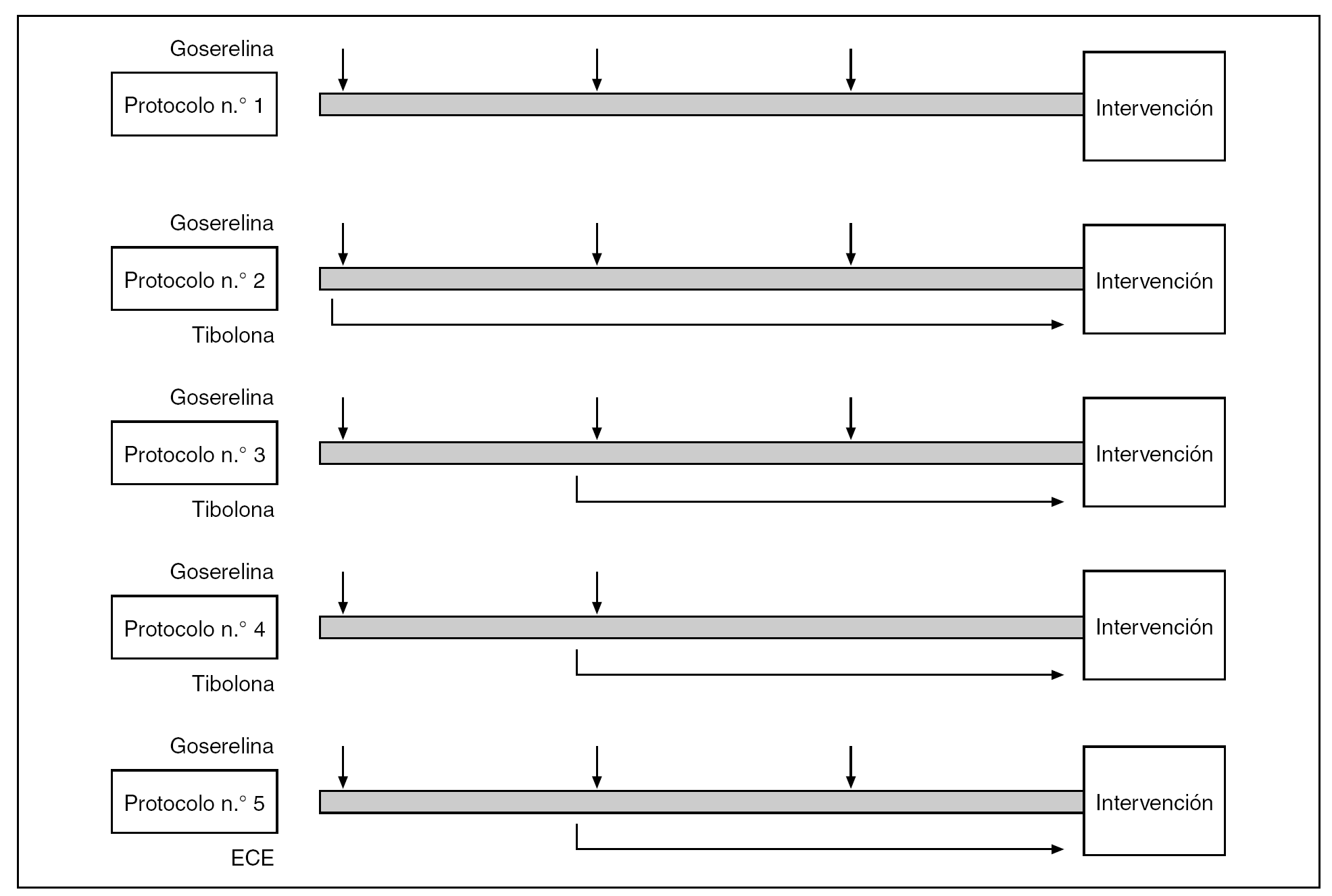
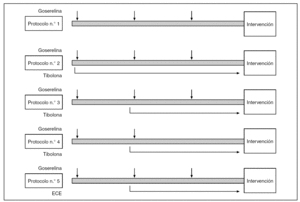
Todas las pacientes elegidas aportaron su consentimiento expreso y firmado para ser incluidas en este protocolo de estudio en el que, mediante un programa informático de generación de números aleatorios, fueron asignadas a uno de 5 protocolos terapéuticos previos a la cirugía (fig. 1):
Figura 1.Esquema de los protocolos terapéuticos. ECE: estrógenos conjugados equinos.
-- Grupo 1 (25 pacientes): acetato de goserelina depot, 3,6 mg, a intervalos de 4 semanas, completando un total de 3 viales.
-- Grupo 2 (25 pacientes): acetato de goserelina depot, 3,6 mg, a intervalos de 4 semanas, completando un total de 3 viales, asociada a tibolona (2,5 mg diarios) desde la primera administración de goserelina hasta la intervención quirúrgica.
-- Grupo 3 (25 pacientes): acetato de goserelina depot, 3,6 mg, a intervalos de 4 semanas, completando un total de 3 viales, asociada a tibolona desde la segunda administración de goserelina hasta la intervención quirúrgica.
-- Grupo 4 (25 pacientes): acetato de goserelina depot, 3,6 mg, a intervalos de 4 semanas, completando un total de 2 viales, asociada a tibolona desde la segunda administración de goserelina hasta la intervención quirúrgica.
-- Grupo 5 (25 pacientes): acetato de goserelina depot, 3,6 mg, a intervalos de 4 semanas, completando un total de 3 viales, asociada a ECE, 0,625 mg, desde la segunda administración de goserelina hasta la intervención quirúrgica.
La exploración ecográfica se realizó por vía abdominal y/o transvaginal mediante un ecógrafo Sonoscope 30 (Kranzbüler. Alemania) con sonda cónvex abdominal de 3,5 MHz y transvaginal de 5 MHz antes de iniciar el tratamiento, y 3-5 semanas después de la última dosis del agonista de GnRH, antes de ser sometidas a la intervención quirúrgica (que se practicó entre 3 y 9 semanas después de la administración del último inyectable de goserelina depot).
El volumen uterino se calculó aplicando una fórmula modificada para el cálculo del volumen del elipsoide: L x AP x T x (4/3) x 3.1416 x 0,524.
Junto a la exploración ecográfica postratamiento, se realizó un estudio analítico en el que se determinaron las concentraciones séricas de hormona foliculoestimulante (FSH), hormona luteinizante (LH) y estradiol.
De las 125 pacientes incluidas inicialmente, 12 no prosiguieron el control en nuestro centro y fueron intervenidas, según la política sanitaria seguida en nuestra comunidad autónoma, en otros centros concertados a tal efecto.
Un grupo de 12 pacientes abandonó el estudio antes de su finalización por diversos motivos y 4 pacientes más fueron intervenidas antes de completar el protocolo de tratamiento (tabla 1).
De las 97 pacientes finales, en 20 de ellas la medición ecográfica del útero para el cálculo del volumen del elipsoide no se practicó de acuerdo con el protocolo de estudio, en alguna de las 2 exploraciones recomendadas, y en 9 pacientes más las determinaciones analíticas se practicaron fuera del período de 3-5 semanas que se estableció para ello (tabla 1).
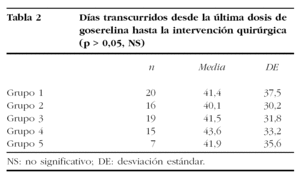
En la última dosis de goserelina se administró una media de 46 días previos a la intervención quirúrgica (46,9 ± 29,5) y no hubo diferencias entre los grupos estudiados (tabla 2).
El tratamiento estadístico se realizó mediante el programa Statview, versión 1.03, propiedad de Abacus Concepts, diseñado para Apple Macintosh, y el programa SPSS, versión 7,5.2 S, propiedad de SPSS Inc., para PC.
Se aplicó un test de normalidad (test de Kolmogorov-Smirnoff). Todas las medias de las variables cuantitativas no mantenían el rango de normalidad y se compararon mediante pruebas no paramétricas (U Mann-Whitney o Kruskal-Wallis, según procediera). Las diferencias se consideraron estadísticamente significativas para un valor de p < 0,05.
RESULTADOS
El análisis de las modificaciones del volumen uterino en los 5 grupos de pacientes (tabla 3) demostró que la reducción más importante se produjo entre las incluidas en los 3 primeros protocolos de tratamiento; hallamos diferencias estadísticamente significativas al comparar las modificaciones en ml (Kruskal-Wallis, p = 0,0079) y próximas a la significación al comparar las modificaciones porcentuales medias respecto al volumen pretratamiento (Kruskal-Wallis, p = 0,0543).
No obstante, cabe destacar que la comparación estadística de las modificaciones medias del volumen uterino de cada uno de los grupos de tratamiento con el grupo control, constituido por las pacientes a las que se administró exclusivamente goserelina, mostró datos interesantes (tabla 4).
No se encontraron diferencias significativas cuando se compararon, mediante la prueba de la U de Mann-Whitney, las reducciones medias (%) del volumen uterino de los grupos de tratamiento 2 y 3 con la reducción media (%) conseguida en el grupo 1 (p = 0,7502 y p = 0,5001, respectivamente).
Sin embargo, al comparar la reducción media (%) del tamaño uterino alcanzada en el grupo de pacientes incluidas en el protocolo de tratamiento 1 con las modificaciones medias (%) conseguidas en las pacientes de los grupos 4 y 5, encontramos diferencias estadísticamente significativas (U de Mann-Whitney, p = 0,0455 y p = 0,004) (tabla 4).
Respecto a los valores hormonales, en todos los grupos se produjo una disminución de las concentraciones séricas medias de estradiol, FSH y LH en la determinación postratamiento practicada en los días que siguieron a la exploración ecográfica.
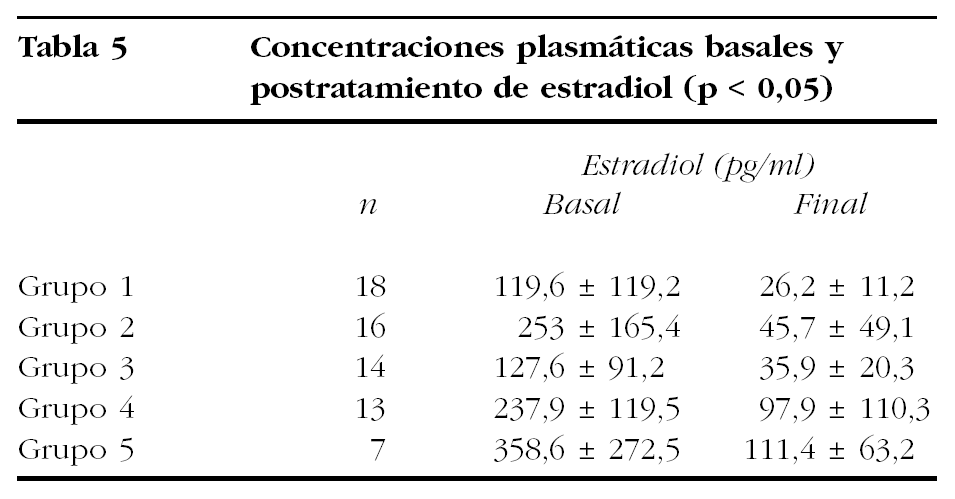
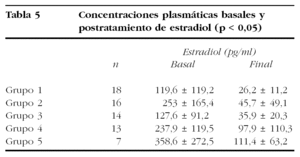
Las concentraciones medias de estradiol (tabla 5) en la analítica basal eran ligeramente inferiores en los grupos de tratamiento 1 y 3, con diferencias significativas (Kruskal-Wallis, p = 0,002). En estos grupos de pacientes, junto con en el grupo 2, se han conseguido menores cifras medias de estradiol postratamiento, con una gran significación estadística en las diferencias entre dichas medias (Kruskal-Wallis, p = 0,0001).
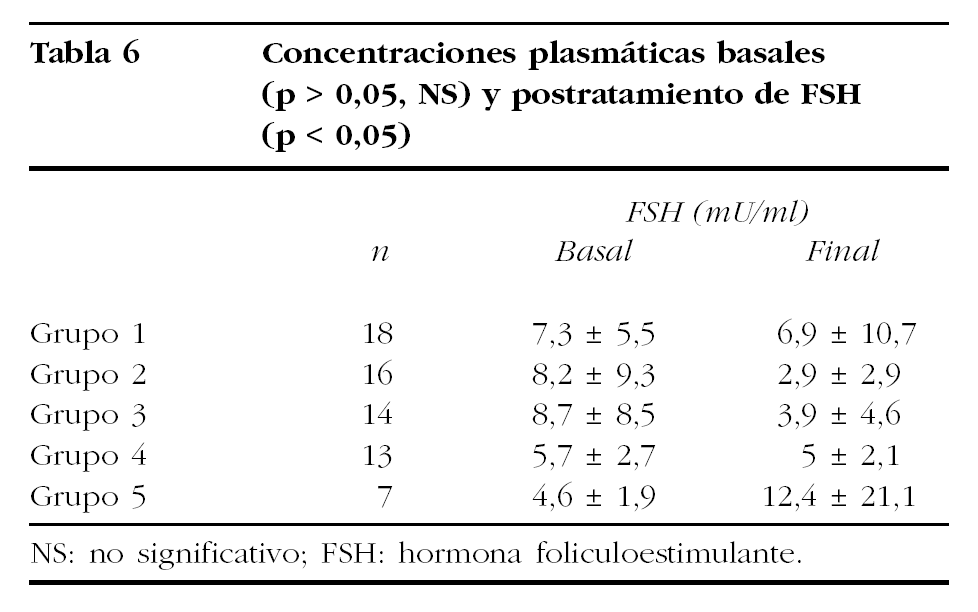
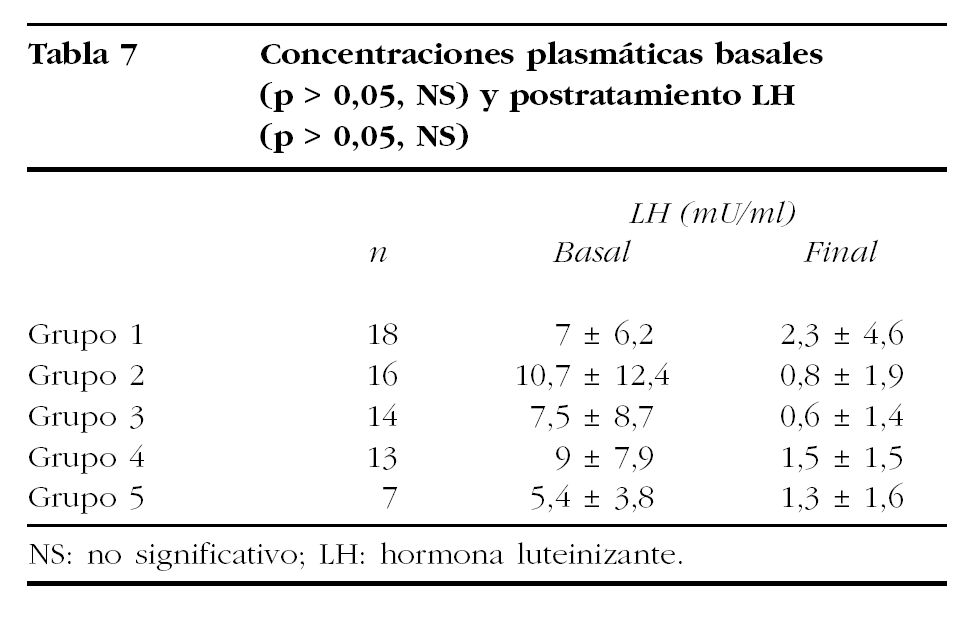
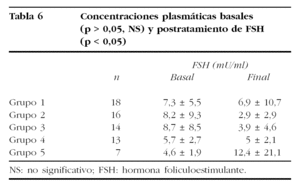
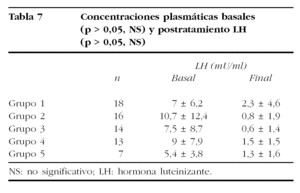
Los valores medios de ambas gonadotropinas quedan reflejados en las tablas 6 y 7. Hay que destacar que las diferencias encontradas en los valores basales de los distintos grupos de tratamiento no fueron significativas (Kruskal-Wallis: FSH, p = 0,4764; LH, p = 0,8615).
La comparación de las concentraciones séricas medias de FSH y LH postratamiento mostró un comportamiento desigual. Mientras la comparación de las medias de FSH sérica mostró diferencias estadísticamente significativas (Kruskal-Wallis, p = 0,0015), no ocurrió lo mismo con los valores medios de LH (Kruskal-Wallis, p = 0,3081).
DISCUSION
Los miomas uterinos (leiomiomas, fibromas, fibromiomas o fibroides) son neoplasias benignas desde el punto de vista histológico y clínico, tan frecuentes en la práctica clínica que pueden detectarse en el 20-25% de las mujeres en edad reproductiva19.
En la etiopatogenia de los leiomiomas se han implicado numerosos factores hormonales (principalmente estrógenos y progestágenos), factores de crecimiento y alteraciones citogenéticas20-25.
Hay evidencias de que los estrógenos y gestágenos están implicados en el origen y el crecimiento de los miomas26-33, y que su efecto estaría mediado por factores de crecimiento, fundamentalmente el factor de crecimiento epidérmico (EGF), los factores de crecimiento insulínico I y II (IGF-I y II), el factor de crecimiento derivado de las plaquetas (PDGF) y el TGF-beta-1 (factor de crecimiento transformante beta 1)34-41.
No es de extrañar, pues, que el hipoestrogenismo hipogonadotropo inducido por la administración de aGnRH se haya mostrado eficaz en la reducción del tamaño de los miomas y el útero miomatoso.
La reducción del tamaño uterino oscila entre el 24 y el 60% del tamaño pretratamiento3,11-14,42-50, después de 3-6 meses de terapia con análogos de GnRH.
Este efecto puede empezar a detectarse a partir de las 4 semanas de haberse iniciado la administración44,48, siendo máxima a los 3 meses de la primera dosis de agonista42,51.
Entre nuestras pacientes, las que recibieron 3 dosis de goserelina depot exclusivamente (grupo 1), la reducción fue del 30% (30,1 ± 16,7).
Este dato es similar a los presentados por otros autores, como Lumsden48 y Miller43, quienes obtienen una reducción del 24,4 y el 23%, respectivamente, tras 3 meses de tratamiento con goserelina depot.
La utilización de otros análogos de GnRH, como triptorelina, leuprolide o nafarelina también se ha mostrado eficaz en la disminución del tamaño del útero miomatoso con resultados variables según los autores, aunque oscilando entre el 12,5%52 y el 61%11 después de 3 meses de tratamiento.
Cuando el tratamiento con análogos se reduce a 8 semanas, Balasch53 ha conseguido disminuir el volumen uterino en un 33,6%, y Golan51 en un 32%.
La disparidad entre los datos aportados en la bibliografía científica y por nosotros mismos se ha tratado de explicar, entre otras teorías, por la distinta sensibilidad de los miomas en función de sus características histológicas.
Podría ser que el contenido de colágeno de los miomas determinara la respuesta al tratamiento con agonistas de GnRH, ya que provocan una hipoplasia de las células a expensas de la reducción de su componente citoplasmático, aunque sin disminución de su número ni evidencia de necrosis o degeneración en su interior45,54.
Respecto al efecto del tratamiento add-back sobre la modificación del tamaño del útero miomatoso, nosotros hemos logrado una reducción media del 25% aproximadamente cuando se administró aGnRH durante 3 meses asociado a tibolona (grupos de tratamiento 2 y 3), un 15% cuando se administraron 2 dosis de aGnRH junto a tibolona (grupo 4) y un 5% cuando se utilizó como terapia add-back en dosis de 0,625 mg de ECE.
Debe tenerse en cuenta que la disminución del estradiol plasmático es el elemento fundamental en la reducción del tamaño tumoral45 y, en este sentido, cabe considerar que entre las pacientes que nosotros tratamos y evaluamos, sólo las incluidas en los grupos de tratamiento 1, 2 y 3 presentaron unas concentraciones medias de estradiol postratamiento propias de supresión hipofisaria (< 50 pg/ml), cuya reducción del tamaño uterino fue igual o superior al 25%. Se ha señalado que el inicio del tratamiento add-back simultáneamente con los aGnRH disminuye la eficacia de éstos en la reducción del volumen uterino55.
Esta afirmación se basa en trabajos como el de West et al56, quienes reducen un 18% el tamaño uterino al iniciar la administración de aGnRH junto al tratamiento add-back con 15 mg de acetato de medroxiprogesterona (AMP), y alcanzaban una reducción del 39% si demoraban 3 meses el tratamiento con el gestágeno. Friedman et al57 sólo consiguieron disminuir un 14% el tamaño uterino al administrar simultáneamente leuprolide y 20 mg diarios de AMP.
Sin embargo, Palomba et al11-13, utilizando 2,5 mg de tibolona como tratamiento add-back durante 6 meses, junto con 3,75 mg de leuprolide depot, desde la primera dosis, no encuentran diferencias significativas en la reducción del volumen uterino al comparar este grupo con otro en que sólo se administró el análogo.
Nosotros tampoco hemos encontrado diferencias en la modificación del tamaño uterino entre los grupos en que la administración de tibolona se inició con la primera o la segunda dosis de goserelina depot (el 26,4 y el 25,1%, respectivamente), o entre éstos y el grupo en que sólo se administró goserelina (30,1%).
Sin embargo, el efecto sobre el tamaño uterino se redujo de una manera considerable cuando sólo se administraron 2 dosis de análogo (15,6%).
Al estudiar los valores séricos de gonadotropinas encontramos concentraciones dispares en los diferentes grupos que establecimos. La reducción de los valores séricos de FSH y LH suele evidenciarse a las 2 semanas de haber iniciado el tratamiento51, y presentar valores inferiores a 5-6 mU/ml, mientras se mantiene su administración51,58.
Según Balasch58, los valores de gonadotropinas (FSH y LH) son poco específicos como índice de supresión hipofisovárica ya que las concentraciones plasmáticas de gonadotropinas inmunorreactivas no reflejan con exactitud la supresión de gonadotropinas biorreactivas mientras se mantiene la administración de agonistas.
Compartimos con este autor esta opinión, ya que en el grupo de pacientes en que se administró sólo goserelina y que sirvió de grupo control en el estudio de la inhibición hipofisovárica, encontramos unas concentraciones de FSH postratamiento ligeramente superiores a las esperadas.
Apoyamos este argumento con el hecho de que fue en este grupo de tratamiento (grupo 1) en el que se consiguieron unas concentraciones medias de estradiol plasmático prequirúrgico más bajas (26,2 ± 11,2).
Este parámetro (estrogenemia inferior a 50 pg/ml) sería, para Balasch58, el mejor indicador de inhibición hipofisaria.
Podemos concluir que en nuestra población de estudio, la terapia add-back con tibolona ha influido mínimamente en la disminución del tamaño del útero miomatoso promovido por goserelina depot, y que la menor regresión observada en otras pacientes parece más un efecto del menor número de dosis de goserelina depot que de la propia tibolona. Además, hemos comprobado que la terapia add-back con 0,625 mg de ECE interfiere en la reducción del tamaño del útero miomatoso, limitándola a un 5%.
Fecha de recepción: 6/7/05
Aceptado para su publicación: 4/4/06
Correspondencia:
Dra. M.R. Espejo Catena.
Servicio de Obstetricia y Ginecología.
Hospital de La Ribera. Alzira.
Avda. Blasco Ibáñez, 88. 46470 Massanassa. Valencia. España.
Correo electrónico: maritaespejo@sego.es