La evaluación del cribado de cáncer de cuello uterino en el sistema público de salud de Cataluña ha identificado, en mujeres de 25-65 años, una cobertura citológica a 3 años del 40,8%; un intervalo entre citologías de 2,4 años y una pérdida de seguimiento del 50% a 3 años. La introducción de la prueba de detección del virus del papiloma humano en el seguimiento de mujeres con resultados citológicos de atipias intraepiteliales de significado indeterminado y como adyuvante a la citología en mujeres con una historia de cribado inadecuada facilita el manejo y detección de las mujeres en riesgo de desarrollar una neoplasia intraepitelial cervical de grado 2 o peor (CIN2+). La prueba de detección del virus del papiloma humano ha demostrado tener una buena sensibilidad y especificidad a tres años para la detección de CIN2+ resultando ser sensiblemente superior a la citología. Por otro lado, ha demostrado tener unos niveles de reproducibilidad altos entre laboratorios y un fácil manejo en situaciones de rutina. El uso de protocolos homogéneos y la existencia de herramientas informáticas de amplio uso han permitido una evaluación equitativa y fiable entre centros. El protocolo ha sido complementado con actividades de formación a profesionales y una monitorización periódica de todas las actividades.
En conclusión, la implantación de un programa de cribado poblacional y la introducción de la prueba de detección del virus del papiloma humano en mujeres mayores de 30 años puede mejorar considerablemente los esfuerzos para la prevención secundaria del cáncer de cuello uterino en Cataluña.
Analysis of the cervical cancer screening activity in the National Health System of Catalonia has identified a cytological coverage at 3 years of 40.8%, an interval of 2.4 years between Pap smears and a loss to follow-up of 50% at 3 years in women aged 25-65 years old. The introduction of human papillomavirus testing in the management of women with cytological results of atypical squamous cell of undetermined significance and as an adjunct to cytology in women with a history of inadequate screening has facilitated the management and detection of women at risk of developing cervical intraepithelial neoplasia grade 2 or worse (CIN2+).
Human papillomavirus testing has demonstrated high sensitivity and specificity at 3 years in the detection of CIN2+and was substantially superior to cytology. Furthermore, it had good inter-laboratory reproducibility and was easy to perform in routine situations. The use of uniform protocols and the extensive availability of software tools have allowed comprehensive and reliable assessment across Catalonia. The protocol has been complemented with educational interventions for healthcare professionals and regular monitoring of all activities.
We conclude that the introduction of organized screening programs and human papillomavirus testing among women older than 30 years can greatly enhance efforts for the secondary prevention of CC in Catalonia.
La detección precoz de lesiones intraepitealiales en el cuello uterino es una medida fundamental para la prevención de formas invasivas y para la reducción de la mortalidad asociada. El impacto de esta prevención depende de la cobertura poblacional y de la calidad de todo el proceso. En España, el cribado de cáncer de cuello uterino se desarrolla en la mayoría de las comunidades autónomas de manera oportunista, es decir, a demanda de la mujer. La cartera de servicios del Sistema Nacional de Salud1 recomienda realizar un cribado citológico entre los 25 y 65 años de edad, el cual se complementa con los protocolos y/o las recomendaciones establecidas por las distintas comunidades autónomas y por las sociedades científicas referentes a este cáncer.
En el año 2006, Cataluña estableció el «Protocolo de las actividades para el cribado de cáncer de cuello uterino en Atención Primaria» (Protocolo 2006)2, con el objetivo de adecuar las actividades preventivas al conocimiento científico sobre dicho cáncer y actualizar y mejorar la efectividad y cobertura de esta actividad.
Las principales recomendaciones que se incluyeron en el Protocolo 2006 fueron:
- 1.
Inicio y fin del cribado: inicio a partir de los 25 años en mujeres sexualmente activas o en su defecto tras tres años de iniciar las relaciones sexuales. En los casos con la primera citología negativa realizar una segunda en el intervalo de un año. Si ambas citologías son negativas realizar cribado mediante citología cada tres años hasta los 65 años de edad.
- 2.
Identificación de cribado inadecuado: identificar a todas las mujeres de 40 años o más sin evidencia de citología previa en los últimos cinco años. Facilitar el acceso al cribado y realizar una citología y una prueba de detección del ADN del virus del papiloma humano (VPH) para tipos de alto riesgo oncogénico. Si ambas pruebas son negativas, establecer un cribado citológico cada tres años. En mujeres mayores de 65 años con ambas pruebas negativas finalizar el protocolo de cribado.
- 3.
Seguimiento de un resultado citológico de células escamosas atípicas de significado indeterminado (ASC-US): realizar una prueba de detección del ADN del VPH para tipos de alto riesgo oncogénico. Si la prueba VPH es negativa, realizar un cribado citológico cada tres años.
- 4.
Seguimiento posconización en pacientes con lesiones intraepiteliales: realizar una prueba de detección del VPH para tipos de alto riesgo oncogénico a los 6 meses después del tratamiento.
- 5.
Captación: el Protocolo 2006 refuerza el papel de las Áreas Básicas de Salud (ABS) en Atención Primaria para mejorar la identificación de mujeres susceptibles de cribado e implica a las matronas en la toma de muestras.
El objetivo del presente estudio es evaluar la actividad preventiva global generada por el «Protocolo de las actividades para el cribado de cáncer de cuello uterino en Atención Primaria» desarrollado en Cataluña durante el período 2006-2012 dentro del sector público y en particular en los centros de Atención Primaria que tienen como proveedor al Institut Català de la Salut y que dan cobertura al 75,1% de la población residente en Cataluña, dada la disponibilidad de un sistema de recogida de la información común para todos los centros que facilita la homogenización y explotación de los datos.
De manera más detallada, se incluyen el análisis de la cobertura poblacional general y del intervalo entre citologías, cobertura por población inmigrante, la evaluación de la prueba de detección del VPH en las mujeres con un cribado inadecuado y en el seguimiento de los casos de ASC-US y finalmente, la evaluación de los aspectos organizativos de los Centros de Atención a la Salud Sexual y Reproductiva de la mujer (ASSIR), lo que es equivalente a centros de ginecología de primer nivel.
Algunos de los aspectos derivados del Protocolo 2006 han sido objeto de publicaciones previas a las cuales referimos en la bibliografía para mayor detalle de los procesos3–7.
Material y métodosDado el carácter oportunista del cribado sin un sistema de recogida de la información específica, para analizar la actividad generada por el Protocolo 2006 se han utilizado distintas fuentes de información:
Sistema de Información de los Servicios de Atención Primaria (SISAP)El SISAP incluye la actividad asistencial pública de aproximadamente seis millones de usuarios en Cataluña (75,1% de las personas residentes). Mediante esta fuente de información se han evaluado los indicadores de cobertura citológica en el sistema público, el intervalo de cribado, el número de pruebas de detección de VPH realizadas, la captación de mujeres con un cribado inadecuado y la identificación y el seguimiento de mujeres con resultados citológicos de ASC-US/células glandulares atípicas de significado indeterminado (AGC).
PoblaciónEsta evaluación incluye a la población femenina de 15 años o mayor asignada a las ABS de Cataluña y a un ASSIR ambos gestionados por el Institut Català de la Salut. Se define como población asignada el número de mujeres de 15 años o mayores asignadas a un ABS cuyo ASSIR de referencia tenía como proveedor el Institut Català de la Salut, mientras que entendemos como población atendida el número de mujeres asignadas que requirieron de alguna actividad asistencial durante el período de estudio.
Variables de estudioLas variables utilizadas fueron código de identificación del paciente encriptado, país y fecha de nacimiento de la mujer, tipo de prueba de cribado realizada (citología o determinación del VPH), resultado de la prueba según nomenclatura Bethesda8 y región sanitaria, fecha y ABS de registro de la prueba. La edad de la paciente se calculó a partir de la fecha de nacimiento y la fecha de realización de la prueba de cribado y se estratificó en cinco grupos de edad: 15-24, 25-39, 40-65, 66-69 y ≥69 años. Además se construyó el grupo de edad de 25-65 años, que corresponde a la población diana del cribado de cáncer de cuello uterino. Se calcularon los indicadores de cobertura citológica, intervalo entre citologías y el número de pruebas de detección del VPH realizadas de manera anual y para el período 2008-2011 con sus respectivos intervalos de confianza al 95% (IC95%)4.
El impacto potencial de la inmigración en el cribado se evaluó comparando la actividad de cribado según el país de nacimiento registrado en el SISAP5.
El intervalo entre citologías se evaluó mediante el seguimiento de la cohorte de mujeres que durante el año 2008 se realizó una primera citología y el resultado fue negativo4.
Las bases de datos utilizadas no incluían identificadores personales de las mujeres, y por tanto, se mantuvo el anonimato durante todo el proceso de análisis. Todos los análisis se realizaron tanto para las mujeres asignadas como atendidas.
Registro de la prueba de detección del ADN del VPHPara el período 2006-2009 se utilizó un registro en formato papel de todas las pruebas de detección del VPH, con el objetivo de garantizar una monitorización al introducir esta prueba de forma rutinaria para grupos específicos de población en Atención Primaria. Posteriormente, esta información, de manera más simplificada, se obtuvo a partir del SISAP (ver sección 1). Las variables de este registro en papel incluían: edad de la mujer en el momento de la recogida de la muestra, motivo de la solicitud, fecha y resultado de la citología previa, fecha y resultado de la prueba de VPH previa, recogida de citología simultánea al VPH, fecha de tratamiento quirúrgico si lo hubiere, centro de recogida y fecha y resultado de la prueba de VPH.
Registro informático de los centros de Anatomía PatológicaPara evaluar prospectivamente el impacto de la introducción de la prueba de detección del VPH y de la citología es necesario disponer de la información de posibles biopsias tomadas en mujeres con resultados positivos en la citología y/o detección del VPH. Para ello y dado que el SISAP no permitía obtener de forma fiable la información de histología, se contactó con laboratorios de Anatomía Patológica que disponían, en 2007, de registros informáticos de las historias clínicas. Finalmente, se incluyeron los registros de los siguientes Servicios de Anatomía Patológica: Hospital Universitario Dr. Josep Trueta, Consorci Hospitalari de Vic, Hospital Universitari Joan XXIII, Hospital del Mar, Hospital Universitari de Bellvitge, Hospital de Granollers, Hospital de Althaia y Laboratorio de Atención Primaria Dr. Robert. El objetivo fue evaluar el uso de la prueba de VPH en la predicción de la neoplasia intraepitelial cervical de grado 2 o peor (CIN2+) confirmada histológicamente, en los siguientes casos:
- 1)
Mujeres con un resultado de ASC-US diagnosticado durante el período 2007-2008, a las que se les realizó al menos una prueba de detección del VPH durante los 6 meses siguientes. Se incluyeron un total de 611 mujeres3.
- 2)
Mujeres identificadas con un cribado inadecuado según los criterios establecidos en protocolo 2006, a las que se les realizó una prueba de detección de VPH concomitante a la citología. Se incluyeron un total de 1.832 mujeres identificadas durante el período 2007-20087.
El seguimiento de todas ellas se realizó mediante la historia clínica informatizada, en la que se incluían datos de citologías, pruebas de detección de VPH y biopsias. El seguimiento fue individualizado durante al menos 3,5 años desde su captación o hasta el desarrollo de una lesión CIN2+ confirmada histológicamente. Las bases de datos fueron anónimas, los resultados citológicos siguieron la nomenclatura Bethesda8, los resultados de VPH se clasificaron como positivos o negativos y los resultados histológicos siguieron la clasificación CIN3,7. El proyecto general fue aprobado por el Comité de Ética del Instituto de Investigación Biomédica de Bellvitge.
Análisis estadísticosLa comparación entre categorías se realizó mediante una prueba de t de Student para las variables continuas y una prueba de chi-cuadrado para las variables categóricas. Para el análisis prospectivo de la información, se construyó la variable personas-año para disponer de un numerador que tuviese en cuenta el seguimiento real de cada mujer desde el inicio del estudio.
El riesgo de desarrollar lesiones CIN2+ confirmadas histológicamente se estimó en base a la combinación de resultados de citología y VPH al inicio del estudio mediante el método de Kaplan-Meier y un análisis de regresión logística ajustado por edad y centro para calcular la razón de probabilidades (odds ratio)3,7.
En ambos grupos, la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para detectar CIN2+ con un IC95% se calcularon para la citología, la prueba de VPH y la combinación de ambas estrategias en relación a los datos histológicos a tres años de la entrada del estudio3,7.
Control de calidad de la prueba VPH entre los laboratorios de referenciaDurante el período 2008-2011 se realizó un control de calidad de la técnica utilizada para la detección del VPH entre los 12 laboratorios de referencia de Cataluña (Hospital Universitario Dr. Josep Trueta, Consorci Hospitalari de Vic, Hospital Universitari Joan XXIII, Hospital del Mar, Hospital Universitari de Bellvitge-Institut Català d’Oncologia, Hospital Clínic, Hospital Universitari Vall d’Hebron, Hospital Universitari Verge de la Cinta, Hospital Universitari Arnau de Vilanova, Consorci Sanitari Parc Tauli y los laboratorios de Atención Primaria Doctor Robert y Bon Pastor). El objetivo fue evaluar la reproducibilidad de la técnica utilizada, la captura de híbridos (HC2; Qiagen, Gaithersburg, MD, USA) y la tasa de error entre los laboratorios de referencia para la prueba (reproducibilidad intralaboratorio) durante el período 2008-2011, con el fin de asegurar la exactitud de los resultados obtenidos y garantizar de esta manera un programa de cribado de cáncer de cuello uterino de calidad. El control de calidad se centralizó en el Hospital Universitari Bellvitge-Institut-Català d’Oncologia que recibió de cada laboratorio 20 muestras anuales de los 3 meses previos. A su vez las muestras analizadas en el Hospital Universitari de Bellvitge-Institut-Català d’Oncologia fueron retestadas durante el año 2008 en el Consorci Hospitalari de Vic y durante el período 2009-2011 en el Hospital del Mar. Se realizó un análisis de concordancia mediante el estadístico Kappa9 y una regresión lineal para determinar los niveles de acuerdo entre los resultados originales y las lecturas del control de calidad tanto a nivel categórico (positivo/negativo) como a nivel continuo. La naturaleza y el origen de los resultados discrepantes se calcularon mediante bootstrapping6.
Encuesta sobre la organización y funcionamiento del cribado en los centros ASSIRPara conocer la organización y el funcionamiento de las actividades preventivas del cáncer de cuello uterino en el ámbito de la Atención Primaria, y con objeto de identificar las áreas de mejora, se realizó un cuestionario dirigido a los coordinadores de los centros ASSIR solicitando información sobre: a) protocolos de actuación, b) implicación y tareas de los profesionales de la salud y del personal administrativo de soporte en la actividad de cribado, c) acciones dirigidas a la captación de mujeres con cribado inadecuado, d) soporte informático, sistemas de información y comunicación, e) utilización del material de educación sanitaria dirigido a la población, f) formación continuada de los profesionales de la salud y g) sistemas de evaluación. Participaron un total de 42 centros ASSIR y la encuesta fue contestada en el 52,4% por ginecólogos-obstetras y en el 47,6% por matronas.
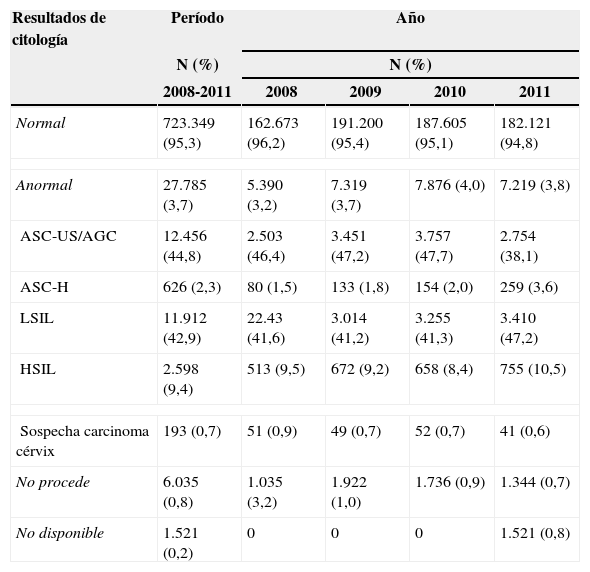
ResultadosCobertura, intervalo de cribado y resultados citológicosEn Cataluña durante el período 2008-2011 en el ámbito del Sistema Nacional de Salud se realizaron 758.690 citologías correspondientes a 595.868 mujeres mayores de 15 años. La cobertura citológica en mujeres entre 25 y 65 años que asistieron a un centro de Atención Primaria fue del 40,8% (tabla 1), mostrando bastante variabilidad entre las diferentes regiones sanitarias siendo las tres regiones sanitarias de Barcelona (Barcelona Ciudad, Barcelona Sud y Barcelona Norte) las que registraron una mejor cobertura de cribado (tabla 2). Un 3,7% de las citologías cervicales fueron informadas como positivas cuya distribución fue: ASC-US/AGC (44,8%), células escamosas atípicas en las que no se puede descartar una lesión de alto grado (ASC-H), (2,3%), lesión intraepitelial escamosa de bajo grado (42,9%), lesión intraepitelial escamosa de alto grado (9,4%) y sospecha de carcinoma (0,7%), (tabla 3). El intervalo medio entre dos pruebas de cribado, a partir de una primera citología negativa se estimó en 2,4 años. Aproximadamente un 50% de las mujeres no volvieron a una segunda ronda de cribado en el período de 3 años después de una citología negativa4.
Cobertura citológica por grupos de edad en mujeres asignadas y atendidas en centros de Atención Primaria públicos en Cataluña durante el período 2008-2011
| Grupos de edad | Mujeres con citología | Mujeres asignadas | Mujeres atendidas | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N | N | % citologías | IC95% | N | % citologías | IC95% | |||
| 15-24 | 67.693 | 272.731 | 24,8 | 24,7 | 25,0 | 204.378 | 33,1 | 32,9 | 33,3 |
| 25-39 | 225.504 | 687.663 | 32,8 | 32,7 | 32,9 | 512.870 | 44,0 | 43,8 | 44,1 |
| 40-65 | 280.685 | 875.038 | 32,1 | 32,0 | 32,2 | 729.235 | 38,5 | 38,4 | 38,6 |
| 66-69 | 13.760 | 93.512 | 14,7 | 14,5 | 14,9 | 87.115 | 15,8 | 15,6 | 16,0 |
| >69 | 8.226 | 363.621 | 2,3 | 2,2 | 2,3 | 340.932 | 2,4 | 2,4 | 2,5 |
| 25-65 | 506.189 | 1.562.701 | 32,4 | 32,3 | 32,5 | 1.242.105 | 40,8 | 40,7 | 40,8 |
| Total | 595.868 | 2.292.564 | 26,0 | 25,9 | 26,1 | 1.874.530 | 31,8 | 31,7 | 31,9 |
IC95%: intervalo de confianza al 95%.
Cobertura citológica por regiones sanitarias y grupos de edad en mujeres asignadas y atendidas en centros de Atención Primaria públicos en Cataluña durante el período 2008-2011
| Región sanitaria | % Cobertura población asignada | % Cobertura población atendida | ||
|---|---|---|---|---|
| 25-65 años | ≥15 años | 25-65 años | ≥15 años | |
| Alt Pirineu - Aran | 15,5 | 11,4 | 18,4 | 13,3 |
| Barcelona (Sud) | 36,9 | 30 | 46,4 | 36,8 |
| Barcelona (Ciutat) | 30,2 | 23,7 | 41,6 | 31 |
| Barcelona (Nord) | 37,1 | 30,6 | 45,5 | 36,7 |
| Camp de Tarragona | 29 | 23,7 | 35,8 | 28,6 |
| Catalunya Central | 26,8 | 21,4 | 31,7 | 24,9 |
| Girona | 31 | 24,7 | 39 | 30,4 |
| Lleida | 24,8 | 19,2 | 29,6 | 22,3 |
| Terres de l’Ebre | 16,1 | 12,3 | 19,2 | 14,3 |
Resultados de las citologías generadas durante el período 2008-2011 y por años individuales en centros de Atención Primaria públicos en Cataluña
| Resultados de citología | Período | Año | |||
|---|---|---|---|---|---|
| N (%) | N (%) | ||||
| 2008-2011 | 2008 | 2009 | 2010 | 2011 | |
| Normal | 723.349 (95,3) | 162.673 (96,2) | 191.200 (95,4) | 187.605 (95,1) | 182.121 (94,8) |
| Anormal | 27.785 (3,7) | 5.390 (3,2) | 7.319 (3,7) | 7.876 (4,0) | 7.219 (3,8) |
| ASC-US/AGC | 12.456 (44,8) | 2.503 (46,4) | 3.451 (47,2) | 3.757 (47,7) | 2.754 (38,1) |
| ASC-H | 626 (2,3) | 80 (1,5) | 133 (1,8) | 154 (2,0) | 259 (3,6) |
| LSIL | 11.912 (42,9) | 22.43 (41,6) | 3.014 (41,2) | 3.255 (41,3) | 3.410 (47,2) |
| HSIL | 2.598 (9,4) | 513 (9,5) | 672 (9,2) | 658 (8,4) | 755 (10,5) |
| Sospecha carcinoma cérvix | 193 (0,7) | 51 (0,9) | 49 (0,7) | 52 (0,7) | 41 (0,6) |
| No procede | 6.035 (0,8) | 1.035 (3,2) | 1.922 (1,0) | 1.736 (0,9) | 1.344 (0,7) |
| No disponible | 1.521 (0,2) | 0 | 0 | 0 | 1.521 (0,8) |
Los porcentajes de las alteraciones citológicas son entre las citologías anormales.
AGC: células glandulares atípicas de significado indeterminado; ASC-H: células escamosas atípicas en las que no se puede descartar una lesión de alto grado; ASC-US: células escamosas atípicas de significado indeterminado; HSIL: lesión intraepitelial escamosa de alto grado; LSIL: lesión intraepitelial escamosa de bajo grado.
Entre la población inmigrante, durante el período de estudio se realizaron 115.488 citologías a 91.427 mujeres. El 51% de las mujeres procedían de Marruecos, Ecuador, Bolivia, Colombia y Rumania. La cobertura citológica y la proporción de citologías positivas entre la población de 25 a 65 años de edad fue significativamente más elevada entre las inmigrantes que entre las mujeres españolas (51 versus 39% y 4,5 versus 3% respetivamente). Las mujeres procedentes de las regiones de América del Norte (6,9%), América Central (6,8%) y oeste de Europa (5,8%) presentaron mayor prevalencia de citología anormal, en cambio las mujeres procedentes de Oceanía (0%) y norte de África (2,6%) presentaron los porcentajes más bajos de citología anormal. Por otro lado, la participación en la segunda ronda de cribado entre las mujeres con una citología normal fue menor entre las mujeres inmigrantes (43,1%) que entre las mujeres españolas (50,7%)5.
Evaluación y monitorización de la prueba de VPHDurante el período 2006-2012 se realizaron un total de 116.970 pruebas de detección de VPH en toda Cataluña, 68% de las cuales seguían las indicaciones del Protocolo. La mayor parte de las pruebas realizadas según el Protocolo 2006, se obtuvieron en mujeres con cribado inadecuado (68,5%), siendo positivas el 6,3%. La determinación de VPH en el seguimiento del ASC-US representó un 24% con un porcentaje de positividad del 48,1% (fig. 1).
La evaluación de la prueba de VPH concomitante a la citología cervical entre las mujeres con cribado inadecuado se realizó en un grupo de 1.832 mujeres (edad media 54,1 años, rango 40-88 años)7. La mayoría (92,4%) tenían ambas pruebas de cribado negativas. Se excluyeron del protocolo por edad mayor de 65 años y ambas pruebas negativas un total de 338 mujeres mientras que en 1.494 mujeres se les realizó un seguimiento de al menos 3,5 años, de las que tan solo 767 mujeres (51,3%) volvieron a la segunda ronda de cribado (fig. 2). La mayor pérdida de seguimiento se observó en las mujeres con ambas pruebas negativas en comparación con aquellas que tenían al menos una prueba positiva (p <0,05).
Resultado de la prueba de detección del VPH y la citología concomitante al inicio del estudio de los casos identificados con un cribado inadecuado que al final del período de seguimiento desarrollaron una lesión CIN2+.
CIN2+: neoplasia cervical intraepitelial de grado 2 o peor. Se entiende por citología positiva cuando el resultado es de ASC-US o peor; Cito-: citología con resultados negativos; Cito+: citología con resultados positivos; VPH-: resultado negativo para la prueba de detección del VPH; VPH+: resultado positivo para la prueba de detección de VPH.
El 2,2% de las mujeres tuvieron un resultado positivo en la citología mientras que la positividad para la prueba de VPH fue del 6,7%. Tan solo el 1,3% de las mujeres tuvieron ambas pruebas positivas una vez fueron identificadas. Entre las mujeres VPH positivas, el 19,5% tenía una citología concomitante anormal. Al final del período de seguimiento, se confirmaron histológicamente nueve casos de CIN2, siete de CIN3 y dos cánceres infiltrantes (18/767, 2,3%). Todos los casos menos un caso de CIN2 fueron diagnosticados en mujeres VPH positivas (fig. 2). Los dos cánceres infiltrantes (un carcinoma escamoso en estadio 2 y un adenocarcinoma en estadio 1 tuvieron una citología de ASC-US y AGC respectivamente al inicio. Las mujeres con CIN2/3 tuvieron una citología concomitante normal en el 56% de los casos. Las mujeres con prueba VPH negativa al inicio siguieron siendo negativas hasta el final del seguimiento en el 96,2% de los casos.
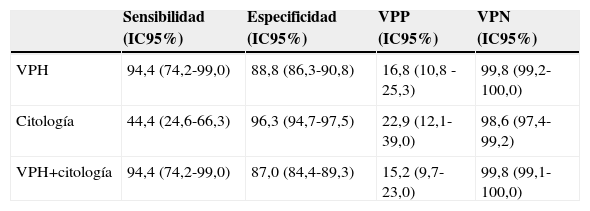
La sensibilidad prospectiva a tres años de la prueba de VPH en la detección de CIN2+ confirmado histológicamente fue mayor que la de la citología e igual a la de la combinación de ambas pruebas (94,4 y 44,4% respectivamente). Sin embargo, la especificidad y el VPP fueron superiores en la citología (96,3 y 22,9%, respectivamente) comparada con los de la prueba de detección del VPH sola (88,8 y 16,8% respectivamente) o con los de la combinación de ambas pruebas (87,0 y 15,2% respectivamente). El VPN fue muy alto en cualquiera de las tres estrategias (tabla 4)7.
Precisión de la prueba de detección del VPH, citología y la combinación de ambas pruebas para la predicción de CIN2+ en mujeres con un cribado inadecuado (análisis basado en 767 observaciones)*
| Sensibilidad (IC95%) | Especificidad (IC95%) | VPP (IC95%) | VPN (IC95%) | |
|---|---|---|---|---|
| VPH | 94,4 (74,2-99,0) | 88,8 (86,3-90,8) | 16,8 (10,8 -25,3) | 99,8 (99,2-100,0) |
| Citología | 44,4 (24,6-66,3) | 96,3 (94,7-97,5) | 22,9 (12,1-39,0) | 98,6 (97,4-99,2) |
| VPH+citología | 94,4 (74,2-99,0) | 87,0 (84,4-89,3) | 15,2 (9,7-23,0) | 99,8 (99,1-100,0) |
CIN2+: neoplasia cervical intraepitelial de grado 2 o peor; IC95%: intervalo de confianza al 95%; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
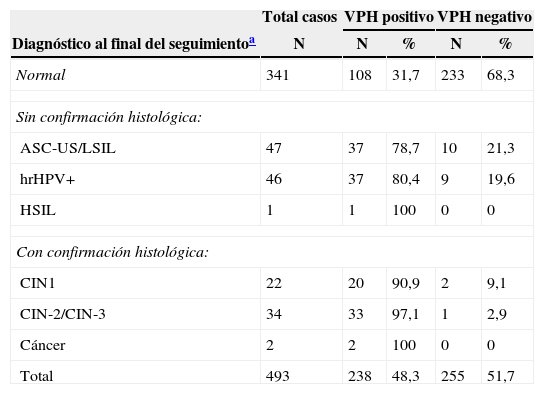
En la evaluación de la prueba de VPH para la predicción de casos CIN2+ en mujeres con citología ASC-US, se analizaron 611 mujeres (edad media de 34,5 años, rango 15-79 años) de las que se obtuvo seguimiento en 493 casos (80,7%) siendo el 48,3% positivas para la prueba VPH.
Casi la totalidad de las lesiones CIN2+ confirmadas histológicamente se identificaron en el grupo VPH positivo (35/36). En este grupo, se identificó un carcinoma escamoso en estadio 2 y un adenocarcinoma mucinoso en estadio 3. Ninguna mujer con resultado VPH negativo desarrolló CIN3 o más durante el intervalo de seguimiento de 3 años y el 91,4% presentó un diagnóstico final negativo para lesión intraepitelial. Tan solo un caso (0,4%) se diagnosticó de CIN2 (tabla 5). La sensibilidad de la prueba de VPH para detectar lesiones CIN2+ con confirmación histológica fue del 97,2% (IC 95%=85,5 - 99,9) y la especificidad del 68,3% (IC95%=63,1-73,2). El VPP de la determinación de VPH fue del 14,3% y el VPN del 99,6% después de un período de seguimiento de 3 años3.
Diagnóstico después del seguimiento mínimo de 3 años de 493 mujeres con citología de ASC-US en función de los resultados de la prueba de detección de VPH
| Total casos | VPH positivo | VPH negativo | |||
|---|---|---|---|---|---|
| Diagnóstico al final del seguimientoa | N | N | % | N | % |
| Normal | 341 | 108 | 31,7 | 233 | 68,3 |
| Sin confirmación histológica: | |||||
| ASC-US/LSIL | 47 | 37 | 78,7 | 10 | 21,3 |
| hrHPV+ | 46 | 37 | 80,4 | 9 | 19,6 |
| HSIL | 1 | 1 | 100 | 0 | 0 |
| Con confirmación histológica: | |||||
| CIN1 | 22 | 20 | 90,9 | 2 | 9,1 |
| CIN-2/CIN-3 | 34 | 33 | 97,1 | 1 | 2,9 |
| Cáncer | 2 | 2 | 100 | 0 | 0 |
| Total | 493 | 238 | 48,3 | 255 | 51,7 |
ASC-US: célula escamosa atípica de significado indeterminado, CIN1: lesión intraepitelial cervical de grado 1; CIN2: lesión intraepitelial cervical de grado 2; CIN3: lesión intraepitelial cervical de grado 3; HSIL: lesión intraepitelial escamosa de alto grado; LSIL: lesión intraepitelial escamosa de bajo grado; VPH+: positivo en la prueba del virus del papiloma humano.
La odds ratio para el desarrollo de CIN2+ al comparar mujeres con citología de ASC-US y prueba VPH positiva versus VPH negativa fue de 45,3 (IC 95%=6,2-333,0) veces superior entre las VPH positivas que entre las negativas3.
Entre las 255 mujeres ASC-US VPH negativas, el 85,1% fueron examinadas al menos una vez por un ginecólogo en un intervalo inferior a los 3 años y con toma de muestra para citología.
Control de calidad interlaboratorio de la prueba de VPH HC2Un total de 946 muestras recogidas para la determinación de VPH durante el período 2008-2011 fueron evaluadas en un segundo laboratorio según criterios preestablecidos6. El coeficiente global de correlación entre el resultado original y el obtenido en el control de calidad fue de 0,95 (p<0,05) para los resultados de los valores de la RLU, unidad con la se expresan los resultados de HC2. El valor de Kappa para la clasificación categórica positiva/negativa fue de 0,91 representando un excelente acuerdo global entre laboratorios6.
Organización y funcionamiento del cribado en los centros ASSIRTodos los centros ASSIR, excepto uno, afirmaron disponer de criterios de actuación unificados. De estos, un 83,3% seguían las indicaciones establecidas en el Protocolo 2006, mientras que un 16,7% referían seguir, también las recomendaciones de la Sociedad Española de Ginecología y Obstetricia y la Asociación Española de Patología Cervical y Colposcopia.
Si bien se observó una cierta variabilidad en la estructura organizativa y funcionamiento del cribado de cáncer de cuello uterino entre los distintos territorios, la actividad de cribado se desarrolló mayoritariamente de forma multidisciplinar. En el conjunto de centros, la identificación de las mujeres candidatas a cribado se realizó por matronas (52%) o por el personal administrativo (23,8%). La toma de muestras (tanto de citología como de la prueba VPH) la efectuaron principalmente las matronas (66,7%), seguido de ginecólogos-obstetras (23,8%) y enfermería (7%). La comunicación de los resultados de la citología la realizaron tanto ginecólogos-obstetras como matronas en porcentajes similares (50 y 40,5%, respectivamente), mientras que la comunicación de los resultados de las pruebas VPH la realizaron más frecuentemente los ginecólogos-obstetras (59,5%) que las matronas (35,7%).
La disponibilidad de sistemas de alerta para identificar a las mujeres que no se realizan habitualmente el cribado estaba disponible en el 5% de los centros mientras el 59,5% realizaban esta identificación a las mujeres que acudían por cualquier motivo al centro sanitario. Algunos centros manifestaron que la coordinación con los equipos de atención primaria facilitaba la captación de las mujeres con un cribado insuficiente, a la vez que destacaron el papel facilitador de las entidades sociales que trabajan con poblaciones de riesgo socialmente desfavorecidas. Casi todos los centros (97,6%) realizaron alguna actuación sistemática (ejemplo: llamada telefónica), para contactar con las mujeres que tras un resultado anormal en la citología o prueba VPH no acudían a la visita.
Más de la mitad de los centros (54,8%) utilizó la historia clínica informatizada (compatible con otros centros), sin embargo, menos del 40% registraron los resultados de las pruebas en formato electrónico. Concretamente, se registraron en la historia clínica electrónica los resultados del 40,5% de las citologías, el 28,6% de las pruebas VPH, del 40,5% de las colposcopias, y del 35,7% de las biopsias, siendo el registro manual en el resto de casos.
En la mayoría de los centros (97,6%), el cribado del cáncer de cuello uterino formaba parte de los objetivos de salud anuales de los profesionales con sistemas de evaluación de la actividad de cribado relacionados con la cobertura y procesos. Asimismo un 73,8% de los centros realizó una formación educativa específica a los profesionales sobre las actividades preventivas del cáncer de cuello uterino aunque esta se llevó a cabo con una periodicidad irregular.
Información y formación a profesionales y población generalDurante el período 2006-2012 se realizaron dos campañas informativas dirigidas a la población general y múltiples conferencias a profesionales. Se ofreció un curso gratuito on-line a los profesionales implicados en el cribado, con el objetivo de reforzar los contenidos del Protocolo 2006 y su aplicabilidad durante la práctica clínica. Dicho curso también incluyó un conocimiento básico sobre la vacuna VPH. Completaron el curso más de 1.500 profesionales en Cataluña. Además, se distribuyó el Protocolo 2006 y un algoritmo resumen sobre las indicaciones de la prueba VPH a todos los centros implicados. Toda esta información estaba accesible en la web del «Canal Cancer del Departament de Salut de la Generalitat de Catalunya»10.
Para las campañas de información dirigidas a la población se dispuso de trípticos de información general sobre el cribado, de información en caso de resultados de citología anormales, pósteres y opúsculos con información más extensa sobre el cribado, el VPH y las vacunas frente al VPH (fig. 3). Así mismo, se realizaron actuaciones de difusión en los medios de comunicación (radio y prensa).
DiscusiónEl análisis de las actividades de cribado de cáncer de cuello uterino, dentro del Sistema Nacional de Salud de Cataluña, permiten conocer, adecuar y mejorar las recomendaciones de la actividad preventiva realizada desde la Atención Primaria11. Por primera vez en la comunidad autónoma de Cataluña se dispone de información directa de la cobertura del cribado del cáncer de cuello de útero, su periodicidad y los resultados de dichas intervenciones11.
En este trabajo se constata que en Cataluña, la cobertura del cribado de cáncer de cuello uterino a 3 años en el sistema público es del 40,8% en mujeres entre los 25 y 65 años. Si bien existen diferencias significativas de cobertura entre áreas geográficas, es evidente que el cribado oportunista tiene más posibilidades de cribar repetidamente a un mismo grupo de mujeres y de no hacerlo en mujeres no sensibilizadas con la prevención de este cáncer. Datos recientes nos confirman que una actuación organizada podría reducir considerablemente el número de mujeres mal cribadas12, lo que está en acuerdo con las recomendaciones europeas y las sociedades científicas pertinentes13–15. Una mayor organización de las actividades preventivas permitiría reclutar a las mujeres para la siguiente ronda de cribado y evitar así la pérdida de aquellas mujeres que difícilmente siguen las intervenciones preventivas. En nuestro caso, el hecho de que solo un 50% de las mujeres acudieron a la segunda ronda de cribado, reafirma la conveniencia de establecer recordatorios. La organización del cribado podría, sin duda, disminuir las diferencias sociales observadas en nuestra población de inmigrantes, en las que la regularidad del cribado fue inferior a la observada en la población nativa5. En Cataluña el cribado del cáncer de cuello de útero se realiza de forma protocolizada, sin embargo, esto dista de tener un amplio impacto entre la población. A pesar de que es posible que la cobertura real en el sector público sea superior a la observada y que las mejores estimaciones sugieren una cobertura de cribado del 70% a 3-5 años16, la ausencia de controles de calidad y de medidas fiables sobre dicha actividad hace que se trate de un modelo poco eficiente. Los esfuerzos llevados a cabo para la coordinación de las actividades preventivas incluidas en el Protocolo 2006 hubieran tenido un mayor impacto si se hubiesen integrado dentro de un programa de cribado poblacional17–19. Se ha constatado que los distintos profesionales implicados en cribado del cáncer de cuello de útero están integrados en la Atención Primaria realizando la actividad de manera multidisciplinar, con una amplia participación de la matrona tanto en la identificación de las mujeres tributarias de cribado, como en la toma de muestras y la comunicación de resultados de la citología11. Este formato puede ser muy útil a la hora de implantar un cribado poblacional.
Un aspecto destacable sobre las recomendaciones del cribado del cáncer de cuello de útero en Cataluña es la introducción de la prueba de detección del VPH en la identificación de mujeres con cribado inadecuado y la selección de mujeres con citología ASC-US2. En mujeres con cribado inadecuado, la prueba VPH ha demostrado tener una mayor predicción de lesiones CIN2+ histológicas que la citología, lo que facilita la identificación de mujeres en riesgo y proporciona un VPN muy elevado a 3 años. La sensibilidad clínica para la detección de lesiones CIN2+ de la prueba de VPH superó en un 50% a la detección de la citología lo que confirma los resultados de otros trabajos20–22. Por otro lado, entre las mujeres con una citología de ASC-US, la detección del VPH selecciona claramente el grupo de mujeres con un alto riesgo subyacente de desarrollar CIN2+. En este sentido, es relevante monitorizar las pruebas complementarias que se realicen en el seguimiento de las mujeres con citología de ASC-US y una prueba VPH negativa para evitar la práctica de pruebas innecesarias.
La detección del VPH mediante HC2 utilizada en el Protocolo 2006, está avalada por su excelente sensibilidad clínica, y por ser una técnica altamente validada, automatizada, reproducible y de fácil implantación. Los controles de calidad han sido excelentes, con valores de concordancia entre laboratorios superiores al 90%6.
Es importante destacar que la prueba de VPH en el Protocolo 2006 se ha indicado a grupos de mayor riesgo de cáncer cervical2. La extensión de dicha prueba a la población general se debería realizar de forma controlada para su adecuada implementación. Es destacable que la prueba VPH en el Protocolo 2006 siempre se realizó bajo una monitorización estricta de su uso, acompañado de controles de calidad anuales6,11. Es recomendable informar adecuadamente de la prueba VPH tanto a profesionales de la salud como a las mujeres con tal de adecuar correctamente su uso y ampliar los intervalos de cribado para evitar el sobrediagnóstico de infecciones transitorias por VPH. Varios países han incorporado la prueba de VPH en el cribado primario como prueba única o asociada a la citología (EE. UU., Holanda)23–25. En España ocho sociedades científicas han manifestado su aprobación para utilizar de forma preferente la prueba VPH en el cribado primario y en el contexto de un cribado organizado de tipo poblacional26.
Otro elemento clave en la evaluación del cribado del cáncer de cuello de útero ha sido la posibilidad de disponer de sistemas de información digitales de uso amplio en los centros de Atención Primaria. El hecho de que la historia clínica en Atención Primaria esté informatizada y que estos datos se vuelquen periódicamente en una base de datos vinculada a un único identificador individual ofrece unas oportunidades de análisis muy importantes11. A pesar de ello, existen aún diferencias geográficas en su uso y todavía existen dificultades para disponer de forma automática de algunos resultados de anatomía patológica y/o microbiología11. Sin embargo, cabe indicar que estas limitaciones, que pueden explicar algunas de las diferencias regionales en la cobertura, están en vías de sistematización y mejora.
La aplicación del Protocolo 2006 se ha acompañado durante todo el período, de actividades formativas dirigidas a profesionales del ASSIR y ABS, que incluían información tanto sobre prevención primaria como secundaria del cáncer de cuello uterino. El apoyo formativo de todos los profesionales implicados en la prevención de este cáncer es importante para proporcionar seguridad, responder dudas y facilitar la correcta aplicación del protocolo. En esta misma línea, es importante mantener las campañas informativas y el material de educación sanitaria sobre cribado dirigido a la población general y como soporte a la información que facilita el profesional sanitario.
Actuaciones recomendadasEn base a los resultados obtenidos en el presente análisis, se recomienda monitorizar con urgencia la pérdida de seguimiento a 3 años de las mujeres que han participado en el cribado. La organización siguiendo los criterios de cribado poblacional, que significa llamar activamente a las mujeres que deben cribarse respetando los intervalos establecidos, sin duda es la mejor opción para asegurar el acceso equitativo de la población e identificar el máximo número de mujeres en riesgo. La evidencia científica sobre las ventajas de implementar un cribado poblacional es máxima y está de acuerdo con las recomendaciones de las sociedades científicas españolas26. Asimismo, es fundamental monitorizar las pruebas adicionales que se realicen en mujeres con una prueba VPH negativa, que normalmente no siguen las recomendaciones establecidas en los protocolos de cribado, para evitar un aumento innecesario de los costes. También es importante mejorar y ampliar el uso de la historia clínica informatizada para la gestión de estas actividades preventivas y la monitorización de la participación de las mujeres en riesgo. Es relevante considerar la progresiva sustitución de la citología por la prueba VPH en el cribado primario dada su mayor sensibilidad en la detección de lesiones precursoras del cáncer de cuello uterino y el mayor intervalo entre pruebas de cribado. Toda actividad de cribado debería someterse a controles de calidad internos y externos. En este sentido, la evaluación interlaboratorio de la HC2 ofreció un modelo sostenible y útil asegurando un buen uso de la técnica6.
ConclusionesLa evaluación del «protocolo de las actividades para el cribado de cáncer de cuello uterino en Atención Primaria» aplicado en Cataluña durante el período 2006-2012ha permitido corroborar una mejora en la detección y en el manejo de mujeres con mayor riesgo de desarrollar un cáncer de cuello uterino, mediante la introducción de la prueba VPH, que ha resultado en un diagnóstico de patología cervical significativa y en una selección más adecuada de las citologías de ASC-US. También confirma que los intervalos amplios entre pruebas de cribado están sujetos a una pérdida importante de seguimiento y que por tanto deberían ir acompañados de un sistema de llamada y rellamada a las mujeres que no acuden a las sucesivas rondas de cribado. Por otro lado, se ha constatado que los esfuerzos para captar a mujeres con una historia de cribado inadecuado (insuficiente o inexistente) deben dirigirse a toda la población afectada, para que impacte de forma significativa en la cobertura poblacional. Y finalmente, el uso de protocolos homogéneos y la existencia de herramientas informáticas de amplio uso entre los centros han permitido una evaluación equitativa y fiable entre los mismos.
Actualmente, las principales sociedades científicas relacionadas con el cribado de cáncer de cuello uterino en España han establecido nuevas recomendaciones para mejorar su eficiencia26. Todas ellas incluyen la implantación de programas de cribado poblacional y la introducción de pruebas para la detección de VPH. En Cataluña, una comisión de trabajo está elaborando una nueva propuesta en la que se puedan incluir las principales recomendaciones derivadas de la evaluación y del conocimiento científico actualizado. Todo ello con criterios de sostenibilidad para ofrecer el máximo nivel de calidad asistencial y preventiva a la población.
Resposabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl proyecto ha recibido financiación parcial mediante becas públicas del Instituto de Salud Carlos III (RCESP C03/09, RTICESP C03/10, RTIC RD06/0020/0095, RD12/0036/0056, and CIBERESP), de la Agencia de Gestión de Ayudas Universitarias y de Investigación (AGAUR) de la Generalitat de Catalunya (2005SGR00695 y 2009SGR126) y del Instituto de Investigación Biomédica de Bellvitge (IDIBELL), (Predoctoral 2013). Ninguna de las fuentes ha tenido ningún papel en la recogida de datos, el análisis, la interpretación de los resultados ni en la elaboración de este artículo.
Conflicto de interesesS. de Sanjose ha recibido ayudas ocasionales para asistencia a convenciones científicas por parte de GlaxoSmithKline, Sanofi Pasteur MSD, Merck y Qiagen. E. Roura ha recibido soporte ocasional para asistencia a convenciones científicas de Sanofi Pasteur MSD, GlaxoSmithKine y Qiagen. A. Torné ha recibido honorarios por actividades docentes de Sanofi Pasteur MSD, GlaxoSmithKline y Roche Diagnostics. F. X. Bosch es miembro del consejo asesor de GlaxoSmithKline, Merck Sharp & Dohme y Sanofi Pasteur MSD. Recibió ayudas para viajes ocasionales a conferencias/simposios/reuniones por parte de GlaxoSmithKline, Sanofi Pasteur MSD, Merck & Co. o Qiagen. El resto de autores declaran no tener ningún conflicto de intereses.
Pla Director d’Oncologia, Dirección del Institut Català d’Oncologia, Institut Català de la Salut, Xavier Castellsagué, Roger Pla, Maria Lluisa de la Puente, Amelia Acera, Laia Bruni, Equipo SISAP, Equipos Centros de Anatomía Patológica, Equipos ABS/ASSIR, Laboratorios de referencia y administración del Programa de investigación en Epidemiología del Cáncer.